人参皂苷生物合成基因组织表达特性的研究
2017-07-31刘娟纪瑞锋陈同袁媛郭娟王英平
刘娟+纪瑞锋+陈同+袁媛+郭娟+王英平+高文远+黄璐琦

[摘要] 采用生物信息学及实时荧光定量方法对10个人参皂苷生物合成关键酶基因的组织表达特性进行研究。运用转录组热图聚类方法分析了四年生吉林人参14个不同部位人参皂苷生物合成基因的表达;运用实时荧光定量PCR的方法测定人参组培苗、不定根中人参皂苷生物合成基因的表达;运用Pearson相关对这10个人参皂苷生物合成关键酶基因表达特性进行分析。结果表明,β-AS,CYP716A52v2在吉林人参及组培苗的根中表达高,与Ro分布相一致;与达玛烷型人参皂苷合成相关的CYP716A47,CYP716A53v2表达呈显著正相关,从分子水平证明了人参皂苷化学成分分布的差异主要由转运引起。
[关键词] 人參;人参皂苷生物合成基因;组织表达
[Abstract] The study is aimed to characterize the tissue expression of 10 key ginsenoside biosynthetic genes using bioinformatics method and real-time quantitative PCR. Heatmap and cluster analysis of 10 ginsenoside biosynthetic genes were performed in four-year-old Jilin ginseng. Using real-time quantitative PCR, the expression correlation of 10 key genes involved in ginsenoside biosynthesis was analyzed in different organs of four-year-old Jilin ginseng including, tissue culture seedling and adventitious root. Pearson correlation was used to analyze the relation between those 10 key genes involved in ginsenoside biosynthesis. The results showed that β-AS and CYP716A52v2 were expressed highly in root of Jilin ginseng and ginseng culture seedling, which was consistent with Ro distribution. In addition, CYP716A53v2 and CYP716A47 which involved in dammarane type ginsenoside biosynthesis were positively correlated, which revealed that the difference of ginsenoside distribution was caused by transport system.
[Key words] ginseng;ginsenoside biosynthetic genes;tissue expression
人参为五加科Araliaceae植物人参Panax ginseng C. A. Mey.的干燥根及根茎,是名贵中药材,在我国已有超过2 000年的用药历史[1]。现代药理学研究表明,人参的主要有效成分人参皂苷具有抗肿瘤、抗衰老、抗炎、抗氧化等药理活性[2-4]。人参皂苷属于三萜类成分,至今已从人参中分离并确定了110余种[5],根据苷元不同,可分为3种类型:一类为齐墩果烷型五环三萜类皂苷(如Ro等);另2类属于达玛烷型四环三萜类皂苷,包括人参二醇型皂苷(如Rb1,Rb2,Rc,Rd,F2,Rg3,Rh2等)和人参三醇型皂苷(如Re,Rg1,Rg2,Rf,Rh等),后两者在人参皂苷中占大多数,具有较好的新药开发前景[6]。
人参皂苷在人参中含量较低,而人参人工种植需要4~15年的生长栽培周期,又面临农药残留、重金属污染及品质退化等问题[7]。因此,为了适应日益增长的用药需求、保护人参资源,近年来国内外学者通过组织培养、生物转化及合成生物学等途径对人参皂苷合成进行探索研究[8]。人参已在中国、日本及韩国成功建立了组培苗、不定根及悬浮细胞等体系,但存在细胞株系不稳定、放大培养困难、目的产物低及培养条件复杂导致成本高等问题[7]。因此,如何有效地分析人参皂苷在不同体系中的合成规律,有助于解析以上问题。
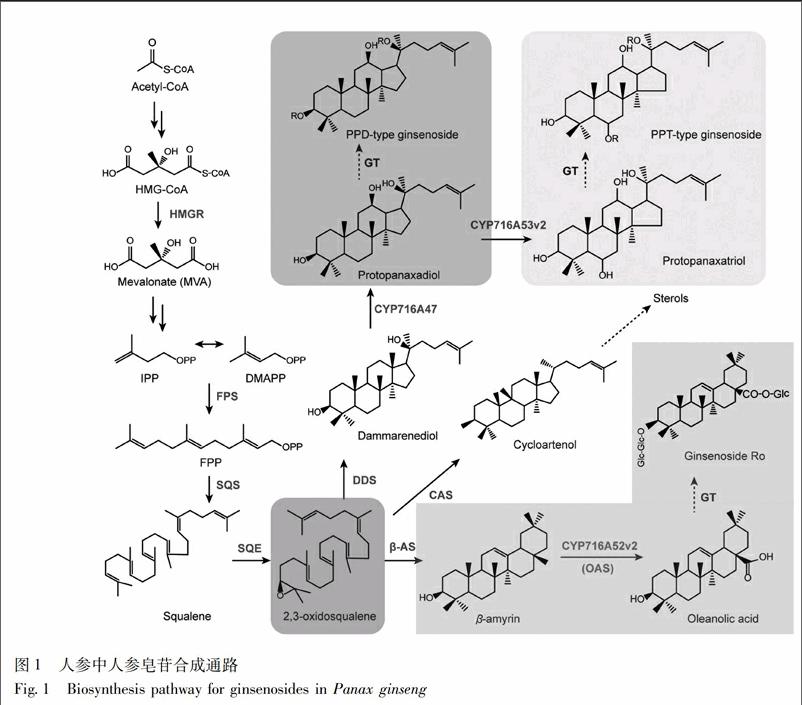
近年来,关于人参皂苷生物合成途径的解析取得一定进展(图1)[8-11]。其中的关键酶包括上游的3-羟基-3-甲基戊二酰CoA还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)、法呢基焦磷酸合酶(farnesyl diphosphate synthase,FPS)、鲨烯合酶(squalene synthase,SQS)、鲨烯环氧酶(squalene epoxidase,SQE),下游的3个分支酶达玛烯二醇-Ⅱ合酶(darmmarenediol-Ⅱ synthase,DDS)、β-香树素合酶(β-amyrin synthase,β-AS)、环阿尔廷醇合酶(cycloartenol synthase,CAS)和3个细胞色素P450酶CYP716A47(形成人参二醇型皂苷前体原人参二醇),CYP716A53v2(形成人参三醇型皂苷前体原人参三醇),CYP716A52v2(oleanolic acid synthase,OAS,形成齐墩果烷型皂苷前体齐墩果酸)。本研究通过人参植株、组培苗及不定根体系,对以上10个关键酶基因进行组织表达特性分析,并探讨了基因表达的相关性,为深入阐明人参皂苷合成途径提供理论依据,为有效筛选皂苷转产型组培材料提供指标基础。
1 材料
1.1 人参组培苗 取人参种子,用70%乙醇水溶液浸泡3 min,然后用1%次氯酸钠浸泡30 min,灭菌去离子水洗3遍,将已成熟的胚状体从种子中转移出来,并在含有1%蔗糖的1/2 MS固体培养基中(25±2) ℃培养3周(16 h光照/8 h黑暗),萌发后的材料转移到分化培养基(MS+3 mg·L-1 6-BA+5 mg·L-1 NAA +1 mg·L-1 IAA)中诱导成苗,可作为后续的实验材料使用。
1.2 人参不定根 组培苗的叶柄切成1.0 cm长,作为诱导人参不定根的外植体。将外植体在1/2 MS(含3.0 mg·L-1 IBA)固体培养基中(25±2) ℃暗培养4周,待外植体形成不定根后将其分离,并继代到1/2 MS液体培养基(含3.0 mg·L-1 IBA)中(25±2) ℃暗培养。3周继代1次,12周后,不定根生长稳定快速,可作为后续的实验材料使用。
1.3 试剂 TRIzol Plant RNA Kit (Life technologies) 购于北京江晨源远生物科技有限责任公司;M-MLV RTase cDNA Synthesis Kit,SYBR Premix Ex Taq均购于大连宝生物公司。引物由上海生工生物工程技术服务有限公司合成。基因测序由北京睿博兴科生物技术有限公司完成。
1.4 仪器 凝胶成像系统(Bio-Rad),制冰机(Sanyo),NanoDrop 2000 核酸/蛋白定量仪(Thermo),台式高速离心机(Eppendorf),超低温冰箱(Thermo),高压蒸汽灭菌锅(TOMY SX-700),实时荧光定量PCR仪(Applied Biosystems 7500)。
2 方法
2.1 Total RNA 提取与单链cDNA的合成 人参不定根分为根尖1 cm (A)、有分支部位(B)、棕黄色老根(C)3个组织部位,人参组培苗分为根、叶及种子3个组织部位。取人参组培苗及不定根不同组织样品分别在液氮中研磨,根据TRIzol Plant RNA Kit说明书提取总RNA,用1%琼脂糖凝胶电泳确定RNA完整性,用核酸/蛋白定量仪对RNA定量。cDNA合成按M-MLV RTase cDNA Synthesis Kit说明书进行,合成的cDNA作为下游反应模板。
2.2 引物的设计与合成 根据文献[8,12-13]及序列信息合成了人参皂苷生物合成关键基因HMGR,FPS,SQS,SQE,DDS,β-AS,CAS,CYP716A47,CYP716A53v2,CYP716A52v2及内参基因IF3G1[14]的引物,由上海生工生物工程技术服务有限公司合成(表1)。
2.3 实时荧光定量PCR 利用实时荧光定量PCR (Real-time PCR,qRT-PCR) 的方法检测上述基因在不同样品的表达模式。选取人参的IF3G1作为内参基因[14]。实时荧光定量PCR反應体系为5 μL SYBR Premix Ex Taq酶,上下游引物(10 μmol·L-1)各0.5 μL,cDNA模板(100 mg·L-1)1 μL,加水补足至10 μL,每个反应体系至少重复3次。扩增程序如下:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火延伸34 s(每次循环后采集荧光信号),40个循环;95 ℃变性10 s,65~95 ℃做熔解曲线分析,每个温度以每步0.5 ℃上升,停留5 s,获得每个基因的Ct进行相对表达量分析。
2.4 基因相对表达量的计算 人参不定根基因表达的计算是以不定根C部位作为基准参比部位,假定10种基因在C部位表达量均为100%,计算10种基因在A,B,C部位的相对表达量;人参组培苗基因表达的计算是以种子作为基准参比部位,计算10种基因在人参组培苗根、叶、种子部位的相对表达量;人参愈伤组织基因表达的计算是以30 d样品作为参比部位,计算10种基因在30,60 d人参愈伤组织的相对表达量。利用美国ABI公司SDS V2.3软件对PCR过程的数据进行收集和分析,然后计算样品基因相对表达量,计算公式为:2-ΔΔCT=2-[(CT目的基因-CT管家基因)待测组-(CT目的基因-CT管家基因)对照组]。
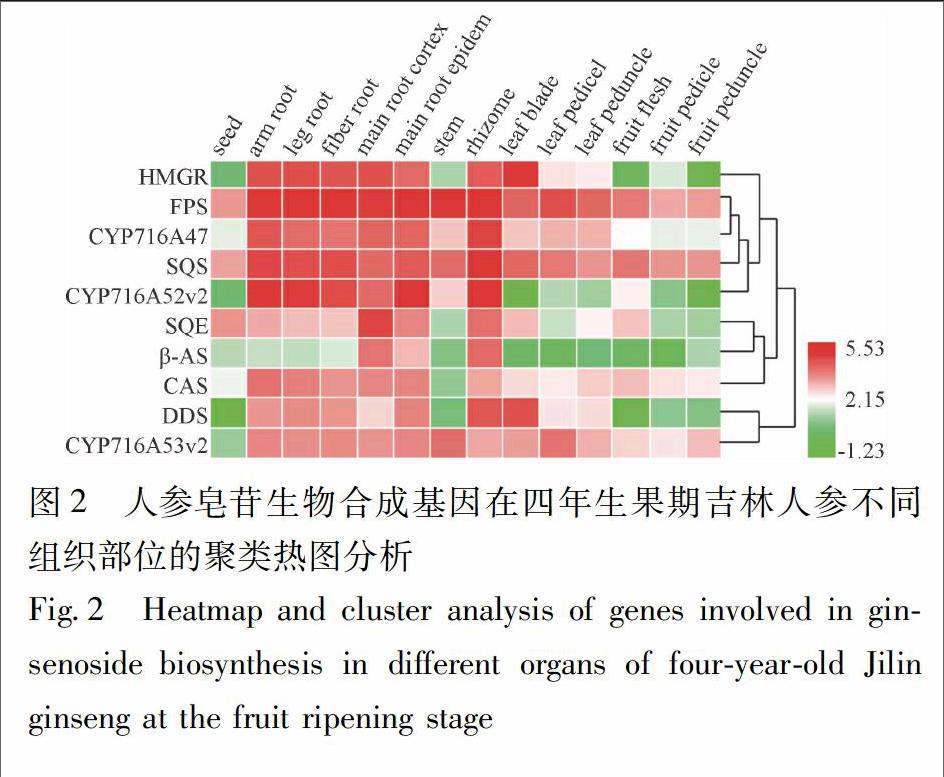
2.5 人参转录组热图聚类分析 将NCBI SRA (sequence read archive)库中四年生果期吉林人参不同组织部位转录组数据(SRR2952867~SRR2952880)进行从头拼接,构建完整的转录本库,运用BioEdit建立本地文库,通过Local BLAST比对分别筛选出与荧光定量一致的序列信息(序列号见表1,E-value=0)。运用Heml软件(Heatmap Illustrator,version 1.0)对基因表达进行热图聚类分析,分析这10个人参皂苷生物合成基因在吉林人参不同组织部位的表达模式及相互关系。
2.6 基因表达相关性分析 利用SPSS 20.0软件对人参不同组织部位的10个基因表达进行Pearson相关性分析,|r|>0.7说明两者呈现高度线性相关,0.7≥|r|≥ 0.5说明两者呈现中度线性相关,0.5≥|r|≥0.3则两者呈现低度相关,|r|<0.3两者相关性极低,P≤0.05为显著水平,P≤0.01为极显著水平[15]。
3 结果与分析
3.1 吉林人参中人参皂苷生物合成基因的表达分析 人参皂苷在人参全株均有分布,主要积累于人参的根、根茎、叶、果实中[8]。因此,为了分析人参皂苷生物合成基因在人参不同器官的表达情况,利用NCBI SRA (Sequence Read Archive)对四年生果期吉林人参不同组织部位的转录组数据(SRR2952867~SRR2952880)进行组装拼接,通过基因序列同源比对及表达热图聚类分析,发现人参皂苷生物合成上游基因FPS,SQS在植株中表达较高,且没有明显的组织特异性;3个分支酶基因表达组织特异性较强,其中CAS主要在根中表达,DDS主要在根茎中表达,β-AS主要在主根及根茎中表达;3个P450基因中,CYP716A52v2主要在地下的根及根茎中表达,CYP716A47,CYP716A53v2在根、茎、叶中均有表达(图2)。从结果可以看出,人参皂苷生物合成基因表达模式大致为根及根茎>叶>果实>种子,其中齐墩果烷型人参皂苷生物合成的组织特异性最明显。
3.2 人参组培苗中人参皂苷生物合成基因表达分析 为了进一步了解不同类型人参皂苷分布与基因表达的关系,采用受控实验,对组培苗中人参皂苷生物合成基因的表达情况及其合成规律进行研究。结果发现,除了HMGR在根、叶、种子中没有表现出表达组织特异性外,其余9个基因均表现出组织表达差异。由于β-AS,CYP716A52v2与Ro合成密切相关,而SQS,β-AS,CYP716A52v2在根中高表达,这与Ro主要在根中分布具有一致性。在叶中表达高的有SQE,CAS,CYP716A47,CYP716A53v2(图3),其中CYP716A47,CYP716A53v2与达玛烷型人参皂苷密切相关,与达玛烷型人参皂苷主要分布于人参叶中一致。其中三醇型人参皂苷在人参叶中含量高而二醇型人参皂苷在人参根中含量高,为从分子层面说明根中含有的二醇型人参皂苷部分来源于叶的合成与运输提供了依据。
3.3 人参不定根中人参皂苷生物合成基因表达分析 人参皂苷主要分布于人参根中木栓化较高的木栓层[8],由于人参不定根A,B,C 3个部位组织木栓化程度存在显著差异,即根尖(A)组织木栓化程度较低,分支部位(B)组织木栓化程度居中,部位老根(C)组织木栓化程度较高[16],因此进一步分析了不同木栓化程度不定根中人参皂苷合成基因的组织特异性表达水平。结果显示,不定根木栓化程度越高,SQS,CAS,CYP716A47,CYP716A53v2表达越高,β-AS表达趋势则相反(图4),暗示在人参不定根中,达玛烷型人参皂苷合成很可能与其木栓化过程密切相关。
3.4 人参皂苷生物合成基因相关性分析 根据人参皂苷生物合成基因在人参不同体系中的表达情况,对这10个基因进行Pearson相关性分析。结果显示,FPS与SQS,CAS,CYP716A47,CYP716A53v2,CAS與CYP716A53v2,CYP716A47与CYP716A53v2这6对基因具有显著正相关(r>0.7)(图5)。其中,上游FPS基因与通路多个酶基因表达具有显著正相关,说明该基因与通路多个人参皂苷合成基因存在互作或具有相同的上游调控元件,是人参皂苷生物合成非常关键的基因;CYP716A47与CYP716A53v2表达呈现显著正相关(r = 0.89),说明二醇型和三醇型达玛烷型人参皂苷在植物中合成的组织部位较一致,因此更说明二醇型与三醇型人参皂苷在植株中分布的不同很有可能是运输导致的。
4 讨论
近年来,随着多种人参皂苷药理活性的确认及相关产品的开发,对人参皂苷的需求量日益增大,因此揭示人参皂苷生物合成网络及代谢调控机制将对提高人参皂苷的生物转化率奠定理论基础。由于人参皂苷的合成与人参生长年限、组织器官、环境因子等多因素密切相关,因此本文采用不同体系对人参皂苷生物合成基因的组织特性表达进行探索研究,为深入挖掘人参皂苷代谢网络的调控机制提供依据,为整体提高代谢途径中基因的表达水平、有效提高组培体系中人参皂苷的产量奠定基础。
前人研究表明,人参皂苷在人参植株的不同器官分布的种类与含量不同,在一至四年生的人参根中主要分布有Rg1,Re,Rb1,在叶子中主要分布有Re,Rd,Rg1[8]。在人参不同组织器官皂苷含量的研究中发现,总皂苷在人参果肉,叶及须根中含量最高,其中Rg1,Re(三醇型人参皂苷)在叶中含量最高,而Rb1,Rb2,Rc(二醇型人参皂苷)在根中含量最高[12,17-18],齐墩果烷型人参皂苷Ro在根中含量远高于叶(约10倍)[19]。Han[20]与Kim等[21]研究小组发现,人参皂苷成分分布与基因表达并不一致,Schramek等[22]用13C标记的同位示踪法发现,人参皂苷合成的前体能从叶子转移到根中,因此有学者提出人参皂苷分布差异与运输密切相关[8,23],但对其转运机制的研究尚未见报道。
本研究表明,不同人参皂苷生物合成基因在人参植株不同部位表达具有组织差异。上游的4个关键酶基因HMGR,FPS,SQS,SQE进行表达分析发现:不同组织部位4个基因地上地下均有表达,以FPS,SQS两者表达最高;SQS在木栓化程度高的不定根C部位显著高于A和B、根的表达高于叶和种子,说明SQS的表达很可能与组培材料的分化相关。合成齐墩果烷型人参皂苷的2个关键酶基因β-AS,CYP716A52v2进行表达分析,发现两者在根中表达远远高于其他部位,这与Ro的分布相一致。合成达玛烷型人参皂苷的3个关键基因DDS,CYP716A47,CYP716A53v2进行表达分析发现:DDS在根和叶中表达较高,说明达玛烷型人参皂苷前体在人参的根、叶均有合成;合成二醇型人参皂苷前体的CYP716A47与合成三醇型人参皂苷前体的CYP716A53v2表达一致(呈现显著正相关,r=0.89),暗示CYP716A53v2表达间接促进CYP716A47表达的提高,从而促进合成更多二醇型的人参皂苷作底物。前人研究已经表明,根中主要分布二醇型人参皂苷、叶中主要分布三醇型人参皂苷[12,17-18],基因表达的结果较好证明了前人论述的结论[8,20-23],同时暗示转移的人参皂苷前体多是二醇型的人参皂苷。合成植物甾醇(如常见的植物激素油菜素内酯、独角金甾醇)前体的关键酶CAS进行表达分析发现,它在人参的根、叶、木栓化的不定根C中表达高,与CYP716A47,CYP716A53v2表达模式基本一致,说明两者的通路存在相关性,也有可能是甾醇类的植物激素对人参皂苷的合成具有调控作用。
[参考文献]
[1] Hemmerly T E. A ginseng farm in Lawrence County, Tennessee[J]. Econ Bot, 1977, 31(2): 160.
[2] Im D, Nah S. Yin and Yang of ginseng pharmacology: ginsenosides vs gintonin[J]. Acta Pharmacol Sin, 2013, 34(11): 1367.
[3] Kang S, Min H. Ginseng, the ′immunity boost′: the effects of Panax ginseng on immune system[J]. J Ginseng Res, 2012, 36(4): 354.
[4] 赵远, 张凡, 曲胜军, 等. 人参主要成分药理研究进展[J].亚太传统医药, 2012, 8: 171.
[5] Yang W Z, Hu Y, Wu W Y, et al. Saponins in the genus Panax L. (Araliaceae): a systematic review of their chemical diversity[J]. Phytochemistry, 2014, 106(10):7.
[6] 薛蛟, 王英平, 肖盛元. 人参皂苷生物合成及调控功能基因研究进展[J]. 特产研究, 2014, 36(3): 72.
[7] 杨金玲, 高丽丽, 朱平. 人参皂苷生物合成研究进展[J]. 药学学报, 2013, 48(2): 170.
[8] Kim Y J, Zhang D, Yang D C. Biosynthesis and biotechnological production of ginsenosides[J]. Biotechnol Adv, 2015, 33(6): 717.
[9] Wang K, Jiang S, Sun C, et al. The spatial and temporal transcriptomic landscapes of ginseng, Panax ginseng C. A. Meyer[J]. Sci Rep, 2015, 5: 18283.
[10] Han J Y, Kim H J, Kwon Y S, et al. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-Ⅱ during ginsenoside biosynthesis in Panax ginseng[J]. Plant Cell Physiol, 2011, 52(12): 2062.
[11] Han J Y, Hwang H S, Choi S W, et al. Cytochrome P450 CYP716A53v2 catalyzes the formation of protopanaxatriol from protopanaxadiol during ginsenoside biosynthesis in Panax ginseng[J]. Plant Cell Physiol, 2012, 53(9): 1535.
[12] 王康宇, 张美萍, 李闯, 等. 人参15个组织器官中皂苷量与6 种人参皂苷生物合成基因表达的相关性研究[J]. 中国中药杂志, 2015, 40(16): 3168.
[13] Kim Y J, Lee O R, Oh J Y, et al. Functional analysis of 3-hydroxy-3- methylglutaryl coenzyme a reductase encoding genes in triterpene saponin-producing ginseng[J]. Plant Physiol, 2014, 165(1): 373.
[14] Wang M, Lu S. Validation of suitable reference genes for quantitative gene expression analysis in Panax ginseng[J]. Front Plant Sci, 2016, 6(696): 1259.
[15] Hazra A, Gogtay N. Biostatistics series module 6: correlation and linear regression[J]. Indian J Dermatol, 2016, 61(6): 593.
[16] 李铁军, 廉美兰, 邵春绘, 等. 酸碱胁迫对人参不定根中皂苷积累的影響及皂苷的组织化学定位研究[J]. 中国中药杂志, 2013, 38(24): 4277.
[17] 逄世峰, 李亚丽, 许世泉, 等. 人参不同部位人参皂苷类成分研究[J]. 人参研究, 2015(1): 5.
[18] 李闯, 王义, 张美萍, 等. 人参不同部位皂苷成分的HPLC测定[J]. 吉林中医药, 2010, 30(4): 347.
[19] 王佳, 郑培和, 许世泉, 等. 人参、西洋参不同部位中齐墩果酸型皂苷含量的对比分析[J]. 特产研究, 2015(2): 23.
[20] Han J Y, In J G, Kwon Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J]. Phytochemistry, 2010, 71: 36.
[21] Kim Y J, Lee O R, Oh J Y, et al. Functional analysis of 3-hydroxy-3-methylglutaryl coenzyme a reductase encoding genes in triterpene saponin-producing ginseng[J]. Plant Physiol, 2014, 165(1): 373.
[22] Schramek N, Huber C, Schmidt S, et al. Biosynthesis of ginsenosides in field-grown Panax ginseng[J]. JSM Biotechnol Biomed Eng, 2014, 2: 1033.
[23] Fukuda N, Shan S, Tanaka H, et al. New staining methodology: eastern blotting for glycosides in the field of Kampo medicines[J]. J Nat Med, 2006, 60: 21.
[责任编辑 吕冬梅]
