环糊精葡萄糖基转移酶生产α-熊果苷的反应条件优化及分子改造
2017-07-31张文蕾宿玲恰陶秀梅吴敬
张文蕾,宿玲恰, 陶秀梅,吴敬*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学,生物工程学院工业生物技术教育部重点实验室,江苏 无锡,214122)
环糊精葡萄糖基转移酶生产α-熊果苷的反应条件优化及分子改造
张文蕾1,2,宿玲恰1,2, 陶秀梅1,2,吴敬1,2*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学,生物工程学院工业生物技术教育部重点实验室,江苏 无锡,214122)
选择4种环糊精葡萄糖基转移酶(CGTase)分别为来源于Paenibacillusmacerans的α- CGTase,Bacilluscirculans251的β- CGTase,BacillusstearothermophilusNO2和Anaerobrancagottschalkii的α/β-CGTase,研究不同种类的CGTase生产α-熊果苷的情况。以麦芽糊精为供体,对苯二酚(Hydroquinone HQ)为受体,通过CGTase和淀粉葡萄糖苷酶的两步酶法反应催化合成α-熊果苷。分别优化不同类型的酶合成α-熊果苷的条件,发现Anaerobrancagottschalkii来源的CGTase在如下最优条件下获得的HQ摩尔转化率最高,为25%:以葡萄糖当量(DE) 值为 9% ~ 13%的50 g/L麦芽糊精作为供体,8 g/L HQ为受体,缓冲液pH 6.0,在40 ℃下反应24 h,沸水浴灭活后,加入糖化酶处理,高效液相色谱检测产物。为了进一步提高CGTase对底物的转化率,利用定点突变技术对A.gottschalkiiCGTase进行分子改造,得到1个突变体Y299A,在最优的反应条件下突变体的HQ转化率可达40%。
环糊精葡萄糖基转移酶;α-熊果苷;酶催化;定点突变
熊果苷(arbutin)又称熊果素,存在于一种来源于杜鹃花科熊果属的灌木植物——熊果叶子细胞中,是一种新兴的无刺激、无过敏、配伍性强的天然美白活性物质,广泛应用于化妆品行业[1-2]。依据结构不同可将熊果苷分为α型和β型,α-熊果苷是β-熊果苷的差向异构体,并且其美白效果是β-熊果苷10倍以上,从安全性上考虑,α-熊果苷比β-熊果苷更具有较高的安全性[3]。鉴于此,国内外许多家化妆品公司已采用α-熊果苷代替β-熊果苷作为美白添加剂[4]。除此之外熊果苷还具有抗炎、抑菌镇咳、平喘抗氧化的作用。
目前文献报道的熊果苷的制备方法分别为天然产物提取法、植物组织培养法、化学合成法以及酶转化法[5]。α-熊果苷的制备方法主要是通过微生物细胞转化法和酶法合成制得,其中微生物细胞转化法是通过不同微生物的酶将糖基转移,1分子葡萄糖的葡糖基转移至1分子HQ上形成了单一的α-熊果苷[6]。酶法转化生产α-熊果苷主要是将糖基转移酶作为催化剂,通过催化糖基转移来合成α-熊果苷,而其中转糖基反应中酶底物一般是双糖或多糖,酶法生产α-熊果苷具有简单方便的优势。赵如奎利用α-CGT合成α-熊果苷,HQ转化率为 7.77%,产量为3.17g/L[7]。SINDHU MATHEW利用来源于Thermoanaerobactersp.的CGT酶生物催化合成α-熊果苷,对HQ转化率最高可达 30%[8]。
环糊精葡萄糖基转移酶(cyclodextringlycosyltransfer,CGT 酶,EC2. 4. 1. 19) 是一种胞外酶,同时也是一种多功能酶,能催化3种转糖基反应 (歧化、环化和耦合反应) 和水解反应[9]。CGTases共有5 个结构域,其中B域含有一个明显的底物结合凹槽,通过凹槽周围氨基酸与底物结合[10]。在底物结合凹槽中存在9 个亚位点,标记为+2~-7,每个亚位点能结合一个葡萄糖残基[11]。对CGTase关键氨基酸的定点突变往往会造成酶活力的变化[19]。+1,+2位点是催化转糖基的关键位点,对其附近的氨基酸进行突变能够有效的改变CGTase的水解和歧化活力,而在其他位点进行突变则效应不明显。+1亚位点附近涉及的氨基酸残基:Leu194、Ala230 和 His233 进行定点饱和突变,附近氨基酸残基的突变能有效提高CGT 酶与底物分子的亲和性[12]。HANS LEEMHUIS等人研究对CGTase转糖基特异性起关键作用的氨基酸,发现将230位的Ala突变为Val后,歧化活力大大降低,其水解能力成为突变酶的主要反应。主要原因是受体位点附近的230Ala的侧链较短,当突变为Val时它的侧链较长会阻碍糖在受体亚位点的结合,导致歧化活力降低。由CGT酶催化的所有反应都以先经过底物结合、糖苷键裂解和糖基-酶共价中间体形成,这一步骤的效率由底物残基和易断裂键的结合速度决定。然后进行亲核氧原子攻击,在转糖基反应中通过糖基受体的O4原子攻击糖基-酶共价中间体的C1原子,在这个步骤中,最关键的是被攻击的+1亚位点的+1位葡萄糖残基的正确取向。Val侧链对+1葡萄糖的O3原子造成空间位阻,因此干扰+1葡萄糖与酶的正确结合[13]。本实验研究了不同来源的CGTase的转糖基生产α-熊果苷的能力,优化酶转化条件,研究转化率最高的CGTase受体位点附近的空间结构,通过对受体位点附近的氨基酸进一步的分子改造提高酶对底物的转化效率。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
含有分别来源于Paenibacillusmacerans(GenBank Accession No. M 208063)、Bacilluscirculans251(No.P43379.1)、Anaerobrancagottschalkii(No.CAH61550.1)、B.stearothermophilusNO2(No.X59042.1)的cgt基因的E.coliBL21(DE3)重组菌由本实验室构建及保藏。
1.1.2 试剂
PrimerStar、T4DNA连接酶、琼脂糖、碱性磷酸酶CIAP、核酸分子量标准均购自宝生物(大连)公司;E.coli感受态细胞制备试剂盒、质粒小量提取试剂盒、胶回收试剂盒、异丙基-β-D-硫代半乳糖苷(IPTG)、氨苄青霉素(Amp)均购自上海生工生物工程公司;α-熊果苷标样购自Sigma公司;其他常规试剂均购于国药集团化学试剂有限公司。
1.2 方法
1.2.1 四种酶生成α-熊果苷的优化及检测
利用4种CGTase合成α-熊果苷,酶转化的反应体系如下:在20 mmol/L pH 6. 0 的柠檬酸-磷酸盐缓冲液体系中包含50 g/L麦芽糊精、8 g/L HQ,适量的4种CGTase,于水浴摇床中反应24 h,反应结束后加入葡萄糖淀粉酶,于40 ℃反应4 h后,沸水浴5 min灭活,离心后经高效液相色谱(HPLC)分析。不同的pH和HQ浓度的酶转化实验只需改变相应的变量,其余同上。
1.2.2A.gottschalkiiCGTase Tyr299突变体的构建与转化
将不同来源的CGTase生产α-熊果苷的条件进行优化,研究不同的温度,pH和HQ浓度下CGTase生产α-熊果苷的摩尔产率。比较4种CGTase生产α-熊果苷的能力差异,对转化率最高的酶的受体位点附近的氨基酸进一步的分子改造提高转化率。
根据蛋白质三维结构分析,本研究以A.gottschalkiiCGTase的299位酪氨酸为研究对象,通过设计一对引物,采用基于一步PCR介导的定点突变方法对CGTase编码基因进行定点突变。引物分别为:正向引物:5’-GGTGAGTGG GCTTTAGGTAA AGATGAA-3’反向引物:5’-TTCATCTTTA CCTAAAGCCC ACTCACC-3’(下划线为突变碱基)。PCR扩增后取10 μL经过Dpn I处理的PCR产物转化E.coliJM109,涂布到LB固体平板(含ampicillin,AMP)上。挑取单菌落接种到LB液体培养基中,培养8~10 h并提取质粒,交由上海生工生物工程有限公司测序。将测序正确的突变质粒转化表达宿主E.coliBL21(DE3),得到含有突变基因的基因工程菌。
线阵声学段内张力则关系到系固在段内的水听器的安全保障性能及其工作稳定性。因此,准确对线阵声学段内张力进行估计和预报是非常有必要的。
1.2.3 突变CGTase的表达
分别将测序正确成功突变的菌株接种于10 mL的LB 培养基中,200 r/min摇床,37 ℃培养8~10 h。取上述菌液按4% (V/V) 的接种量,接种至100 mL TB,37 ℃培养当菌体长至OD600为0.6 时,添加IPTG 至0.01 mmol/L,25 ℃继续诱导48 h后,发酵液8 000 r/min、4 ℃离心15 min,除去菌体,上清即为粗酶液。
1.2.4 酶活测定
歧化活力[18]:取600 μL含有终浓度4 mmol/L的4-硝基苯基-α-D-麦芽庚糖-4-6-O-亚乙基(EPS)和20 mmol/L的麦芽糖溶液于50 ℃保温10 min,然后加入0.1 mL适当稀释的酶液,反应10 min,加入50 μL 3 mol/L HCl终止反应,5 min后用50 μL 3 mol/L NaOH溶液中和,然后加入 100 μL α-葡萄糖苷酶于60 ℃反应60 min,加入100 μL 1 mol/L Na2CO3溶液将pH调节到pH8以上,401 nm处测定溶液的吸光值。1个酶活单位(U)定义为每分钟转化1 μmol EPS所需的酶量。
1.2.5 突变体的晶体结构模拟
野生型 (突变型) CGT 酶的理论晶体结构通过SWISS-MODEL蛋白模拟在线服务器进行同源模拟获得[15],模板为来源于B.circulans251的CGT 酶 (PDB 编码:1CXK)[16]。麦芽九糖抑制剂由模板PDB 1CXK 的活性位点转移至模型的活性位点。
2 结果与讨论
2.1 四种来源CGTase的表达与合成α-熊果苷的条件优化
将来源于P.macerans、B.circulans251、B.stearothermophilusNO2和A.gottschalkii分别属于 α-CGTase、β-CGTase和α/β-CGTase进行摇瓶发酵,粗酶液的岐化活力分别为:55 U/mL、20 U/mL、55 U/mL和 60 U/mL,本文研究不同类型的CGTase的转糖基作用,不同来源的CGTase生产α-熊果苷的能力有很大差异,以上4种酶的最适加酶量分别为74 U/mL、60 U/mL、65 U/mL和 60 U/mL 对它们合成α-熊果苷的条件进行优化,分别研究温度,pH和HQ浓度对反应的影响。
2.1.1 反应温度对生产α-熊果苷的影响
为考察温度对CGTase合成α-熊果苷的影响,以HQ和麦芽糊精为底物用4种CGTase分别在30~50 ℃范围内进行酶转化,由图1可知,在低于40 ℃的时候,温度升高有利于提高酶的活性,相应的HQ的转化率会提高,最高为来源于A.gottschalkii的转化率可达23%。当酶反应温度过高,酶对底物的催化活力会降低,而且高温下HQ易氧化,导致反应体系中可利用的底物变少,转苷效率降低。4种CGTase均在40℃对HQ的转化率较高,因此选择40 ℃为酶反应的最佳温度。
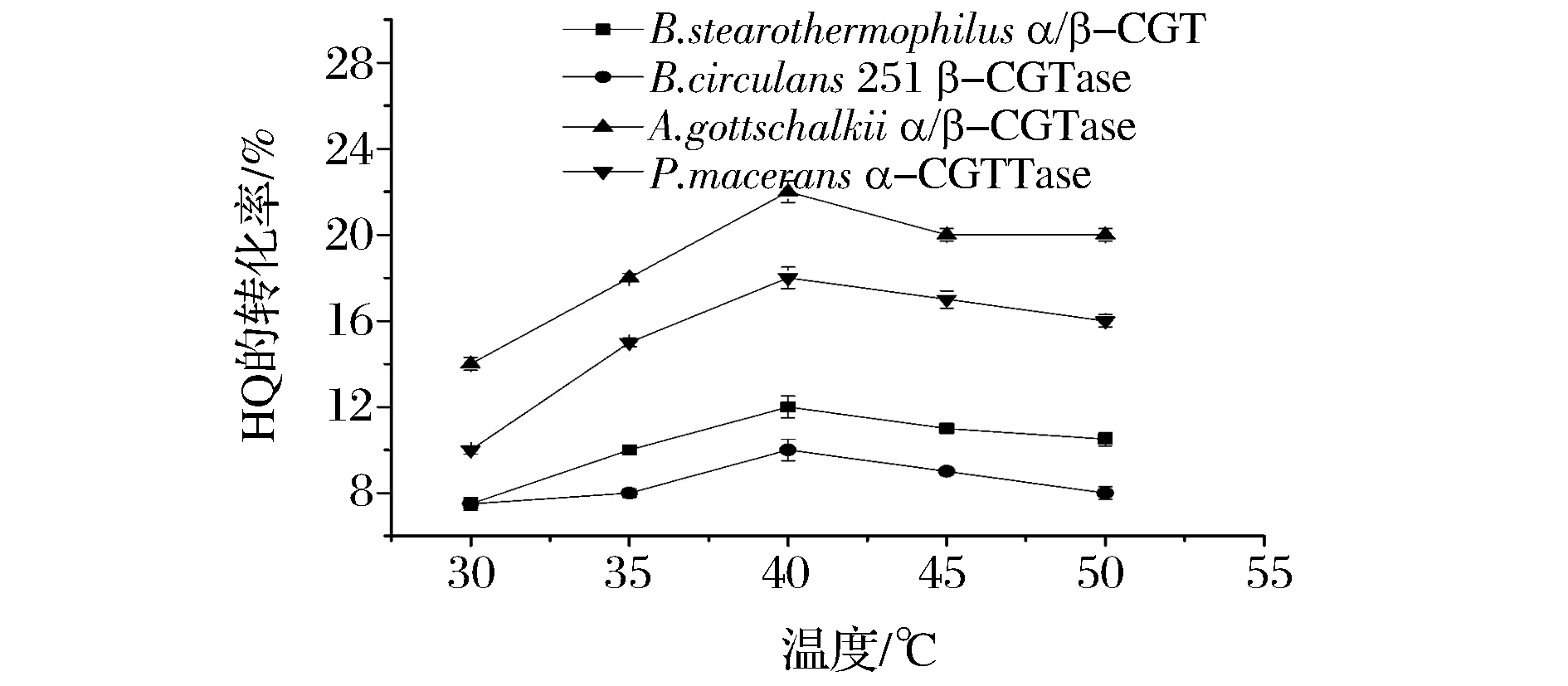
图1 反应温度对生产α-熊果苷的影响Fig.1 Effects of temperature on the yield of α-arbutin
2.1.2 pH对生产α-熊果苷的影响
为考察转化α-熊果苷的最适pH,本研究分别在pH 5.0~7.0范围内用4种CGTase在40 ℃下进行酶转化,结果如图2所示。4种CGTase在pH6.0时对HQ的转化率最高,A.gottschalkii来源的酶可以达到25%。原因可能是由于pH6.5时底物HQ与酶的受体位点的结合更容易,因此有利于CGTase的转糖基作用,选择pH6.0作为生产α-熊果苷的初始pH。
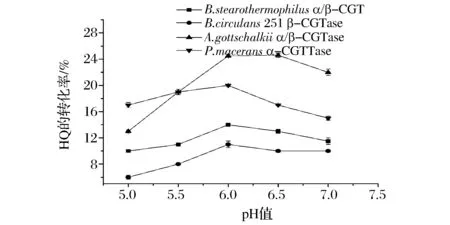
图2 pH对生产α-熊果苷的影响Fig.2 Effects of pH on the yield of α-arbutin
2.1.3 HQ浓度对生产α-熊果苷的影响
CGTase转化HQ生成α-熊果苷的反应是双底物反应,底物的浓度是影响酶反应转化率的重要因素。麦芽糊精浓度过高会残留在酶反应体系中,造成浪费,过低又会影响HQ的转化。HQ的毒性对酶反应有抑制作用,在高浓度下更易氧化,当缓冲液中HQ浓度超过8 g/L时,酶活性会下降[7]。因此,糖基供体与受体的比例对生产α-熊果苷影响较大,本研究考察了HQ对α-熊果苷产量的影响。反应体系为50 g/L的麦芽糊精,不同质量浓度的HQ,40 ℃下进行酶转化。结果如图3:HQ的转化率随着浓度先增加后降低,当HQ的浓度为8 g/L时,摩尔转化率最高可以达到25%,此时α-熊果苷的产率为7.9g/L。因此本研究选择8 g/L的HQ和50 g/L的麦芽糊精为生产α-熊果苷的最佳底物浓度。
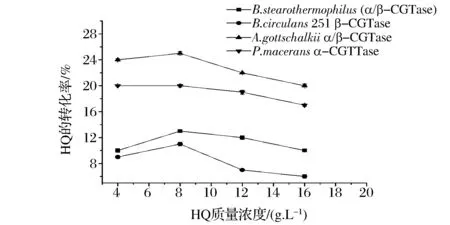
图3 HQ质量浓度对生产α-熊果苷的影响Fig.3 Effects of HQ concentration on the yield of α-arbutin
2.2A.gottschalkiiCGTaseTyr299突变体的构建及对合成α-熊果苷的影响
2.2.1A.gottschalkiiCGTase突变体的构建
通过对α-熊果苷合成条件优化,4种CGTase中A.gottschalkii来源的CGT酶的HQ的摩尔转化率最高为25%,尝试对CGTase进行分子改造,提高CGT酶的歧化活力以A.gottschalkiiCGTase的299位氨基酸为目标,通过设计一对引物,利用PCR扩增技术,得到扩增序列,用双酶切验证后经凝胶电泳分析,突变体在2 166bp和3 716bp处有特异性条带,如图4所示。将测序正确的突变菌株,摇瓶发酵获得酶液,用于酶转化生产α-熊果苷。
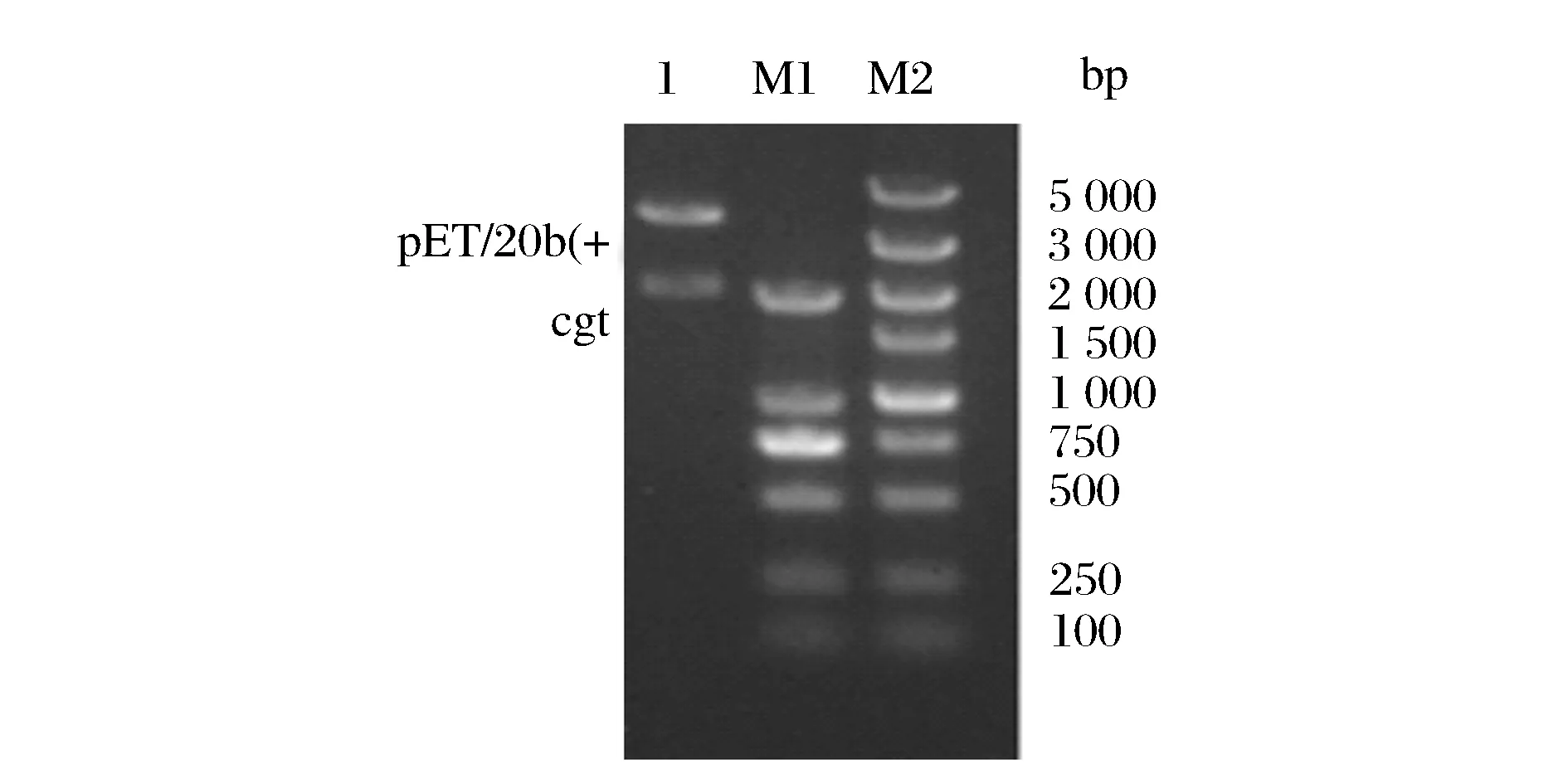
M1,M2-DNA Marker;1-质粒双酶切后的条带图4 重组质粒pET-20b(+)-cgt酶切验证Fig.4 Restriction analysis of recombinant plasmid pET-20b(+)-cgt
2.2.2 突变对酶活及α-熊果苷产量的影响
对原始酶的第299位氨基酸进行突变后酶活也相应的改变,原始酶的粗酶液的酶活为 60 U/mL,突变体Y299 A的岐化活力为 69 U/mL,通过定点突变,酶的歧化活力得到了提高。通过对突变酶生产α-熊果苷的条件优化发现其最适酶转化条件与野生酶相同,因此在20 mmol/L pH 6.0的柠檬酸-磷酸盐缓冲液体系中加入终浓度为50 g/L麦芽糊精,HQ含量为8 g/L ,水浴摇床在不同的温度中反应24 h,反应结束后加入糖化酶处理后经高效液相色谱(HPLC) 分析。结果如图5所示:野生型的转化率为25%,突变体转化率可达到40%,突变体Y299A 相对于野生型转化的熊果苷产量取了较显著的提高。

图5 野生型 CGT 酶与麦芽九糖抑制剂在实299位氨基酸处的作用的模拟结构Fig.5 Close-up the wild-type CGTases theoretical structure with a maltononaose substrate at acceptor Site
推测突变体的转化率提高的原因,利用SWISS-MODEL蛋白模拟系统,模拟CGT酶的晶体结构。通过结构比对(如图5),发现突变前第299位酪氨酸在受体位点+1和+2之间,该位点在空间结构中处于非常重要的位置。Tyr的较大的苯环侧链形成了空间位阻,较大程度的阻挡了+2位附近的受体氧原子攻击糖基-酶共价中间体,导致转糖基作用较弱[16]。通过结构模拟将Tyr突变为侧链最短的非极性的丙氨酸Ala,如图6所示,CGT 酶第299 位的氨基酸由Tyr突变为Ala后苯环对受体位点的空间位阻效应消失,使得HQ和糖基-酶的共价中间体更好地接触而且Ala为非极性氨基酸,对非极性的HQ亲和性高于极性的酪氨酸更加有利于转糖基作用。
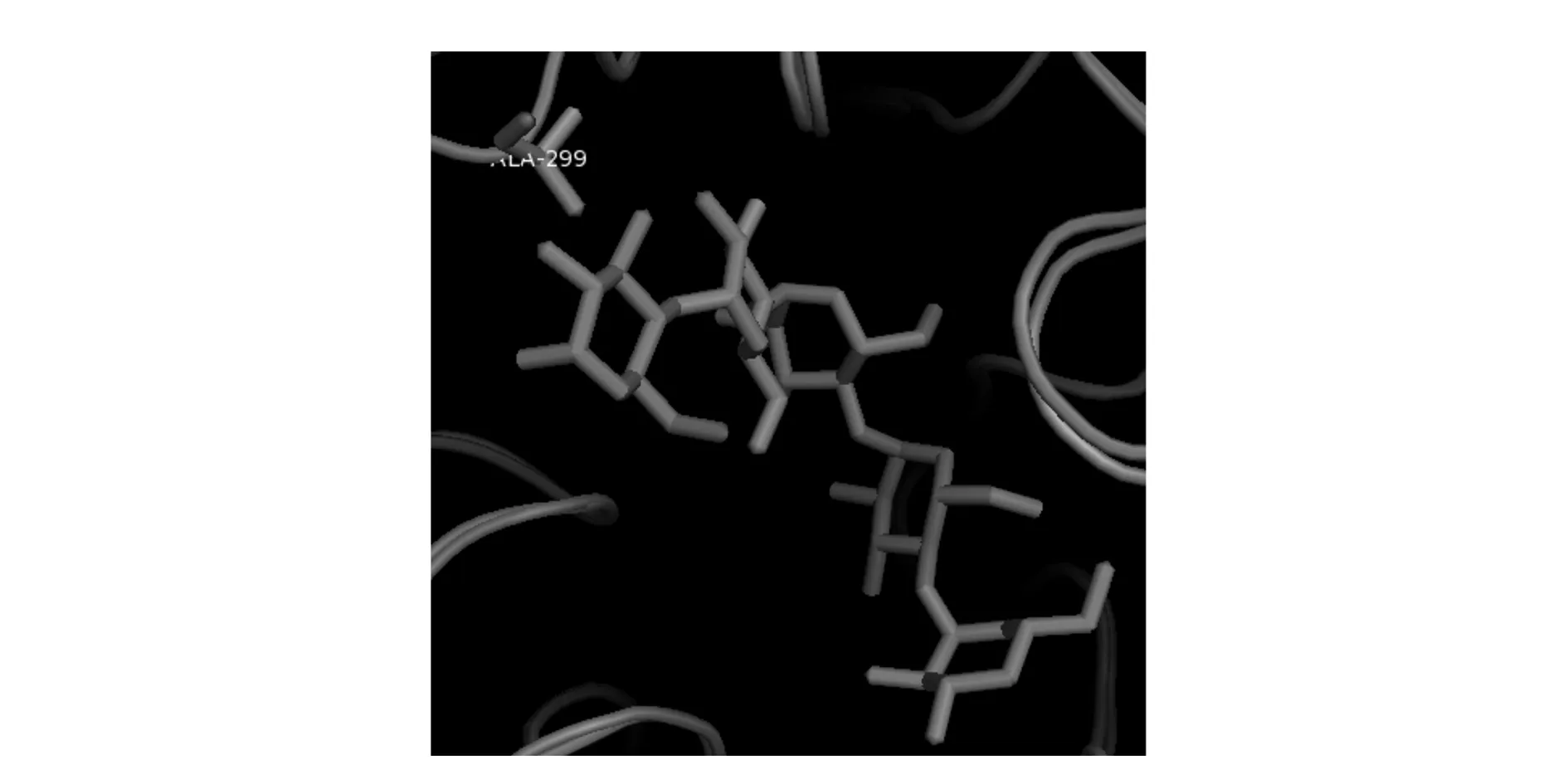
图6 突变型 CGT 酶与麦芽九糖抑制剂在实299位氨基酸处的作用的模拟结构Fig.6 Close-up the mutant CGTases theoretical structure with a maltononaose substrate at acceptor Site
3 结语
本实验将来源于A.gottschalkii、P.macerans、B.stearothermophilusNO2以及B.circulans251的CGTase用于生产α-熊果苷,分别探索了温度,pH,对苯二酚浓度对酶反应转化率的影响,得出最适温度均为40℃,最适pH均为6.0,最佳底物浓度为50 g/L的麦芽糊精,对苯二酚的质量浓度为8 g/L时,反应24 h均达到平衡,糖化酶处理熊果苷的转化率分别为25%、20%、14%、11%。利用定点突变将A.gottschalkiiCGTaseTyr 299突变为Ala,获得突变基因Y299A,相同条件下突变酶Y299A的α-熊果苷的转化率为40%,实现了α-熊果苷的产量的提高,转化率达到了目前利用CGTase生产α-熊果苷的最高。
[1] 周桦,吴晓势,张晓炜,等.毛细管气相色谱法测定化妆品中熊果苷[J].中国公共卫生,2002,18(5): 584.
[2] 郑晓珂,毕跃峰,冯卫生,等.卷柏化学成分研究[J].药学学报,2004,39(4): 266-268.
[3] FUNAYAMA M,ARAKAWA H,YAMAMOTO R,et al.Effects of alpha-and beta-arbutin on activity of tyrosinases from mushroom and mouse melanoma[J].Biosci Biotechnol Biochem,1995,59(1):143-144.
[4] NISHIMURA T,KOMETANI T,OKADS S.Inhibitory effects of hydroquinone-o-glueoside on melanin synthesi[J].YakugakuZasshi,1995,115(8): 620-626.
[5] 郭起,陈朗秋,蔡进,等.熊果苷的合成新方法[J].化学试剂,2010,32(1):17-20
[6] KITAO S,SEKINE H.α-D-Glucosyl transfer to phenolic compoundsby sucrose phosphorylase fromLeuconostocmesentkroidesand production of arbutin[J].Biosci Bioteeh Biochem,1994,58(1):38-42.
[7] 赵如奎,吴剑荣,詹晓北.α-环糊精葡萄糖基转移酶催化合成 α-熊果苷[J].生物加工过程,2015,13(4):11-13.
[8] SINDHU M, PATRICK A.Regioselective glycosylation of hydroquinone to α-arbutin by cyclodextrin glucanotransferase fromThermoanaerobactersp.[J]. Biochemical Engineering Journal ,2013,79:187-193.
[9] VASSILEVA A,BURHAN N,BESCHKOV V,et al.Cyclodextrin glucanotransferase production by free and agar gel immobilized cells ofBacilluscirculansATCC 21783[J].Process Biochem,2003,8(11) :1 585-1 591.
[10] KLEIN C,SCHULZ G E. Structure of cyclodextringlycosyltransferaserefined at 2.0 Å resolution[J]. Journal of Molecular Biology, 1991,217(4): 737-750. DOI:10.1016/0022-2836(91)90530-J
[11] STROKOPYTOV B, KNEGTEL RMA, PENNINGA D, et al.Structure of cyclodextringlycosyl transferase complexed with a maltononaose inhibitor at 2.6 Åresolution. Implications for product specificity[J].Biochemistry, 1996, 35(13): 4 241-4 249.
[12] 许乔艳,韩瑞枝,李江华,等.亚位点+1 处突变提高软化类芽胞杆菌环糊精糖基转移酶底物麦芽糊精特异性[J].生物工程学报, 2014, 30(1): 98-108.
[13] LEEMHUIS H, ROZEBOOM HJ, WILBRINK M, et al.Conversion of cyclodextrin glycosyltransferase into a starch hydrolase by directed evolution: the role of alanine 230 in acceptor subsite +1[J]. Biochem, 2003,42(24): 7 518-7 526.
[14] SHIN Hyun-dong, PARK Tae-Hyung, LEE Yong-Hyun,et al.Site-directed mutagenesis and functional analysis of maltose-binding site of β-cyclodextrin glucanotransferase fromBacillusfirmusvar.alkalophilus[J]. Biotechnology Letters, 2000(22):115-121.
[15] ARNOLD K, BORDOLI L, KOPP J, et al. The SWISS-MODEL workspace: a web-based environment for protein structure homologymodeling[J]. Bioinformatics, 2006, 22(2): 195-201.
[16] UITDEHAAG J C M, MOSI R, KALK K H, et al. X-ray structures along the reaction pathway of cyclodextringlycosyltransferase elucidate catalysis in the α-amylase family[J]. Nat Struct Biol, 1999, 6(5):432-436.
[17] LI Z, LI B, GU Z, et al. Extracellular expression and biochemical characterization of α-cyclodextringlycosyltransferase fromPaenibacillusmacerans[J].Carbohyd Res, 2010, 345(7): 886-892.
[18] Van der Veen BA, UITDEHAAG J, PENNINGA D, et al. Rational design of cyclodextrin glycosyltransferase fromBacilluscirculansstrain 251 to increase α-cyclodextrin production[J]. J MolBiol, 2000,296(4): 1 027-1 038.
[19] HYUN-DONG S,PARK T H,LEE Y H. Site-directed mutagenesis and functional analysis of maltose-binding site of β-cyclodextrin glucanotransferase fromBacillusfirmusvar. alkalophilus[J]. Biotechnology Letters, 2000, 22(2): 115-121.
Optimization of conditions for production of α-arbutin by cyclodextrin glucosyltransferase and its molecular modification
ZHANG Wen-lei1,2,SU Ling-qia1,2,TAO Xiu-mei1,2,WU Jing1,2*
1(State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(School of Biotechnology and Key Laboratory of Industrial Biotechnology Ministry of Education, Jiangnan University, Wuxi 214122, China)
α-CGTase ofPaenibacillusmacerans,β-CGTase ofBacilluscirculans251, α/β-CGTase ofBacillusstearothermophilusNO2andAnaerobrancagottschalkiiwere selected to study the effects of cyclodextrin glucosyltransferase (CGTase) on production of α-arbutin.α-arbutin was synthesized by a two-step enzymatic reaction system of CGTase and amyloglucosidase. The optimum conditions for the synthesis of α-arbutin were optimized, and the highest conversion rate of hydroquinone (HQ) was 25% by CGTase fromAnaerobrancagottschalkii. The optimum conditions for enzyme conversion were as follows: 50 g/L maltodextrin with glucose equivalent (DE) of 9%-13%, 8 g/L hydroquinone, buffer pH 6.0, reaction at 40 ℃ for 24 h. The production of α-arbutin was determined by high performance liquid chromatography. In order to further improve the conversion rate of HQ, site - directed mutagenesis on CGTase under the optimal reaction conditions was carried out, and the hydroquinone conversion rate of the mutant Y299A was 40%.
Cyclodextrin glucosyltransferase(CGTase); α-arbutin;enzyme-catalyzed;site-directed mutagenesis
硕士研究生(吴敬博士为通讯作者,E-mail:jingwu@jiangnan.edu.cn)。
国家杰出青年基金(31425020)
2016-12-12,改回日期:2017-02-18
10.13995/j.cnki.11-1802/ts.201706008
