大孔树脂纯化菠萝蜜果皮黄酮工艺
2017-07-31段宙位王世萍窦志浩
段宙位,谢 辉,何 艾,王世萍,刘 佳,窦志浩,*
(1.海南省农业科学院农产品加工设计研究所,海南海口 571100;2.海南大学食品学院,海南海口 570228)
大孔树脂纯化菠萝蜜果皮黄酮工艺
段宙位1,谢 辉1,何 艾1,王世萍1,刘 佳2,窦志浩1,*
(1.海南省农业科学院农产品加工设计研究所,海南海口 571100;2.海南大学食品学院,海南海口 570228)
本实验以菠萝蜜果皮为原料,比较5种大孔树脂对菠萝蜜果皮黄酮吸附率和解吸率的影响,筛选出适合纯化菠萝蜜果皮黄酮的大孔树脂,通过单因素和正交实验优化纯化工艺;测定菠萝蜜果皮黄酮纯化前后清除DPPH自由基和ABTS自由基作用,分析纯化效果。结果表明:NKA-9树脂纯化菠萝蜜黄酮效果较好,最佳条件为粗提液浓度6 mg/mL,上样流速1.5 mL/min;洗脱剂70%(v/v)乙醇,洗脱流速2.5 mL/min,菠萝蜜果皮黄酮纯度提高至80.15%。菠萝蜜果皮黄酮纯化后清除DPPH自由基和ABTS自由基IC50值分别为0.0054、0.015 mg/mL,优于纯化前的IC50值0.041、0.092 mg/mL。以上说明,NKA-9树脂适合分离纯化菠萝蜜果皮黄酮。
大孔树脂,菠萝蜜果皮黄酮,纯化
菠萝蜜,又称苞萝,是桑科桂木属常绿乔木,有“热带水果皇后”之称[1]。据统计,2014年我国菠萝蜜种植面积约20万亩,产量约120万t[2]。菠萝蜜产量高,果实硕大,含有糖类、蛋白质、维生素等多种营养物质。菠萝蜜以鲜食为主,也有加工成果脯、果酱等产品,在此过程中产生果皮果腱等废弃物约占整果的40%~60%[3]。据报道,菠萝蜜果皮富含糖类、多酚、黄酮、果胶等活性成分[4],而其中的黄酮类化合物具有抗凝血[5]、降血糖[6]、抗氧化[7]、抗肿瘤[8]、抗抑郁[9]等作用。因此,研究菠萝蜜果皮利用途径,具有重要意义。
大孔树脂法常用于天然产物分离纯化,具有稳定性高、选择性强、易操作等优点[10]。国内外应用大孔树脂纯化黄酮的报道较多,如陈晓侠等[11]用AB-8树脂纯化蛹虫草黄酮;顾采琴等[12]用H103树脂纯化香蕉皮黄酮;何彦峰等[13]用HPD400型树脂纯化枸杞黄酮,但目前未见利用大孔树脂纯化菠萝蜜果皮黄酮及比较纯化前后抗氧化性的报道。因此,本实验在提取菠萝蜜果皮黄酮的基础上,考察树脂种类、上样浓度、解吸剂、流速等因素对纯化效果的影响,确定最佳纯化条件;采用DPPH自由基法和ABTS自由基法比较纯化前后黄酮的抗氧化性,以期为菠萝蜜果皮的高值化利用提供参考。
1 材料与方法
1.1 材料与仪器
菠萝蜜 海口南北水果市场;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) Sigma公司;果胶酶(100000 U/g) 江苏锐阳生物科技有限公司;NKA-9、NKA-Ⅱ、D101、AB-8、X-5树脂 南开大学化工厂。
BSZ-100柱层析系统Φ16 mm×500 mm层析柱 上海嘉鹏科技有限公司;TU-1810分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 菠萝蜜果皮黄酮提取工艺流程 菠萝蜜果皮→清洗→烘干(55 ℃)→粉碎→过筛(40目)→浸提→过滤→测定吸光值→计算得率
1.2.2 菠萝蜜果皮黄酮的提取及含量测定
1.2.2.1 菠萝蜜果皮黄酮粗提液的制备 称取一定质量的菠萝蜜果皮粉末,按果胶酶用量300 U/g、乙醇浓度80%(v/v)、温度55 ℃、pH5.5、底物质量浓度45 g/L、时间2.0 h条件提取黄酮,经浓缩干燥后,得到纯度为13.15%的菠萝蜜果皮黄酮粗提物。将菠萝蜜果皮黄酮用20%(v/v)乙醇溶解,得菠萝蜜果皮黄酮粗提液(以下简称“粗提液”),备用。
1.2.2.2 黄酮的测定与标准曲线的绘制 参考段宙位等[14]方法测定黄酮含量,移取0.25 mL样液于10.0 mL比色管中,用蒸馏水定容至5.0 mL。分别往其中加入5%亚硝酸钠溶液0.5 mL,混匀静置6 min;再加入10%硝酸铝溶液0.5 mL,混匀静置6 min;再向其中加入1 mol/L氢氧化钠溶液4.0 mL,混匀静置15 min。同时用蒸馏水做空白对照,于510 nm波长处测定吸光度。
用70%的乙醇溶液配制成0.2 mg/mL的芦丁标准溶液,分别移取(1.0、2.0、3.0、4.0、5.0 mL)于10.0 mL的具塞试管中,用蒸馏水定容至5.0 mL。按上述方法测定吸光值,建立标准曲线方程:y=11.975x-0.0325,R2=0.9996,式中y表示吸光值,x表示芦丁质量浓度(浓度范围0.02~0.10 mg/mL)。
1.2.2.3 黄酮纯度的测定 取0.25 mL样品溶液,按1.2.2.2方法测定吸光度,按下式计算黄酮纯度。
纯度(%)=(A+0.0325)×40×V×100/(11.975×1000m)
式中,A为吸光值;V为样液体积(mL);m为样品质量(g);40为稀释倍数。
1.2.3 树脂吸附与解吸特性的测定 参考陈建中等[10]方法,计算大孔树脂对菠萝蜜果皮黄酮粗提液的吸附量、吸附率、解吸率与回收率。
1.2.4 树脂预处理 参考吴海霞等[15]方法处理树脂。
1.2.5 吸附与解吸实验
1.2.5.1 树脂的筛选 取1.2.4方法处理的5种树脂各5.0 g,加入100 mL粗提液,30 ℃下振摇(180 r/min)3 h,测定吸光值;将上述树脂,用超纯水洗至无色,加入70%乙醇100 mL,振摇(180 r/min)20 min,取上清液,510 nm处测定洗脱液吸光值。
1.2.5.2 粗提液浓度对吸附效果的影响 配制4.0~8.0 mg/mL粗提液,量取上述溶液各100 mL,向其中加入NKA-9树脂5.0 g,振摇3 h,取上清液,510 nm处测定吸光值。
1.2.5.3 洗脱剂对菠萝蜜果皮黄酮解吸率的影响 取饱和吸附的NKA-9树脂各5.0 g,分别加入50%~90%(v/v)乙醇100 mL,振摇20 min,取上清液,510 nm处测定吸光值。
1.2.5.4 上样流速对菠萝蜜果皮黄酮吸附率的影响 准确称取一定量的树脂,填充于Φ16 mm×500 mm层析柱内,以1.0~3.0 mL/min流速上样层析柱,取流出液,510 nm处测定吸光值。
1.2.5.5 洗脱流速对菠萝蜜果皮黄酮解吸率的影响 将粗提液按上述最优条件上柱,待吸附平衡后,用70%乙醇,以1.5~3.5 mL/min流速洗脱,取流出液,510 nm处测定吸光值。
1.2.5.6 菠萝蜜果皮黄酮纯化正交实验 选择影响菠萝蜜果皮黄酮回收率较大的四个因素粗提液浓度、上样流速、解吸剂、洗脱流速做正交实验,因素水平如表1所示。
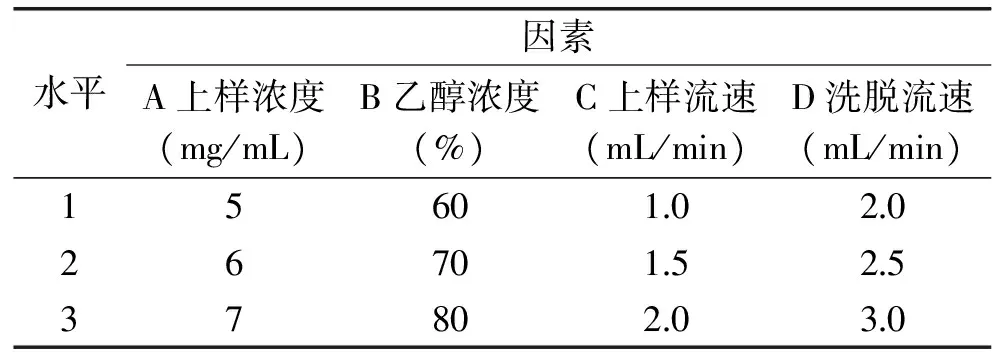
表1 因素与水平表Table 1 Factors and levels table
1.2.5.7 动态吸附与洗脱曲线的绘制 将1.2.4方法处理的NKA-9树脂填充(湿法装柱)于层析柱中,以1.5 mL/min速度将6.0 mg/mL粗提液通过层析柱,分管收集,每管9 mL,测定吸光值。按每10管1个柱体积(BV),绘制吸附曲线。待吸附平衡后,用70%(v/v)乙醇以2.5 mg/mL速度洗脱,同上述方法收集洗脱液,绘制洗脱曲线。
1.2.6 菠萝蜜果皮黄酮纯化效果分析 比较菠萝蜜果皮黄酮纯化前后的纯度,清除DPPH自由基[16]与ABTS自由基[17]能力,分析黄酮的纯化效果。
1.2.7 数据处理 所有实验数据重复3次取平均值,采用Excel 2007进行数据统计分析,Origin8.5软件绘制图形。
2 结果与分析
2.1 树脂吸附与解吸实验
2.1.1 树脂筛选 大孔树脂的表面性质、孔径及比表面积对被吸附物的吸附特性影响较大[12]。由表2可知,极性树脂NKA-9与NKA-Ⅱ树脂对菠萝蜜果皮黄酮的吸附能力较强;乙醇对树脂的解吸效果较好,其中AB-8树脂的解吸率最高,NKA-9树脂次之。这可能是因为菠萝蜜果皮黄酮是一种极性物质,分子质量比较小,根据树脂吸附特性,极性树脂对极性物质有较强的吸附能力,吸附树脂易于分离与其孔径相当的化合物,菠萝蜜果皮黄酮在极性、孔径较小的树脂上更易吸附分离,同样条件下树脂比表面积越大,吸附量越大;而在洗脱过程中,树脂和菠萝蜜果皮黄酮之间主要靠范德华力结合,结合能力较弱,易被乙醇破坏,解吸效果较好。综合考虑大孔树脂对菠萝蜜果皮黄酮的吸附与解吸性能,确定NKA-9大孔树脂作为吸附填料。

表2 不同树脂吸附与解吸性能比较Table 2 Static adsorption and desorption of different resins
2.1.2 粗提液浓度对吸附效果的影响 由图1可知,粗提液浓度在4~6 mg/mL时,吸附率变化较小,吸附量逐渐增大;当浓度大于6 mg/mL时,吸附率逐渐变小,吸附量变化不大。这是因为粗提液浓度过高,超出树脂的吸附能力,吸附率下降;浓度过低树脂未达到饱和吸附,吸附量增加。综合考虑NKA-9树脂对菠萝蜜果皮黄酮吸附率与吸附量的影响,样品浓度选择6 mg/mL左右为宜。

图1 粗提液浓度对吸附效果的影响Fig.1 Effect of concentration on the adsorption efficiency of crude flavonoids from jackfruit peel
2.1.3 洗脱剂对菠萝蜜果皮黄酮解吸率的影响 由图2可知,被吸附的菠萝蜜果皮黄酮用70%(v/v)乙醇洗脱效果较好,增加或降低乙醇浓度,均影响洗脱效果。这可能是因为70%(v/v)乙醇易把吸附的菠萝蜜果皮黄酮从树脂中萃取出来。因此,洗脱剂(乙醇)浓度选择70%(v/v)左右为宜。

图2 乙醇浓度对菠萝蜜果皮黄酮解吸率的影响Fig.2 Effects of ethanol concentration on the desorption ratio of flavonoids from jackfruit peel
2.1.4 上样流速对吸附率的影响 由图3可知,粗提液上样流速越快,吸附率越小,这是因为粗提物通过层析柱速度快,菠萝蜜果皮黄酮未被NKA-9树脂充分吸附便流出层析柱。1.5 mL/min流速下,NKA-9树脂对粗提液的吸附率仅比1.0 mL/min时低0.91%,但粗提液处理量增加了0.5倍。在较高吸附率前提下,适当加快粗提液上柱速度,利于生产,因此,上样流速选择1.5 mL/min左右为宜。

图3 上样流速对吸附率的影响Fig.3 Effect of flow velocity on the adsorption ratio of flavonoids from jackfruit peel
2.1.5 洗脱流速对解吸率的影响 由图4可知,解吸率随乙醇洗脱速度增大而降低,这是因为乙醇洗脱树脂速度较快时,乙醇与黄酮接触不充分,不能将其完全置换出来。2.5 mL/min流速下,乙醇洗脱树脂的解吸率仅比1.5 mL/min时低1.93%,但黄酮洗脱量增加66.67%。在较高解吸率前提下,适当加快乙醇洗脱速度,利于生产应用,因此,洗脱流速选择2.5 mL/min左右为宜。

图4 洗脱流速对解吸率的影响Fig.4 Effect of elution velocity on the desorption ratio of flavonoids from jackfruit peel

表4 方差分析表Table 4 Analysis of variance table
2.1.6 正交实验结果 由表3可知,影响NKA-9树脂纯化菠萝蜜果皮黄酮效果的四个因素次序为A>B>C>D,即上柱浓度>乙醇浓度>上样流速>洗脱流速,最优水平A2B2C1D1。由表4可知,四个因素对菠萝蜜果皮黄酮回收率影响均不显著,且上样流速、洗脱流速对回收率的影响更小,综合考虑回收率、纯化效率,最终确定菠萝蜜果皮黄酮的纯化工艺为A2B2C2D2,即粗提液浓度6 mg/mL、洗脱剂70%乙醇、上样流速1.5 mL/min、洗脱流速2.5 mL/min。按照A2B2C2D2条件补加实验,得黄酮回收率为82.16%,进一步验证此工艺对纯化菠萝蜜果皮黄酮有效。

表3 正交实验结果Table 3 Result of orthogonal design
2.2 菠萝蜜果皮黄酮动态吸附与洗脱曲线
由图5可知,流出液中黄酮浓度随粗提液用量的增加而增大,当粗提液用量小于20 BV时,流出液中含有较少的黄酮,说明大部分粗提液被吸附;当粗提液用量大于20 BV时,流出液中黄酮含量增加较快,其中粗提液用量65 BV时,流出液中黄酮的浓度达81.34 μg/mL,接近于菠萝蜜果皮黄酮粗提液初始浓度,说明吸附达到平衡。

图5 菠萝蜜果皮黄酮动态吸附曲线Fig.5 Dynamic adsorption curve of flavonoids from jackfruit peel
由图6可知,当乙醇用量小于1.5 BV时,菠萝蜜果皮黄酮的溶出随着洗脱剂用量增加而增大,在乙醇用量1.5 BV时,洗脱液中黄酮浓度达到最大值903.55 μg/mL;当乙醇用量大于1.5 BV时,黄酮的溶出随洗脱剂用量增大而减小,其中4.5 BV时洗脱液中黄酮浓度为57.97 μg/mL,到7 BV时黄酮浓度仅为6.23μg/mL,说明此时解吸基本完成。

图6 菠萝蜜果皮黄酮动态洗脱曲线Fig.6 Dynamic elution curve of flavonoids from jackfruit peel
2.3 菠萝蜜果皮黄酮纯化前后效果比较
由表5可知,菠萝蜜果皮黄酮经NKA-9树脂纯化后,纯度由13.15%提高至80.15%;清除DPPH自由基IC50值由0.041 mg/mL降低至0.0054 mg/mL;清除ABTS自由基IC50值由0.092 mg/mL降低至0.015 mg/mL,说明经NKA-9树脂纯化后菠萝蜜果皮黄酮的纯度和抗氧化性明显增强,NKA-9树脂纯化菠萝蜜果皮黄酮效果较好。
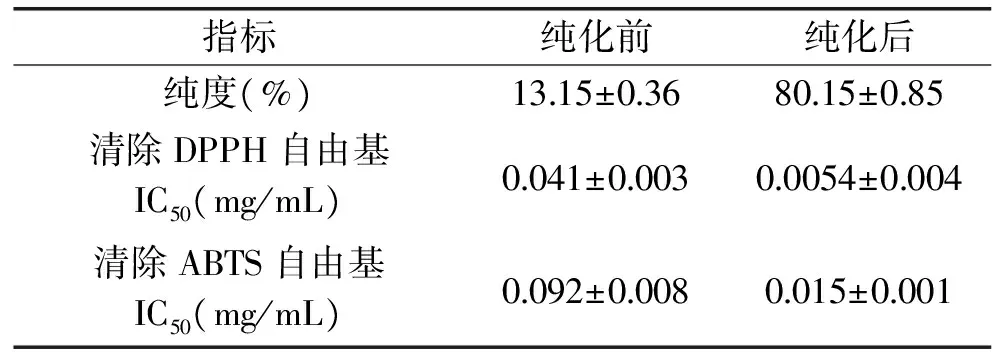
表5 菠萝蜜果皮黄酮纯化前后效果比较Table 5 Comparison purification effect of flavonoids from jackfruit peel
3 结论
比较了5种大孔树脂对菠萝蜜果皮黄酮的吸附与解吸特性,筛选出NKA-9大孔树脂适合分离纯化菠萝蜜果皮黄酮。通过树脂吸附-解吸实验,确定最佳纯化条件为粗提液浓度6 mg/mL,上样流速1.5 mL/min;洗脱剂70%(v/v)乙醇,流速洗脱2.5 mL/min。此条件下,黄酮回收率为82.16%(相对于菠萝蜜果皮黄酮粗提物),纯度提高至80.15%。比较了菠萝蜜果皮黄酮纯化前后的抗氧化性,菠萝蜜果皮黄酮纯化后清除DPPH自由基和ABTS自由基IC50值分别为0.0054、0.015 mg/mL,优于纯化前的0.041、0.092 mg/mL,说明经过NKA-9大孔树脂纯化后菠萝蜜果皮黄酮的纯度显著提高,抗氧化性明显增强。
[1]Jagtap U B,Waghmare S R,Lokhande V H,et al.Preparation and evaluation of antioxidant capacity of Jackfruit(ArtocarpusheterophyllusLam.)wine and its protective role against radiation induced DNA damage[J]. Industrial Crops and Products,2011,34(3):1595-1601.
[2]张星启,宋贤良,陈颖森,等. 响应面优化菠萝蜜果皮果胶的酶法提取工艺[J].广东农业科学,2015,11(3):89-93.
[3]姚定.菠萝蜜果皮果胶提取及特性研究[D].合肥:安徽农业大学,2009.
[4]Tan Y,Li H,Lai W,et al. Crude Dietary Polysaccharide Fraction Isolated from Jackfruit Enhances Immune System Activity in Mice[J]. Journal of Medicinal Food,2013,16(7):663-668.
[5]Lin Yuheng,Shen Xiaolin,Yuan Qipeng,et al. Microbial biosynthesis of the anticoagulant precursor 4-hydroxy-coumarin[J]. Nature Communications,2013(4):2603.
[6]Baliga M S,Shivashankara A R,Haniadka R,et al. Phytochemistry,nutritional and pharmacological properties of Artocarpus heterophyllus Lam(jackfruit):A review[J]. Food Research International,2011,44(7):1800-1811.
[7]Coelho P S,Monteiro A A.Expressin of resistance to downy
mildew at cotyledon and adult plant stages in Brassica oleracea[J].Euphytica,2003,133:279-284.
[8]Shen N,Huang X D,Li Z W,et al. Effects of hemerocallis citrine baroni flavonids on CCl4-induced liver fibrosis of rats[J]. Acta pharmaceutica Sinica,2015,50(5):547-551.
[9]Paulke A,Noldner M,Schubert M,et al. St.John’s wort flavonoids and their metabolites show antidepressant activity and accumulate in brain after multipleoral doses[J]. Pharmazie,2008,63(4):296-302.
[10]陈建中,葛水莲,昝立峰,等. 响应面优化大孔树脂分离纯化茼蒿总黄酮[J].食品与发酵工业,2015,41(11):115-120.
[11]陈晓侠,宋渊,张纪柏. 吸附树脂对蛹虫草黄酮纯化工艺条件纯化[J].食品科学,2015,36(4):68-73.
[12]顾采琴,谢琳琳,张织芬. 香蕉皮黄酮的分离纯化及抑菌活性研究[J].食品科学,2014,34(16):98-102.
[13]何彦峰,杨仁明,胡娜,等. 大孔吸附树脂纯化枸杞总黄酮的研究[J].食品工业科技,2012,33(18):274-278.
[14]段宙位,李维国,窦志浩,等. 沉香叶黄酮类化合物的提取及其抗氧化活性[J].食品科学,2015,36(6):45-50.
[15]吴海霞,吴彩娥,李婷婷.大孔树脂纯化银杏叶黄酮的研究[J].现代食品科技,2013,29(12):2964-2969.
[16]Li Yanhong,Jiang Bo,Zhang Tao,et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chemistry,2008,106(2):444-450.
[17]Stphanie Dudonne,Xavier Vitrac,Philippe Couti6re,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agriculture and Food Chemistry,2009,57(5):1768-1774.
Purification of flavonoids from jackfruit peel with macroporous resin
DUAN Zhou-wei1,XIE Hui1,HE Ai1,WANG Shi-ping1,LIU Jia2,DOU Zhi-hao1,*
(1.Institute of Processing&Design of Agroproducts,Hainan Academy of Agricultural Science,Haikou 571100,China;2.Collage of Food Science and Technology,Hainan University,Haikou 570228,China)
The best macroporous resin for purification jackfruit peel flavonoids was selected from five types resin by adsorption and desorption capacities. Based on single factor test,an orthogonal design was applied to optimize purification process. Analysis purification effect was evaluated by DPPH and ABTS radical scavenging assay. The results showed that NKA-9 macroporous resin was feasible for the purification. During the resin adsorption process,the optimum adsorption conditions were sample concentration 6 mg/mL,flow rate 1.5 mg/mL. The desorption conditions were elution concentration 70%(v/v)alcohol,with eluanting velocity 2.5 mL/min .The optimized purification increased the purity of the flavonoid extract from jackfruit peel to 80.15%. The IC50of the final purified product for scavenging DPPH and ABTS free radicals were 0.0054,0.015 mg/mL,much better than 0.041,0.092 mg/mL of crude flavonoids. The results suggested that NKA-9 type macroporous resin can be used to purify the flavonoids from jackfruit peel.
macroporous resin;flavonoids from jackfruit peel;purification
2017-02-14
段宙位(1985-),男,硕士,助理研究员,研究方向:营养与功能食品研究,E-mail:universeduan@163.com。
*通讯作者:窦志浩(1961-),男,本科,研究员,研究方向:农产品加工与保鲜,E-mail:513408658@qq.com。
海南省省属科研院所技术开发研究专项(KYYS-2015-10)。
TS201.2
B
1002-0306(2017)13-0186-05
10.13386/j.issn1002-0306.2017.13.035
