新型含双酚衍生物三枝氟硼二吡咯染料的合成及其光物理性能
2017-07-31丁丽萍王南翔
丁丽萍, 祁 欣, 王南翔, 甄 文
(南京航空航天大学 材料科学与技术学院,江苏 南京 210016)
·研究论文·
新型含双酚衍生物三枝氟硼二吡咯染料的合成及其光物理性能
丁丽萍, 祁 欣*, 王南翔, 甄 文
(南京航空航天大学 材料科学与技术学院,江苏 南京 210016)
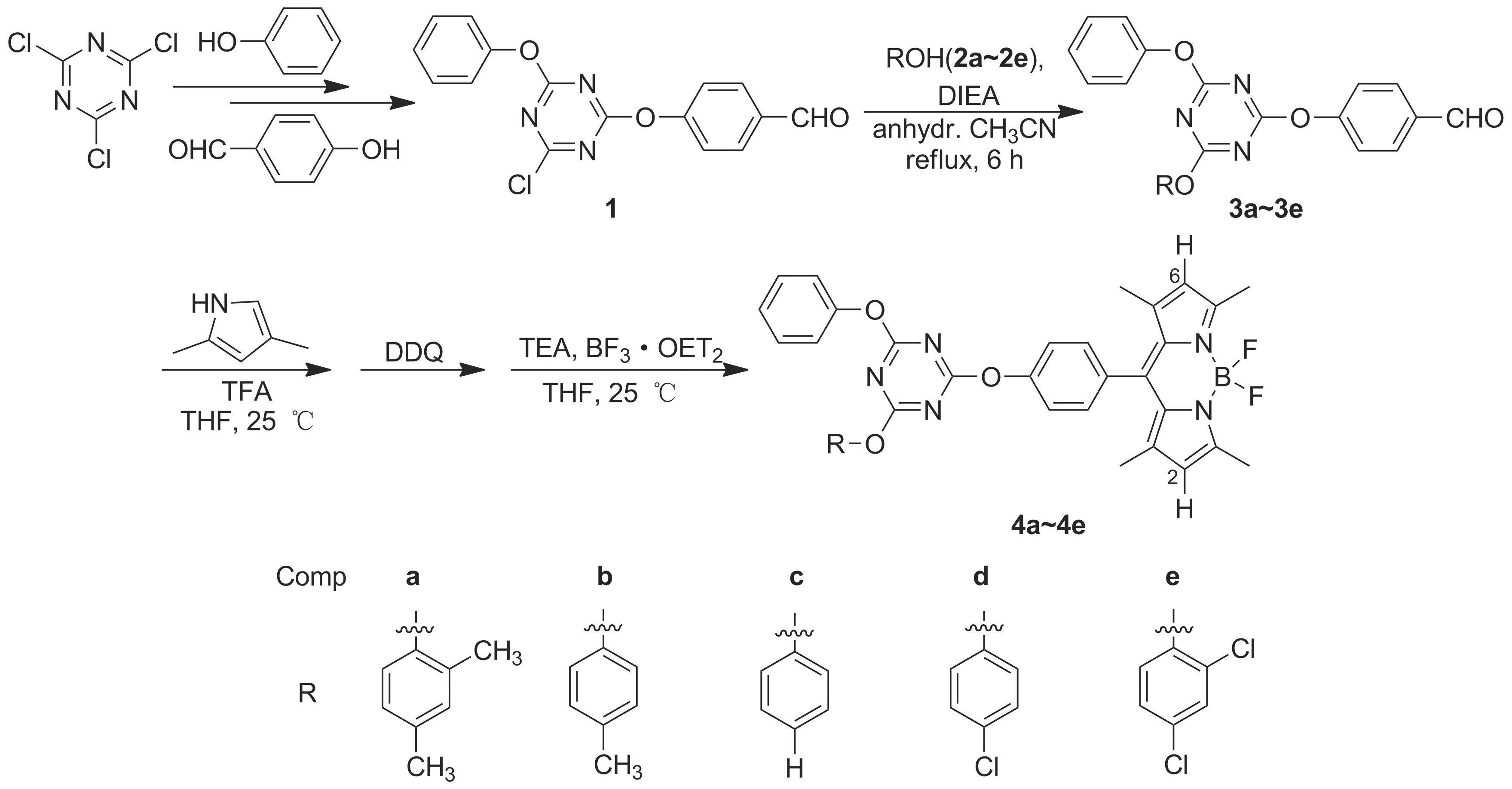
以三聚氯氰为原料合成含醛基的二酚氧基取代中间体(1); 1分别与酚衍生物(2a~2e)经取代反应制得三酚氧基中间体(3a~3e); 3a~3e经缩合、氧化和配位等反应合成了5个新型的含双酚衍生物三枝氟硼二吡咯(BODIPY)荧光染料(4a~4e),其结构经1H NMR,13C NMR和HR-MS(ESI)表征。4a~4e的最大吸收波长和发射波长分别位于499 nm和508 nm,荧光量子产率为0.41~0.55,显示出BODIPY荧光核典型的光物理性能。
三聚氯氰; 氟硼二吡咯; 三酚氧基取代; 三枝; 合成; 荧光染料
氟硼二吡咯(BODIPY)具有高消光系数、高荧光量子产率以及对光和化学反应的高稳定性,是近30年中发展起来的一种非常重要的荧光材料[1-2],被广泛应用于荧光标记[3]、化学传感器[4]、太阳能转换[5]及光动力治疗剂[6]等诸多领域。目前已有大量有关该类荧光材料结构的研究,以提高荧光量子产率、实现红/近红外发射、增大斯托克斯位移及增强光稳定性等[7-8]。其中,
Scheme 1
对于荧光团[9-11]和8-位芳环[12-13]的后期修饰是两种常用的拓展结构多样性和改变BODIPY性能的途径。
对于8-位芳环的化学修饰,由于荧光核平面与芳环平面近于相互垂直,在芳环上引入官能团几乎不会对BODIPY光物理性能产生影响,因此,该途径被更多地用于引入某些化学官能团以实现特定的性能和应用,如基于光诱导电子转移(PET)类的荧光传感器[14-16]。按照这种合成方案,文献报导了一种由1,3,5-三噁嗪环桥联的三枝BODIPY结构[17-19],分别联接BODIPY的8-位芳基和两个亲核基团,其合成路线基于三聚氯氰在不同温度下的顺次亲核取代反应。该方法操作简便、通用,既可引入了不同的官能团又无需化学修饰BODIPY荧光核母体结构。
在本课题组前期报道的单酚三枝BODIPY工作基础上[20],为进一步拓展结构的多样性和合成条件,本文以三聚氯氰为原料合成二酚氧基取代中间体(1),进而与5个酚衍生物经取代反应制得系列三取代中间体3a~3e,再经缩合、氧化和配位等反应合成了5个新型的含双酚衍生物的三枝氟硼二吡咯染料(4a~4e, Scheme 1),其结构经1H NMR,13C NMR和HR-MS(ESI)表征。并研究了化合物的光物理性质。
1 实验部分
1.1 仪器与试剂
WRS-1A型数字熔点仪(温度未校正);UV-1800型紫外-可见分光光度计;Bruker AVANCE(III) 400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);IR Affinity-1型红外光谱仪(KBr压片);Bruker Daltonics micrOTOF-Q II 型质谱仪;Cary Eclipse型荧光分光光度计。
[20]方法合成;三聚氯氰(99%), Aldrich;其余所用试剂均为分析纯,其中无水四氢呋喃、苯和甲苯采用钠和二苯甲酮经回流处理,乙腈和液体有机叔胺用分子筛干燥。
以荧光素的0.1 mol·L-1NaOH溶液(Φf=0.85)为标准计算荧光量子产率[20]。
1.2 合成
(1) 3a~3e的合成(以3a为例)
氮气保护下,在反应瓶中加入1 328 mg(1.0 mmol)、乙腈20 mL、 2,4-二甲基苯酚(2a)184 mg(1.5 mmol)和N,N-二异丙基乙胺(DIEA)0.33 mL(2.0 mmol),搅拌下回流反应6 h。冷却至室温,减压浓缩,加入二氯甲烷30 mL,依次用1 mol·L-1盐酸(10 mL)、水(10 mL)、 5%碳酸钠溶液(2×10 mL)及水(10 mL)洗涤,无水硫酸钠干燥,减压浓缩后,经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶10]纯化得白色固体3a 238 mg。
分别用2b~2e代替2a,用类似的方法合成3b~3e。
3a: 产率57.4%, m.p. 126.4~127.7 ℃;1H NMRδ: 9.98(s, 1H, CHO), 7.87(d,J=8.4 Hz, 2H), 7.35(t,J=7.6 Hz, 2H), 7.30(d,J=8.4 Hz, 2H), 7.22(t,J=7.6 Hz, 1H), 7.12(d,J=8.0 Hz, 2H), 7.02(s, 1H), 6.99(d,J=8.4 Hz, 1H), 6.91(d,J=8.0 Hz, 1H), 2.30(s, 3H), 2.13(s, 3H);13C NMRδ: 190.8, 173.8, 173.0, 156.0, 151.5, 148.0, 136.0, 135.6, 134.0, 131.2, 127.6, 126.2, 122.2, 121.4, 121.0, 20.8, 16.2; IRν: 2 918(CH3), 2 852(CH3), 1 678(C=O) cm-1; MSm/z: Calcd for C24H19N3O4{[M+H]+}414.1, found 414.1。
3b: 白色固体243 mg,产率60.8%, m.p. 121.3~123.4 ℃;1H NMRδ: 9.99(s, 1H, CHO), 7.88(d,J=8.0 Hz, 2H), 7.24(m, 1H), 7.36(t,J=7.6 Hz, 4H), 7.31(d,J=8.0 Hz, 2H), 7.14(t,J=9.2 Hz, 4H), 7.01(d,J=8.0 Hz, 2H), 2.34(s, 3H);13C NMRδ: 190.7, 173.9, 173.0, 156.0, 151.1, 149.2, 136.1, 133.9, 129.7, 126.3, 122.3, 121.3, 120.9, 21.1; IRν: 3 052(ArH), 2 923(CH3), 2 840(CH3), 1 700(C=O) cm-1; HR-MSm/z: Calcd for C23H17N3O4{[M+H]+}400.129 7, found 400.129 0。
3c: 白色固体265 mg,产率68.7%, m.p.164.1~165.9 ℃;1H NMRδ: 9.99(s, 1H, CHO), 7.88(d,J=8.0 Hz, 2H), 7.36(t,J=7.2 Hz, 4H), 7.31(d,J=8.0 Hz, 2H), 7.23(t,J=7.6 Hz, 2H), 7.12(d,J=8.0 Hz, 4H);13C NMRδ: 190.8, 173.4, 173.0, 156.0, 151.5, 134.2, 129.5, 126.2, 122.3, 121.3; IRν: 3 053(ArH), 2 927(CH3), 2 838(CH3), 1 701(C=O) cm-1; MSm/z: Calcd for C22H15N3O4{[M+H]+}386.1, found 386.1。
3d: 白色固体302 mg,产率72.0%, m.p. 148.6~149.4 ℃;1H NMRδ: 10.0(s, 1H, CHO), 7.90(d,J=8.0 Hz, 2H), 7.37(t,J=8.0 Hz, 2H), 7.32(d,J=3.6 Hz, 2H), 7.30(d,J=2.8 Hz, 2H), 7.25(m, 1H), 7.10(m, 4H);13C NMRδ: 190.7, 173.8, 173.6, 173.1, 155.9, 151.4, 149.9, 134.3, 131.2, 129.6, 126.3, 122.8, 122.3, 121.3; IRν: 3 014(ArH), 2 918(CH3), 2 852(CH3), 1 708(C=O) cm-1; HR-MSm/z: Calcd for C22H14N3O4Cl{[M+H]+}420.075 5, found 420.075 1。
3e: 白色固体342 mg,产率75.3%, m.p. 120.8~122.0 ℃;1H NMRδ: 10.0(s, 1H, CHO), 7.89(dd,J=2.0, 8.0 Hz, 2H), 7.42(d,J=2.0 Hz, 1H), 7.36(m, 2H), 7.30(m, 2H), 7.23(m, 2H), 7.10(m, 3H);13C NMRδ: 190.7, 173.8, 173.2, 155.9, 151.4, 146.4, 142.8, 134.3, 131.2, 130.2, 129.5, 128.1, 126.3, 124.1, 122.2, 121.2; IRν: 3 056(ArH), 1 711(C=O) cm-1; MSm/z: Calcd for C22H13N3O4Cl2{[M+H]+}454.0, found 454.0。
(2) 染料4a~4e的合成(以4a为例)
氮气保护下在反应瓶中加入3a 207 mg(0.5 mmol)、四氢呋喃10 mL、 2,4-二甲基吡咯98 mg(1.01 mmol),搅拌下加入三氟乙酸0.15 mL,于室温反应2 h。滴加含有2,3-二氯-5,6-二氰-1,4苯醌(DDQ)114 mg(0.50 mmol)的四氢呋喃溶液10 mL,滴毕(10 min),反应1 h。经氧化铝(15~20 g)柱层析[洗脱剂:V(二氯甲烷) ∶V(甲醇)=40 ∶1]纯化得棕红色洗脱液,减压蒸干,真空干燥2 h,氮气保护下加入四氢呋喃10 mL,搅拌下加入三乙胺1.2 mL,滴加三氟化硼乙醚溶液1.5 mL,于室温反应8 h。加水(30 mL)淬灭反应,减压蒸出有机溶剂,残留物用二氯甲烷(30 mL)萃取,萃取液依次用饱和氯化钠溶液(2×30 mL)和水(30 mL)洗涤,无水硫酸钠干燥,减压浓缩后,经薄层层析[展开剂:V(二氯甲烷) ∶V(石油醚)=1 ∶5]纯化得橙红色固体4a 96.4 mg。
分别用3b~3e代替3a,用类似的方法合成4b~4e。
4a: 产率30.5%, m.p.257.2~258.6 ℃;1H NMRδ: 7.38~7.34(m, 2H), 7.25~7.17(m, 5H), 7.16(s, 1H), 7.14(s, 1H), 5.98(s, 2H, 2,6-H), 2.56(s, 6H, 3,5-H), 2.29(s, 3H), 2.16(s, 3H), 1.28(s, 6H, 1,7-H);13C NMRδ: 173.9, 173.0, 155.7, 151.6, 148.1, 143.1, 140.5, 135.9, 132.4, 131.9, 131.4, 129.5, 129.0, 127.6, 126.1, 122.2, 121.1, 118.9, 29.7, 20.8, 16.2, 14.5; IRν: 2 962(CH3), 2 922(CH3), 1 548(C=C) cm-1; MSm/z: Calcd for C36H32N5O3BF2{[M+H]+}632.3, found 632.3。
4b: 橙红色固体99.1 mg, 产率32.1%, m.p.203.1~204.9 ℃;1H NMRδ: 7.37(t,J=7.6 Hz, 2H), 7.26~7.20(m, 5H), 7.16(d,J=8.0 Hz, 4H), 7.03(d,J=8.0 Hz, 2H), 5.98(s, 2H, 2,6-H), 2.55(s, 6H), 2.32(s, 3H), 1.29(s, 6H);13C NMRδ: 173.9, 173.0, 155.8, 151.8, 151.6, 149.4, 142.9, 140.4, 135.9, 130.0, 129.2, 125.9, 122.3, 121.6, 121.0, 20.8, 14.5; IRν: 2 953(CH3), 2 920(CH3), 1 566(C=C) cm-1; HR-MSm/z: Calcd for C35H30N5O3BF2{[M+H]+}618.248 8, found 618.248 4。
4c: 红色黏稠液体86.1 mg,产率28.5%;1H NMRδ: 7.37(t,J=7.6 Hz, 4H), 7.26~7.20(m, 6H), 7.15(d,J=8.0 Hz, 4H), 5.98(s, 2H, 2,6-H), 2.55(s, 6H), 1.30(s, 6H);13C NMRδ: 173.8, 173.0, 155.8, 151.9, 151.5, 143.1, 140.4, 132.6, 131.4, 129.5, 129.0, 126.2, 122.3, 121.3, 14.6; IRν: 3 057, 2 961(CH3), 2 920(CH3), 1 593(C=C) cm-1; MSm/z: Calcd for C34H28N5O3BF2{[M+H]+}604.2, found 604.2。
4d: 红色黏稠液体93.7 mg,产率29.4%;1H NMRδ: 7.39~7.30(m, 4H), 7.27~7.21(m, 5H), 7.16~7.13(m, 2H), 7.10(dd,J=2.0 Hz, 8.4 Hz, 2H), 5.98(s, 2H, 2,6-H), 2.55(s, 6H), 1.30(s, 6H);13C NMRδ: 173.8, 173.6, 173.1, 155.8, 151.6, 149.9, 143.0, 140.4, 132.7, 131.4, 129.6, 126.3, 122.8, 122.2, 121.3, 14.5; IRν: 3 055(ArH), 2 968(CH3), 2 918(CH3), 1 591(C=C) cm-1; HR-MSm/z: Calcd for C28H22N5O2BF2Cl2[M+]637.186 4, found 637.185 6。
4e: 红色黏稠液体107 mg,产率31.9%;1H NMRδ: 7.43(s, 1H), 7.37(t,J=7.6 Hz, 2H), 7.26~7.21(m, 6H), 7.14(d,J=7.2 Hz, 3H), 5.99(s, 2H, 2,6-H), 2.56(s, 6H), 1.30(s, 6H);13C NMRδ: 173.9, 173.1, 155.8, 151.8, 151.5, 146.5, 143.0, 140.3, 130.2, 129.5, 129.1, 128.2, 127.9, 126.3, 124.1, 122.1, 121.3, 14.6; IRν: 3 065(ArH), 2 961(CH3), 2 918(CH3), 1 554(C=C) cm-1; MSm/z: Calcd for C34H26N5O3BF2Cl2{[M+H]+}672.2, found 672.2。
2 结果与讨论
2.1 合成
目标产物三枝氟硼二吡咯染料4a~4e的合成路线见Scheme 1,其中三酚氧基取代1,3,5-三噁嗪中间体3的合成是关键步骤。在3的合成中,4-羟基苯甲醛的选用引入了后续缩合反应所必要的醛基,苯酚作为一种亲核试剂,另外五个含不同取代基的苯酚衍生物2a~2e作为亲核进攻的底物。由于3的合成为三个不同苯酚类亲核试剂的顺次反应,各种可能的亲核反应活性差别不大,首先需要探索各种可能的双酚取代反应产物的分离和提纯。实验结果表明:在本文所选用的苯酚衍生物中,采用文献报道的将4-羟基苯甲醛作为第二个亲核试剂的合成方案[20],该方案最为适合,因为含有双醛基的副产物比较容易利用柱层析去除。为了简洁起见,合成过程中始终选用苯酚作为第一个引入的亲核试剂。
在3的合成中,与文献报道的苯胺衍生物双取代产物[17]不同,由于酚氧基相对较弱的给电子效应,原料双取代产物1中的氯原子具有更强的反应活性,但是在相同的反应条件下(碳酸钠的H2O/THF溶液,回流)下,初步实验中2a和2e均未得到相应的目标产物3a和3e,尽管TLC显示原料已消失。显然,苯酚衍生物2相对较弱的亲核性不足以与碱性水溶液中的水解过程相竞争。
为避免水解的影响,先以2d为亲核试剂,选用固体N,N-二甲氨基吡啶(DMAP)为傅酸剂以便于溶剂和反应温度的改变,考察了无水溶剂、有机碱作为傅酸剂对合成3d的影响,结果见表1。

表1 溶剂和反应温度对合成3d的影响
由表1可以看出,在常规加料比n(1) ∶n(2d) ∶n(DMAP)=1 ∶1.5 ∶2、反应10 h条件下,结果表明乙腈为溶剂时,3d产率最高,为52.0%,是制备3d最合适的溶剂。THF沸点低,反应温度受到限制。苯和甲苯同样收率不高,尽管后者可以提供较高的反应温度。因此,乙腈除了较高的沸点外,溶剂的极性也应是一个影响因素。而在乙腈中回流反应时间超过6 h,产率不再提高。
随后进一步研究了乙腈溶剂中几种常用有机碱对3d产率的影响,结果见表2。

表 2 有机碱对3d产率的影响
由表2可以看出,N,N-二异丙基乙基胺(DIEA)、三乙胺和吡啶为溶剂时,收率分别为72.0%, 68.2%和58.4.%。说明N,N-二异丙基乙基胺的效果最好,而吡啶相对效果最差,这可能与几种有机碱的亲核性有关,N,N-二异丙基乙基胺较大的空间位阻使其自身参与亲核进攻的可能性最低。进一步加大傅酸剂的用量以及延长反应时间(>6 h),均不能有效提高产物的产率。因此,合成三枝中间体3d的优化反应条件为:无水乙腈为溶剂,加料比n(1) ∶n(2d) ∶n(DIEA)=1 ∶1.5 ∶2,回流反应6 h。
在该条件下,合成了系列三枝中间体3,实验结果见表3。
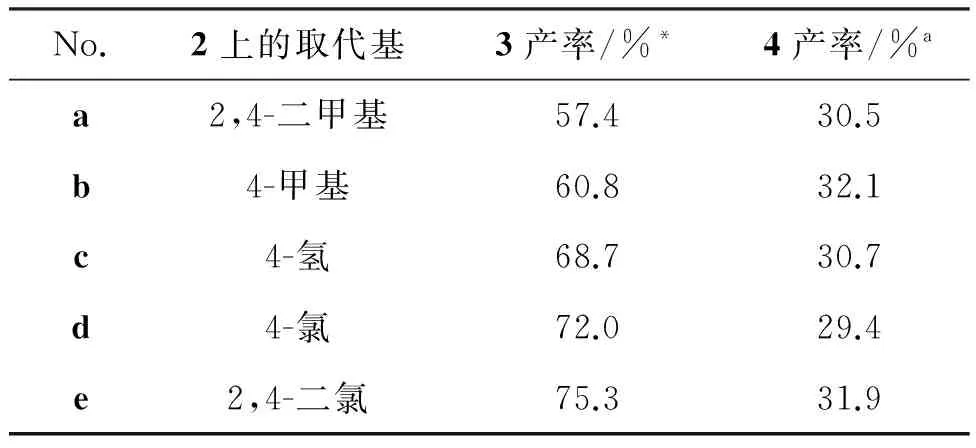
表3 三枝中间体3和染料4的产率
*以二枝中间体1计;a以三枝中间体3计。
由表3可以看出,酚2a~2e的结构对反应产率有一定影响,从2,4-二甲基苯酚到2,4-二氯苯酚,相应的3a~3e产率逐步提高。显然,随着芳环上取代基团吸电子能力的提高,酚羟基的酸性逐步增加,在碱性条件下,酚氧基团的亲核活性逐步增强。
参照文献报道的染料合成过程[17,20],室温下三氟乙酸催化3a~3e与2,4-二甲基吡咯缩合、DDQ氧化、三氟化硼配位、色谱分离,分别得到五种新型含双酚衍生物三枝氟硼二吡咯染料4a~4e,产率较好。
2.2 表征
三枝中间体3b的1H NMR分析显示了δ9.9处的醛基氢吸收峰,δ2.34处显示有甲基的单峰,13C NMR(δ190.7)和IR(1 700 cm-1处的强烈吸收带)分析同时也证明了醛基的存在。HR-MS分析表明分子离子峰位于400.129 0{[M+H]+},证明其结构正确。
对于染料4b,1H NMR分析显示δ5.98处有BODIPY环上的2-位和6-位两个质子的吸收单峰。HR-MS谱中618.248 4{[M+H]+}确证染料结构。而染料4d的HR-MS谱中强度为3 ∶1的637.185 6峰[M+]和639.186 8峰{[M+2]+},确证了结构中一个氯原子的存在。
2.3 光物理性能
对4d进行了光谱分析,图1为4d在不同溶剂中的吸收曲线和在乙腈中的荧光光谱。由图1可见,这种新型染料具有氟硼二吡咯荧光核典型的光物理性能,最大吸收和最大发射波长分别位于499 nm和508 nm附近。

图1 4d在不同溶剂中的吸收曲线和在乙腈中的荧光光谱(激发波长499 nm)
对5种新型染料进行了光物理性能分析(表4),均显示氟硼二吡咯荧光核典型的光物理性能,最大吸收和最大发射波长分别在499 nm和508 nm附近,摩尔消光系数在60 000 mol·L-1左右,荧光量子产率为0.41~0.55,斯托克斯位移值均较小(316~355 cm-1)。

表4 染料的光物理数据(乙腈溶剂,25 ℃)
a以0.1 mol·L-1荧光素的NaOH水溶液为标准 (Ff=0.85)[20]。
设计并合成了5个新型的含双酚衍生物的三枝氟硼二吡咯染料,探索了苯酚类亲核试剂的反应顺序、溶剂、反应温度和有机碱种类等影响因素,在优化的第三步反应条件下,三酚氧基取代的1,3,5-三噁嗪中间体最高产率可达75.3%。研究发现酚亲核试剂上侧链的取代基对反应产率有一定影响,从2,4-二甲基苯酚到2,4-二氯苯酚,随着吸电子能力的提高,相应的取代反应产率从57.4%提高至75.3%。所得染料具有典型的氟硼二吡咯荧光核的光物理性能。该研究工作有助于进一步拓展该结构的多样性。
参考文献
[1] Ulrich G, Ziessel R, Harriman A. The chemistry of fluorescent bodipy dyes:Versatility unsurpassed[J].Angew Chem Int Ed,2008,47(7):1184-1201.
[2] Loudet A, Burgess K. BODIPY dyes and their derivatives:Syntheses and spectroscopic properties[J].Chemical reviews,2007,107(11):4891-4932.
[3] Jia X, Yu X, Yang X,etal. A highly selective copper fluorescent indicator based on aminoquinoline substituted BODIPY[J].Dyes and Pigments,2013,98(2):195-200.
[4] Isik M, Ozdemir T, Turan I S,etal. Chromogenic and fluorogenic sensing of biological thiols in aqueous solutions using BODIPY-based reagents[J].Organic letters,2012,15(1):216-219.
[5] Wu W, Guo H, Wu W,etal. Organic triplet sensitizer library derived from a single chromophore(BODIPY) with long-lived triplet excited state for triplet-triplet annihilation based upconversion[J].J Org Chem,2011,76(17):7056-7064.
[6] Lim S H, Thivierge C, Nowak-Sliwinska P,etal.Invitroandinvivophotocytotoxicity of boron dipyrromethene derivatives for photodynamic therapy[J].Journal of medicinal chemistry,2010,53(7):2865-2874.
[7] Ni Y, Lee S, Son M,etal. A diradical approach towards BODIPY-based dyes with intense near-infrared absorption aroundλ=1 100 nm[J].Angewandte Chemie International Edition,2016,55(8):2815-2819.
[8] Boens N, Verbelen B, Dehaen W. Post functionalization of the BODIPY core:Synthesis and spectroscopy[J].European Journal of Organic Chemistry,2015,30:6577-6595.
[9] Jiang X D, Zhang H, Zhang Y,etal. Development of non-symmetric thiophene-fused BODIPYs[J].Tetrahedron,2012,68(47):9795-9801.
[10] Okujima T, Tomimori Y, Nakamura J,etal. Synthesis ofπ-expanded BODIPYs and their fluorescent properties in the visible-near-infrared region[J].Tetrahedron,2010,66(34):6895-6900.
[11] Rihn S, Retailleau P, Bugsaliewicz N,etal. Versatile synthetic methods for the engineering of thiophene-substituted bodipy dyes[J].Tetrahedron Letters,2009,50(50):7008-7013.
[12] Lee H Y, Bae D R, Park J C,etal. A selective fluoroionophore based on BODIPY-functionalized magnetic silica nanoparticles:Removal of Pb2+from human blood[J].Angewandte Chemie,2009,121(7):1265-1269.
[13] Ueno T, Urano Y, Kojima H,etal. Mechanism-based molecular design of highly selective fluorescence probes for nitrative stress[J].J Am Chem Soc,2006,128(33):10640-10641.
[14] Lu H, Zhang S S, Liu H Z,etal. Experimentation and theoretic calculation of a BODIPY sensor based on photoinduced electron transfer for ions detection[J].The Journal of Physical Chemistry A,2009,113(51):14081-14086.
[15] Dodani S C, He Q, Chang C J. A turn-on fluorescent sensor for detecting nickel in living cells[J].Journal of the American Chemical Society,2009,131(50):18020-18021.
[16] Rurack K, Kollmannsberger M, Resch-Genger U,etal. A selective and sensitive fluoroionophore for HgII,AgI,and CuII with virtually decoupled fluorophore and receptor units[J].Journal of the American Chemical Society,2000,122(5):968-969.
[17] Qi X, Kim S K, Han S J,etal. Study on the BODIPY-triazine-based tripod fluorescent systems:Various structures from similar procedure[J].Supramolecular Chemistry,2009,21(6):455-464.
[18] Röhr H, Trieflinger C, Rurack K,etal. Proton- and redox-controlled switching of photo- and electrochemiluminescence in thiophenyl-substituted boron-dipyrromethene dyes[J].Chemistry—A European Journal,2006,12(3):689-700.
[19] Lazarides T, Charalambidis G, Vuillamy A,etal. Promising fast energy transfer systemviaan easy synthesis:Bodipy-porphyrin dyads connectedviaa cyanuric chloride bridge,their synthesis,and electrochemical and photophysical investigations[J].Inorganic chemistry,2011,50(18):8926-8936.
[20] Lu J, Qi X, Yue T,etal. Synthesis and photophysical properties of tripod BODIPY dyes bearing mono-phenolic derivatives[J].Tetrahedron,2015,71(8):1304-1310.
Synthesis and Photophysical Properties of Novel Tripod BODIPY Dyes Bearing Bis-Phenolic Derivatives
DING Li-ping, QI Xin*, WANG Nan-xiang, ZHEN Wen
(College of Material Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing 210016, China)
A bis-phenoxy substituted intermediate(1) bearing an aldehyde group was synthesized from cyanuric chloride. A series of tris-phenoxy substituted intermediates(3a~3e) were synthesized by nucleophilic substitution of 1 with phenolic nucleophiles(2a~2e). Five new tripod boron dipyrromethene(BODIPY) dyes(4a~4e) bearing bis-phenolic derivatives were synthesized by condensation, oxidation, and coordination reaction from 3a~3e. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI). The maximum absorption wavelength and emission wavelength of 4a~4e located around 499 nm and 508 nm, respectively. And the fluorescent quantum yields were between 0.41~0.55. That indicated the typical photophysical properties of the BODIPY fluorophore.
cyanuric chloride; boron dipyrromethene; tris-phenoxy substitution; tripod; synthesis; fluorescent dye
2016-12-23;
2017-05-24
南京航空航天大学科研启动基金资助项目; 江苏高校优势学科建设工程项目
丁丽萍(1991-),女,汉族,江苏泰州人,硕士研究生,主要从事有机功能材料的合成研究。 E-mail: dingliping91@163.com
祁欣,教授, E-mail: qixin@nuaa.edu.cn
O626.13; O626.29
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.16324
