参附注射液对于失血性休克大鼠动物模型的内皮细胞蛋白C受体的影响
2017-07-31陆景伟朱文献苏文利王毅鑫
陆景伟, 朱文献, 苏文利, 王毅鑫
(上海市普陀区中心医院急诊科, 上海 普陀区 200062)
参附注射液对于失血性休克大鼠动物模型的内皮细胞蛋白C受体的影响
陆景伟, 朱文献, 苏文利, 王毅鑫
(上海市普陀区中心医院急诊科, 上海 普陀区 200062)
目的:本研究旨在探讨参附注射液对于失血性休克大鼠动物模型肾脏内皮细胞蛋白C受体(EPCR)表达的影响及其可能的机制。方法:成年健康SD大鼠50只,随机分为五组:空白对照组、假手术组、失血性休克组、林格液复苏组、参附注射液复苏组,每组10只。建立失血性休克大鼠动物模型成功后,林格液组采用林格液复苏;参附注射液组采用参附注射液(10mL/kg)和林格液组成的液体复苏。休克后6h分别处死大鼠,留取外周血清和肾组织,采用全自动生化分析仪检测血清尿素氮和肌酐水平,采用免疫组化检测肾脏的损伤程度,采用RT-PCR法和Western blot法检测肾脏组织EPCR的表达。结果:与空白对照组和假手术组相比较,失血性休克组大鼠血清尿素氮和肌酐水平,肾组织EPCR的表达以及肾脏组织的损伤程度明显升高(P<0.05);林格液组和参附注射液组复苏后血清尿素氮和肌酐水平,肾组织EPCR的表达以及肾脏组织的损伤程度均明显下降,差异差异有统计学意义;其中,参附注射液组的下降程度更加明显,与林格液组相比较,差异差异有统计学意义(P<0.05)。结论:失血性休克大鼠的血清尿素氮和肌酐水平,以及肾脏组织EPCR表达增加,这与失血性休克时肾脏损伤有关。参附注射液可以抑制肾组织EPCR的表达,从而起到保护肾脏功能的作用。
失血性休克; 肾损伤; 内皮细胞蛋白C受体; 参附注射液
大手术、主动脉瘤破裂、消化道大出血以及外伤等导致的血液大量丢失常常导致失血性休克(hemorrhagic shock, HS)。研究发现,大约1/3的HS患者会发生急性肾损伤(acute kidney injury,AKI)[1]。AKI会导致HS患者多器官衰竭发病率和死亡率增加[2]。肾脏组织对于血液低灌注和缺氧非常敏感。HS导致的肾脏组织缺氧,会激活免疫系统和凝血系统,产生一系列的炎症反应和凝血反应,最终导致AKI[3]。目前,已将抗炎和抗凝列为HS新的治疗靶点。血管内皮细胞广泛地参与了机体的炎症与凝血过程。血管内皮细胞受损后,其调节炎症和抗凝的功能下降,进而导致白细胞黏附,微血栓形成,发生弥散性血管内凝血(disseminated intravascular coagulation,DIC)。内皮细胞蛋白C受体(endothelial protein C receptor,EPCR)是近年来发现的位于血管内皮细胞的新型蛋白受体,是体内蛋白激酶C系统的重要的组成部分之一[4,5]。在血管内皮细胞受损后,内皮细胞释放大量的EPCR,致血浆中的可溶性EPCR升高。目前,血浆中可溶性EPCR的水平已被用来反映血管内皮细胞受损的标志。但是,目前国内外尚无研究报道HS后肾脏组织局部的EPCR的表达变化。参附注射液源自我国传统医学中的参附汤,具有“益气温阳固脱”之功。现代药理学研究发现,其可以降低血管间黏附分子-1(ICAM一1)、TNF-α等炎症因子的表达,减轻血管内皮细胞的损伤[6,7]。本研究旨在通过失血性休克大鼠模型,以血清尿素氮和肌酐水平以及肾组织EPCR的表达水平为研究指标,观察HS前后的改变,初步探讨HS早期AKI损伤的发生机制以及参附注射液的干预作用。
1 材料与方法
1.1 动物分组:成年Sprague-Dawley(SD)大鼠50只,雄性,年龄6~7周,体重250~300g,购买自四川大学华西医学中心实验动物中心。按照简单随机法随机分为五组:空白对照组、假手术组、失血性休克组、林格液复苏组、参附注射液复苏组,每组10只。动物房温度维持在25.0±0.5℃,采用常规饲料喂养,自由饮水。
1.2 失血性休克模型的建立:参考Umeda等人[8]的方法。50mg/kg戊巴比妥钠腹腔注射,麻醉成功后将其仰卧固定于鼠板上。①空白对照组:不进行其他操作,6h后取外周血和肾组织。其余4组均进行股动静脉插管。分离右侧股动脉,使用PowerLab 15T(ADInstruments,澳大利亚)行动脉插管,动脉插管经三通及压力传感器连接多功能监护仪监测平均动脉压(mean arterial pressure,MAP)。经股静脉放血,液体复苏;②假手术组:动静脉插管后不予其他操作,于6 h后取外周血和肾组织;③失血性休克组:插管成功后,15min内放血使MAP降至35mmHg,使其稳定60min,即为HS造模成功。6 h后取外周血和肾组织;④林格液复苏组:造模成功后,30min内输注3倍失血量的林格液复苏。于造模成功后的6h后取外周血和肾组织;⑤参附注射液复苏组:参附注射液10mL/kg,再输入林格液补充至失血量3倍,所有液体在30min内输完。于造模成功后的6h后取外周血和肾组织。
1.3 反转录多聚酶链反应(reverse transcription polymerase chain reaction,RT-PCR):RT-PCR检测肾组织EPCR mRNA的表达。参考基因库设计合成(上海生工生物工程技术服务有限公司):EPCR引物系列为:上游引物:5'-TCTACCTGTCCCAGTTCAA-3';下游引物:5'-CATACCGAGTCCGATTGT-3'。β-actin引物系列为:上游引物:5'-AAAGAAAGGGTGTAAAACGCA-3';下游引物:5'-TCAGGTCATCACTATCGGCAAT-3'。采用Trizol试剂盒(Invitrogen,美国)提取总RNA。按Takara公司说明书的操作步骤反转录合成cDNA。反应在Gene Amp PCR System 2400型(PE,美国)上进行。PCR循环条件为:94℃预变性5min,94℃变性30s,不同退火温度(EPCR 53.3℃,β-actin 58℃)退火30s,72 ℃延伸1min,共30~32个循环;循环结束后继续于72℃延伸5min,-20 ℃保存备用。取5μL PCR扩增产物与1μL 6 x Loadingbuffer液混合均匀后,用1.5%琼脂糖凝胶(Sigma, 美国),5V/cm进行电泳,采用Gel3.0行灰度扫描分析。以目的基因与β-actin的PCR产物条带灰度之比作为反映目的基因mRNA水平的相对指标。
1.4 Western blot检测:肾脏组织经研磨、裂解后用酶标仪测蛋白浓度,根据所测得蛋白浓度上样总蛋白质量为 80 μg,经SDS-PAGE凝胶电泳分离后,采用电印迹转移法将蛋自质转至 PVDF 膜,丽春红S染色,根据所需目标条带剪膜,用质量浓度为5%的脱脂奶粉的TBS-T溶液室温封闭2h后,分别加入兔抗大鼠EPCR单克隆抗体(R&D Systems,美国)和 GAPDH 抗体(R&D Systems,美国),4℃孵育过夜,室温下 TBS-T 溶液洗膜后加入二抗(R&D Systems,美国)孵育2 h,用TBS-T 溶液洗膜后与ECL 试剂反应,胶片曝光,扫描胶片,用Image J软件计算条带光密度(OD)值,以EPCR与 GAPDH 条带的 OD 比值来评定的 AKT、P-AKT 蛋自质的表达水平。
1.5 病理组织学检查:将肾脏置于4%多聚甲醛缓冲液固定,常规石蜡包埋,制成 3~4 μm 厚石蜡切片从上述已制成的石蜡切片中,各组随机取3张切片,采用苏木精-伊红(HE)染色,100倍光镜下观察,镜下观察各组肾脏组织形态结构及炎症细胞浸润情况,评价肾小管受损的情况。肾小管受损采用以下的损伤评分系统,0分:没有肾小管上皮细胞凋亡,管腔扩张或出血;1分:<5%的肾小管出现上皮细胞凋亡,管腔扩张或出血;2分:5~25%的肾小管出现上皮细胞凋亡,管腔扩张或出血;3分:25~75%的肾小管出现上皮细胞凋亡,管腔扩张或出血;3分:>75%的肾小管出现上皮细胞凋亡,管腔扩张或出血。
1.6 血清尿素氮和肌酐水平检测:取大鼠外周血2mL,3000g离心15min,取上层血清,采用UniCel DxC 800型全自动生化分析仪(Beckman Coulter,美国)测量血清尿素氮和肌酐水平。
2 结 果
2.1 五组大鼠的肾组织的EPCR mRNA水平比较:与空白对照组(0.726±0.458)比较,假手术组肾组织的EPCR mRNA(1.052±0.619)的表达升高,但是差异差异无统计学意义(P>0.05);失血性休克组(2.771±0.924)较空白对照组和假手术组比较均明显升高,差异有统计学意义(P<0.05);林格液复苏后(1.428±0.617)较失血性休克组表达明显下降,差异有统计学意义(P<0.05);参附注射液组(0.951±0.406)较失血性休克组和林格液组的肾组织EPCR mRNA表达亦明显下降,差异有统计学意义(P<0.05)。见图1。
2.2 五组大鼠的肾组织的EPCR蛋白质水平比较:与空白对照组(142±13ng/mL)比较,假手术组肾组织的EPCR蛋白(145±15ng/mL)质的表达升高,但是差异无统计学意义(P>0.05);失血性休克组(282±11ng/m)l较空白对照组和假手术组比较均明显升高,差异有统计学意义(P<0.05);林格液复苏后(202±18ng/mL)较失血性休克组表达明显下降,差异有统计学意义(P<0.05);参附注射液组(153±15ng/mL)较失血性休克组和林格液组的肾组织EPCR 蛋白质表达亦明显下降,差异有统计学意义(P<0.05)。见图2。
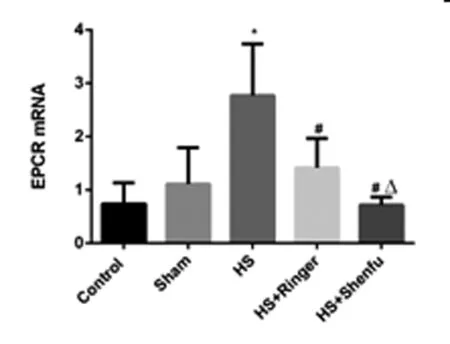
图1 五组大鼠的肾组织的EPCR mRNA水平比较
注:*与空白对照组和假手术组相比较,P<0.05;#与失血性休克组相比较,P<0.05;Δ与林格液组相比较,P<0.05
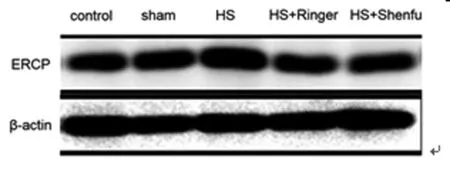
图2 五组大鼠的肾组织的EPCR 蛋白质水平比较
2.3 五组大鼠的血清尿素氮和肌酐水平比较:与空白对照组比较,假手术组血清尿素氮和肌酐的水平升高,但是差异无统计学意义(P>0.05);失血性休克组较空白对照组和假手术组比较均明显升高,差异有统计学意义(P<0.05);林格液复苏后较失血性休克组水平明显下降,差异有统计学意义(P<0.05);参附注射液组较失血性休克组和林格液组的血清尿素氮和肌酐的水平亦明显下降,差异有统计学意义(P<0.05)。见图3、表1。
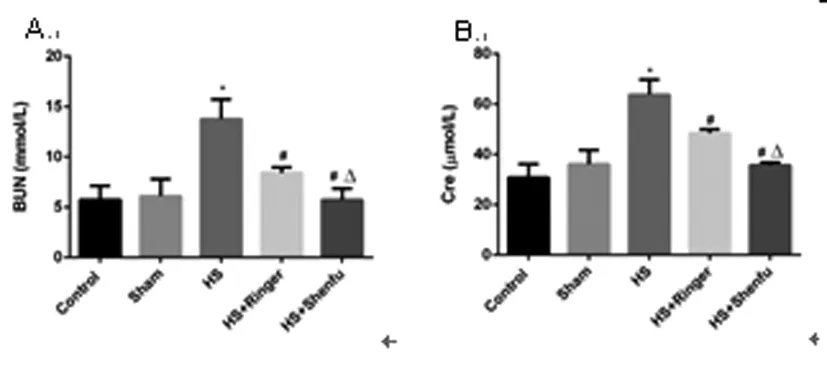
图3 五组大鼠的血清尿素氮和肌酐水平比较
A. 血清尿素氮水平比较; B.血清肌酐水平比较
注:*与空白对照组和假手术组相比较,P<0.05;#与失血性休克组相比较,P<0.05;Δ与林格液组相比较,P<0.05
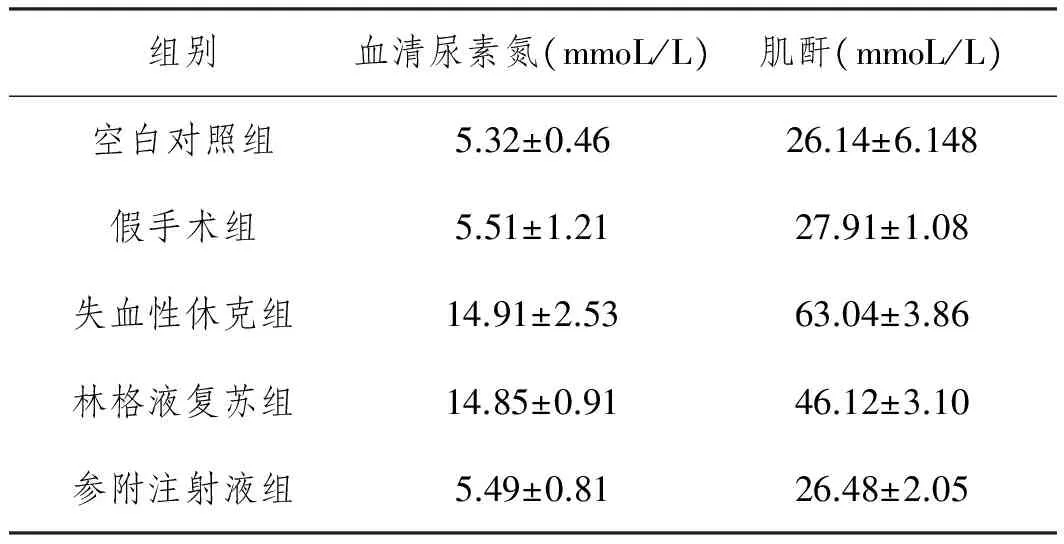
表1 五组大鼠的血清尿素氮和肌酐水平
2.4 五组大鼠的肾脏组织损伤情况比较:空白对照组(0.34±0.02分)与假手术组(0.51±0.02分)的肾小管细胞核清晰可见,核较大,边界清楚,染为蓝色。失血性休克组(2.84±0.24分)可见大量的肾小管上皮细胞水肿和凋亡,肾小管管腔扩张,出血。损伤评分明显高于空白对照组与假手术组,差异有统计学意义(P<0.05);林格液(1.37±0.13分)和参附注射液(0.54±0.01分)复苏后,肾脏组织损伤明显减轻,损伤评分明显低于失血性休克组,差异有统计学意义(P<0.05)。见图4,图5。
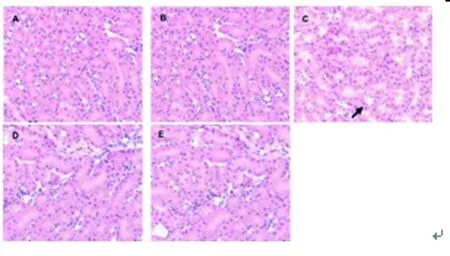
图4 五组大鼠的肾组织损伤情况比较
A.空白对照组; B.假手术组;C.失血性休克组;D.林格液复苏组;E. 参附注射液复苏组
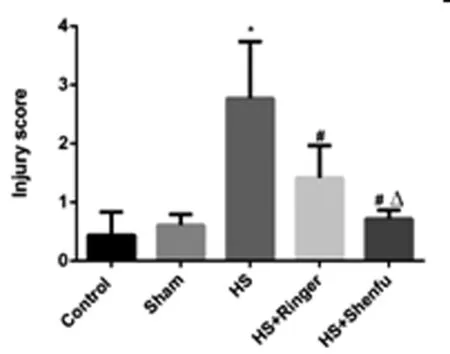
图5 五组大鼠的肾组织损伤评分比较
注:*与空白对照组和假手术组相比较,P<0.05;#与失血性休克组相比较,P<0.05;Δ与林格液组相比较,P<0.05)
3 讨 论
血管内皮细胞广泛地参与了机体的炎症与凝血过程。在机体发生失血性休克的时候,血管内皮细胞大量表达各种免疫分子,例如Toll样受体、补体受体以及T淋巴细胞共刺激分子等。1994年Fukudome等[9]利用基因克隆技术首次从内皮细胞基因文库中得到了能够编码蛋白质C的结合位点的蛋白,因此命名为EPCR。EPCR是一种I型跨膜蛋白,其分子结构与主要组织相容性复合物I型分子相似。EPCR通过与蛋白质C结合,可使蛋白质C的活化效率提高5~20倍[10]。EPCR在机体内以结合型和可溶型两种形式存在。结合型EPCR主要存在大血管内皮细胞的表面。可溶型EPCR(sEPCR)来自与结合型EPCR。当内毒素或凝血酶与大血管内皮细胞接触时,可以通过蛋白酶-3介导结合型EPCR从血管内皮细胞表面脱落成为sEPCR进入循环系统[11~13]。目前,血浆中sEPCR的水平已被用来反映血管内皮细胞受损的生物标志物[14,15]。
参附注射液源自明代著名医学家薛己(薛立斋)编撰的《校注妇人良方》中的参附汤,其由人参一两、附子五钱组成。我国传统医学认为其具有益气、温阳、固脱之功效,主治厥脱及阳虚诸证。现代临床上,主要用于急性心力衰竭、心源性猝死以及休克等疾病[16,17]。这些疾病在我国传统医学的理论体系中属于心肾阳虚、阳气欲脱、脉细欲绝以及病势危急等证。利用现代药物学技术将其改制为注射液之后,其发挥临床疗效的速度更加迅速。现代药理学的研究结果显示,参附注射液可以减少血管间黏附分子-1(ICAM-1)、TNF-α等炎症因子的表达,减轻血管内皮细胞的损伤;抑制黄嘌呤氧化酶,抑制氧自由基对于血管内皮细胞的损伤,抑制失血性休克缺血-再灌注时血管内皮细胞的过氧化;能抑制Caspase-3表达,同时上调Bcl-2,抑制细胞凋亡,对内皮细胞具有保护作用[18~20]。
本实验结果发现,与空白对照组比较,假手术组肾组织的EPCR mRNA和蛋白质的表达升高,但是差异无统计学意义(P>0.05),提示创伤对于肾脏组织EPCR的表达具有一定的诱导升高的作用,可能与创伤导致的机体应激反应导致肾小管血管内皮细胞损伤有关。但是,因为本研究的假手术组的创伤较轻微(仅仅暴露了左股动静脉),其程度不足以导致假手术组肾组织的EPCR mRNA和蛋白质的表达升高到差异有统计学意义的程度。失血性休克组与空白对照组和假手术组相比明显升高,提示除了创伤因素导致肾小管血管内皮细胞损伤外,因为短时间内大量失血导致的休克参与诱导肾脏组织EPCR的mRNA和蛋白质表达水平的增加。其原因可能与体内多种炎症细胞因子的共同作用效应有关。经液体复苏后,林格液组及参附注射液组肾脏组织中的EPCRmRNA和蛋白质的表达均明显下降,与失血性休克组相比较,具差异有统计学意义(P<0.05),提示失血性休克早期经过充分的液体复苏,血液得到了补充,无论是林格液还是参附注射液都可以改善机体的微循环,保护肾小管血管内皮细胞。另外,参附注射液组的EPCR mRNA和蛋白质表达水平更低,提示其抗凝和抗炎活性较高,与林格液相比较,能够更加有效地保护肾小管血管内皮细胞。
另外,与空白对照组比较,假手术组肾组织大鼠血清血清尿素氮和肌酐的水平升高,但是差异无统计学意义(P>0.05),提示创伤对于肾脏功能具有一定的影响。失血性休克组与空白对照组和假手术组相比明显升高,提示除了创伤因素导致肾功能障碍之外,因为短时间内大量失血导致肾脏缺氧和血流低灌注,严重影响了大鼠的肾功能。经液体复苏后,林格液组及参附注射液组大鼠血清血清尿素氮和肌酐的水平明显下降,与失血性休克组相比较,具差异有统计学意义(P<0.05),提示失血性休克早期经过充分的液体复苏,血液得到了补充,纠正了肾脏缺氧和血流低灌注,从一定程度上恢复了肾脏的正常功能。
空白对照组与假手术组的肾小管形态基本正常。失血性休克组可见大量的肾小管上皮细胞损伤。损伤评分明显高于空白对照组与假手术组,差异有统计学意义(P<0.05);经过林格液和参附注射液复苏后,肾脏组织损伤明显减轻。这从形态学的角度再次证实了参附注射液可以保护失血性休克大鼠的肾功能。
综上所述,失血性休克大鼠的血清尿素氮和肌酐水平,以及肾脏组织EPCR表达增加,这与失血性休克时急性肾脏损伤有关。参附注射液可以抑制肾组织EPCR的表达,从而起到保护肾脏功能的作用。
[1] Angele MK,Schneider CP,Chaudry IH.Bench to bedside review:Latest results in hemorrhagic shock[J].Crit Care,2008,12:218.
[2] Gomes E,Antunes R,Dias C,et al.Acutekidney injury in severe trauma assessed by RIFLE criteria:A commonfeature without implications on mortality[J].Scand Trauma Resusc Emerg Med,2010,18:1.
[3] Bihorac A,Delano MJ,Schold JD,et al.Incidence,clinical predictors,genomics,and outcome of acutekidney injury among trauma patients[J].Ann Surg,2010,252:158~165.
[4] Mohan Rao LV,Esmon CT,Pendurthi UR.Endothelialcellprotein Creceptor:a multiliganded and multifunctional receptor[J].Blood,2014,124(10):1553~1562.
[5] Navarro S,Bonet E,et al.Theendothelialcellprotein Creceptor:its role in thrombosis[J].Thromb Res,2011,128(5):410~416.
[6] 孙艳玲,吴五洲,刘先义,等.参附对大鼠肾缺血再灌注损伤NF-κB细胞黏附分子-1、TNF-α表达的影响[J].中国临床药理学与治疗学,2008,13(9):1005~1009.
[7] 胡刚,刘先义,夏中元.参附注射液对肠缺血-再灌注大鼠肺损伤的影响[J].中国中医急症,2008,17(4):513~515.
[8] Umeda K,Takahashi T,Inoue K,et al.Prevention of hemorrhagic shock induced intestinal tissue injury by glutamine via heme oxygenase-1 induction[J].Shock,2009,31:40~49.
[9] Fukudome K,Esmon CT.Identification,cloning,and regulation of a novel endothelial cell protein C/activated protein C receptor[J].Biol Chem,1994,269:26486~26491.
[10] Pendurthi UR,Rao LV.Factor VIIa interaction with endothelial cells and endothelial cell protein C receptor[J].Thromb Res,2010,125(Suppl 1):19~22.
[11] Dennis J,Johnson CY,Adediran AS,et al.The endothelial protein C receptor(PROCR)Ser219Gly variant and risk of common thrombotic disorders:a HuGE review and meta-analysis of evidence from observational studies[J].Blood,2012,119(10):2392~2400.
[12] Ruf W,Schaffner F.Role of the protein C receptor in cancer progression[J].Thromb Res,2014,133(Suppl 2):85~89.
[13] Bouwens EA,Stavenuiter F,Mosnier LO.Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway[J].Thromb Haemost.2013;11 Suppl 1:242~253.
[14] Javanmard SH,Shahsavarzadeh T,Saadatnia M.Soluble thrombomodulin and endothelial cell protein C receptor levels in patients with cerebral venous and sinus thrombosis[J].Eur Neurol,2013,70(3-4):156~158.
[15] Sarig G,Meir A,Wollner M,et al.Soluble endothelial protein C receptor and coagulation parameters as prognostic factors in non-small cell lung carcinoma[J].Thromb Haemost,2013,11(4):768~771.
[16] 黄宏伟.中医辨证论治联合PCI术和西药治疗冠心病急性心肌梗死60例[J].中医研究,2016,29(5):22~25.
[17] 赵静,黄淑芬.BiPAP联合参附注射液治疗心肾阳虚型充血性心衰32例[J].中医研究,2016,29(5):14~16.
[18] 胡丹丹,徐慧连,楼黎明.参附注射液对脓毒症大鼠心肌组织Bcl-2、Bax表达的影响[J].浙江中西医结合杂志,2016,26(1):14~17.
[19] 张志刚,孙国栋,常文华,等.参附注射液对阿霉素所致心衰大鼠氧化应激水平及血管紧张素Ⅱ的影响[J].中国医药导报,2016,13(1):21~24.
[20] 严志聪.参附注射液对老年脑梗死患者血清IL-6及TNF-α的影响[J].实用中西医结合临床,2016,16(3):43~44
1006-6233(2017)07-1161-05
上海市医学重点专科建设项目,(编号:ZK2015A19)
王毅鑫
A
10.3969/j.issn.1006-6233.2017.07.031
