重症肌无力伴微小胸腺瘤临床病理分析
2017-07-31孙婷吴桥刘英雪乞国艳秦秀娟康维
孙婷 吴桥 刘英雪 乞国艳 秦秀娟 康维
·论著·
重症肌无力伴微小胸腺瘤临床病理分析
孙婷 吴桥 刘英雪 乞国艳 秦秀娟 康维
目的 探讨微小胸腺瘤伴重症肌无力(MG)患者胸腺病理特征及与临床关系。方法 回顾分析2007年4月至2017年3月重症肌无力患者445例胸腺切除病理特征,对其中256例伴微小胸腺瘤胸腺病理特点进行分类并结合临床分型、年龄、术后危象发生与否进行分析。结果 微小胸腺瘤伴胸腺增生86例,50岁以下者多于50岁以上者,且女性多于男性;伴胸腺萎缩124例,50岁以下者多于50岁以上者,无性别差异;伴萎缩及滤泡增生30例,无性别及年龄差异;伴非萎缩非增生胸腺16例,均为女性,无年龄差异。256例患者,年龄16~64岁,其中6例发生重症肌无力危象。结论 微小胸腺瘤与MG发生相关,重视MG患者手术根治性切除胸腺并全方位病理取材,提高微小胸腺瘤检出率,为临床诊断、治疗及预后评估提供依据。
微小胸腺瘤;重症肌无力;临床病理特征分析
重症肌无力(MG)是由体液免疫介导,细胞免疫依赖、补体参与的神经肌肉接头处信号传递障碍引起的自身免疫性疾病。胸腺是中枢免疫器官,研究表明,胸腺异常是MG发病的组织基础。2004版WHO肿瘤分类及诊断标准定义微小胸腺瘤通常是指X线、CT及肉眼检查无明显肿瘤,直径<1 mm的多灶性上皮增生,可发生于皮质、髓质。微小胸腺瘤临床上不易发现[1],病理上容易漏诊。通过对256例伴微小胸腺瘤MG患者胸腺病理的特征并结合临床特征进行分析,对其与重症肌无力的关系进行探讨。
1 资料与方法
1.1 一般资料 收集石家庄市第一医院(河北省重症肌无力诊疗中心)2007年5月至2017年3月MG患者胸腺瘤及胸腺切除标本445例,所有患者根据临床表现,经新斯的明试验、肌电图及CT等检查确诊为MG。其中256例伴微小胸腺瘤。男94例,女162例;年龄16~64岁。术后出现危象6例。
1.2 方法 MG患者胸腺及胸腺瘤切除标本,(胸腺瘤手术切除胸腺者以瘤旁胸腺组织作为观察对象),均经10%中性甲醛固定,尽可能多取材,最多者取材37张,经常规制片,HE染色及免疫组织化学染色,由高年资病理医师进行显微镜下全面观察:无肉眼可见肿瘤,显微镜观察上皮样细胞呈巢、团状排列,直径<1 mm,且免疫组化CK及CK19均阳性定义为微小胸腺瘤(图1)。对含微小胸腺瘤的胸腺组织进行病理分析:单位体积内胸腺小叶数目多且皮、髓质均无明显萎缩,可见生发中心者归入胸腺滤泡增生组(图2、3);如单位体积胸腺小叶数量明显减少,大部分被脂肪替代,皮、髓质明显减少,皮质减少明显,归入胸腺萎缩组(图4);胸腺小叶单位体积数量减少,皮、髓质萎缩,但个别区域可见生发中心者归入胸腺萎缩伴滤泡增生组;胸腺单位体积数量较多,皮、髓质无明显萎缩者归入非增生、非萎缩组。

图1 CK19(+)的微小胸腺瘤(免疫组化SP×400)
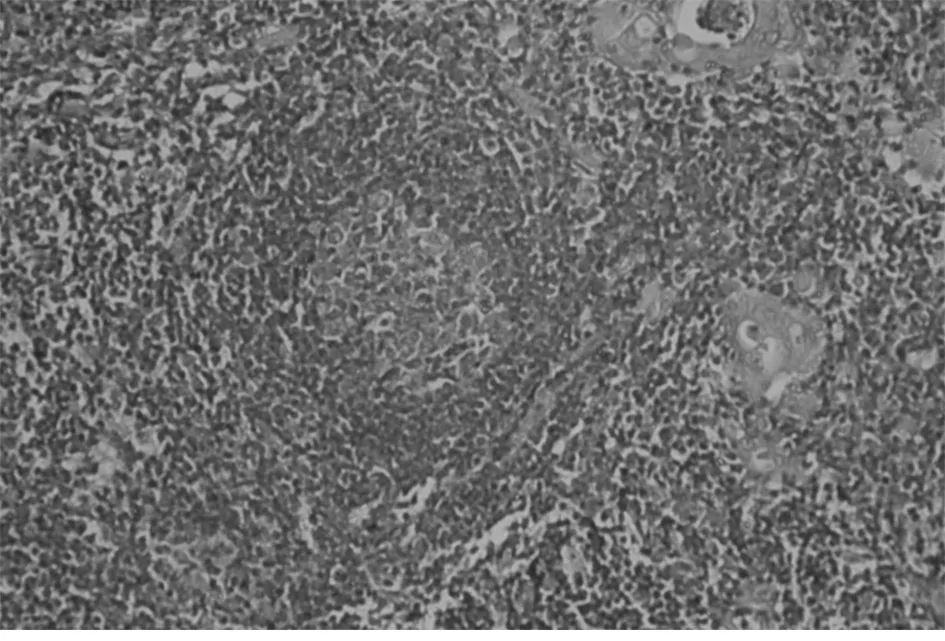
图2 胸腺滤泡性增生,生发中心(HE染色×200)
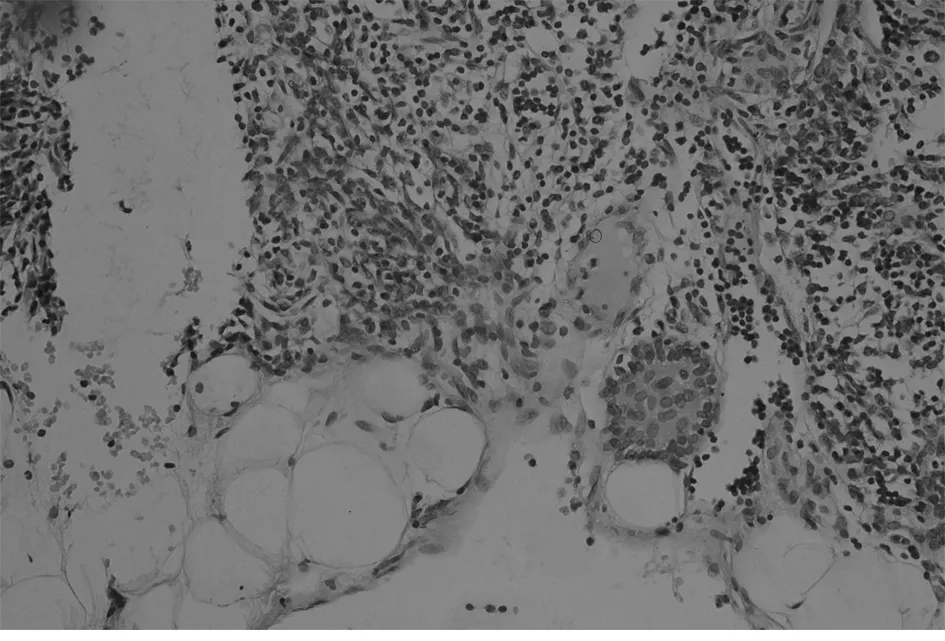
图3 微小胸腺瘤(HE染色×400)
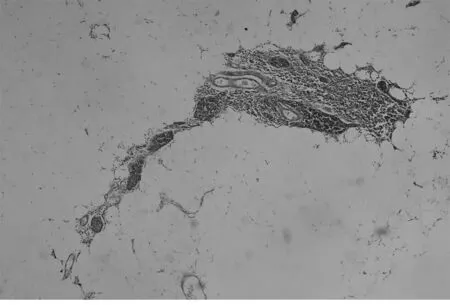
图4 萎缩的胸腺中见多发微小胸腺瘤(HE染色×100)
1.3 临床分型 采用改良Osserman分型。Ⅰ型眼肌型,病变仅限于眼外肌;Ⅱ型:全身型,有一组以上肌群受累;Ⅲ型:重度激进型,起病急,进展快,发病数周或数月内累及咽喉肌,半年内累计呼吸肌伴或不伴有眼肌受累,生活不能自理;Ⅳ型:迟发或重度型,隐袭起病,进展缓慢,2年内逐渐有Ⅰ、Ⅱ型累及呼吸肌。
1.4 统计学分析 应用SPSS 10.0统计软件,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 MG伴微小胸腺瘤患者胸腺病理与年龄的关系 256例微小胸腺瘤伴胸腺滤泡增生86例,伴胸腺萎缩124例,伴胸腺萎缩及滤泡增生30例,正常胸腺16例。在256例微小胸腺瘤MG患者中,<50岁年龄组伴胸腺滤泡增生组及伴胸腺萎缩组均多于≥50岁年龄组,差异有统计学意义(P<0.05);微小胸腺瘤伴胸腺萎缩同时伴滤泡增生组P>0.05,即无年龄差异;非增生非萎缩组仅为<50岁者,无统计学差异。见表1。
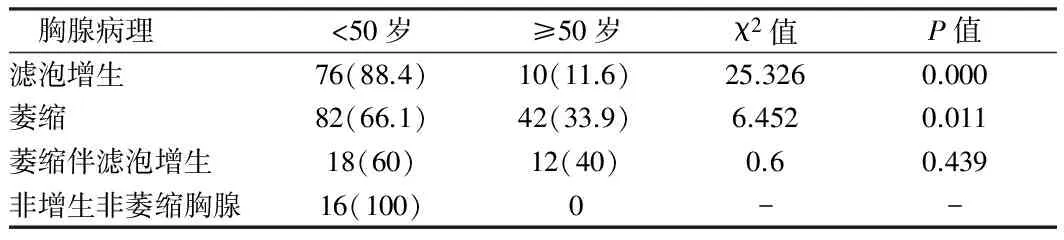
表1 MG伴微小胸腺瘤患者胸腺病理与年龄的关系 例(%)
2.2 不同性别MG伴微小胸腺瘤患者胸腺病理情况 微小胸腺瘤发病总体女性多于男性。男女发病率为1∶1.67。在伴胸腺滤泡增生组女性患者多于男性患者,差异有统计学意义(P<0.05);在伴非萎缩非增生组均为女性;而在微小胸腺瘤伴胸腺萎缩组及伴萎缩并伴滤泡增生组男女发病率差异无统计学意义。见表2。
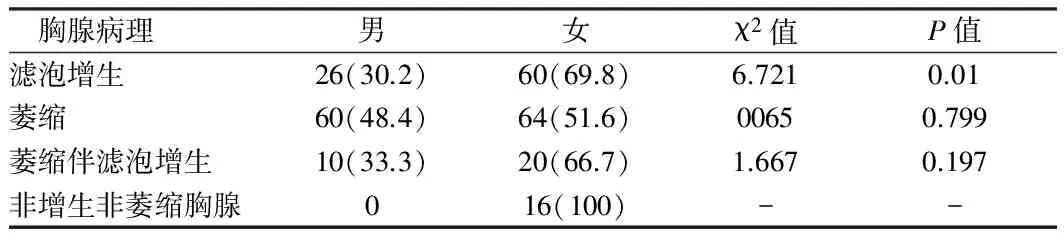
表2 不同性别MG伴微小胸腺瘤患者胸腺病理情况 例(%)
2.3 微小胸腺瘤伴胸腺不同病理类型与临床分型情况 56例微小胸腺瘤MG患者,无论伴发何种胸腺组织类型,临床分型均以Ⅱ型为主。见表3。
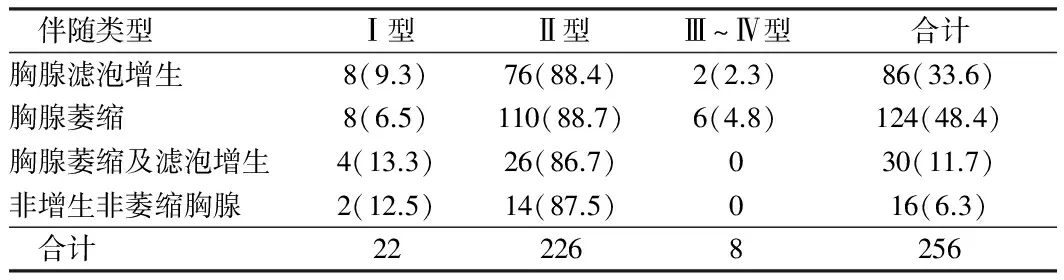
表3 微小胸腺瘤伴胸腺不同病理类型与临床分型情况 例(%)
3 讨论
胸腺的病理检查对MG的发病、诊断和治疗有重要意义,然而目前仍有不少患者得不到及时的诊断和治疗,即使发现MG,大多忽略病变的性质,停留于一般的诊断和药物治疗[2]。即使手术,不少医院病理科没有考虑到微小胸腺瘤的存在,做不到纵隔脂肪的彻底清扫,非专业的病理工作者未认识到微小胸腺瘤的散发特点,没有做到广泛取材。HE染色切片仅做一般形态学描述,未做详细胸腺病理分类,以致诊断深度不够,易造成漏诊,使治疗针对性不强,疗效欠佳。
虽然MG发病机制尚未完全阐明,但是目前研究认为其与细胞免疫及体液免疫参与有很大关系[3]。胸腺是中枢免疫器官,是T细胞分化、发育、成熟的场所,T细胞在经历阳性选择与阴性选择过程中由于机体内、外环境的异常改变,受某些因素的影响不能正常分化、发育成熟,使自身免疫耐受机制受到损害,这些不能正常成熟的T细胞继而引起体液免疫的异常,产生的自身免疫抗体如乙酰胆碱受体抗体,造成神经、肌肉接头处信号传递障碍,引起肌无力。胸腺上皮细胞是可分泌多种因子,同时可通过表达自身免疫调节基因编码蛋白(autoimmune regulator gene,AIRE)而发挥胸腺免疫耐受作用[4]。
资料显示,约80%的MG患者的胸腺不正常[5],MG胸腺的共同点是[6]:B细胞数量增多和激活的T、B细胞和上皮细胞功能异常以及对AchR致敏。胸腺上皮细胞异常增生及功能异常可能是引起胸腺内环境改变进而引起自身免疫异常的原因之一,而微小胸腺瘤即增生的上皮细胞功能的异常可能引起胸腺内环境的改变,使自身免疫耐受机制受到破坏,从而引发MG。
微小胸腺瘤是胸腺中胸腺上皮细胞增生聚集而成的呈巢、团状分布的上皮团,多数在皮质、髓质区或其交界区域呈多灶性分布。在正常人胸腺中仅占4%[7],而在本组MG患者胸腺资料中占57.53%,MG患者发病率明显高于正常人群。伴有微小胸腺瘤的MG患者胸腺病理类型多样,说明微小胸腺瘤的上皮细胞异常与MG的发生可能有一定的关联。
如表1所示,在256例微小胸腺瘤MG患者中,小于50岁患者比50岁以上患者更易发生微小胸腺瘤伴胸腺滤泡增生和微小胸腺瘤伴滤泡萎缩。胸腺滤泡增生是引起MG的主要原因之一,少数50岁以上患者胸腺仍呈增生状态,可以解释为微小胸腺瘤的存在或其他因素可能阻碍了增龄性萎缩,使胸腺仍呈活跃的增生状态。在微小胸腺瘤伴胸腺萎缩组,在MG患者的萎缩的胸腺中皮、髓质仍保留,部分见孤立的皮质结节,微小胸腺瘤孤立或在皮、髓质中散在分布。虽然,随着年龄的增长,胸腺逐渐萎缩,即呈增龄性萎缩[8],T细胞的发育随年龄的增长而减少,胸腺小叶数量及胸腺细胞减少,但T细胞的产生还在继续,因此正常老年人的胸腺仍能发挥作用,维持人体的正常免疫功能。由于微小胸腺瘤的存在,新生的上皮细胞同失去了正常皮髓质分界的胸腺细胞混杂在一起,可能参与了不成熟胸腺细胞的活化过程,破坏了正常T细胞分化发育、成熟的微环境,导致不成熟的T细胞产生,同样可以引发自身免疫耐受的破坏引发MG。这就可以解释胸腺呈萎缩状态但却仍然伴发MG了。≥50岁MG患者相对于伴胸腺增生者绝对数有所增加,但仍是50岁以下者多于50岁以上者,P<0.05,差异有统计学意义;微小胸腺瘤的存在对年轻患者的免疫反应刺激和影响更大些。同样胸腺呈萎缩伴滤泡增生组MG患者,可能是由于残余的皮质产生的致敏T淋巴细胞刺激B细胞增生,导致生发中心形成,此现象例数较少,在各年龄组无统计学上差异。非增生非萎缩胸腺则全部分布在<50岁年龄组,可能是年轻患者增龄性萎缩不明显,伴有微小胸腺瘤的胸腺虽有不成熟的T细胞产生,但在胸腺内还未能引起生发中心的产生,可能在周围淋巴器官激发体液免疫产生自身抗体而引起MG。
由表1可推证:微小胸腺瘤的上皮细胞可能影响了MG患者各类胸腺内的T淋巴细胞的生长、发育和成熟,从而引起自身免疫耐受的破坏而引发自身免疫性疾病的发生,微小胸腺瘤伴随的病理变化各式各样,但50岁以内MG患者无论伴胸腺增生还是胸腺萎缩比50岁以上患者多见,差异有统计学意义。其中的机制还有待于进一步的研究。
表2中,256例微小胸腺瘤伴MG患者中男女发病率为1∶1.67,这与报道[9]相近。微小胸腺瘤伴胸腺滤泡增生的MG患者中女性患者多于男性患者,(P<0.05),差异有统计学意义,在伴非萎缩非增生组均为女性。与相关报道的生理水平的雄激素较雌激素具有更强的致胸腺退化作用较符合[10]。这些改变是否如报道[11]受女性雌激素影响还有待于进一步研究、探讨。而在微小胸腺瘤伴胸腺萎缩组及伴萎缩并伴滤泡增生组男女发病率差异无统计学意义。
在256例微小胸腺瘤MG患者术后肌无力危象发生6例,分别微小胸腺瘤伴滤泡增生1例、微小胸腺瘤伴萎缩5例、微小胸腺瘤伴萎缩及滤泡增生2例。其共性均病史较长,且有激素和免疫制剂治疗史,微小胸腺瘤伴胸腺萎缩危象发生绝对例数多应引起重视。
分析256例微小胸腺瘤MG患者,临床分型以Ⅱ型为主。患者的临床分型与病理类型之间无相关性。因此临床医师仅凭临床分型尚不能预测病理分型。因此术后详尽的病理取材及分型对临床医师的治疗及预后评估起着至关重要的作用。
MG发生是一个多因素共同作用的结果,虽然在MG发病机制中,微小胸腺瘤如何发挥了何种作用尚不清楚,与胸腺病理类型的相关机制也需要进一步深入研究,伴MG患者与性别、年龄的各种联系,与之相关的各种致病机制尚待进一步研究证实。但由于胸腺与MG发病的密切联系,胸腺切除已成为治疗MG较好方式之一,但行手术切除时,一定考虑到微小胸腺瘤的散发性,做全胸腺切除及纵膈脂肪组织清扫,并对切除胸腺的标本进行全方面取材,尽可能发现胸腺组织的各种病理变化特点,尤其是不漏诊微小胸腺瘤。将有助于提高人们对MG的更深入的认识,并能为指导临床个体化治疗方案的的制定及预后评估提供更可靠的依据,还可及时为患者制定一些预防措施,为MG发病机制的研究提供更多的线索。
1 Moonscape E,Rosati S,Picayune A,et al.Microscopic.Thomas:hematological evidence of multiform cortical and dullard origin,Histopathology,1992,20:263-266.
2 涂来慧.重视不同类型胸腺病理变化在重症肌无力治疗中的价值.中华神经科杂志,2005,38:67-69.
3 Hoffacker V,Schultz A,Tiesinga JJ,et al.Thymomas alter the T-cell subset composition in the blood:a potential mechanism for thymoma-associated autoimmune disease.Blood,2000,96:3872-3879.
4 张慜,李柱一.胸腺与重症肌无力.中国神经免疫学和神经病学杂志,2011,18:361-364.
5 Defilippi VJ,Richman DP,Ferguson MK.Transcerviacl thymecttomy for myasthenia gravis.Ann Thorac Surg,1994,57:194.
6 刘伟,佟倜,纪振东,等.胸腺病理在重症肌无力胸腺切除手术后远期预后生存分析中的作用.中国免疫学杂志,2001,17:377-379.
7 Puglisi F,Finato N,Mariuzzi L,et al.Microscopic thymoma and myasthenia gravis.J Clin Pathol1995,48:682-683.
8 于泓晶,吴明媛,向砥,等.胸腺的增龄化萎缩与免疫重建.中国细胞生物学学报,2010,32:485-490.
9 孟云霄,毕娅兰,卢朝辉,等.胸腺瘤与自身免疫性疾病.中国神经免疫学和神经病学杂志,2014,21:294-297.
10 邹仲之,尹昕.激素与胸腺退化.国外医学内分泌学分册,1984,1:22-26.
11 李杰,刘丽华,张荟雪,等.雌激素与重症肌无力胸腺细胞增殖与凋亡的关系.临床神经病学杂志,2013,26:150-151.
10.3969/j.issn.1002-7386.2017.16.017
项目来源:石家庄市科学技术研究与发展课题(编号:141462313)
050011 河北省石家庄市第一医院(孙婷、吴桥、刘英雪、乞国艳、秦秀娟、康维);石家庄平安医院(吴桥)
乞国艳,050011 河北省石家庄市第一医院;
E-mail:qiguoyan1106@sina.com
R 746.1
A
1002-7386(2017)16-2469-04
2017-03-15)
