山羊早期胎儿组织TET1与Wnt通路基因的 表达变化及其相关性
2017-07-31谭强罗南剑张艳丽安炳星陈秋羊赵永聚
谭强,罗南剑,张艳丽,安炳星,陈秋羊,赵永聚
山羊早期胎儿组织TET1与Wnt通路基因的 表达变化及其相关性
谭强,罗南剑,张艳丽,安炳星,陈秋羊,赵永聚
(西南大学动物科技学院/重庆市牧草与草食家畜重点实验室/重庆市草食动物资源保护与利用工程技术研究中心,重庆 400715)
【目的】通过检测TET1和Wnt信号通路相关基因以及DKK家族基因在山羊胎儿发育早期的表达变化,分析TET1与Wnt通路基因的相关性,为TET1调控山羊胎儿发育研究提供理论依据。【方法】选取12只健康大足黑山羊母羊,自然发情后与同一只种公羊自然交配。采用剖腹产手术的方法,分别获得妊娠20、25、30、60和90d的胎儿,对胎儿的生长指标(体重、体长)进行统计,并采集了60和90d胎儿的组织器官样品(心、肝、肺、肾、脑、皮肤),通过Real-time PCR(RT-PCR)检测各样品中TET1基因,DKK家族基因(DKK1、DKK2、DKK3)和Wnt家族基因(Wnt2、Wnt2b、Wnt4、Wnt5a、Wnt5b、Wnt7b、Wnt16)的相对表达量。利用SPSS软件分析山羊胎儿发育早期不同阶段TET1与WNT信号通路相关基因相关性以及基因表达显著性(<0.05)。【结果】山羊妊娠早期胎儿生长在60d后有显著变化。荧光定量检测结果表明,TET1基因表达随妊娠天数的增加呈上升趋势。Wnt家族基因在山羊胎儿发育中都检测到表达(Wnt2,-2b,-4,-5a,-5b,-7b,-16)。其中,Wnt2和Wnt7b表达量随胎儿发育逐渐增高;Wnt2b、Wnt5a、Wnt5b、Wnt7b在妊娠30 d时有显著高表达(<0.05);Wnt4在胎儿发育20 d时表达显著(<0.05);Wnt16基因在妊娠25 d有显著高表达(<0.05)。DKK家族基因表达检测结果显示,DKK1在胎儿发育早期阶段都有表达,DKK2/3在妊娠初期表达量较低,后期表达增高。通过组织中基因表达检测显示,TET1在90d胎儿肝、肺、肾和脑中的表达水平相比于60d胎儿组织升高,肝中表达量显著(<0.05)。Wnt家族基因Wnt2在组织器官中有相对活跃的表达,妊娠90d胎儿肺中表达量极显著(<0.01);Wnt16基因在胎儿皮肤组织中表达显著(<0.05),且维持在一个较高的水平;Wnt5a和Wnt7b在肾中表达显著(<0.05),其他Wnt基因在组织中都有表达。相关性分析显示,胎儿生长指标(体重、体长)变化与TET1的表达呈极显著正相关(<0.01);TET1在胎儿发育早期的表达与Wnt2、Wnt7b、Wnt16呈现正相关,与Wnt2b、Wnt4、Wnt5a、Wnt5b呈负相关,其中与Wnt5b呈显著负相关(<0.05),与Wnt7b呈极显著正相关(<0.01)。Wnt通路基因之间也有相互关系,Wnt2与Wnt4呈极显著负相关(<0.01)。Wnt2与Wnt7b,Wnt2b与Wnt5a、Wnt5b,Wnt5a与Wnt5b呈极显著正相关(<0.01)。Wnt4与Wnt5a呈显著正相关(<0.05)。【结论】获得了TET1与Wnt基因在山羊胎儿发育早期的表达模式,并进行了相关性分析,填补了这些基因在山羊方面的研究空白;TET1与Wnt基因对山羊胎儿早期的发育和组织的形成是一个动态的调控变化过程;TET1基因表达与部分Wnt基因呈现显著正相关,部分呈现显著负相关;Wnt通路基因之间表达量呈现一定的相关性。这些数据为TET1与Wnt分子调控山羊早期胎儿发育的机制深入研究提供了参考。
山羊胎儿;TET1;Wnt通路基因;表达变化;相关性
0 引言
【研究意义】TET1(Ten-Eleven-Translocation1)是参与主动去甲基化过程的主要作用酶之一[1-2]。其介导的表观遗传调控系统在哺乳动物中普遍存在[3]。Wnt (wingless-type MMTV integration site family)信号通路,关系到胚胎附植前后的胎儿发育、胎盘发生等生理事件[4]。而妊娠早期胚胎发育对妊娠期间胎儿的发育及出生后发育都有影响,因此明确TET1与Wnt基因在山羊胎儿早期发育的表达模式,对于优质羔羊生产研究提供指导作用。【前人研究进展】TET1属于α-酮戊二酸和Fe2+依赖的双加氧酶家族成员,是一种5mC羟化酶,主要在胎儿组织和干细胞中表达,能启动DNA去甲基化程序,调控胚胎干细胞的发育[2, 5]。TET1家族蛋白参与整个胚胎的发育过程,相关研究显示同时敲除TET家族基因TET1/3后,胚胎早期发育中转录组多样性有所增加[6],在父系小鼠TET1敲除的后代胎儿出现生长缺陷、死亡率增高、发育迟缓等现象[7]。Wnt基因由NUSSE等[8]发现,后来相继发现多个Wnt家族基因。Wnt通路关系到生物体生长、发育、疾病和细胞癌变等过程,并通过细胞间信号传递对许多不同组织器官的形成进行调控,包括肾、肠、骨、皮肤、心脏和肺等[9-13]。其中经典Wnt信号通路(Wnt/β- cantenin)广泛参与维持干细胞的多功能性,诱导特定组织和器官的生长等生物学过程,对哺乳动物发育生长,包括早期胚胎组织器官发育都有调控作用,其通路相关因子也相继被发现[14-17]。DKK 作为Wnt信号通路拮抗物,能够维持 Wnt信号通路的稳态,调控通路下游基因表达,在胚胎发育过程中也发挥重要作用[18],其缺失往往导致胚胎生长发育障碍,出现胎儿发育不全或致死[19-20]。同时,在肿瘤研究中发现TET1通过抑制Wnt通路拮抗基因DKK来维持一个低甲基化水平,能够对Wnt通路在结直肠癌发生调控中具有相互作用[21]。此外,LI等[22]发现,TET1/2/3缺失的小鼠胚胎(8.0—8.5d)Wnt通路表现超活性,TET1蛋白在小鼠胚胎和ESCs细胞中对Wnt通路具有关键性调控,通过建立神经细胞和中胚层细胞命运决定之间的适当平衡。【本研究切入点】大量研究表明,TET1和Wnt基因对胚胎发育调控过程中具有生理和时空上的一致性,且能够相互作用调节[7, 23-24],在人[25]、小鼠[17]、牛[16]、绵羊[4]、马[26]上都有所研究,而山羊上,TET1和Wnt基因在早期胎儿发育中的表达模式不清楚,两者之间相互关系在山羊中的研究尚为空白。【拟解决的关键问题】以大足黑山羊妊娠早期胎儿为对象,检测胎儿早期发育过程中TET1、Wnt通路相关基因及DKK家族的动态表达变化模式。通过相关分析,探求基因之间的相互关系,为进一步研究TET1和Wnt通路调控山羊胎儿发育提供理论依据。
1 材料与方法
1.1 试验地点、时间
本试验于2015年10月至2016年7月在西南大学畜牧场、重庆市牧草与草食家畜重点实验室和西南大学动物医院进行。
1.2 试验动物
选取西南大学种羊场12只健康的1.5周岁大足黑山羊空怀母羊,与同一只大足黑山羊公羊进行自然交配,交配后观察返情情况,如果没有,则以最后一次配种日期为妊娠0 d。在妊娠20 d(n=4)、25 d(n=3)、30 d(n=3)、60 d(n=5)、90 d(n=7),剖腹产手术获得胎儿,测胎儿体重及体长。采集心、肝、肺、肾、脑、皮肤组织样品,液氮中保存待用。
1.3 总RNA提取和cDNA合成
RNA提取采用TIAN GEN生物公司提供的RNAsimple Total RNA Kit,按照说明书提供步骤进行操作。提取RNA通过核酸测定仪检测RNA浓度,合格样品-80℃保存。
cDNA合成采用TIAN GEN提供FastQuant RT Kit(with gDNase)。根据说明书步骤操作,cDNA样品-80℃保存。
1.4 引物合成和PCR分析
Wnt基因、TET1和DKK家族基因引物序列如表1,委托上海生工生物公司设计合成。
1.5 Real-time PCR分析
Real-time PCR用于检测妊娠早期胎儿发育各组织中基因的相对表达量。反应体系包括:Nuclease-Free Water(3.6μL)、上游引物(0.2μL)、下游引物(0.2μL)、GoTaq®qPCR Master Mix(5μL),样品1μL,构成总体积为10μL反应体系。反应条件为95℃变性10min,95℃15s,退火复性1min,40个PCR循环,采用默认设置自动生成Ct值。RT-PCR相对定量的内参基因选择在胚胎发育阶段表达相对较为稳定的β-Actin[14]。每个样品设置3个重复。
1.6 数据分析
RT-PCR结果采用Bio-Rad CFX Manager软件导出为Excel,数据标准化处理参考Pfaffl2-ΔΔt方法[27]。采用20 d胎儿组织作为参考样品,计算ΔCt(ΔCt= Ct参考样品目的基因- Ct参考样品内参基因),ΔΔCt=(Ct目标样品中目的基因-Ct目标样品内参基因)-ΔCt,根据公式计算基因相对表达量。所有试验都设有3组重复,结果用平均值±标准差表示。所得组织相对表达量采用SPSS18.0进行差异性分析(LSD法),显著水平<0.05;用Bivariate Correlations 估计基因与胎儿生长指标、基因与基因之间的相关性。
2 结果
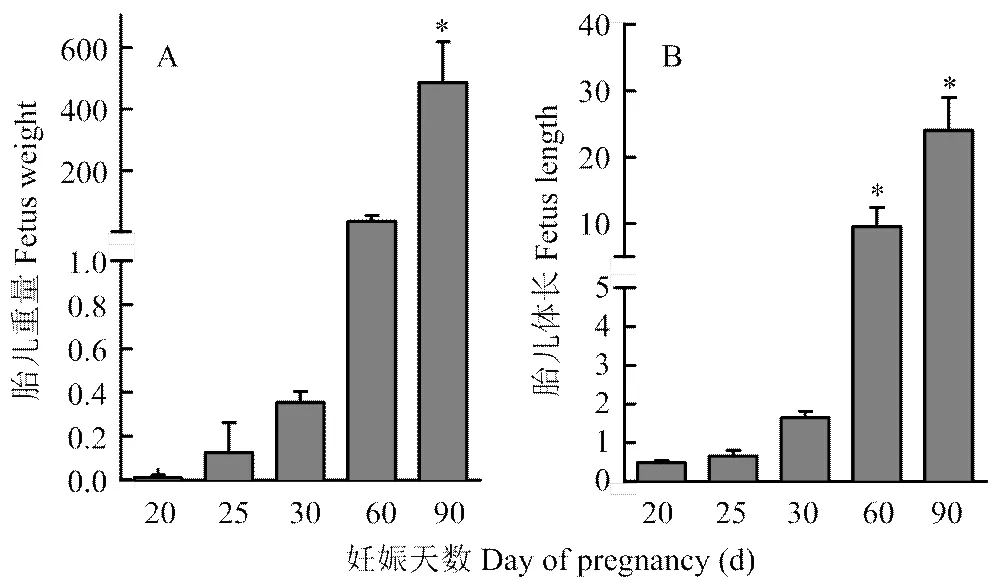
2.1 胎儿生长发育指标
剖腹产获得山羊发育前期(20、25、30、60和90d)完整胎儿,并对其重量和体长变化进行了统计,得到胎儿生长变化趋势(图1)。从图1-A、B可以看出,山羊胎儿早期发育体重在60 d后显著增加,体长在30 d后显著增加。
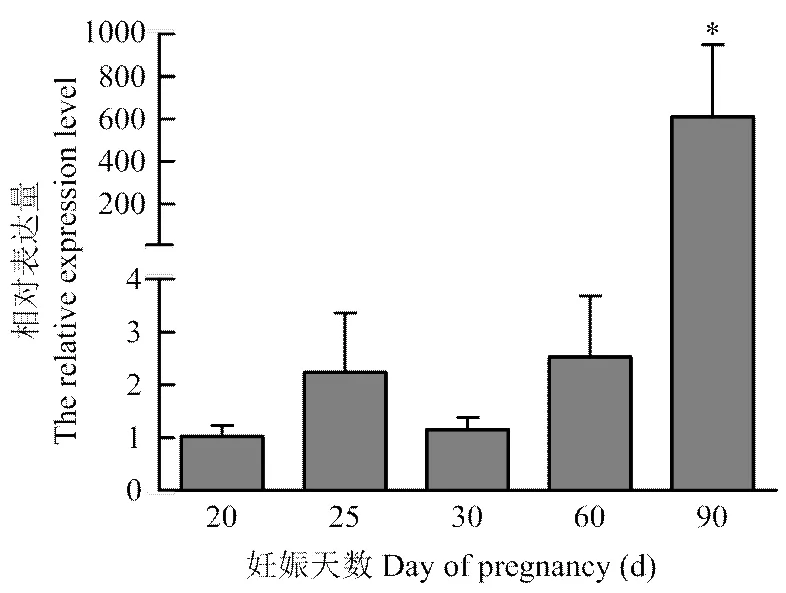
2.2 TET1基因在胎儿发育早期阶段的表达
RT-PCR结果表明,在胎儿发育早期阶段,TET1基因均有表达。检测发现TET1表达量总体呈现上升的趋势(图2),与胎儿体重、体长指标具有一致性。其中在25 d有突出表达,但经过差异比较,与20 d和30 d表达量差异不显著(>0.05),不具有统计学意义。妊娠90 d的胎儿,TET1具有显著高表达,表达量显著高于20、25、30和60 d表达量(<0.05)。
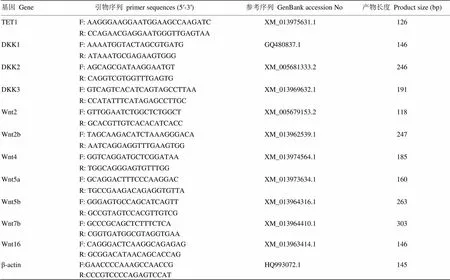
表1 荧光定量基因引物列表
* P<0.05
2.3 WNT家族基因在胎儿发育早期阶段的表达
WNT家族基因Wnt2、Wnt2b、Wnt4、Wnt5a、Wnt5b、Wnt7b 、Wnt16在发育早期胎儿组织中都有表达。Wnt2和Wnt7b表达量随胎儿发育逐渐增高,在发育后期表达量较高,妊娠90 d胎儿中表达显著(<0.05);Wnt2b、Wnt5a、Wnt5b、Wnt7b在妊娠30 d胎儿中有显著高表达(<0.05);Wnt4基因的表达量呈现先降低后升高的变化,在妊娠20 d胎儿中表达显著(<0.05);Wnt16基因在妊娠25 d胎儿中有显著表达(<0.05)。胎儿早期发育阶段,Wnt2与Wnt7b表达变化相似;Wnt2b表达量较低;Wnt4在早期阶段的表达较高,而Wnt5a和Wnt5b的表达量的变化趋势与Wnt4相反,在妊娠30d胎儿有显著表达(<0.05)。Wnt7b表达量在20、25 d不显著。Wnt16基因20、30和90d表达水平相似,在60 d表达量较低,25 d相对于60 d显著表达。其中Wnt2与Wnt7b表达变化趋势与胎儿TET1基因的变化(图2)有相似性,与胎儿生长发育变化也具有一致性。
* P<0.05
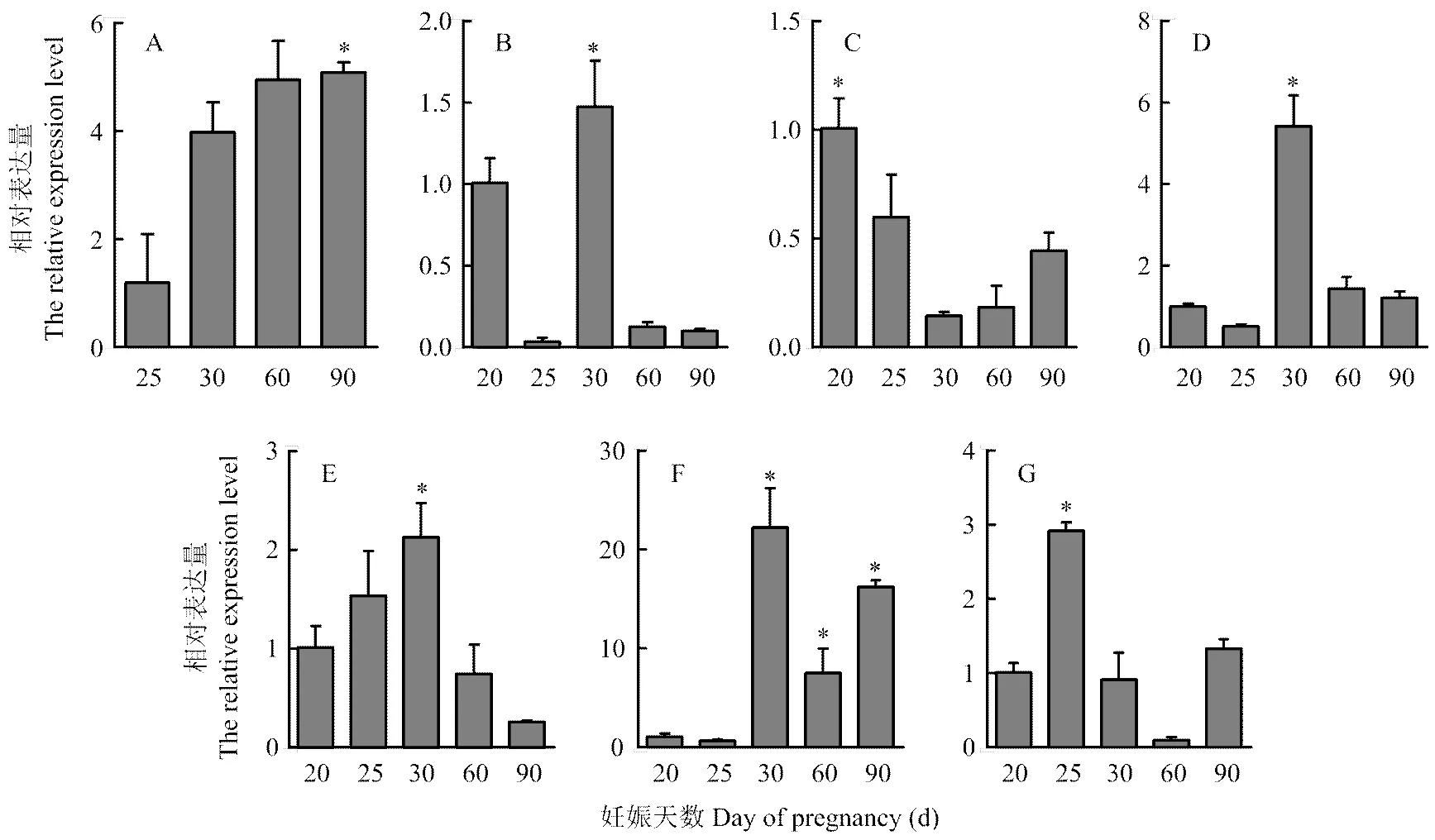
A: Wnt2; B: Wnt2b; C: Wnt4; D: Wnt5a; E: Wnt5b; F: Wnt7b; G: Wnt16. * P<0.05
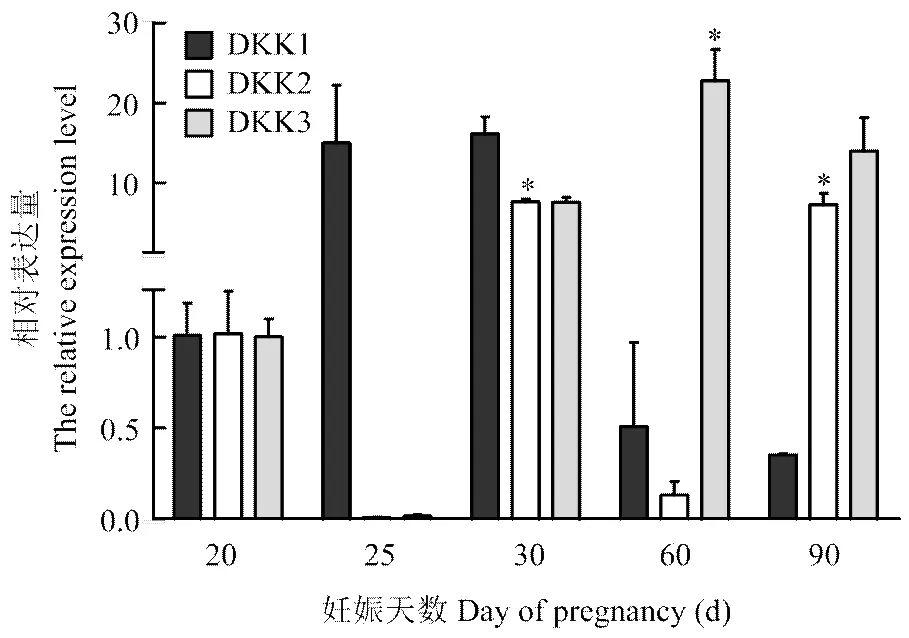
2.4 DKK家族基因的相对表达
DKK家族基因RT-PCR检测结果表明,胎儿发育早期阶段DKK1都有表达(图4),表达量变化由升高到降低,但都不具有显著性(>0.05);DKK2在妊娠30和90 d胎儿中表达量显著高(<0.05);DKK3在妊娠60 d胎儿中表达显著高(<0.05),25 d时表达量低。可以看出,DKK2与DKK3在胎儿发育早期阶段(20、25、30 d)的表达具有同步性。通过与Wnt家族基因表达变化对比发现,DKK1表达变化趋势与Wnt2b、Wnt5a、Wnt5b、Wnt16其有一致性,而与Wnt4的变化呈现相反趋势。DKK3与Wnt7b表达变化趋势具有一致性。
2.5 TET1、Wnt家族基因在胎儿不同组织中的表达
妊娠60、90 d胎儿各组织TET1均检测到了表达。60 d胎儿组织中TET1基因表达较低,在肺中几乎不表达。与60 d表达相比较,在90d胎儿中,TET1在肝、肺、肾和脑中的表达变化升高,肝中表达量显著(<0.05、图5-A)。
* P<0.05
通过单因素ANOVA同一组织中WNT基因的表达分析(图5-B和图5-C),可以看出,Wnt2基因在组织器官中有相对较高的表达量,表达活跃,与其他WNT家族基因相比,差异显著(<0.05),其中妊娠90d胎儿肺中表达量极显著(<0.01);Wnt2b,Wnt4,Wnt5b在各组织中表达较低;Wnt16基因在妊娠60、90 d胎儿皮肤组织中表达显著(<0.05),维持在一个较高的水平;Wnt5a在60 d胎儿脑、肾和皮肤组织中表达显著(<0.05),在90 d胎儿肾组织中表达显著;Wnt7b在妊娠60d胎儿肾、脑和皮肤组织中有显著表达(<0.05),但发育生长到90d胎儿各组织中,Wnt7b表达较低,不具有显著性。
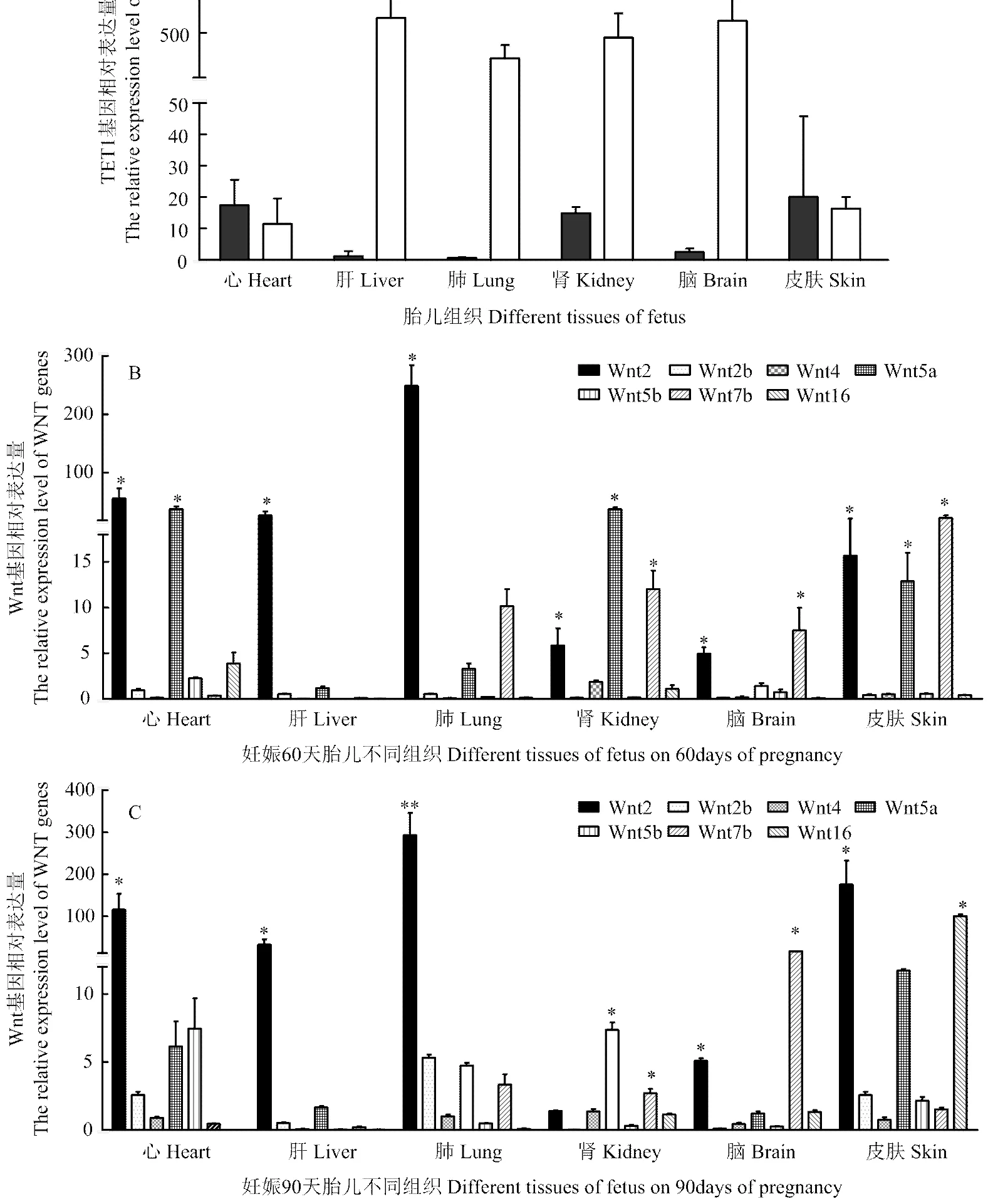
A: TET1; B: WNT family on 60 days; C: WNT family on 90days. * P<0.05
2.6 相关性分析
2.6.1 生长指标与基因 由表2可见,胎儿生长指标(体重、体长)变化与TET1的表达呈极显著正相关(<0.01);体长变化与DKK1呈现显著负相关(<0.05),与Wnt2呈现显著正相关(<0.05),与Wnt5b呈现极显著负相关。Wnt7b与体重变化呈现显著正相关,而Wnt5b呈现显著负相关(<0.05)。
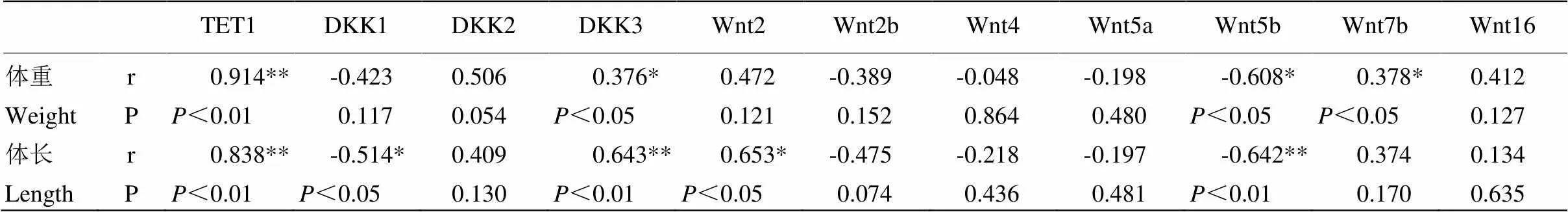
表2 山羊早期胎儿生长指标和基因之间的相关性
同行数据无*表示差异不显著(>0.05),肩标*表示差异显著(<0.05),**表示差异极显著(<0.01)。下同
In the same row, values with no * superscripts mean no significant difference (>0.05), while with * mean significant difference (<0.05),** mean highly significant difference(<0.01). The same as below
2.6.2 基因与基因 相关性分析发现TET1在胎儿发育早期的表达与Wnt2、Wnt7b、Wnt16呈现正相关,与Wnt2b、Wnt4、Wnt5a、Wnt5b呈现负相关,其中与Wnt5b呈显著负相关(<0.05),与Wnt7b呈极显著正相关(<0.01),TET1与山羊胎儿发育早期调控相关的WNT基因有一定联系性和相关性的。WNT通路相关拮抗物DKK家族的表达同样具有一定的联系,DKK3与Wnt4、Wnt16呈显著负相关(<0.05)。除此之外,通过相关分析发现,WNT通路中的各因子之间也有一定的关联性,通路基因之间有一定的互作性。Wnt2与Wnt4呈极显著负相关(<0.01)。Wnt2与Wnt7b,Wnt2b与Wnt5a、Wnt5b,Wnt5a与Wnt5b呈极显著正相关(<0.01)。Wnt4与Wnt5a呈显著正相关(<0.05,表3)。
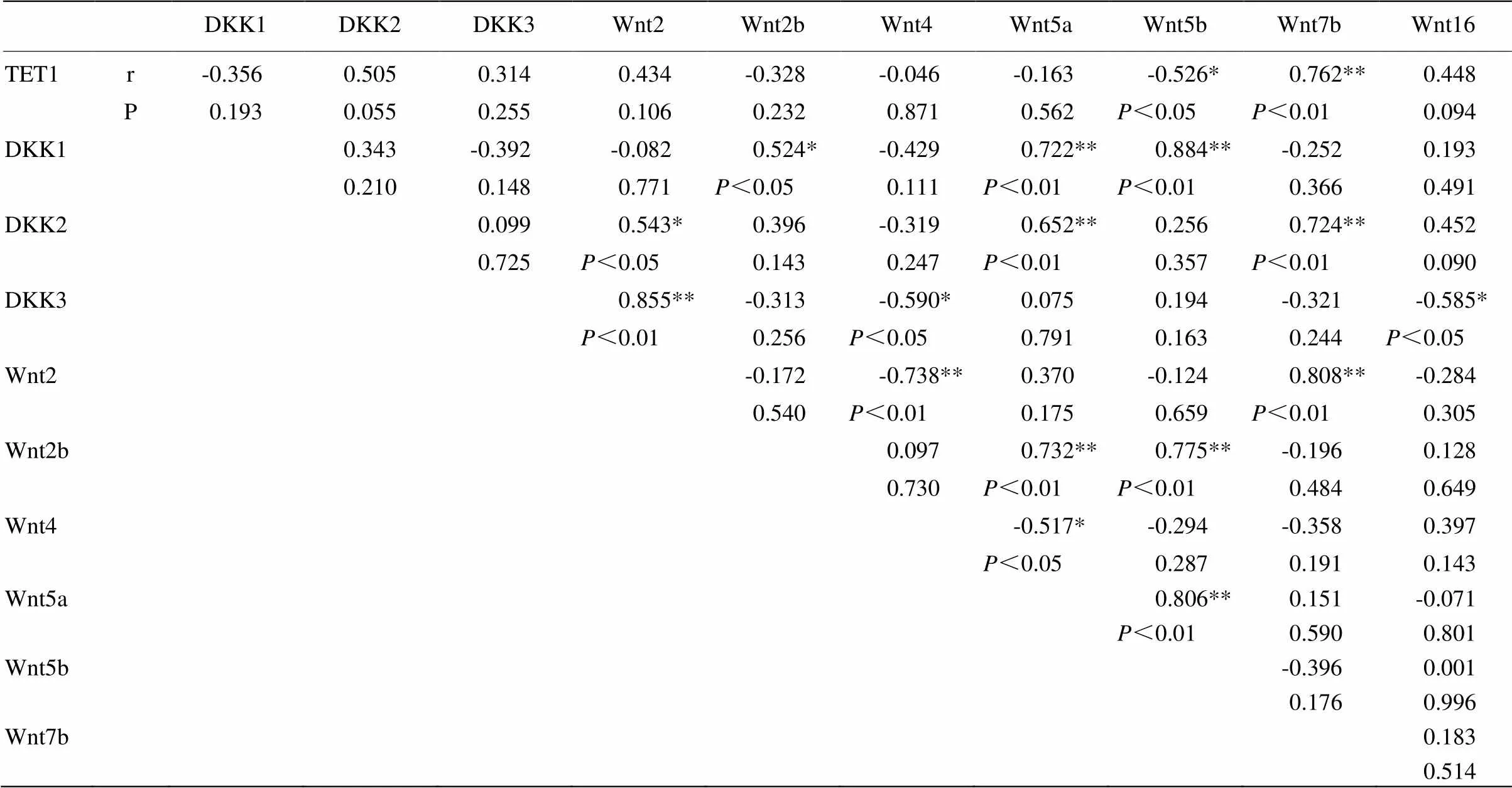
表3 TET1与WNT通路基因以及DKK家族基因之间的相关性分析
3 讨论
TET1属于α-酮戊二酸和Fe2+依赖的双加氧酶家族成员,可催化5-甲基胞嘧啶(5-methylcytosine, 5mC)转化为5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)的反应,是参与主动去甲基化过程(5mC→ 5hmC→5fC→5caC→C)的主要作用酶之一[28]。最近研究发现TET家族酶催化5mC形成5hmC已经成为哺乳动物发育中一个重要的表观遗传修饰,5hmC作为去甲基化的中间产物,是一种重要表观遗传标记。基因组甲基化修饰有利于胚胎干细胞的自我更新分化形成胚胎,进一步分化发育为胎儿各组织器官及胎盘[29]。CAO等[30]的研究显示在猪体内外,核移植胚胎发育早期细胞阶段中表现5mC向5hmC的转化,TET1参在此过程起主要作用,说明其通过甲基化参与过程调控早期胚胎发育。TET蛋白可能是对某些细胞内的通路进行调节的结果,实现早期胚胎发育调控作用[6]。目前在山羊胎儿发育中的研究较少,其具体的分子调控尚不清楚。
本研究结果显示:伴随胎儿的生长发育,TET1表达量逐渐增加,而且与胎儿生长(体重、体长)是极显著正相关的,说明TET1基因可能调控山羊胎儿早期的生长发育。在妊娠90 d时,TET1组织表达量最高,在此阶段,由于前期TET1表达量积累以及显著高表达,增加了组织中TET蛋白维持基因转录的协调性,促进了胎儿的组织器官细胞大量分化[6]。KIM等[5]的研究也表明TET1在超表达转基因小鼠早期神经发生形成中具有调节作用。从TET1组织的表达可以证实这一点,在妊娠90d阶段,胎儿的组织器官细胞大量分化,所以TET1在这一时段表达增加,发挥重要的组织形成调控作用。在本试验中,还检测到TET1在山羊胎儿肝组织中的表达显著,肝脏是机体血糖代谢的重要组织器官,在机体中具有高的活性,在形成的过程中可能存在相应的去甲基化介导机制调节。
目前关于Wnt基因的研究多采用小鼠模型。动物发育的研究领域也多在小鼠胚胎、胎盘[17, 31]、绵羊胎儿胎盘[4]。在山羊,尤其是胎儿早期发育中鲜有研究。Wnt信号通路是哺乳动物中普遍存在的一条信号通路,Wnt蛋白家族是一类保守性较高的信号分子,在脊椎动物中共有19个成员,它们通过细胞跨膜受体FZD以及LRP5/6 co-receptors实现信号传递[15],参与胚胎的生长,形态发育、组织的稳定、能量代谢的平衡以及干细胞的维持等多种生物学发育过程[32]。本研究检测了7种Wnt家族基因(Wnt2,-2b,-4,-5a,-5b,-7b,-16)在山羊胎儿发育早期的变化情况,值得关注的是,Wnt2b、Wnt5a和Wnt5b只在胎儿发育30d阶段显著高表达,说明它们在妊娠30d这个阶段有相似的调控作用,关于山羊胎儿这一阶段的研究未见报道。QUINN等[33]在绵羊25,30d等阶段研究表明有多种胎盘血管形成因子。基因相关分析显示,Wnt2b与Wnt5a、Wnt5b具有极显著的正相关,在后期的组织表达的检测(Fig.5)中,Wnt2b和Wnt5b表达水平很低,在早期发育的后面阶段,调控作用较小。可以推测,Wnt2b与Wnt5b对山羊早期胎儿的发育调控中可能是一种协同关系。此外,Wnt2基因在笔者所鉴定胎儿组织中都呈现显著性表达,Wnt2对多种组织器官的发育形成是不可或缺的[34],对肝和肺的形成具有很重要作用,其表达变化模式也是维持增长的趋势。所以,Wnt2可能是Wnt家族中调控山羊早期胎儿发育的一个关键因子,作为候选分子,值得后续的深入研究。
Wnt通路相关基因与组织的发育是紧密关联的, CAPRIOLI等[35]报道的Wnt4基因对小鼠气管和肺的发育中都是必须的,尤其是在气管及支气管的发育,此外,很多Wnt基因被证实与肺的发育有关,这些基因的缺陷会导致肺的发育不全,包括Wnt7b[36],Wnt5a[37],Wnt2/2b[38]等。本试验中,只有Wnt2在山羊胎儿肺组织中表达显著,其他基因表达较少,可能是存在试验误差或者山羊胎儿肺的发育与这些基因的关系较小。PIETILÄ在研究中提出,DKK1控制Wnt7b在肾乳头中的水平来调控肾脏的发育[39],相关分析也显示,这两者呈现负相关。Wnt家族编码的其他基因也关系到肾脏的发育和形成,包括Wnt4、Wnt7b、Wnt2b、Wnt11等[40],本试验中检测到Wnt7b在胎儿肾中有显著表达,这与以上研究相符合,但其他基因并没有突出表达。同时发现Wnt5a在肾脏中也有显著表达,目前研究未见到报道,说明Wnt5a对山羊胎儿肾脏形成具有很重要作用,而且Wnt5a在大脑和心脏中表达较高,也参与这些器官的形成和发育。TEH等[41]证明Wnt16的两种亚型在成人不同组织中表达,而且Wnt16能活跃角化细胞的增殖。在此试验中,Wnt16基因仅在胎儿皮肤组织中显著表达,说明对山羊皮肤上皮组织的形成有突出作用。
TET1蛋白对Wnt信号通路通过调节其拮抗物DKK家族(DKK1/2/3),对各种疾病或者正常组织的发生产生作用。有研究表明,TET1蛋白通过降低DKK1/2/3[21]或者Sfrp4[22]等基因甲基化程度,调节DKK基因表达,抑制Wnt信号通路表达,从而抑制各种疾病产生或促进正常组织的生长发育。本试验通过检测不同组织TET1和Wnt信号通路相关基因表达量,并且进行了基因间表达量相关性分析。结果表明TET1与Wnt通路部分基因之间存在显著的相关性,可作为筛选与山羊胎儿早期发育相关候选基因的理论依据。而对于TET1、Wnt基因家族和通路相关基因在胎儿早期发育中的功能需要进一步深入研究,TET1与Wnt信号通路的对应调节作用还需要分子生物学功能验证。胎儿早期进行调控及其生理分子机制则需要进一步研究阐明。
4 结论
明确了山羊胎儿发育早期不同组织TET1与Wnt家族基因及其通路相关基因表达变化,补充了山羊上这一领域研究空白。相关性分析揭示了基因之间的相互关系,可作为筛选与山羊胎儿早期发育相关候选基因的理论依据。
References
[1] ITO S, D'ALESSIO A C, TARANOVA O V, HONG K, SOWERS L CZHANG Y. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification2010, 466(7310):1129-1151.
[2] TAHILIANI M, KOH K P, SHEN Y H, PASTOR W A, BANDUKWALA H, BRUDNO Y, AGARWAL S, IYER L M, LIU D R, ARAVIND LRAO A. Conversion of 5-Methylcytosine to 5- Hydroxymethylcytosine in Mammalian DNA by MLL Partner TET12009, 324(5929):930-935.
[3] FRAUER C, ROTTACH A, MEILINGER D, BULTMANN S, FELLINGER K, HASENODER S, WANG M X, QIN W H, SODING J, SPADA FLEONHARDT H. Different binding properties and function of CXXC zinc finger domains in dnmt1 and tet12011, 6(2): e166217.
[4] HAYASHI K, BURGHARDT R C, BAZER F WSPENCER T E. WNTs in the ovine uterus: Potential regulation of periimplantation ovine conceptus development2007, 148(7): 3496-3506.
[5] KIM H, JANG W Y, KANG M C, JEONG J, CHOI M, SUNG Y, PARK S, KWON W, JANG S, KIM M O, KIM S HRYOO Z Y. TET1 contributes to neurogenesis onset time during fetal brain development in mice2016, 471(4):437-443.
[6] KANG J, LIENHARDA M, PASTOR W A, CHAWLA A, NOVOTNY M, TSAGARATOU A, LASKEN R S, THOMPSON E C, SURANI M A, KORALOV S B, KALANTRY S, CHAVEZ LRAO A. Simultaneous deletion of the methylcytosine oxidases Tet1 and Tet3 increases transcriptome variability in early embryogenesis2015, 112(31):E4236-E4245.
[7] YAMAGUCHI S, SHEN L, LIU Y T, SENDLER DZHANG Y. Role of Tet1 in erasure of genomic imprinting2013, 504(7480): 460-464.
[8] NUSSE RVARMUS H E. Many tumors induced by the mouse mammary-tumor virus contain a provirus integrated in the same region of the host genome1982, 31(1):99-109.
[9] DAS A, TANIGAWA S, KARNER C M, XIN M, LUM L, CHEN C, OLSON E N, PERANTONI A OCARROLL T J. Stromal-epithelial crosstalk regulates kidney progenitor cell differentiation2013, 15(9):1035.
[10] DASGUPTA RFUCHS E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation1999, 126(20):4557-4568.
[11] GRIGORYAN T, WEND P, KLAUS ABIRCHMEIER W. Deciphering the function of canonical Wnt signals in development and disease: conditional loss- and gain-of-function mutations of beta-catenin in mice2008, 22(17):2308-2341.
[12] KIM B M, BUCHNER G, MILETICH I, SHARPE P TSHIVDASANI R A. The stomach mesenchymal transcription factor Barx1 specifies gastric epithelial identity through inhibition of transient Wnt signaling2005, 8(4):611-622.
[13] PINTO D, GREGORIEFF A, BEGTHEL HCLEVERS H. Canonical Wnt signals are essential for homeostasis of the intestinal epithelium2003, 17(14):1709-1713.
[14] KEMP C, WILLEMS E, ABDO S, LAMBIV LLEYNS L. Expression of all Wnt genes and their secreted antagonists during mouse blastocyst and postimplantation development2005, 233(3):1064-1075.
[15] SONDEREGGER S, POLLHEIMER JKNOFLER M. Wnt Signalling in Implantation, Decidualisation and Placental Differentiation - Review2010, 31(10):839-847.
[16] LU W G, TU Z W, WANG S M, LU J H, WANG Q, WANG W X, WANG B Y, WANG H B, NI H MGUO Y. Spatiotemporal expression of Wnt signaling pathway components during bovine placental development2013, 80(8):893-902.
[17] MARIKAWA Y. Wnt/beta-catenin signaling and body plan formation in mouse embryos2006, 17(2):175-184.
[18] NIEHRS C. Function and biological roles of the Dickkopf family of Wnt modulators2006, 25(57):7469-7481.
[19] LIEVEN O, KNOBLOCH JRUTHER U.The regulation of Dkk1 expression during embryonic development2010, 340(2):256-268.
[20] FOSSAT N, JONES V, KHOO P L, BOGANI D, HARDY A, STEINER K, MUKHOPADHYAY M, WESTPHAL H, NOLAN P M, ARKELL RTAM P P L. Stringent requirement of a proper level of canonical WNT signalling activity for head formation in mouse embryo2011, 138(4):667-676.
[21] NERI F, DETTORI D, INCARNATO D, KREPELOVA A, RAPELLI S, MALDOTTI M, PARLATO C, PALIOGIANNIS POLIVIERO S. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway2015, 34(32):4168-4176.
[22] LI X, YUE X J, PASTOR W A, LIN L Z, GEORGES R, CHAVEZ L, EVANS S MRAO A. Tet proteins influence the balance between neuroectodermal and mesodermal fate choice by inhibiting Wnt signaling2016, 113(51):E8267-E8276.
[23] ISHIKAWA T, TAMAI Y, ZORN A M, YOSHIDA H, SELDIN M F, NISHIKAWA STAKETO M M. Mouse Wnt receptor gene Fzd5 is essential for yolk sac and placental angiogenesis2001, 128(1):25-33.
[24] PARR B A, CORNISH V A, CYBULSKY M IMCMAHON A P. Wnt7b regulates placental development in mice2001, 237(2):324-332.
[25] NUSSE R.Wnt signaling in disease and in development2005. 15(1):28-32.
[26] ATLI M O, GUZELOGLU ADINC D A. Expression of wingless type (WNT) genes and their antagonists at mRNA levels in equine endometrium during the estrous cycle and early pregnancy2011, 125(1-4):94-102.
[27] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR2001, 29(9):e45.
[28] WU H, ZHANG Y. Reversing DNA methylation: mechanisms, genomics, and biological functions2014, 156(1-2):45-68.
[29] MEISSNER A, MIKKELSEN T S, GU H C, WERNIG M, HANNA J, SIVACHENKO A, ZHANG X L, BERNSTEIN B E, NUSBAUM C, JAFFE D B, GNIRKE A, JAENISCH RLANDER E S. Genome-scale DNA methylation maps of pluripotent and differentiated cells2008, 454(7205):766-791.
[30] CAO Z B, ZHOU N R, ZHANG Y, ZHANG Y L, WU R H, LI Y S, ZHANG Y HLI N. Dynamic reprogramming of 5-hydroxymethylcytosine during early porcine embryogenesis2014, 81(3): 496-508.
[31] MOHAMED O A, DUFORT DCLARKE H J. Expression and estradiol regulation of Wnt genes in the mouse blastocyst identify a candidate pathway for embryo-maternal signaling at implantation2004, 71(2):417-424.
[32] REYA TCLEVERS H. Wnt signalling in stem cells and cancer2005, 434(7035):843-850.
[33] QUINN K E, ASHLEY A K, REYNOLDS L P, GRAZUL-BILSKA A TASHLEY R L. Activation of the CXCL12/CXCR4 signaling axis may drive vascularization of the ovine placenta2014, 47:11-21.
[34] POULAIN MOBER E A. Interplay between Wnt2 and Wnt2bb controls multiple steps of early foregut-derived organ development2011, 138(16):3557-3568.
[35] CAPRIOLI A, VILLASENOR A, WYLIE L A, BRAITSCH C, MARTY-SANTOS L, BARRY D, KARNER C M, FU S, MEADOWS S M, CARROLL T JCLEAVER O. Wnt4 is essential to normal mammalian lung development2015, 406(2): 222-234.
[36] RAJAGOPAL J, CARROLL T J, GUSEH J S, BORES S A, BLANK L J, ANDERSON W J, YU J, ZHOU Q, MCMAHON A PMELTON D A. Wnt7b stimulates embryonic lung growth by coordinately increasing the replication of epithelium and mesenchyme2008, 135(9):1625-1634.
[37] LI C G, XIAO J, HORMI K, BOROK ZMINOO P. Wnt5a participates in distal lung morphogenesis2002, 248(1): 68-81.
[38] GOSS A M, TIAN Y, TSUKIYAMA T, COHEN E D, ZHOU D, LU M M, YAMAGUCHI T PMORRISEY E E. Wnt2/2b and beta-catenin signaling are necessary and sufficient to specify lung progenitors in the foregut2009, 17(2):290-298.
[39] PIETILA I, ELLWANGER K, RAILO A, JOKELA T, BARRANTES I D, SHAN J D, NIEHRS CVAINIO S J. Secreted Wnt antagonist Dickkopf-1 controls kidney papilla development coordinated by Wnt-7b signalling2011, 353(1):50-60.
[40] MERKEL C E, KARNER C MCARROLL T J. Molecular regulation of kidney development: is the answer blowing in the Wnt?2007, 22(11):1825-1838.
[41] TEH M T, BLAYDON D, GHALI L R, BRIGGS V, EDMUNDS S, PANTAZI E, BARNES M R, LEIGH I M, KELSELL D PPHILPOTT M P. Role for WNT16B in human epidermal keratinocyte proliferation and differentiation .2007, 120(Ptz):330-339.
(责任编辑 林鉴非)
Expression Patterns and Correlation of Wnts and TET1 Genes in Early Fetal Tissues of Dazu Black Goat
TAN Qiang, LUO NanJian, ZHANG YanLi, AN BingXing,CHEN QiuYang, ZHAO YongJu
(College of Animal Science and Technology, Southwest University/Chongqing Key Laboratory of Forage&Herbivore/Chongqing Engineering Research Center for Herbivores Resource Protection and Utilization, Chongqing 400715)
【Objective】The aim of the research was to quantitate the relative expression level of TET1, Wnt and DKK genes during early fetus development in goat, analyze the correlation between TET1 and Wnts genes in further. 【Method】Twelve healthy Dazu black goats copulated with the same ram by wild pairing while these goats with spontaneous estrus. Caesarean section was used to obtain fetus that pregnancy on days 20, 25, 30, 60 and 90, respectively, the growth indexes of the fetus (fetal weight, fetal length) were tested, and the tissue samples of 60d and 90d (fetal heart, liver, lung, kidney, brain and skin) were collected. Real-time (RT-PCR) was used to detect the relative expression level of TET1 gene, DKK family genes (DKK1, DKK2, DKK3) and Wnt family genes (Wnt2, Wnt2b, Wnt4, Wnt5a, Wnt5b, Wnt7b, Wnt16). SPSS software was used to analyze the correlation between TET1 and Wnt signaling pathway genes (<0.05) at different stages of fetal development. 【Result】According to the statistics, there were significant changes in fetal development in early pregnancy after 60d. The results showed that the expression of TET1 gene increased with the development of gestational days. All Wnt family genes were detected in the fetus (Wnt2, -2b, -4, -5a, -5b, -7b, -16). Among these changes of fetal development, Wnt2 and Wnt7b expression increase with fetal development gradually; Wnt2b, Wnt5a, Wnt5b, and Wnt7b genes has a significant highly expression on pregnancy 30d (<0.05); the expression of Wnt4 was significantly in fetus on pregnancy 20d (<0.05); Wnt16 gene was significantly in fetus on pregnancy 25d (<0.05). The expression level of DKK family genes showed that DKK1 was detected in the early pregnancy of fetal development, and DKK2/3 performed a low expression level in the early pregnancy, whereas increased in later stage. The expression level of TET1 in liver, lung, kidney and brain in 90d fetus was higher than 60d fetal tissue, there was a significantly expression in liver (<0.05). Interestingly, Wnt2 had a highly significant expression level in all tissues of fetus on pregnancy 60 and 90d, especially in lung (<0.01); Wnt16 had a highly expression in fetal skin (<0.05); Wnt5a and Wnt7b had a significantly expression level in kidney (<0.05), other Wnt genes of Wnt family were detected in fetal tissues as well. Correlation analysis showed that the fetal growth indexes (fetal weight, body length) were positively correlated to changes in the expression of TET1 (<0.01); TET1 in early fetal development and the expression of Wnt2, Wnt7b and Wnt16 gene showed a positive correlation, and negatively correlated with Wnt2b, Wnt4, Wnt5a and Wnt5b, which was negatively correlated with Wnt5b (<0.05), and significantly and positively correlated with Wnt7b (<0.01). There was also a correlation between Wnt pathway genes, Wnt2 and Wnt4 showed a significant negative correlation (<0.01). Wnt2 and Wnt7b, Wnt2b and Wnt5a, Wnt5b, Wnt5a and Wnt5b showed a significant positive correlation (<0.01). Wnt4 was positively correlated with Wnt5a (<0.05). 【Conclusion】The dynamic expression patterns of TET1 and Wnt genes in early fetal development of goat, and correlation of these genes were obtained from this study which fill the blank of those genes in this research field. The article revealed TET1 and Wnts regulate the embryonic development and the formation of tissues by a dynamic pattern. TET1appeared a positively correlation with some Wnt genes while negatively with others. It is also showed interactive in Wnt signaling pathway genes. The data obtained from the research will provide a reference for molecular mechanism research of TET1 and Wnts.
goat fetus; TET1; Wnt signaling pathway; expression pattern; correlation
2016-09-01;接受日期:2017-05-22
国家级大学生创新创业训练计划(201510635013)、重庆高校创新团队建设计划资助项目(CXTDG201602004)、中央高校基本业务费专项资金(XDJK2017A003)、重庆市社会民生科技创新专项项目(cstc2016shmszx80064)
谭强,Tel:18883394145;E-mail:tq19952010@126.com。罗南剑,Tel:13996488708;E-mail:luonanjian28@sina.cn。谭强和罗南剑为同等贡献作者。通信作者赵永聚,Tel:023-68251255;E-mail:zyongju@163.com
