鸡3种主要DNA病毒多重感染复合PCR检测方法的建立
2017-07-31李学伍刘媛王丽邓瑞广赵东杨继飞柴书军
李学伍,刘媛,王丽,邓瑞广,赵东,杨继飞,柴书军
(1.河南省农业科学院动物免疫学重点实验室,河南郑州450002; 2.河南科技大学动物科技学院,河南洛阳471023)
鸡3种主要DNA病毒多重感染复合PCR检测方法的建立
李学伍1,刘媛2,王丽1,邓瑞广1,赵东1,杨继飞1,柴书军1
(1.河南省农业科学院动物免疫学重点实验室,河南郑州450002; 2.河南科技大学动物科技学院,河南洛阳471023)
依据GenBank中注册的鸡马立克氏病病毒(MDV)、鸡传染性喉气管炎病毒(ILTV)、鸡痘病毒(FPV)基因组核苷酸序列中的保守序列设计引物,3种病毒各设计3对引物,共计9对引物,经生物学软件筛选后,得到3对相互匹配较佳的引物。3对匹配引物经单一PCR验证后,优化复合PCR反应条件,确定最佳的退火温度、引物浓度和Taq DNA聚合酶浓度;经特异性、敏感性试验及简化PCR试验,建立简易复合PCR检测方法。复合PCR扩增出的3条带大小与预期一致,即228 bp(MDV)、400 bp(ILTV)、499 bp(FPV);建立的复合PCR方法能同时检测出100 fg MDV、ILTV、FPV的DNA。同时依据PCR技术原理,将经典的三温热循环改进为二温热循环试验,即将退火和延伸合并为一步(62℃),缩短了反应时间。建立的3种病毒的复合PCR检测方法具有较高的特异性和敏感性,可以用于临床病料的快速诊断。
马立克氏病病毒;传染性喉气管炎病毒;鸡痘病毒;DNA病毒;复合PCR
鸡马立克氏病、传染性喉气管炎、鸡痘分别是由马立克氏病病毒(Marek’s disease virus,MDV)、传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)、鸡痘病毒(fowlpox virus,FPV)引起的鸡病毒性传染病,病原体均为线性双股DNA病毒,其中MDV、ILTV为疱疹病毒科成员,FPV为痘病毒科成员[1-2]。MDV和ILTV一旦感染鸡群则终身带毒,2种病毒均存在于很多鸡场,在非免疫鸡场往往引起大群发病,即便在严格免疫的鸡场也时常发病,很难根除;鸡痘是鸡常见的传染病,在不同年龄段的鸡群中经常发生,往往造成雏鸡的大批死亡。上述鸡的3种传染病均呈世界性分布,在我国许多养鸡场呈现不同程度的流行,是严重危害我国养鸡业健康发展的3大主要疫病[3-4]。
随着鸡病毒类疫苗的反复多次和长期注射,病毒基因组被大量注入鸡的体内,病毒的重组与变异逐渐显现,临床上出现了温和毒株、强毒株和超强毒株[5-8],中和抗体的保护临界值不断升高,预防压力越来越大。临床症状和病理变化不具特征,多种病毒混合感染较为普遍,对于发病鸡的临床鉴别诊断十分困难。因此,鸡病的诊断更加依赖实验室检测。聚合酶链式反应(PCR)为实验室检测鸡病最常用的方法之一,已被广泛应用于多种鸡病的检测。近些年来,人们又研发了复合PCR检测方法,并成功用于鸡多种病毒的鉴别诊断[9-10],复合PCR不仅具有常规PCR的优点,而且可同时检测多种病毒,在临床混合感染的鉴别诊断中发挥了重要作用,而目前对于MDV、ILTV和FPV的PCR检测均为常规PCR检测[11-13]。建立一种同时检测MDV、ILTV和FPV的简易复合PCR检测方法已成为当务之急。为此,本研究建立特异、敏感、快速、一次性同时检测MDV、ILTV、FPV的简易复合PCR方法,以期为鸡多病毒混合感染的早期快速鉴别诊断奠定基础。
1 材料和方法
1.1 材料
1.1.1 毒株及病料ILTV(K317株)、FPV(鹌鹑化弱毒株)、鸡传染性支气管炎病毒(IBV,LDT3-A株)、鸡新城疫病毒(NDV,LaSota株)均为活疫苗株,购于哈兽研维科生物有限公司;MDV(广西毒株)、禽流感病毒(AIV,H9N2株)均由河南省动物免疫学重点实验室提供。临床发病鸡的组织病料由金大众华夏畜禽疫病诊疗中心提供。
1.1.2 主要试剂Premix Taq(Ex Taq Version 2.0 plus dye)、基因组DNA提取试剂盒、DNA Marker均购自大连宝生物工程有限公司。
1.2 方法
1.2.1 引物设计与合成下载GenBank中MDV不同毒株的Meq基因、ILTV不同毒株的gB基因、FPV不同毒株的4b基因的核苷酸序列,通过序列比对,筛选出Meq、gB、4b基因的保守序列[14],利用Primer Premier 6.0生物学软件在保守序列区设计引物,每种基因的保守序列设计特异性引物3对,3种基因的保守序列共设计特异性引物9对,应用生物学软件筛选出匹配最佳的引物[15-16],引物由生工生物工程(上海)股份有限公司合成。
1.2.2 病毒DNA的制备以ILTV、FPV冻干疫苗悬液、MDV细胞培养物为样本,应用基因组DNA提取试剂盒分别提取制备MDV、ILTV、FPV的DNA,DNA提取制备的具体步骤按试剂盒说明书进行,利用核酸分析仪测定提取病毒DNA的OD260/OD280及其质量浓度,将提取的DNA稀释至工作质量浓度,-20℃保存备用。
1.2.3 单一PCR扩增分别以ILTV、MDV、FPV的DNA为模板,利用对应的引物进行常规单一PCR扩增,采用50 μL反应体系:Premix Taq 25 μL,上、下游引物(20 μmol/L)各1 μL,模板DNA(100 ng/μL) 1 μL,ddH2O 22 μL。PCR反应程序为:95℃30 s,匹配退火温度30 s,72℃40 s,30个循环;72℃延伸5 min,反应结束后4℃保存。琼脂糖凝胶电泳检测扩增产物,并在凝胶成像仪中检测PCR扩增结果。
1.2.4 复合PCR
1.2.4.1 反应条件优化以单一PCR反应体系和反应条件为基础,以MDV、ILTV、FPV DNA的混合物为模板,优化复合PCR的反应条件,筛选出复合PCR反应的最佳条件。复合PCR反应体系中可优化的条件主要包括引物浓度、退火温度、Taq DNA聚合酶用量。对上述反应条件进行反复多次扩增试验,并通过对扩增产物的检测,最终确定反应条件。
1.2.4.2 复合PCR敏感性试验取少量MDV、ILTV、FPV DNA进行混合,并测定混合后的DNA质量浓度,用灭菌双蒸水系列稀释已知质量浓度的混合DNA样品,以不同稀释度的混合DNA为模板进行复合PCR扩增试验,琼脂糖凝胶电泳检测PCR扩增产物,测定复合PCR的检出极限,评估复合PCR的敏感性。
1.2.4.3 复合PCR特异性试验以IBV、AIV、NDV为参比病毒测定复合PCR的特异性,分别以IBV、AIV、NDV核酸及其混合物为模板进行复合PCR扩增,同时以MDV、ILTV、FPV、AIV、IBV、NDV多种病毒核酸混合物为模板进行复合PCR扩增,琼脂糖凝胶电泳检测PCR扩增产物,评估复合PCR的特异性。
1.2.4.4 复合PCR简化试验利用Taq DNA聚合酶活性特点,将热变性、退火和延伸三循环PCR进行简化,由3个反应阶段的循环改为2个反应阶段的循环,即退火和延伸在1个温度下同时完成[17]。应用简化后的复合PCR对MDV、ILTV、FPV DNA进行多次扩增,琼脂糖凝胶电泳检测PCR扩增产物,评估简化复合PCR的可行性。
1.2.4.5 复合PCR的验证试验分别应用复合PCR、单一PCR、琼脂扩散(AGP)、酶联免疫吸附试验(ELISA)对临床表现疑似马立克病、传染性喉气管炎、鸡痘病的鸡组织病料进行检测,共检测由河南省部分鸡场送检病鸡的组织病料137份,并对不同方法的检测结果进行比较。
2 结果与分析
2.1 引物筛选结果
根据3种病毒不同毒株基因的相对保守序列设计出9对引物,利用生物学软件对9对引物进行模拟筛选,经筛选得到复合PCR匹配引物3对。引物序列见表1。

表1 MDV、ILTV、FPV PCR扩增引物
2.2 单一PCR扩增结果
由图1可见,单一PCR扩增时,3种病毒均扩增出与试验设计相符的特异性片段,扩增片段的大小分别为:228 bp(MDV)、400 bp(ILTV)和499 bp (FPV)。可见,筛选获得的复合PCR引物在对3种病毒单独扩增时,均获得了较好的扩增结果,为复合PCR扩增奠定了基础。
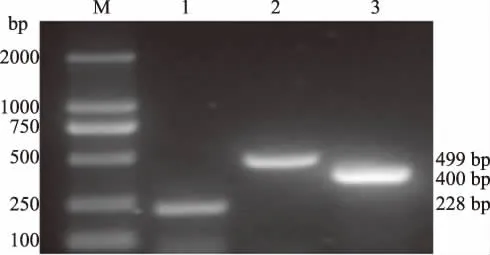
图1 MDV、ILTV、FPV单一PCR扩增结果
2.3 复合PCR反应条件的优化结果
2.3.1 退火温度以单一PCR退火温度为基础,以MDV、ILTV、FPV DNA的混合物为模板,依据Tm值设定不同的退火温度(50、52、54、56、58、60、62、64℃)进行复合PCR试验,琼脂糖凝胶电泳检测复合PCR扩增产物。结果表明,复合PCR的适宜退火温度为56℃(图2)。
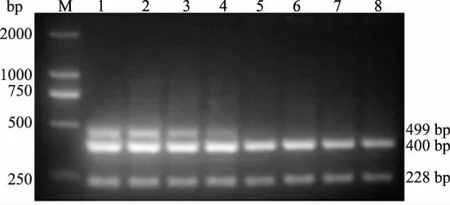
图2 MDV、ILTV、FPV复合PCR退火温度的优化结果
2.3.2 引物浓度以单一PCR引物浓度为基础,以MDV、ILTV、FPV DNA的混合物为模板,3种病毒扩增引物的浓度分别设定为1.00、1.25、2.00、2.50、3.00 μmol/L,进行复合PCR扩增。结果显示,最佳引物浓度为2 μmol/L(图3)。
2.3.3 Taq DNA聚合酶用量采用复合PCR适宜退火温度和引物浓度,以MDV、ILTV、FPV DNA的混合物为模板,应用不同的酶量(0.50、0.75、1.00、1.25、1.50 U)进行复合PCR试验。结果显示,Taq DNA聚合酶适宜用量为1.00 U(图4)。
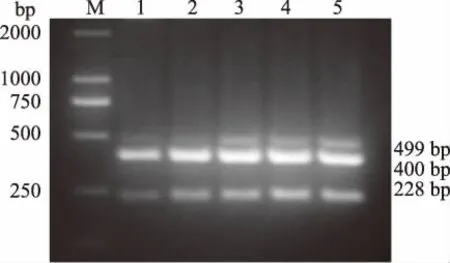
图3 MDV、ILTV、FPV复合PCR引物浓度的优化结果
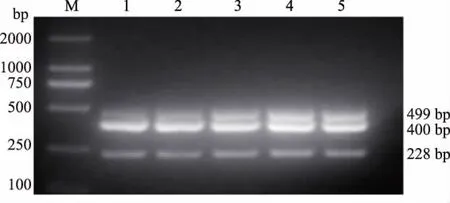
图4 MDV、ILTV、FPV复合PCR Taq DNA聚合酶用量的优化结果
2.4 复合PCR的敏感性检测结果
以复合PCR的优化条件为基础,以不同用量MDV、ILTV、FPV的DNA为模板(1 ng、100 pg、10 pg、1 pg、100 fg、10 fg、1 fg)进行复合PCR试验。结果显示,复合PCR对MDV、ILTV、FPV DNA的检测极限为100 fg(图5)。
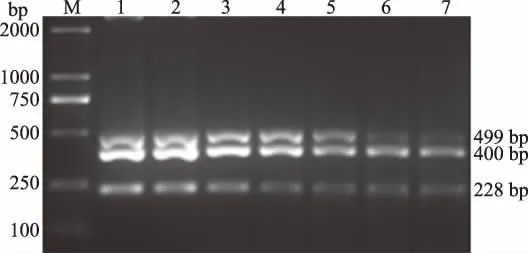
图5 MDV、ILTV、FPV复合PCR敏感性检测结果
2.5 复合PCR的特异性检测结果
以优化的复合PCR反应条件为基础,以MDV、ILTV、FPV、IBV、AIV、NDV的核酸为模板,进行复合PCR扩增,检测复合PCR扩增的特异性。结果显示,IBV、NDV和AIV分别与MDV、ILTV、FPV的核酸混合,分别出现与预期MDV、ILTV、FPV相符的目的片段,而单独扩增IBV、NDV和AIV的核酸均没有扩增出任何条带,混合6种病毒核酸的复合PCR体系只能扩增出与试验设计相符的MDV、ILTV、FPV核酸的特异性扩增条带(图6)。
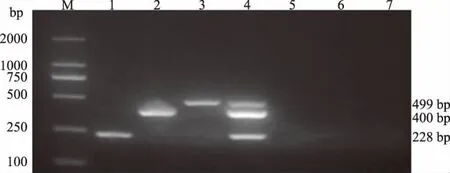
图6 MDV、ILTV、FPV复合PCR的特异性检测结果
2.6 复合PCR的简化结果
将复合PCR的三温循环简化为二温循环,使退火和延伸在同一温度下完成,结果显示,退火延伸温度为62℃时扩增效果较好(图7)。
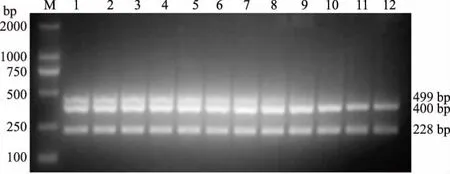
图7 简化复合PCR的退火延伸温度筛选结果
2.7 复合PCR检测验证试验结果
分别应用复合PCR、单一PCR、AGP和ELISA对137份鸡的组织病料进行检测(表2),复合PCR、单一PCR的检出率均为79.6%(109/137),AGP、ELISA的检出率分别为41.6%(57/137)、70.1% (96/137),复合PCR和单一PCR的检出符合率均为100%,AGP、ELISA的检出符合率分别为52.3%、88.1%。

表2 复合PCR与单一PCR、AGP、ELISA检测结果的比较
3 结论与讨论
多重PCR技术是能同时扩增同一病原核酸的不同基因片段或多个病原不同核酸片段的技术,具有高效快捷、特异性强、敏感性高、成本低等优点,对于多种病原的鉴别诊断比单一PCR诊断更为快速[18-21]。建立多病原高效复合PCR检测方法的关键是设计引物,引物的各项指标直接关系到复合PCR检测方法的成败,与单一PCR引物相比,复合PCR引物要具有高度特异性,每对引物自身不仅不能存在互补序列,而且不同引物对之间也不能存在互补序列,确保所有引物均无发卡结构和引物二聚体;引物对之间既具有相近的退火温度,同时具有较高的扩增特异性,只扩增目的片段[22];扩增片段的大小具有明显的差异,确保各病毒扩增片段在电泳图谱上可以直观地区分。其次是引物浓度和Taq DNA聚合酶用量的优化,可使建立的复合PCR方法对病毒的检测具有更高的敏感性。
本试验结果表明,建立的复合PCR检测方法只能扩增MDV、ILTV、FPV的DNA片段,具有较高的特异性;扩增片段的大小差异明显(228、400、499 bp),便于肉眼直观鉴别,对3种病毒的最低检出极限为100 fg,具有较高的敏感性;复合PCR、单一PCR、AGP、ELISA对临床样品的检测结果显示,复合PCR与单一PCR的检出结果完全一致,二者的检出率均明显高于AGP和ELISA,表明复合PCR对临床样品检测结果可靠。
Taq DNA聚合酶是PCR反应体系中的关键试剂之一,Taq DNA聚合酶在不同温度下均具有DNA互补片段的延伸活性,其最佳活性温度为70~75℃,此温度下互补链的合成延伸速度为150~300 bp/s,当温度降为60~70℃时互补链延伸速度为60~120 bp/s,当温度升至75~80℃时互补链延伸速度约为150 bp/s;对于小于500 bp的扩增片段,选择上述任何一个温度范围,均可在较短时间内完成互补链的延伸并产生目的片段[13]。常规PCR的扩增均为三温热循环扩增,即变性温度、退火温度和延伸温度,Taq DNA聚合酶的宽温度范围活性特点为退火和延伸的合并奠定了基础[17]。本试验经反复筛选确定了退火延伸温度为62℃,实现了退火和延伸同温进行,将复合PCR的三温热循环简化为二温热循环,不仅缩短了PCR的反应时间,而且二温热循环的退火延伸温度高于三温热循环的退火温度,进一步保障了扩增产物的特异性。不同检测方法对临床病料的检测结果表明,复合PCR与单一PCR具有相同的检出结果,能够应用于临床检测,为多病原混合感染的鉴别诊断奠定了基础。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]宁宜宝.兽用疫苗学[M].北京:中国农业出版社,2008.
[3]刘玉山,史玉颖.2014年山东省鸡病流行概况[J].家禽科学,2015(2):24-26.
[4]于自民,马明杰,何召庆.我国北方主要鸡病毒病流行现状[J].兽医导刊,2015(9):46-48.
[5]Gimeno I M.Marek’s disease vaccines:A solution for today but a worry for tomorrow[J].Vaccine,2008,26(3): 31-41.
[6]Tian M,Zhao Y,Lin Y,et al.Comparative analysis of oncogenic genes revealed unique evolutionary features of field Marek’s disease virus prevalent in recent years in China[J].Virology Journal,2011,8(1):121-131.
[7]Gong Z H,Zhang L J,Wang J L,et al.Isolation and analysis of a very virulent Marek’s disease virus strain in China[J].Virology Journal,2013,10(1):155-162.
[8]Zhuang X,Zou H,Shi H,et al.Outbreak of Marek’s disease in a vaccinated broiler breeding flock during its peak egg-laying period in China[J].BMC Vet Res,2015,11 (1):157-163.
[9]黄溢泓,韦正吉,李志源.五种禽呼吸道病病原多重PCR检测方法的建立和应用[J].中国兽医科学,2010,40(2):164-168.
[10]庞耀珊,谢芝勋.二温式多重PCR同时检测鸡的6种呼吸道病病原方法的建立[J].中国兽医科学,2001,31(5):4-7.
[11]邵攀峰,陈红英,崔保安,等.鸡传染性喉气管炎病毒PCR快速检测方法的建立[J].安徽农业大学学报,2010,37(1):58-62.
[12]晏勇邦,陈芳艳,陈瑞爱,等.鸡痘病毒PCR检测方法的建立及临床应用[J].畜牧与兽医,2011,43(5): 80-82.
[13]张丽娟,龚振华,管远红,等.一种用于马立克氏病病原检测的PCR技术研究[J].江西农业大学学报,2014,36(1):216-220.
[14]邵西群,邵群,闫喜军.大数量序列的PCR保守引物设计实践[J].生物信息学,2007,8(4):171-175.
[15]张新宇,高燕宁.PCR引物设计及软件使用技巧[J].生物信息学,2004,7(4):15-19.
[16]尤超,赵大球,梁乘榜.PCR引物设计方法综述[J].现代农业科技,2011,3(17):48-52.
[17]卢圣栋.现代分子生物学实验技术[M].北京:高等教育出版社,1993.
[18]曹宏云,尚崇华.多重PCR技术在畜禽病原学检测中的应用[J].湖北农业科学,2010(7):1719-1721.
[19]Li M,Xie Z,Xie Z,et al.Simultaneous detection of four different neuraminidase types of avian influenza A H5 viruses by multiplex reverse transcription PCR using a GeXP analyser[J].Influenza Other Respir Viruses,2016,10(2):141-149.
[20]Gao Q,Yun B,wang Q,et al.Development and application of a multiplex PCR method for rapid differential detection of subgroup A,B,and J avian leukosis viruses[J].J Clin Microbiol,2014,52(1):37-44.
[21]刘媛,李学伍,王丽,等.鸡4种主要RNA病毒病多重感染复合PCR检测方法的建立[J].河南农业科学,2016,45(11):105-109.
[22]Lee E,Kim E J,Shin Y K,et al.Design and testing of multiplex RT-PCR primers for the rapid detection of influenza A virus genomic segments:Application to equine influenza virus[J].J Virol Methods,2016,228:114-122.
Establishment of Multiplex PCR Detection Method for Three Kinds of Main DNA Viruses in Chicken
LI Xuewu1,LIU Yuan2,WANG Li1,DENG Ruiguang1,ZHAO Dong1,YANG Jifei1,CHAI Shujun1
(1.Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China; 2.College of Animal Science and Technology,Henan Science and Technology University,Luoyang 471023,China)
Specific primers were designed upon the conservative sequences of Marek’s disease virus (MDV),infectious laryngotracheitis virus(ILTV),and fowlpox virus(FPV)genomic nucleotide sequences from registered in GenBank.Three pairs of specific primers for each virus were designed,a total of 9 pairs of primers for three viruses(MDV,ILTV,FPV)were screened by biological software,and three pairs of primers matched each other.After verification of three pair suitable primers with singleplex PCR,the reaction conditions of the multiplex PCR were optimized,including annealing temperature,concentrations of primers and Taq DNA polymerase.The simple multiplex PCR assay was successfully established after specificity,sensitivity and simplified test.The specific bands with lengths of 228 bp(MDV),400 bp (ILTV),499 bp(FPV)were amplified by the multiplex PCR,which were consistent with those expected.The results demonstrated that the method could simultaneously amplify these three viruses at a sensitivity of 100 fg when all three viruses were present.According to the principle of PCR technology,the classical PCR(a three step thermal cycle assay)was improved to be a two step thermal cycle assay,namely annealing and extension step were merged into one step(62℃),and the reaction time was shortened.This mul-tiplex PCR for three DNA viruses was both highly specific and sensitive,and could be used as a rapid diagnostic assay for clinical samples.
Marek’s disease virus;infectious laryngotracheitis virus;fowlpox virus;DNA viruses;multiplex PCR
S855.3
A
1004-3268(2017)07-0101-05
2017-01-12
公益性行业(农业)科研专项(201303033)
李学伍(1964-),男,河南通许人,研究员,博士,主要从事动物病原学和免疫学研究。E-mail:lixuewu2002@126.com
