转基因苜蓿草KK179-2品系特异性实时荧光PCR检测方法的建立
2017-07-31刘二龙卢丽吕英姿蒋湘李嘉琪林学勤杜雅萍郑高彬
刘二龙,卢丽,吕英姿,蒋湘,李嘉琪,林学勤,杜雅萍,郑高彬
(1.黄埔出入境检验检疫局,广东广州510730;2.广东出入境检验检疫局,广东广州510623)
转基因苜蓿草KK179-2品系特异性实时荧光PCR检测方法的建立
刘二龙1*,卢丽2,吕英姿1,蒋湘1,李嘉琪1,林学勤1,杜雅萍1,郑高彬1
(1.黄埔出入境检验检疫局,广东广州510730;2.广东出入境检验检疫局,广东广州510623)
根据转基因低木质素苜蓿草品系KK179-2 5’端外源插入序列与苜蓿草基因组DNA之间的邻接区序列设计引物和探针,建立了KK179-2品系特异性实时荧光PCR检测方法,并对其特异性、灵敏度及可重复性进行了测定。结果表明:建立的定量实时荧光PCR检测方法特异性良好;标准曲线线性相关系数(R2)为0.99,扩增效率E为105%;检测限为20拷贝,定量限为200拷贝。重复性实验显示本方法的标准偏差(SD)及相对标准偏差(RSD)都在可接受范围内。综上,建立的KK179-2品系特异性定量PCR检测方法适于快速、准确、稳定地对转基因苜蓿草KK179-2品系进行检测。
转基因苜蓿KK179-2;品系特异性;定量实时荧光PCR
苜蓿是美国继玉米、小麦、大豆后第四大农作物,因其蛋白质含量约占总干草质量的17%~20%,是一种重要的饲料作物。转基因苜蓿KK179-2是由孟山都公司和Forage Genetics International(FGI)共同开发的转基因低木质素苜蓿品种,商品名为HarvXtraTM。KK179-2于2014年11月10日获得美国农业部(USDA)动植物卫生检疫局(APHIS)批准可在美国种植。目前批准用于食品及加工产品的国家为澳大利亚、加拿大、日本、墨西哥、新西兰、韩国、美国七个国家(山东草业网,2014;Clive等,2014;国家质检总局,2014)。木质素是维管植物细胞壁的重要组成成分,由于苜蓿木质素不易被消化,因而降低了苜蓿的营养价值,转基因苜蓿品系KK179-2与传统苜蓿相比,木质素最高可减少22%(ISSSA,2017;Health,2015)。2014年5月1日澳新食品标准局(FSANZ)批准转基因苜蓿KK179-2可用于食品。KK179-2目前尚未获得我国农业部转基因生物安全证书。
低木质素的苜蓿品系KK179-2在苜蓿基因组中插入了咖啡酰CoA甲基转移酶(CCOMT)编码序列(CCOMT是参与G型木质素生物合成路径的酶),该片段引入的方式为反向重复序列,表达时可以产生双链RNA,从而产生RNA干扰(RNAi),抑制内源CCOMT RNA的翻译及CCOMT酶的水平,导致KK179-2的G木质素含量降低进而减少苜蓿木质素整体含量(ISSSA,2017;Health,2015;蔺占兵等,2003)。
随着国内对高品质牛奶需求的增强,目前我国进口苜蓿量逐年增加,转基因监管的风险也随之增大。国内和欧盟暂未出台KK179-2的官方检测方法。本研究基于KK179-2的5’端外源插入片段与苜蓿草基因组DNA之间的邻接区序列建立了转基因苜蓿KK179-2品系特异性TaqMan实时定量荧光PCR方法,以满足转基因苜蓿KK179-2品系标识的需求。
1 材料与方法
1.1 材料转基因玉米品系MIR162,转基因玉米品系89034,转基因玉米品系NK63,转基因玉米品系BT11,转基因大豆GTS40-3-2,转基因大米Bt63,非转基因大叶苜蓿、小麦、油菜籽、转基因苜蓿J101和转基因苜蓿J163由本实验室购置及储备。转基因苜蓿KK179-2的阳性质粒由苜蓿内源基因acc部分片段和KK179-2的5’边界序列共586 bp克隆入PUC57载体,转化至感受态细胞TOP10进行保存。
1.2 试剂Premix Ex TaqTM(TaKaRa);引物和探针由英潍捷基公司合成,稀释成终浓度为10 μmol/L的工作液使用。植物DNA提取试剂盒DP302、质粒DNA提取试剂盒购自天根公司。
1.3 仪器ABI7500,ABI75000FAST实时荧光定量PCR仪(美国应用生物系统公司)、微量分光光度计(nanodrop2000c,美国)、研磨机(IKA,德国)。
1.3 方法
1.3.1 植物材料以及混合样品基因组DNA的提取与纯化按照天根DNA提取试剂盒操作说明书提取DNA,用微量分光光度计nanodrop2000c测定其浓度。4℃保存备用。
1.3.2 引物和探针设计转基因苜蓿KK179-2外源插入片段元件组成及序列见图1和图2(ISSSA,2017)。

图1 转基因苜蓿KK179-2品系外源插入片段示意图

图2 KK179-2 5’端邻接区序列及引物探针在序列上的位置
基于KK179-2苜蓿5’端外源插入片段与苜蓿基因组DNA之间的邻接区序列,使用Primer-EXpress 3.0软件(AppliedBiosystems,USA)设计引物和探针。并将设计的引物和探针在NCBI网站数据库中进行Blast比对,确定引物和探针理论上的特异性。内源基因acc(acetyl CoA carboxylase)(Alexander,2007)引物和探针用于检测苜蓿样品基因组DNA是否成功提取以及是否适于进行实时荧光PCR扩增。序列信息详见表1。

表1 引物和探针序列
1.3.3 实时荧光PCR反应体系实时荧光PCR检测反应体系为20 μL:Premix Ex Taq TM 10 μL,10 μmol/L上、下游引物各0.4 μL,ROX Reference Dye II 0.2 μL,探针0.6 μL,DNA模板1 μL和ddH2O 7.4 μL。实时荧光PCR检测的反应程序为:Stage1:预变性95℃30 s;Stage 2:95℃5 s,60℃34 s,40个循环,于60℃收集荧光信号。
1.2.4 实时荧光PCR检测方法的特异性提取转基因玉米品系MIR162,转基因玉米品系89034,转基因玉米品系NK63,转基因玉米品系BT11,转基因大豆GTS40-3-2,转基因大米Bt63,非转基因大叶苜蓿、小麦、油菜籽、转基因苜蓿J101,转基因苜蓿J163和KK179-2阳性质粒的DNA,利用1.2.3体系和参数进行特异性检测。
1.2.5 KK179-2的灵敏度测试及标准曲线建立将KK179-2质粒DNA溶液用TE缓冲液梯度稀释至2×107~2×100拷贝/μL共8个浓度,按1.2.3实时荧光PCR反应体系进行扩增,每个浓度设置9个平行重复,以Ct≤36,且其RSD≤25%的最低稀释度为定量下限(LOQ)。能100%检出的最低稀释度为检测下限(LOD)。并由以上浓度梯度建立KK179-2品性特异性实时荧光PCR标准曲线,其扩增效率要求为90%~110%,R2≥0.98。
1.2.6 实时荧光PCR检测KK179-2的可重复性测试将1.2.5中的2×105~2×102拷贝/μL 4组不同浓度的DNA扩增结果计算标准偏差(SD)和相对标准偏差(RSD)以进行可重复性分析。
2 结果与分析
2.1 引物和探针设计及体系建立对多组品系特异性引物和探针的反应效率、扩增曲线和扩增效果进行筛选和分析,最终选择KK179-2-F/R/P引物和探针的序列见表1。
2.2 实时荧光PCR检测KK179-2的特异性测试采用acc-1/2/p引物和探针对1.2.4中所有提取的材料DNA样品进行实时荧光PCR扩增,只有苜蓿类的非转基因大叶苜蓿、转基因苜蓿J101、转基因苜蓿J163和KK179-2质粒DNA来源的模板出现扩增曲线,其他无典型扩增曲线,表明苜蓿内源基因acc扩增结果正确(图3 A),提取DNA模板质量符合实时荧光PCR要求。
采用KK179-2品系特异性引物和探针对1.2.4中12种材料所提取的DNA样品进行实时荧光PCR扩增时,只有KK179-2质粒来源的DNA模板有典型荧光扩增曲线,其他作物的DNA模板均无典型扩增曲线(图3 B)。说明本方法可特异性检测KK179-2。
2.3 KK179-2的灵敏度测试及标准曲线建立将提取的KK179-2质粒DNA用TE缓冲液梯度稀释至2×107~2×100拷贝/μL进行实时荧光PCR扩增,结果如表2所示。当模板量为200拷贝时,9个平行扩增反应均出现扩增,Ct值≤36,且标准偏差(SD)值为0.4,模板量为2拷贝时,无扩增曲线,所以本文建立的KK179-2品系特异性荧光PCR检测方法的定量下限LOQ为200拷贝的KK179-2质粒DNA,LOD为20拷贝的KK179-2质粒DNA。
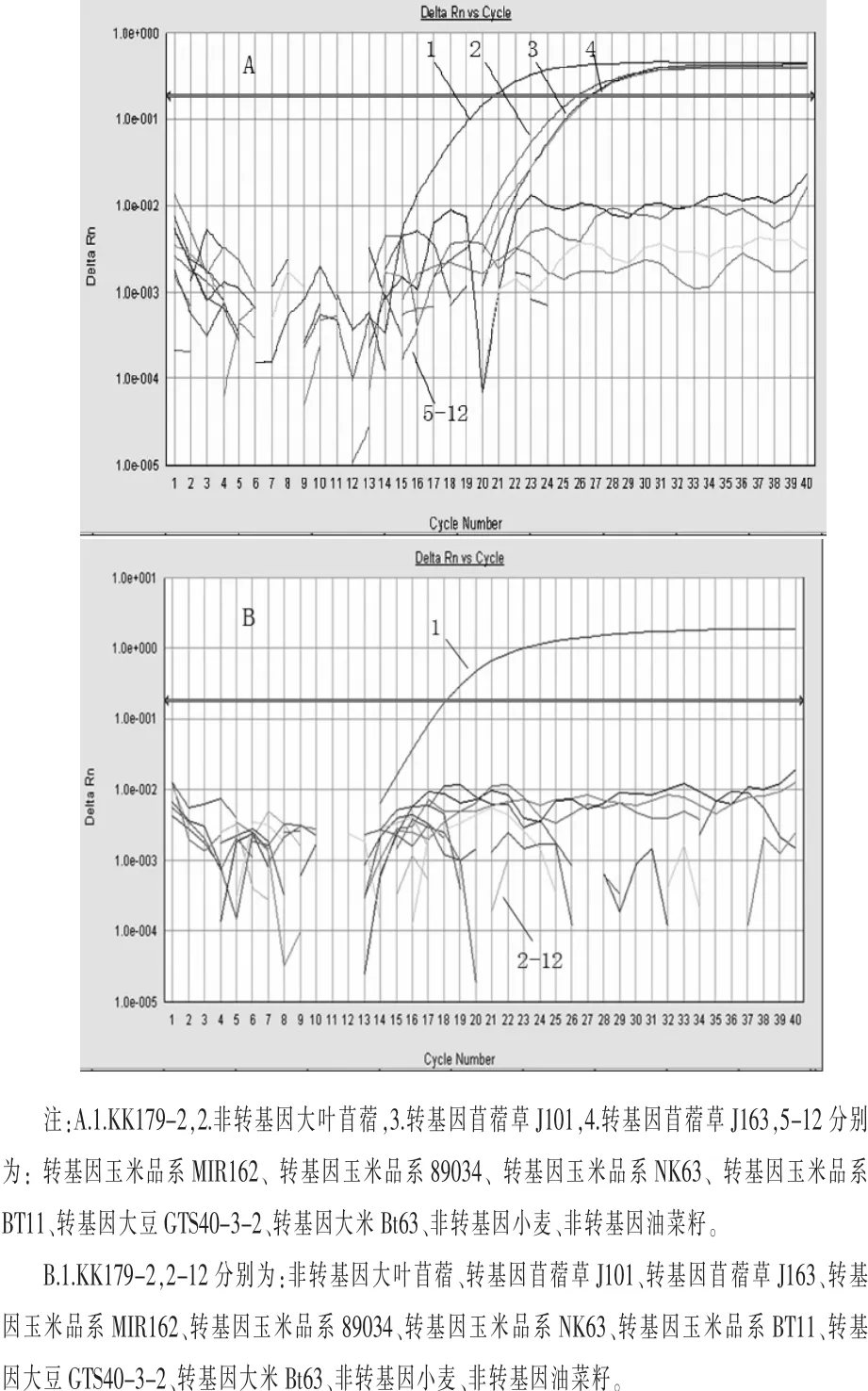
图3 实时荧光PCR特异性测试
以2×107~2×100拷贝KK179-2质粒DNA为模板进行实时荧光PCR扩增,建立KK179-2品系特异性标准曲线,线性回归方程为y=-3.2086x+42.426,线性相关系数(R2)为0.99,扩增效率E为105%(图4C,D),表明标准曲线的线性良好,扩增效率良好,且标准曲线的R2大于0.98,均符合定量检测标准曲线相关系数及扩增效率的要求(Engl,2014;Alexander,2007),因此说明本文建立的方法在2×107~2×100拷贝线性区间内适合于KK179-2的定量分析。
2.4 重复性测试由表2可知,4个10倍稀释浓度梯度2×105~2×102拷贝的KK179-2阳性质粒DNA进行的扩增结果表明,4组9次平行重复Ct值的标准偏差(SD)为0.06~0.15,相对标准偏差(RSD)为0.18%~0.53%,均在可接受的范围之内,表明本文建立的转基因苜蓿KK179-2品系特异性实时荧光PCR方法具有很好的可重复性。
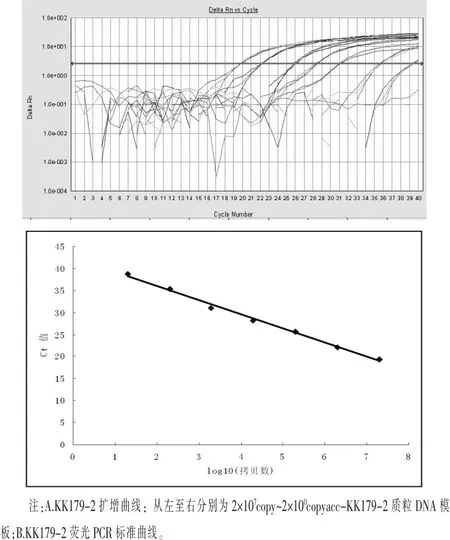
图4 KK179-2品系特异性灵敏度测试扩增图及标准曲线
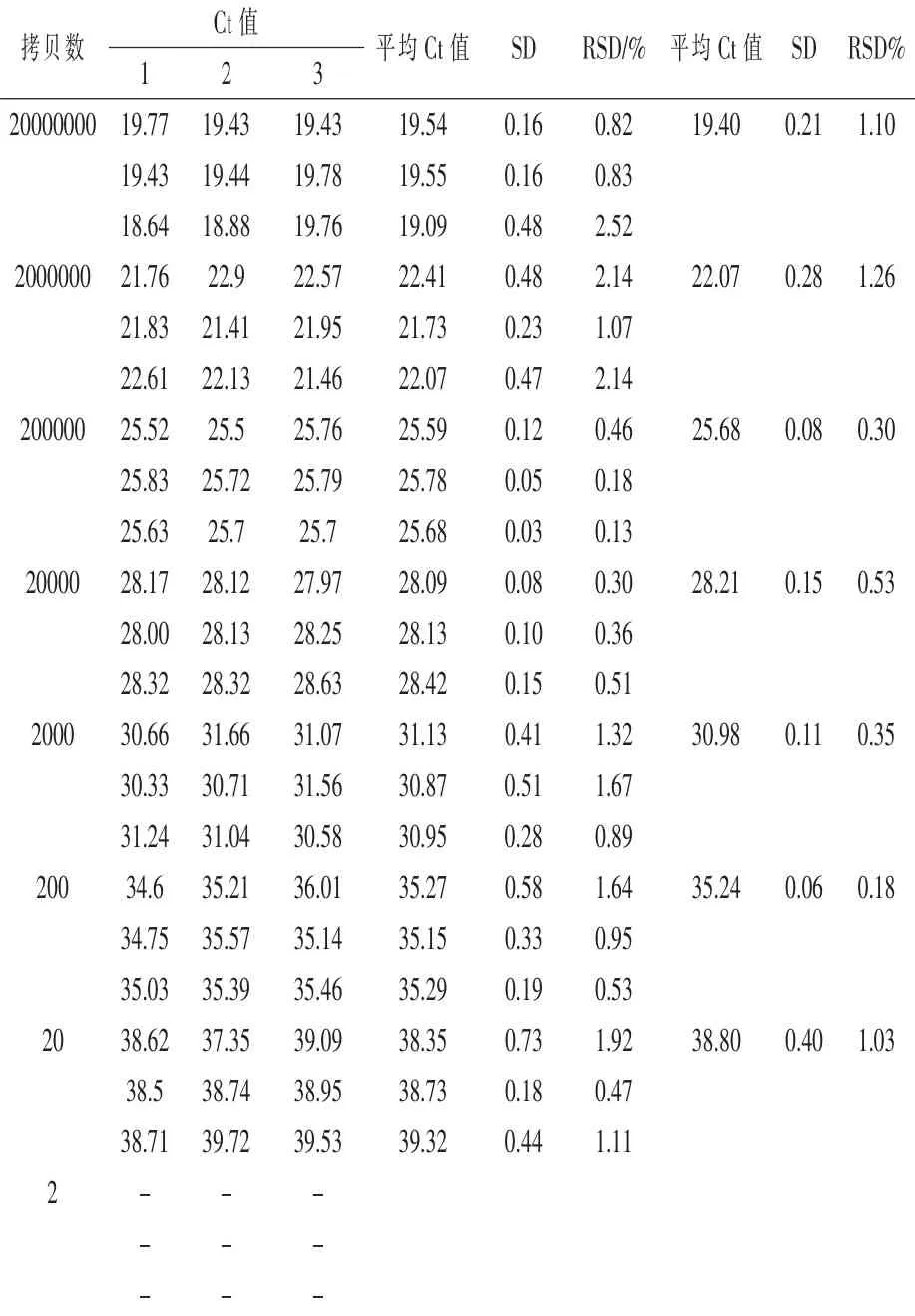
表2 实时荧光PCR检测KK179-2品系的重复性和灵敏度
3 讨论
目前我国奶牛存栏数为1500万头,而国内的苜蓿产量及质量,不能满足生产高档牛奶的需求,苜蓿进口量逐年攀升。转基因苜蓿通过饲料进入动物养殖的食物链,对食品安全存在潜在风险。为保障消费者的知情权,转基因产品标识制度在30多个国家和地区应用,中国目前实施无阀值的强制性标识制度(Chief Medical Officer of the RussianFederation,2014;Gang等,2008;ECNO. 1829,2003;APEC-JIRCAS,2001;Ministry of Agriculture and Forestry of South Korea,2000)。
转基因产品标识制度的实施需要建立相应检测方法作为支撑。品系特异性检测方法是基于外源插入片段和宿主基因接合区的边界序列建立的检测方法,目前被认为是最适合转基因标识的检测判定方法(Gang等,2008;Zimmermann,2000)。与其他筛选启动子、终止子、抗生素标记基因和转入目的基因不同,品系特异性检测方法具有很高的特异性,对于相同质粒构建的不同品系也能很好的区分(Taverniers,2001)。目前已有多种转基因作物品系如大豆、油菜、棉花、水稻和转基因苜蓿等建立了相关的品系特异性检测方法(刘二龙等,2015;刘欣等,2015;汪秀秀等,2014;蒋利平等,2013;Gang等,2008)。
目前对转基因产品的检测应用最广泛的是荧光PCR检测技术,相较普通PCR,其具更高的灵敏度、特异性和稳定性。可通过荧光信号的积累实现实时监测整个PCR进程,而后通过扩增曲线和标准曲线对未知模板进行定性或定量分析。
本文根据转基因苜蓿品系KK179-2 5’端外源插入序列与苜蓿草基因组DNA之间的邻接区序列设计引物和探针,建立的转基因苜蓿KK179-2品系特异性实时荧光PCR检测方法特异性好、灵敏度高、稳定性强、快速准确,适用于对转基因苜蓿KK179-2进行品系特异性筛查,可为进境转基因苜蓿的监管提供有力技术支撑。
[1]国家质检总局.澳新批准孟山都转基因苜蓿用于食品[DB/OL].http:// www.aqsiq.gov.cn/xxgk_13386/zxxxgk/201406/t20140604_414412.htm
[2]蒋利平,翁绿水,肖国樱.转基因水稻B2A68事件特异性检测方法的建立[J].杂交水稻,2013,5:60~67.
[3]刘二龙,卢丽,吕英姿,等.转基因苜蓿草J101品系特异性实时荧光PCR检测方法的建立[J].植物检疫,2015,29(3):77~82.
[4]刘二龙,卢丽,吕英姿,等.转基因苜蓿草J163品系特异性实时荧光PCR检测方法的建立[J].食品安全质量检测学报,2015,29(1):272~278.
[5]刘欣,张国丛,周兴虎,等.转基因大豆MON89788实时荧光PCR检测方法的建立[J].食品科学,2015,4:193~197.
[6]蔺占兵,马庆虎,徐洋.木质素的生物合成及其分子调控[J].自然科学进展,2003,5:9~15.
[7]山东草业网.2014年1~6月中国进口苜蓿干草40.56万吨同比增26.94%[EB/OL].(2014-08-07)[2014-11-01]http://www.sdcy.gov.cn/art/ 2014/8/7/art_5561_83138.html.
[8]汪秀秀,杨捷琳,宋青,等.转基因棉花GHB119品系特异性定量PCR检测方法的建立.农业生物技术学报,2014,3:380~388.
[9]Alexander T W,Reuter T,McAllister T A.Qualitative and quantitative polymerase chain reaction assays for an alfalfa(Medicago sativa)-specific reference gene to use in monitoring transgenic cultivars[J].Agric Food Chem,2007,8(55):2918~2922.
[10]APEC-JIRCAS Joint Symposium and Workshop on Agricultural Biotechnology.GMO labeling and detection methods in Japan.2001-06-10
[11]Charlene L,Richard E C.Alfalfa plant and seed corresponding to transgenic eventKK197-2 and methods for detection thereof:US 2014259227A1 [P].2014-9-11.
[12]Chief Medical Officer of the Russian Federation,Hygiene requirements to safety and nutrition value of food products[EB/OL].(2007-06-25)[2014-11-01]http://apps.fas.usda.gov/gainfiles/200707/1462918630.pdf.
[13]Clive J.2014年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2015,1:1~14.
[14]European Commission.Commission regulation(EC)No.1829,Concerning on genetically modified food and feed.2003-09-22.
[15]European Network of GMO laboratories(ENGL).Definition of minimum performance requirements for analytical methods of GMO testing[EB/ OL](2008-10-13)[2014-11-01].http://gmo-crl.jrc.ec.europa.eu/doc/Min-Perf-requirements Analyticalmethods.pdf.
[16]Gang Wu,Yuhua Wu,Ling Xiao,et al.Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J]. Food Chemistry,2008,1:232~238.
[17]Health Canada,Novel Food Information Reduced Lignin Alfalfa KK197-2[DB/OL].http://www.hc-sc.gc.ca/fn-an/gmf-agm/appro/alfalfa_kk197-2_luzerne-eng.php
[18]ISSSA.org,KK179-2,[EB/OL].http://www.isaaa.org/gmapprovaldatabase/ event/default.asp EventID=356
[19]Ministry of Agriculture and Forestry of South Korea,MAF Notification,31.Guidelines for labeling of genetically modified agricultural products.2000-04-22.
[20]Taverniers I,Windels P,van Bockstaele E,et al.Use of cloned DNA fragments for event-specific quantification of genetically modified organisms in pure and mixed food products[J].European Food Research and Technology,2001,213(6):417~424.
[21]Zimmermann A,Lüthy J,Pauli U.Event specific transgene detection in Bt11 corn by quantitative PCR at the integration site.Lebensmittel-Wissenschaft und-Technologie,2000,33:210~216.■
To establish event-specific quantitative TaqMan real time PCR detection methods for genetically modified(GM)low-lignin alfalfa events KK179-2 the specific primer pairs and probe based on the 5’insert-to-plant junction sequence spanning the alfalfa genomic DNA and transgene insert DNA of KK179-2 were designed.The specificity,sensitivity and repeatability of this method were analyzed.Results showed that the developed quantitative realtime PCR detection method was specific for KK179-2.The correlation coefficient of standard curve was 0.99 and the efficiency of real time PCR was 105%.The limit of quantification(LOQ)and limit of detection(LOD)of this assay were 200 copies and 20 copies of KK179-2 plasmid DNA,respectively.Repeatability test of the established event-specific real time PCR method showed that the standard deviation(SD)and the relative standard deviation(RSD)were all in the acceptable range.Therefore,the established event-specific quantitative real time PCR method was suitable for fast,accurate and stable detection of GM alfalfa KK179-2.
genetically modified alfalfa KK179-2;event-specific;quantitative real time PCR
S816.17
A
1004-3314(2017)14-0031-05
10.15906/j.cnki.cn11-2975/s.20171408
广东出入境检验检疫局科技项目(2017GDK41、2016GDK60)
*通讯作者
