成人恶性外周神经鞘瘤的CT和MRI表现
2017-07-31吴红清宋玲玲项一宁贵州医科大学附属医院影像科病理科贵州贵阳550004
吴红清,宋玲玲*,项一宁,朱 霞,眭 贺(.贵州医科大学附属医院影像科,.病理科,贵州 贵阳 550004)
成人恶性外周神经鞘瘤的CT和MRI表现
吴红清1,宋玲玲1*,项一宁2,朱 霞1,眭 贺1
(1.贵州医科大学附属医院影像科,2.病理科,贵州 贵阳 550004)
目的 探讨成人恶性外周神经鞘瘤(MPNST)的CT和MRI表现。方法 回顾性分析经过手术病理证实为MPNST 20例患者的CT和MRI表现。结果 20例MPNST位于下肢4例、肩背部及脊柱4例、腹腔内3例、胸壁2例、纵隔2例、乳腺1例、前列腺1例、阴囊1例、头皮1例、左侧上颌窦及眶底1例。20例中,19例为肿块型,1例弥漫型。病灶最大截面约1.41 cm×1.42 cm~17.10 cm×18.08 cm。16例边界不清,4例边界尚可。14例CT平扫示病灶呈等、低密度,内部密度欠均匀,2例见多发钙化灶,7例周围骨质呈明显溶骨性破坏;10例CT增强示病灶实质呈中度、明显渐进延迟强化,囊变及坏死区未见明显强化,7例病灶内见纡曲动脉血管影。7例MR平扫示病灶T1WI呈等低信号,T2WI呈混杂高信号,T2WI上囊变区呈明显高信号,3例MRI增强示病灶呈明显不均匀强化,囊变坏死区不强化。1例MR动态增强扫描时间-信号强度曲线呈平台型,DWI呈高信号。结论 MPNST的CT及MRI表现具有一定特征性,可提高MPNST的诊断准确率。
神经鞘瘤;成年人;体层摄影术,X线计算机;磁共振成像
恶性外周神经鞘瘤(malignant peripheral nerve sheath tumor, MPNST)是一种来源于周围神经或显示向神经鞘膜分化的恶性软组织肉瘤,具有神经分化潜能,占所有软组织肉瘤的5%~10%[1-5]。2002年WHO神经系统肿瘤分类将神经肉瘤、神经纤维肉瘤、恶性施万细胞瘤及恶性神经鞘瘤统称为MPNST,2013年将MPNST归类入软组织肿瘤,并指出其包括上皮样恶性外周神经鞘瘤和恶性蝾螈瘤(malignant triton tumour, MTT)2个特殊亚型。MPNST虽然发病率低,但侵袭性强,恶性程度高,患者远期生存率低,故分析其影像学征象具有重要临床价值,但MPNST的影像学表现多为个案报道。本研究回顾性分析本院经手术病理证实的20例MPNST的CT及MRI表现,以期提高MPNST的影像学诊断水平。
1 资料与方法
1.1 一般资料 收集2007年1月—2016年12月我院收治的经手术病理证实的MPNST患者20例,男12例,女8例,年龄24~83岁,平均(46.2±15.0)岁。临床主要表现为包块伴疼痛5例,其中1例合并发热;无痛性包块9例;术后复发包块5例,弥漫性原位复发1例。病史1周~3年。20例患者中,接受CT平扫14例,CT增强检查10例,同时行CT平扫和CT增强扫描7例,MR平扫7例,MRI增强检查3例,同时行MR平扫和增强扫描2例。
1.2 仪器与方法 CT检查:采用Siemens Somatom Sensation 16排螺旋CT机,扫描参数:管电压 120 kV,管电流210 mAs;增强扫描时经肘前静脉高压注射非离子型对比剂(碘帕酮)75 ml,速率3 ml/s,层厚及层间距≤5 mm。MR检查:采用GE SignaHDxt 1.5T MR成像系统,根据检查部位选择不同的线圈,层厚及层间距随检查部位而定,胸腰椎检查层厚及层间距≤4 mm,肩背部及其他部位检查层厚及层间距≤8 mm。所有病例均行轴位、冠状位和矢状位平扫,序列为SE T1WI、T2WI和短时反转恢复(STIR)序列,参数:T1WI,TR 1 970 ms,TE 19 ms,T1 750 ms;T2WI,TR 4 500 ms,TE 100 ms;STIR,TR 8 000 ms,TE 70 ms。FOV 24 cm×24 cm,矩阵256×256~512×512,NEX 2;1例行DWI扫描,SE-EPI序列,TR 4 600 ms,TE 69 ms,矩阵256×256,b值分别为0、1 000 s/mm2。增强扫描采用Gd-DTPA 0.1 ml/kg体质量,经肘前静脉注射,速率2.5 ml/s。
1.3 图像分析 由3名放射科主任医师共同阅片,讨论并达成一致意见。分析内容包括病灶的部位、大小、边缘、生长方式、密度/信号,肿瘤对周围组织侵袭性,病灶增强后的强化方式、强化程度等。
2 结果
2.1 病变部位、形态、生长方式 20例MPNST患者,发生于下肢4例、腹腔3例、肩背部及脊柱4例、胸壁2例、纵隔2例、乳腺1例、前列腺1例、阴囊1例、头皮1例、上颌窦及眶底1例;其中6例为复发患者。20例中,19例为肿块型,1例为弥漫型。病灶最大截面约1.41 cm×1.42 cm~17.10 cm×18.08 cm,中位最大径为9.25 cm,其中13例瘤灶最大径>5.00 cm。16例边界欠清、4例边界清晰。19例为肿块型,呈侵袭性生长,相邻脂肪层受累,表现为广泛或局部脂肪间隙模糊,其中14例病灶向相邻肌间隙延伸生长,7例伴溶骨性骨质破坏,1例囊实性病灶发生于T12~L4椎体层面,病灶侵及椎管,椎体骨质呈溶骨性破坏,腰段脊柱发生严重变形;1例为弥漫型,发生于左侧上颌窦和眶底,周围多发骨质破坏。20例患者中,淋巴结转移7例,肺转移3例,胸壁转移2例,胸膜转移3例,肾上腺转移1例。1例合并神经纤维瘤病Ⅰ型(neurofibromatosis type Ⅰ, NFⅠ)并脊柱侧弯。
2.2 CT表现 14例患者CT平扫显示病灶以等、低密度为主(图1A),其中2例出现多发点状、条状、片状钙化(图2A)。10例CT增强扫描示瘤灶实性部分呈中度、明显强化(中度强化4例,明显强化6例),强化多不均匀,强化方式呈渐进延迟强化,囊性及坏死成分未见强化,其中7例瘤灶于动脉期见散在纡曲杂乱血管影(图2B)。
2.3 MRI表现 7例MR平扫表现为T1WI混杂等低信号,T2WI混杂高信号,其中1例发生于左侧股骨后内段,可见病灶包绕股动静脉,沿股神经走行;发生于T12~L4的脊柱肿瘤呈囊实性混杂信号,T1WI呈等低信号,T2WI呈高信号(图3)。3例增强扫描示肿瘤呈明显不均匀强化,其内见多发不规则片状不强化低信号(图1B)。1例发生于左侧乳腺的瘤灶MR动态增强扫描的时间-信号强度曲线呈平台型,DWI呈明显弥散受限(图4)。
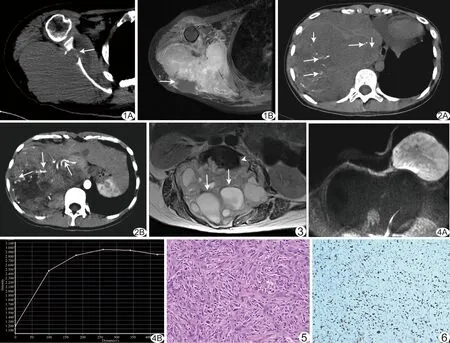
图1 患者女,49岁,肩背部MPNST A.CT示右侧肩背部软组织肿块,密度不均匀,累及右侧肩胛骨,呈溶骨性骨质破坏,边缘不规整,可见碎骨片影(箭); B.MR增强示肿块明显不均匀强化,坏死灶不强化(箭),病灶边缘不清楚,邻近肌肉组织受侵 图2 患者女,24岁,腹腔内MPNST A.CT平扫示腹腔内巨大团块状软组织肿块,密度不均匀,内见多发点结状钙化灶(长箭),另见多发斑片状坏死灶(短箭); B.CT增强呈不均匀明显强化,局部见大片状不强化坏死灶,其内见多发纡曲动脉血管影(箭) 图3 患者男,39岁,T12~L4椎体MPNST MR平扫见T12~L4水平囊实性肿块,内见多发囊状长T2信号影(箭),边界清,邻近椎体受侵(箭头),椎管明显扩大 图4 患者女,58岁,乳腺MPNST A.DWI示左乳病灶为高信号; B.MR动态增强示时间-信号曲线为平台型 图5 病理图 镜下见肿瘤细胞呈长梭形,排列紊乱,纵横交错,呈放射状、漩涡状及栅栏状排列,内可见1~2个红核仁(HE,×100) 图6 免疫组化染色图 S-100蛋白染色强阳性,胞核及胞质着色(En Vision,×100)
2.4 肿瘤大体观、病理表现及免疫组化 肿瘤切面多呈灰白色、实性、质中、鱼肉状,无明显包膜,呈类圆形或分叶状肿块。HE染色镜下可见肿瘤与周围组织界限不清,呈浸润性生长,肿瘤细胞排列紊乱,纵横交错,呈放射状、漩涡状及栅栏状排列(图5)。肿瘤细胞呈长梭形,核浆比增大,染色质增粗。可见到少许红核仁。核分裂象易见,可见瘤巨细胞。本组20例均接受免疫组化染色,19例(19/20,95.00%)S-100阳性表达(图6),其中2例呈散在阳性表达;16例(19/20,80.00%)Ki-67阳性(15%~80%);14例(14/20,70.00%)Vim阳性。
3 讨论
3.1 MPNST临床表现 MPNST属神经来源的恶性肿瘤,病因尚不清楚,发病机制可能与基因突变NFⅠ基因蛋白产物缺失或p16(INK4A)基因重组相关[2]。研究[3-4]报道,约50% 的MPNST患者并发NFⅠ型,而NFⅠ中超过10%可发展为MPNST。本文20例患者中1例合并NFⅠ型,可能与本研究病例数小有关。MPNST主要起源于坐骨神经、臂丛神经和股神经,可发生于身体各处,最常见于躯干(约50%),其次是四肢(约30%)、头颈部(约20%),也有极少数发生于肾上腺、心脏、泪腺、跟骨以及阴道等[3-7]部位。本研究中,发生于肩背部及脊柱占20.00%(4/20)、下肢占20.00%(4/20)、头皮占5.00%(1/20),与既往研究[8]报道不一致,可能为本组病例数较少有关。MPNST发病率约0.1/100 000[7-8]。男女发病率相近,多发生于20~50岁[3,6];本组男女比例为4∶3,平均发病年龄(46.2±15.0)岁。成人MPNST直径通常较大[3,9],本组瘤灶中位最大径为9.25 cm,13例最大径>5.00 cm。MPNST多表现为局部巨大无痛性肿块,本组9例为无痛性包块,占45.00%(9/20)。MPNST形态规则或不规则,边界多不清[10],肿瘤易发生坏死、出血,并易发生淋巴结及血行转移,血行转移最易发生于肺,手术切除后易局部复[8,11]。本组20例均伴坏死,其中1例为囊实性,但本组病灶未见出血,推测可能与影像检查时间有关。本组淋巴结转移7例,肺部转移3例,复发6例,均与既往研究[3,6-7]报道一致。
3.2 MPNST的病理表现 MPNST大体病理多为梭形或球形肿块,切面灰白、灰红色,常伴有出血、坏死,可有假包膜;组织学特征包括紧密和疏松的束状结构交替出现,肿瘤细胞呈束状或漩涡状排列。瘤细胞梭形,上皮样瘤细胞亦存在,但相对少见。核具有多形性,弯曲,波浪状,核染色质深,核分裂象一般>4个/10个高倍视野,可出现原始神经上皮、平滑肌、骨、横纹肌母细胞等异源性分化[12]。本组20例病理表现基本与之相符。
3.3 MPNST的影像学表现 由于MPNST病灶可分为实性、囊实性及囊性,易合并出血、坏死、假性囊变及钙化[4],因此在CT及MRI上肿瘤表现为密度及信号的复杂及多样化。有研究[13]报道,MPNST的影像表现与其病理分型有关。Antoni A区(束状型)由梭形细胞及纤维成分密集排列而成,血供丰富,CT平扫表现为实性软组织样密度,不易发生囊变;T1WI表现为等低信号,T2WI为稍高信号,可呈明显均匀及延迟性强化。Antoni B区(网状型)细胞稀少,呈疏松网状结构排列,CT平扫呈稍低密度影,T1WI呈液样低信号,T2WI为高信号,边界清,强化不明显。本组20例瘤灶内均出现坏死,大小不一,提示MPNST病灶内同时存在Antoni A区和Antoni B区,但比例不同。MPNST瘤灶呈中度、明显强化,多数强化不均匀,瘤灶内可见斑片状、网格状无强化区。本组病例强化方式也遵循这一规律,推测与Antoni A区占主要优势有关。本组7例于动脉期出现纡曲杂乱血管影,提示MPNST肿瘤血供丰富,生长迅速,可作为MPNST的一个重要影像学特征。
MPNST的CT、MRI特征如下:①瘤灶主要发生于坐骨神经、臂丛神经和股神经等外周神经走行的区域,肿块发展迅速并与邻近组织分界不清,侵犯邻近骨质可呈明显溶骨性骨质破坏,瘤灶边界不清;②以实性成分为主的肿块,CT密度及MRI信号不均匀,内含多发片状不规则坏死灶,可有囊变及钙化;③CT及MR增强检查多呈明显不均匀强化,常见多发纡曲增粗肿瘤血管影,瘤灶内可见斑块状、网格状无强化区,实质部分呈渐进性延迟强化。
3.4 鉴别诊断 MPNST需与外周良性神经源性肿瘤相鉴别,外周良性神经源性肿瘤一般发生于20~50岁,无性别差异,生长缓慢,极少有恶变。外周良性单发神经源性肿瘤常比较局限,边缘清晰,肿瘤周围无水肿或仅有轻微水肿,无恶性肿瘤侵袭性生长、远处转移等特点,易与恶性肿瘤相鉴别[10]。发生于四肢的MPNST需与成人横纹肌肉瘤及平滑肌肉瘤相鉴别,成人横纹肌肉瘤罕见,发病年龄40~87岁,中位年龄 50~59岁,肿块明显不均匀强化,易发生远处转移,最常转移至肺;平滑肌肉瘤好发40~60岁中老年,肿瘤血供丰富,增强后以斑片状不均匀强化多见,术后局部复发率较高,血行转移较多[14]。
总之,MPNST好发于躯干、四肢及肋间神经,瘤灶以实性及囊实性多见,其影像学表现有一定的特征性。肿块多较大,边界欠清,易侵及邻近组织,增强后实质部分呈明显不均匀渐进性强化或延迟强化。MPNST易发生远处器官及淋巴结转移,术后易复发。熟悉MPNST的影像学特点有助于提高其诊断准确率,以指导临床治疗。
[1] Deyle DR, Escobar DZ, Peng KW, et al. Oncolytic measles virus as a novel therapy for malignant peripheral nerve sheath tumors. Gene, 2015,565(1):140-145.
[2] Wang J, Ou SW, Guo ZZ, et al. Microsurgical management of giant malignant peripheral nerve sheath tumor of the scalp: Two case reports and a literature review. World J Surg Oncol, 2013,11(1):269.
[3] Alharbi B. Malignant peripheral nerve sheath tumor of kidney—A case report. Int J Surg Case Rep, 2013,4(10):914-916.
[4] Arava S, Bagmar S, Jain P, et al. Primary intracardiac malignant peripheral nerve sheath tumor: A rare case report. Indian J Pathol Microbiol, 2015,58(4):531-533.
[5] Rajabi MT, Riazi H, Hosseini SS, et al. Malignant peripheral nerve sheath tumor of lacrimal nerve: A case report. Orbit, 2015,34(1):41-44.
[6] Gahlot GP, Mridha AR, Nath D, et al. Intraosseous primary malignant peripheral nerve sheath tumor of the calcaneus: An unusual case and review of literature. Indian J Pathol Microbiol, 2015,58(2):220-222.
[7] Ozdal B, Oz M, Korkmaz E, et al. Malignant peripheral nerve sheath tumor of the vulva, an unusual differential diagnosis for vulvar mass. Int J Surg Case Rep, 2014,5(11):793-795.
[8] Stucky CC, Johnson KN, Gray RJ, et al. Malignant peripheral nerve sheath tumors (MPNST): The Mayo Clinic experience. Ann Surg Oncol, 2012,19(3):878-885.
[9] Li CS, Huang GS, Wu HD, et al. Differentiation of soft tissue benign and malignant peripheral nerve sheath tumors with magnetic resonance imaging. Clin Imaging, 2008,32(2):121-127.
[10] Hu SW, Lin WC, Tsai HJ, et al. Immunoprofiles in malignant peripheral nerve sheath tumor: Three case reports and literature review. Kaohsiung J Med Sci, 2006,22(3):135-142.
[11] Baehring JM, Betensky RA, Batchelor TT. Malignant peripheral nerve sheath tumor:The clinical spectrum and outcome of treatment. Neurology, 2003,61(5):696-698.
[12] 李琛,张智弘,潘敏鸿,等.恶性外周神经鞘瘤52例临床病理分析.临床与实验病理学杂志,2016,32(6):644-647.
[13] 张春艳,程敬亮,张勇,等.前列腺恶性外周神经鞘瘤1例.中国医学影像技术,2016,32(7):1154.
[14] 范帆,包强,王尔祯,等.四肢软组织平滑肌肉瘤的磁共振诊断.放射学实践,2010,25(5):546-549.
CT and MRI features of malignant peripheral nerve sheath tumor of adults
WUHongqing1,SONGLingling1*,XIANGYining2,ZHUXia1,SUIHe1
(1.DepartmentofRadiology, 2.DepartmentofPathology,theAffiliatedHospitalof
GuizhouMedicalUniversity,Guiyang550004,China)
Objective To explore the CT and MR features of malignant peripheral nerve sheath tumor (MPNST) of adults. Methods The CT and MRI findings of 20 patients of MPNST confirmed by pathology were analyzed retrospectively. Results Among 20 cases, the lesions were located in the lower extremities (n=4), shoulder and spine (n=4), abdomen (n=3), chest wall (n=2), mediastinum (n=2), breast (n=1), prostate (n=1), scrotum (n=1), scalp (n=1), left maxillary sinus and orbital bottom (n=1). Nineteen cases appeared as solid masses and 1 case appeared as diffuse lesion. The maximum cross section of the lesions were about 1.41 cm×1.42 cm—17.10 cm×18.08 cm. Sixteen cases were ill-defined margin and 4 cases were well-defined margin. CT scan showed 14 cases were lower density or isodensity and with patchy inhomogeneous density. Multiple calcification were found in 2 cases and osteolytic destruction were found in 7 cases. Enhanced CT of 10 cases showed solid component and gradually delayed enhancement, while cystic lesion and necrosis were not enhancement. The tortuous arteries were displayed in 7 cases. Seven cases were performed MRI and the lesions appeared as hypo-intensity on T1WI and hypo-intensity on T2WI with obviously high intensity of cystic component. Enhanced MRI of 3 cases showed significantly heterogeneous enhancement, cyst and necrosis had no enhancement. MR dynamic enhancement of 1 case showed time-signal intensity curve was platform type. DWI showed high signal. Conclusion MPNST has certain CT and MR characteristics which are helpful to improve the diagnostic accuracy.
Neurilemmoma; Adult; Tomography, X-ray computed; Magnetic resonance imaging
吴红清(1991—),女,湖北随州人,在读硕士。研究方向:骨骼与肌肉影像诊断。E-mail: 693227509@qq.com
宋玲玲,贵州医科大学附属医院影像科,550004。E-mail: 105967454@qq.com
2017-01-03
2017-05-03
10.13929/j.1003-3289.201701012
R739.43; R445
A
1003-3289(2017)07-1052-05
