结直肠癌肝脏、腹主动脉旁淋巴结寡转移的MDT策略
2017-07-31古朝阳邓祥兵王自强
古朝阳 邓祥兵 王自强
结直肠癌肝脏、腹主动脉旁淋巴结寡转移的MDT策略
古朝阳1,2邓祥兵1王自强1
结直肠癌是最常见的恶性肿瘤之一,发病率和死亡率均居所有肿瘤前列。转移是结直肠癌预后不佳的主要因素之一,其常见转移部位为肝、肺及淋巴结系统等,其中肝脏是结直肠癌血行转移最主要的靶器官之一。针对结直肠癌转移病灶,多学科综合诊疗(MDT),是治疗的最佳选择。而随着多学科诊疗的进展,结直肠癌“寡转移”逐渐被提出,寡转移是指肿瘤生物侵袭性较温和的一段时期,存在于局限性原发灶与广泛性转移之间的过渡阶段,转移瘤的数量有限且转移器官具有特异性。本文通过对2例结直肠癌同时性肝脏寡转移患者(其中一例伴同时性腹主动脉旁淋巴结转移)MDT治疗策略的分析与文献复习,就结直肠癌肝脏及孤立的腹主动脉旁淋巴结(PALN)寡转移的概念及诊治进展做一综述。
结直肠肿瘤; 肿瘤转移; 肝脏寡转移; 腹主动脉旁淋巴结寡转移; 多学科专家组
结直肠癌是最常见的恶性肿瘤之一,根据世界卫生组织统计,结直肠癌是男性第二位和女性第三位常见的恶性肿瘤,我国发病率为20.6/10 万,并呈逐年上升趋势。复发和转移是结直肠癌预后不佳的主要因素,其常见转移部位为肝、肺及淋巴结系统[1],其中肝脏是结直肠癌血行转移最主要的靶器官。结直肠癌肝转移是结直肠癌治疗的重点和难点之一,约有15~25%结直肠癌患者在确诊时即合并有肝转移,而另 15~25%的患者将在结直肠癌原发灶根治术后发生肝转移,其中绝大多数(80~90%)的肝转移灶无法获得根治性切除[2-6]。研究表明,有一部分最初肝转移灶无法切除的患者经治疗后可以转化为可切除[7]。20世纪90年代,“寡转移”的概念由Hellman和Weichselbaum共同提出[8],它是指肿瘤生物侵袭性较温和的一段时期,存在于局限性原发灶与广泛性转移之间的过渡阶段,转移瘤的数量有限且转移器官具有特异性。而寡转移病灶的诊治均依赖于多学科综合讨论(multidisciplinary team,MDT),基于患者的身体条件、肿瘤的病理学特征、影像分期等情况,运用现有的多种医疗手段,对肿瘤进行个体化的综合评估和治疗,改善患者生存质量。
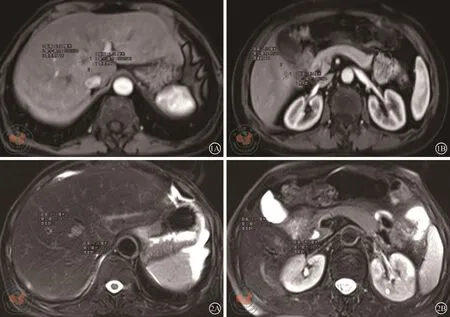
图1 肝脏MRI。图1A,1B分别示:病例一患者新辅助治疗前肝脏MRI显示肝脏转移灶大小约分别为:2.1 cm×1.5 cm,1.3 cm×1.2 cm 图2 肝脏MRI。图2A,2B分别示:病例一患者新辅助治疗后肝脏MRI显示肝脏转移灶大小约分别为:1.3 cm×0.9 cm,1.0 cm×0.75 cm
病例简介
一、病例一
患者58岁女性,以“大便不成形8月余,加重4月”为主诉入院,直肠指检:距肛门5 cm可触及一质硬包块,累及管腔全周,不易推动,退出后见指套血染;肠镜:距肛5 cm可见一巨大新生物致管腔狭窄。病理活检示:(距肛5 cm)查见腺癌。腹部增强CT:直肠中、下段管壁增厚,多系肿瘤病变,局部系膜淋巴结增大增多,左侧侧方淋巴结肿大,边缘强化明显;肝右叶结节,多系转移;胸部CT平扫未见异常;上腹部MRI发现肝脏两枚结节大小分别为:2.1 cm×1.5 cm,1.3 cm×1.2 cm(见图1A、1B)。肿瘤标志物:癌胚抗原 13.47 ng/ml(正常<3.4 ng/ml),甲胎蛋白:2.39 ng/ml(正常<8.0 ng/ml)。初步诊断:直肠癌同时性肝转移(cT4N+M1,Ⅳ期)
(一)MDT讨论结果
考虑患者局部分期较晚,直肠肿瘤环周切缘阳性合并肝脏转移,左侧侧方淋巴结可疑转移,决定先行盆腔局部短程放疗加全身化疗,待化疗后再次评估是否可手术切除。
(二)治疗经过
经过4周期mFOLFOX6方案化疗及盆腔局部短程放疗后,肝转移灶分别缩小至约1.3 cm×0.9 cm,1.0 cm× 0.75 cm,(见图2A、2B),癌胚抗原下降到2.29 ng/ml(正常<3.4 ng/ml),环周切缘转为阴性。再次MDT讨论后,行腹腔镜辅助直肠癌根治性前切除、左侧侧方淋巴结清扫、预防性造瘘、肝左内叶肿瘤射频消融、肝右叶肿瘤局部切除术。
(三)术后病理
直肠腺癌,中分化,侵及浆膜下层,新辅助疗效评价为肿瘤消退分级(tumor regression grading,TRG2)[9]。局部及左侧侧方淋巴结(0/19)未见转移,肝脏标本病理回示腺癌,免疫组化结果支持肠癌肝转移。
(四)术后诊断
直肠中分化腺癌伴同时性肝转移(ypT3N0M1a,IV期)。
(五)术后治疗及随访
建议患者继续行辅助化疗,但患者因经济原因仅追加1周期mFOLFOX6方案化疗后终止治疗。术后随访13个月未见局部复发及远处转移,肝脏未再发现新发病灶。
二、病例二
患者44岁女性,以“体检发现乙状结肠肿块3月”为主诉入院,查体未见明显异常。肠镜示:距肛20 cm结肠新生肿物,结肠多发息肉,病检:腺癌。腹部增强CT提示:乙状结肠肠壁增厚,浆膜面毛糙,动脉期强化明显,局部见多发肿大淋巴结,腹中动脉可见一枚短径5.8 mm淋巴结(见图3A)显示,肝右后叶肿块影。胸部平扫CT未见异常。上腹部增强MRI提示肝右后上段见大小约3.9 cm×2.5 cm肿块影(见图4A),动脉期不均匀明显强化。AFP:1.51 ng/ml(正常<8 ng/ml),CEA:84.77 ng/ml(正常<3.4 ng/ml)。初步诊断:乙状结肠癌伴肝、腹主动脉旁淋巴结转移(cT4aN2M1b,IV期)
(一)MDT讨论结果
经多学科讨论后建议先行新辅助化疗,如肿瘤无进展再行手术治疗。
(二)治疗经过
经过3周期mFOLFOX6方案化疗后,患者乙状结肠肿瘤未见明显缩小,腹主动脉旁淋巴结(para-aortic lymph node,PALN)增大(见图3B),肝转移灶缩小至2.6 cm ×1.9 cm(见图4B),遂行乙状结肠癌根治术、腹主动脉旁淋巴结清扫、右肝肿瘤局部切除术。
(三)术后病理
乙状结肠中分化腺癌,侵及浆膜下结缔组织。淋巴结:系膜内(5/20)、腹主动脉旁(1/25)枚,查见癌转移。“肝脏”中分化腺癌,侵及肝脏被膜,标本之肝切缘未见癌转移,余肝组织大片肝细胞脂肪变性,结合形态学符合肠癌肝转移。新辅助疗效评价为TRG3[9]。
(四)术后诊断
乙状结肠中分化腺癌伴肝、腹主动脉旁淋巴结转移(ypT3N2bM1b,Ⅳ期)
(五)术后治疗及随访
后续患者追加7周期mFOLFOX6方案化疗。随访16个月未见局部复发及远处转移,肝脏亦未发现新发病灶。两病例特点见表1。
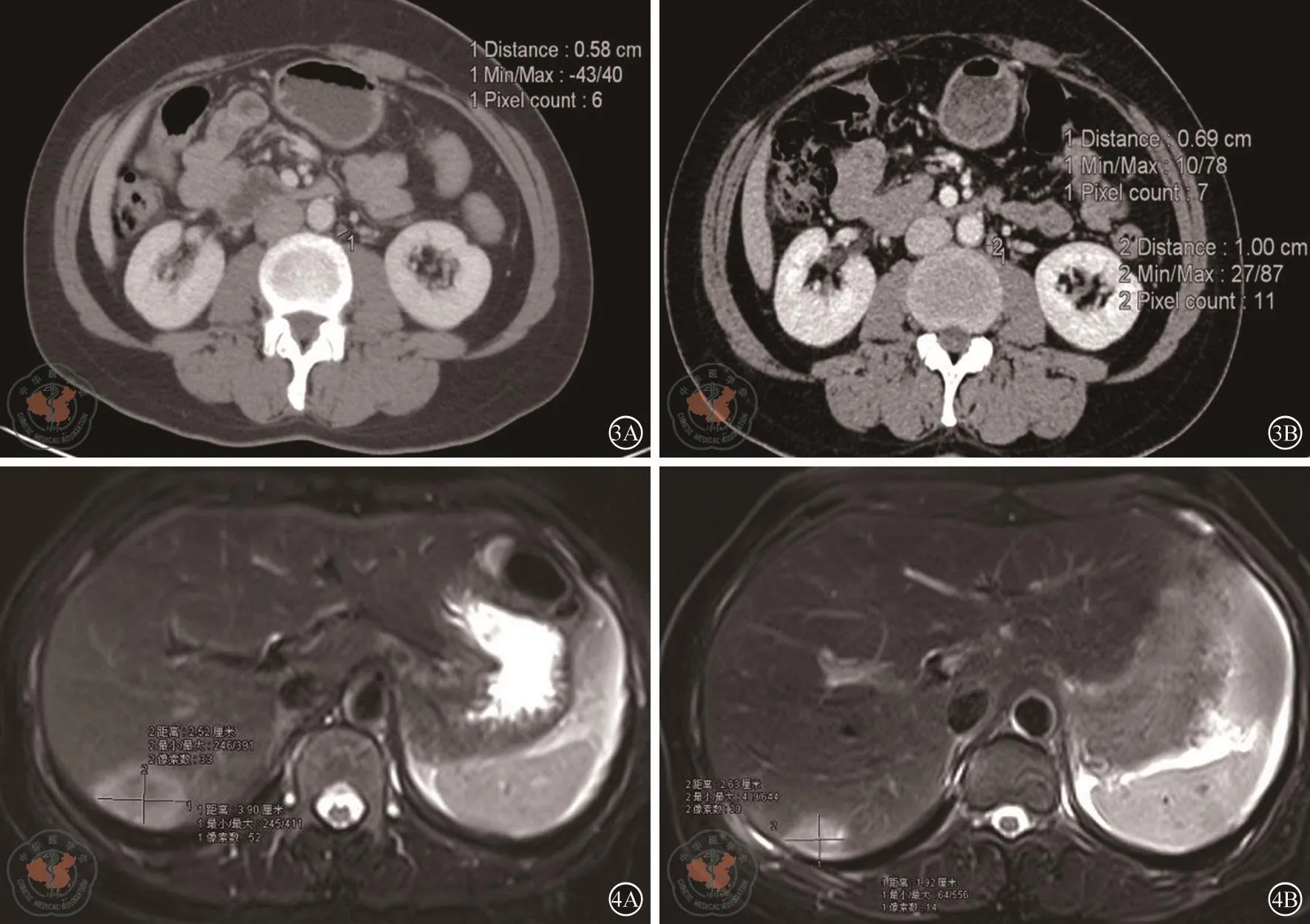
图3 腹部增强CT。图3A示:新辅助化疗前腹主动脉旁淋巴结肿大,短径0.58 cm;图3B示:3周期mFOLFOX6方案新辅助化疗后腹主动脉旁淋巴结长大,短径变为0.69 cm 图4 肝脏MRI。图4A示:病例二患者新辅助化疗前肝脏MRI显示肝转移灶大小约为:3.9 cm×2.5 cm;图4B示:病例二患者新辅助化疗后肝脏MRI显示肝转移灶大小约为:2.6 cm×1.9 cm
讨 论
肝脏寡转移在结直肠癌较常见也是结直肠癌转移的一种常见形式,20世纪90年代,“寡转移”的概念由Hellman和Weichselbaum共同提出[8]。寡转移来自于肿瘤的微转移,是恶性肿瘤远处转移的一个相对稳定的状态,寡转移具有器官的特异性,但仍不具备全身广泛转移的能力,转移灶的数目可以单发也可以多发,转移部位不仅仅局限于单一器官[10]。2016版欧洲肿瘤内科学会(EuropeanSociety of Medical Oncology,ESMO)mCRC共识指南将寡转移定义一般指转移部位≤2个、总体转移数目≤5个的疾病状态。手术完全切除肝转移灶仍是目前能治愈结直肠癌肝转移的最佳方法[11-15],寡转移的患者也不例外,故符合条件的患者均应在适当的时候接受手术治疗。部分初诊时无法切除的肝转移灶经治疗后转化为可切除病灶时也应适时接受手术治疗。随着技术的进步,肝转移灶的大小、数目、部位等已不再是影响判断结直肠癌肝转移患者是否适宜手术的单一决定因素。是否适合手术切除主要从以下3个方面来判断[16-20]:(1)结直肠癌原发灶能够或已经根治性切除;(2)根据肝脏解剖学基础和病灶范围,肝转移灶可完全(R0)切除,且要求保留足够的肝脏功能(肝脏残留容积≥30~50%);(3)患者全身状况允许,没有不可切除的肝外转移病变,或仅为肺部结节性病灶,但不影响肝转移灶切除决策的患者。部分初诊无法切除的肝转移灶,经过系统的综合治疗后可转为适宜手术切除[12,21],其术后5年生存率与初始肝转移灶手术切除的患者相似[22-23],此类患者应当采取较为积极的诱导方案,应用有效的强烈化疗,并考虑联合肝动脉灌注化疗及分子靶向药物治疗。
对于确诊时合并肝转移的患者,在原发灶无出血、梗阻症状或无穿孔时,除肝转移灶在技术上切除容易且不存在不良预后因素的患者外,均建议应用新辅助治疗[24],也可联合分子靶向治疗。肝转移灶完全切除的患者,建议接受术后辅助化疗[25],特别是没有进行过术前化疗及辅助化疗的患者。经过术前化疗(包括联合分子靶向药物)证实有效的方案,术后如无禁忌应该作为首选的辅助治疗方案。

表1 两病例特点比较
上述两例患者新辅助治疗后肝脏转移灶均得到缩小,病例一原发灶得到降期。由于病例一术中超声发现其中一枚转移灶位置较深,且与肝中静脉关系密切,故行射频消融,另一枚转移灶行切除术。病例二无论是原发灶还是肝转移灶均行根治性切除。两位患者均建议术后继续行辅助治疗但病例一由于经济原因术后仅行1周期辅助治疗后终止治疗,病例二继续行7周期mFOLFOX6方案化疗。病例一术后随访13个月,病例二术后随访16个月,均未见局部复发及远处转移,肝脏亦未再发现新发病灶。对于结直肠癌肝脏寡转移的患者来说,能否早期诊断、及时行以手术为主的综合治疗对患者的预后有至关重要的影响。随着外科技术和器械及化疗药物的不断发展,结直肠癌肝转移患者的3年生存率可达60~86%,5年生存率可达36~58%[26]。
孤立的腹主动脉旁淋巴结转移(包括同时性和异时性)在结直肠癌中并不常见,据Shibata等报道其发生率不足2%[27-28],结直肠癌合并同时性肝、腹主动脉旁淋巴结转移(PALNM)者则更少见。据美国癌症联合委员会 (American Joint Committee on Cancer,AJCC)意见,腹主动脉旁淋巴结转移代表远处播散,属于Ⅳ期疾病;然而,日本结直肠癌协会(Japanese Society for Cancer of the Colon and Rectum,JSCCR)则认为PALNM代表肿瘤的局部转移,属于Ⅲ期疾病,所以对于PALNM的处理策略有所争论也不足为怪。对于影像学提示阳性(在CT上淋巴结的短径大于0.5 cm,并且边缘不规则或有毛刺,或呈斑点样改变;或者在PET-CT上高摄取[29-30])的腹主动脉旁淋巴结是否行腹主动脉旁淋巴结清扫(para-aortic lymph node dissection,PALND)一直有争议,有两项关于同时性PALNM的大宗报道显示[29-30],行PALND后其5年的总体生存率在22.7~33.9%之间,5年无病生存率在17.6~26.5%之间。Bae等[30]对同时性PALNM和肝转移的病人进行分析发现,PALNM的患者与肝转移者有相似的生存率。Choi等[27]对孤立PALNM的病例对照研究显示行PALND的患者有着更高的生存率(5年 OS:53.4% vs.12%,P=0.045),术后并发症发生率为25%(3例手术部位感染,2例肠梗阻,1例失血过多),术后死亡率为0。其报道的在行PALND术后同时性PALNM的总体生存率明显低于异时性PALM患者(29月vs. 61月,P=0.227),然而无统计学意义。Gagniere 等[31]报道显示孤立的PALNM行PALND术后的5年总体生存率和无病生存率分别为56%和51%,术后90天内的死亡率为0,由于作者对于PALND相关的手术并发症未单独报道,故无法获得PALND相关并发症的具体数据。然而,PALNM的患者在行PALND及辅助化疗后,仍有56~80%的患者会出现局部或远处的复发[32],未行PALND仅行放化疗的病人其复发率在60~68%之间[33-34]。
这些研究结果充分说明合并PALNM的患者预后较差,而对PALNM的患者行PALND并不一定让患者明显获益,所以如何筛选出能从PALND中受益的患者至关重要。相对于异时性PALNM,同时性PALNM肿瘤的临床进展更快,预后更差,所以对于同时性PALNM的患者在经过严格筛选后可积极行PALND。具体的MDT策略为:(1)若原发灶和腹主动脉旁转移淋巴结转移均可一期切除则行根治术加PALND,术后行辅助放化疗或先行新辅助治疗再行手术;(2)若原发灶或腹主动脉旁转移淋巴结不能一期切除,则先行新辅助治疗后再次评估;(3)对于不能手术切除的腹主动脉旁转移淋巴结则建议行系统化疗加局部放疗。病例二在MDT讨论后决定行PALND,清扫范围包括左肾静脉上缘到髂总血管下缘沿着腹主动脉的所有淋巴组织,术后随访16月未见复发和转移,这提示我们,对于影像学(CT、MRI、PET-CT)证实的同时性PALNM的患者尤其是经新辅助治疗无法控制或继续进展的PALNM,行PALND可能使患者获益。
目前对于肝脏寡转移尚缺乏具体的、统一的判断标准,因此各种治疗方法的效果无法进行比较,但现有的数据及结直肠癌肝转移的指南均支持在系统性全身治疗的基础上,积极行以手术为主的多学科、多种治疗方法共同参与的治疗方案。结直肠癌肝脏寡转移的表现形式多样,多学科综合讨论尤其重要,依据病人的身体情况、原发肿瘤的生物学行为、有无淋巴结转移等情况综合考虑,制定个体化的治疗方案,积极采取手术治疗,根治性切除肿瘤及转移灶是综合治疗的基础,且与预后密切相关。虽然目前对于MDT的相关报道较少,但其因自身优势,越来越得到大家的认可,结直肠癌的多学科诊疗也不例外,将MDT与患者的病情相结合,不断的促进结直肠癌诊疗模式的发展与完善,将为结直肠癌患者生活质量的提高及预后的改善做出积极贡献。
[ 1 ] Arru M, Aldrighetti L, Castoldi R, et al.Analysis of Prognostic Factors nf l uencing Long-term Survival After Hepatic Resection for Metastatic Colorectal Cancer [J]. World Journal of Surgery, 2008, 32(1):93–103.
[ 2 ] Vibert E, Canedo L, Adam R. Strategies to treat primary unresectable colorectal liver metastases [J]. Semin Oncol, 2005, 32(6 suppl 8):33–39.
[ 3 ] Kemeny N. Management of liver metastases from colorectal cancer [J]. Oncology (Williston Park), 2006, 20(10):1161-1176, 1179; discussion 1179-1180, 1185-1166.
[ 4 ] Lau WY, Lai EC. Hepatic resection for colorectal liver metastases [J]. Singapore Med J, 2007, 48(7):635–639.
[ 5 ] Taniai N, Akimaru K, Yoshida H, et al. Surgical treatment for better prognosis of patients with liver metastases from colorectal cancer [J]. Hepatogastroenterology, 2007, 54(78):1805–1809.
[ 6 ] Arru M, Aldrighetti L, Castoldi R, et al. Analysis of prognostic factors inf l uencing long-term survival after hepatic resection for metastatic colorectal cancer [J]. World J Surg, 2008, 32(1):93–103.
[ 7 ] Sharma S, Camci C, Jabbour N. Management of hepatic metastasis from colorectal cancers: an update [J]. J Hepatobiliary Pancreat Surg, 2008, 15(6):570-580.
[ 8 ] Hellman S, Weichselbaum RR.Oligometastases [J]. J Clin Oncol, 1995, 13(1):8-10.
[ 9 ] Benson AB, Venook AP, Bekaii-Saab T, et al. Rectal Cancer, Version 2.2015 [J]. J Natl Compr Canc Netw, 2015, 13(6):719-728; quiz 728.
[ 10 ] Weichselbaum RR. Hellman S. Oligometastases revisited [J]. Nat Rev Clin Oncol, 2011, 8(6):378-382.
[ 11 ] Bentrem DJ, DeMatteo RP, Blumgart LH. Surgical therapy for metastatic disease to the liver [J]. Ann Rev Med, 2005, 56:139-156.
[ 12 ] Abdalla EK. Commentary: Radiofrequency ablation for colorectal liver metastases : do not blame the biology when it is the technology [J]. Amer J Surg, 2009, 197(6):737-739.
[ 13 ] Hur H, Ko YT, Min BS, et al. Comparative study of reseaction and radiofrequency ablation in the treatment of solitary colorectal liver metastases [J]. Amer J Surg, 2009, 197(6):728-736.
[ 14 ] Reuter NP, Woodall CE, Scoggins CR, et al. Radiofrequency ablation vs. resection for hepatic colorectal metastasis : therapeutically equivaient? [J]. J Gastrointest Surg, 2009, 13(3):486-491.
[ 15 ] Dexiang Z, Li R, Ye W, et al. Outcome of patients with colorectal liver metastasis: analysis of 1, 613 consecutive cases [J]. Ann Surg Oncol, 2012, 19(9):2860-2868.
[ 16 ] Sharma S, Camci C, Jabbour N. Management of hepatic metastasis from colorectal cancers: an update [J]. J Hepatobiliary Pancreat Surg, 2008, 15(6):570-580.
[ 17 ] Timmerman RD, Bizekis CS, Pass HI, et al. Local surgical, ablative, and radiation treatment of metastases [J]. Ca Cancer J Clin, 2009, 59(3):145-170.
[ 18 ] Van der Voort van Zijp J, Hoekstra HJ, Basson MD. Evolving management of colorectal cancer [J]. World J Gastroenterol, 2008, 14(25):3956-3967.
[ 19 ] Lochan R, White SA, Manas DM. Liver resection for colorectal liver metastasis [J]. Surgical Oncology, 2007, 16(1): 33-45.
[ 20 ] Adam R, Hoti E, Bredt LC. Oncosurgical strategies for metastatic liver cancer [J]. European Journal of Cancer Supplements, Cir Esp, 2011, 89(1):10-19.
[ 21 ] Folprecht G, Gruenberger T, Bechstein WO, et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial [J]. Lancet Oncol, 2010, 11(1):38-47.
[ 22 ] Adam R. Chemotherapy and surgery: new perspectives on the treatment of unresectable liver metastases [J]. Ann Oncol, 2003, 14 Suppl 2: ii13-ii16.
[ 23 ] Goldberg RM, Sargent DJ, Morton RF, et al. Randomized controlled trial of reduced-dose bolus fluorouracil plus leucovorin and irinotecan or infused fluorouracil plus leucovorin and oxaliplatin in patients with previously untreated metastatic colorectal cancer: a North American Intergroup Trial [J]. J Clin Oncol, 2006, 24(21):3347-3353.
[ 24 ] Benoist S, Nordlinger B. Neoadjuvant treatment before resection of liver metastases [J]. Eur J Surg Oncol, 2007, 33(Suppl 2):S35-41.
[ 25 ] Adam R, Bhangui P, Poston G, et al. Is perioperative chemotherapy useful for solitary, metachronous, colorectal liver metastases? [J]. Ann Surg, 2010, 252(5):774-787.
[ 26 ] Matias M, Casa-Nova M, Faria M, et al.Prognostic Factors after Liver Resection for Colorectal Liver Metastasis [J]. 2015, 28(3):357-349.
[ 27 ] Choi PW, Kim HC, Kim AY, et al.Extensive lymphadenectomy in colorectal cancer with isolated para-aortic lymph node metastasis below the level of renal vessels [J]. J Surg Oncol, 2010, 101(1):66-71.
[ 28 ] Shibata D, Paty PB, Guillem JG, et al.Surgical management of isolated retroperitoneal recurrences of colorectal carcinoma [J]. Dis Colon Rectum, 2002, 45(6):795-801.
[ 29 ] Min BS, Kim JS, Kim NK, et al.Extended lymph node dissection forrectal cancer with radiologically diagnosed extramesenteric lymph node metastasis [J]. Ann Surg Oncol, 2009 , 16(12):3271-3278.
[ 30 ] Bae SU, Han YD, Cho MS, et al.Oncologic outcomes of colon Cancer patients with extraregional lymph node metastasis: comparison of isolated paraaortic lymph node metastasis with resectable liver metastasis [J]. Ann Surg Oncol, 2016, 23(5):1562-1568.
[ 31 ] Gagnière J, Dupré A, Chabaud S, et al. Retroperitoneal nodal metastases from colorectal cancer: curable metastases with radicalretroperitoneal lymphadenectomy in selected patients [J]. Eur J Surg Oncol, 2015 , 41(6):731-737.
[ 32 ] Wong JS, Tan GH, Teo MC.Management of para-aortic lymph node metastasis in colorectal patients: A systemic review [J]. Surgical Oncology, 25 (2016) , 411-418.
[ 33 ] Razik R, Zih FS, Haase E, et al.Long-term outcomes following resection of retroperitoneal recurrence of colorectal cancer [J]. Eur J Surg Oncol, 2014 , 40(6):739-476.
[ 34 ] Takenoue T, Yamada Y, Miyagawa S, et al.Cisplatin-5-fluorouracil therapy with remarkable effect and 5-year survival for paraaortic lymph node metastases of rectal carcinoma in females: a case report [J]. Jpn J Clin Oncol, 1999, 29(11):582-586.
MDT strategy for liver and para-aortic lymph node oligometastasis in colorectal cancer
Gu Chaoyang1,2,Deng Xiangbing1, Wang Ziqiang1.1Department of Gastrointestinal Surgery, West China Hospital, Sichuan University, Chengdu 610041, China;2West China School of Medicine, Sichuan University, Chengdu 610041, China Corresponding author: Wang Ziqiang, Email: wangzqzyh@163.com
Colorectal cancer is one of the most common malignant tumors,the morbidity and mortality rank the forefront of cancers.Metastasis is one of the main factors of poor prognosis in colorectal cancer. The common metastatic sites are the liver, lung and lymph node system, and the liver is one of the most important target organ. For the colorectal cancer metastatic lesions, multidisciplinary team (MDT) is the best choice for treatment.With the progress of multidisciplinary diagnosis and treatment, colorectal cancer″Oligometastasis″, was gradually raised. The oligometastasis refers to a period in which the tumor is less invasive and has a transitional stage between the primary lesion and the extensive metastasis, the number of metastatic lesions is limited and the metastatic organ is specif i c.In this study, the MDT treatment strategies of two cases of colorectal cancer patients with synchronous liver metastases (one case with synchronous paraaortic lymph node metastasis) are analyzed and the concept of liver and PALN oligometastasis in colorectal cancer and the progress of treatment are reviewed.
Colorectal neoplasms; Neoplasm Metastasis; Liver oligometastasis; Para-aortic lymph node oligometastasis; Multidisciplinary team
2017-04-16)
(本文编辑:赵志勋)
10.3877/cma.j.issn.2095-3224.2017.04.014
四川省科技厅科技支撑计划(No.2016SZ0043)
610041 成都,四川大学华西医院胃肠外科1;610041 成都,四川大学华西临床医学院2
王自强,Email:wangzqzyh@163.com
古朝阳, 邓祥兵, 王自强.结直肠癌肝脏、腹主动脉旁淋巴结寡转移的MDT策略[J/CD].中华结直肠疾病电子杂志, 2017, 6(4): 330-335.
