铁离子对固定化和游离态硝化细菌活性的影响
2017-07-29梁沪莲郭小雅刘洋刘伶俐宋志文徐
梁沪莲+郭小雅+刘洋+刘伶俐+宋志文+徐爱玲
摘 要:采用聚乙二醇—海藻酸钠—氯化钙方法包埋淡水型和海水型硝化细菌,比较分析铁离子对固定化和游离态硝化细菌中氨氧化菌和亚硝酸盐氧化菌活性的影响。结果表明,Fe3+对游离态硝化细菌的影响大于固定化硝化细菌,当Fe3+浓度为1 mg·L-1时固定化淡水硝化细菌氨氧化活性最高,游离态淡水型氨氧化活性受Fe3+影响较大,120 h后明显降低,但对亚硝酸盐氧化活性影响均较小。在不同Fe3+浓度条件下,固定化海水硝化细菌氨氧化活性和亚硝酸盐氧化活性与不加Fe3+组基本相同,而游离态海水型氨氧化和亚硝酸盐氧化活性均随Fe3+浓度增大而略有降低。
关键词:铁离子;固定化;硝化细菌;硝化活性
硝化细菌属化能自养菌,具有代时长、生长缓慢、易流失、对环境因子变化敏感等特點[1,2]。微生物固定化技术利用化学或物理手段将游离微生物固定在特定载体上,使其保持活性并可反复利用,对解决硝化细菌菌体流失,提高抗冲击负荷能力,维持系统稳定运行有重要作用[3]。
铁是微生物的矿物营养,对微生物生长必不可少,其主要作用是:元素铁存在于细胞色素、铁氧还蛋白和铁硫蛋白中,是氧化还原载体和电子传递链的组成部分,能使氨氧化的中间物羟氨释放的2个电子经电子传递链传给氧,磷酸化产生能量[4]。硝化细菌具有复杂的膜内褶结构,铁离子能够加大细胞膜渗透性,从而加快营养物质的吸收速度。研究表明,在活性污泥系统中,铁能加快硝化作用的进行。但微生物对矿质元素的需要仅是微量的,含量过高会引起抑制或毒害作用[5,6]。
本研究利用聚乙二醇—海藻酸钠—氯化钙作为包埋载体,分别制备淡水型和海水型硝化细菌固定化小球,研究Fe3+对固定化和游离态硝化细菌中氨氧化菌和亚硝酸盐氧化菌活性的影响。
1 材料与方法
1.1 实验材料
硝化细菌菌剂包括淡水型硝化细菌和海水型硝化细菌两种,由实验室自行制备,均由氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)组成。
人工海水由海水素(青岛通用海大海水素有限公司)配制而成,盐度28‰。
1.2 实验方法
1.2.1 硝化细菌固定化方法
采用4%聚乙二醇、2.5%海藻酸钠的混合包埋剂,以4% CaCl2溶液为交联剂,按菌胶比1∶2进行包埋,交联时间24 h,详细方法参见文献[7]。
1.2.2 Fe3+对氨氧化菌活性的影响
实验分为淡水和海水硝化细菌组。淡水实验组用氯化铵配制10 mg·L-1氨氮溶液,加入三氯化铁使Fe3+浓度分别为0、0.5、1、5、10 mg·L-1,分别加入1 g固定化小球或相当剂量的游离态硝化细菌,设定空白对照组。25 ℃、150 r/min条件下摇床培养,每24 h测定氨氮浓度。海水实验组采用人工海水溶液,氨氮浓度15 mg·L-1,其余同淡水组。
1.2.3 Fe3+对亚硝酸盐氧化菌活性的影响
实验分为淡水和海水硝化细菌组。淡水试验组用亚硝酸钠试剂配制20 mg·L-1亚硝酸盐溶液,加入三氯化铁使Fe3+浓度为0、0.5、1、5、10 mg·L-1,分别加入1 g固定化小球或相当剂量的游离态硝化细菌,设定空白对照组。25 ℃、150 r/min条件下摇床培养,每24 h测定亚硝酸盐氮浓度。海水实验组采用人工海水溶液,其余同淡水组。
1.3 分析方法
氨氮采用纳氏试剂分光光度法测定;亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法测定[8]。
2 结果与分析
2.1 硝化细菌固定化效果
研究发现,采用聚乙二醇包埋硝化细菌无法成球。海藻酸钠对微生物细胞起一定保护作用,可提高固定化细胞活性[9];水溶液中海藻酸钠会电解产生海藻酸阴离子,与氯化钙产生的二价钙离子发生静电作用而交联[10]。添加海藻酸钠,以氯化钙作为交联剂,不仅容易成球,无粘连现象,而且制作的小球机械强度高,传质性能好。但海藻酸钠浓度过高会出现拖尾现象,浓度过低,不易形成小球;氯化钙浓度过高,不利于硝化细菌活性,浓度低时,交联不彻底,固定化小球易破碎溶解[11]。通过正交实验,确定了制备的固定化小球的最佳方法,采用该方法制备的小球弹性好,无破损(见图1)。
2.2 Fe3+对固定化和游离态硝化细菌AOB活性的影响
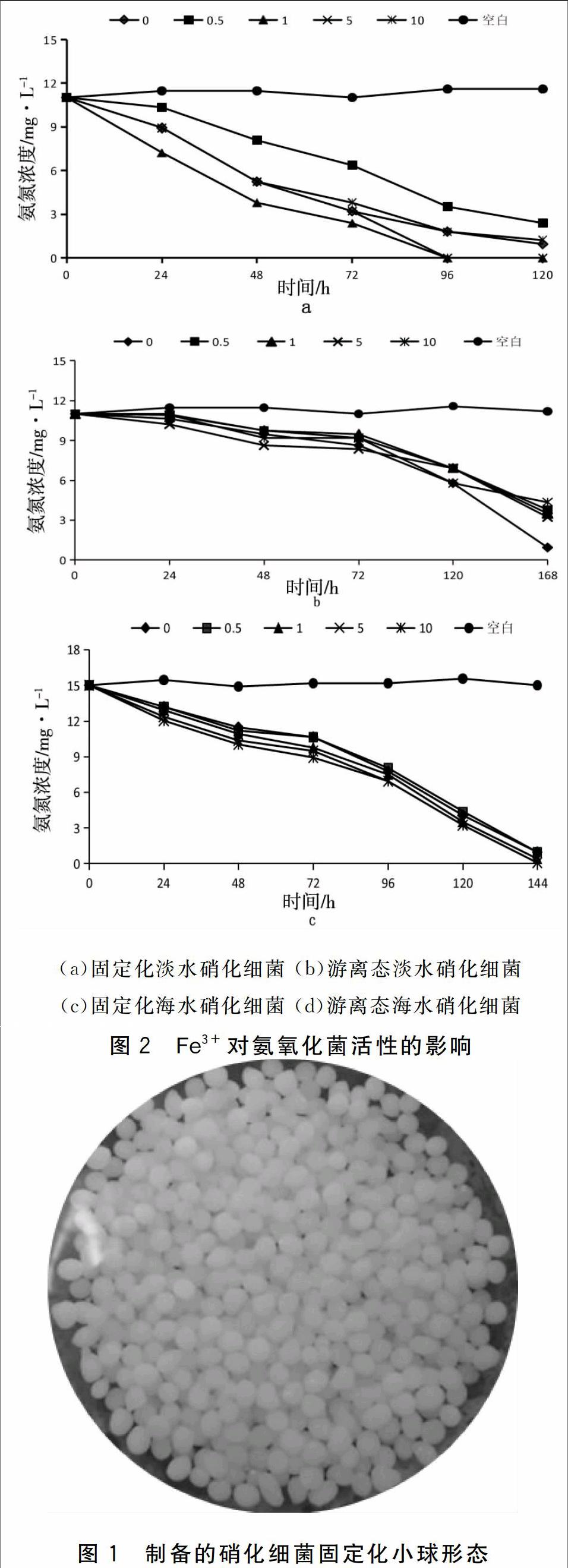
考察Fe3+对固定化和游离态硝化细菌菌剂中氨氧化菌活性的影响。结果见图2。
从图2中可以看出,Fe3+对固定化淡水硝化细菌的影响较固定化海水硝化细菌大,当Fe3+浓度为1 mg·L-1和5 mg·L-1时,固定化淡水硝化细菌氨氧化活性较高,并且1 mg·L-1浓度组大于5 mg·L-1浓度组,0.5 mg·L-1浓度组氨氧化菌活性则有所降低;在不同Fe3+浓度条件下,固定化海水硝化细菌氨氧化活性基本相同。
Fe3+对游离态淡水硝化细菌活性的影响较游离态海水硝化细菌大。反应初期Fe3+对淡水型和海水型氨氧化活性的影响均较小,120 h后氨氧化活性降低,经过168 h处理,游离态海水组氨氮去除率随Fe3+浓度增大而降低,均在60%左右;而淡水型10 mg·L-1浓度组氨氮去除率为61%,不加Fe3+组去除率为91.5%,其余组去除率在70%左右。
2.3 Fe3+对固定化和游离态硝化细菌NOB活性的影响
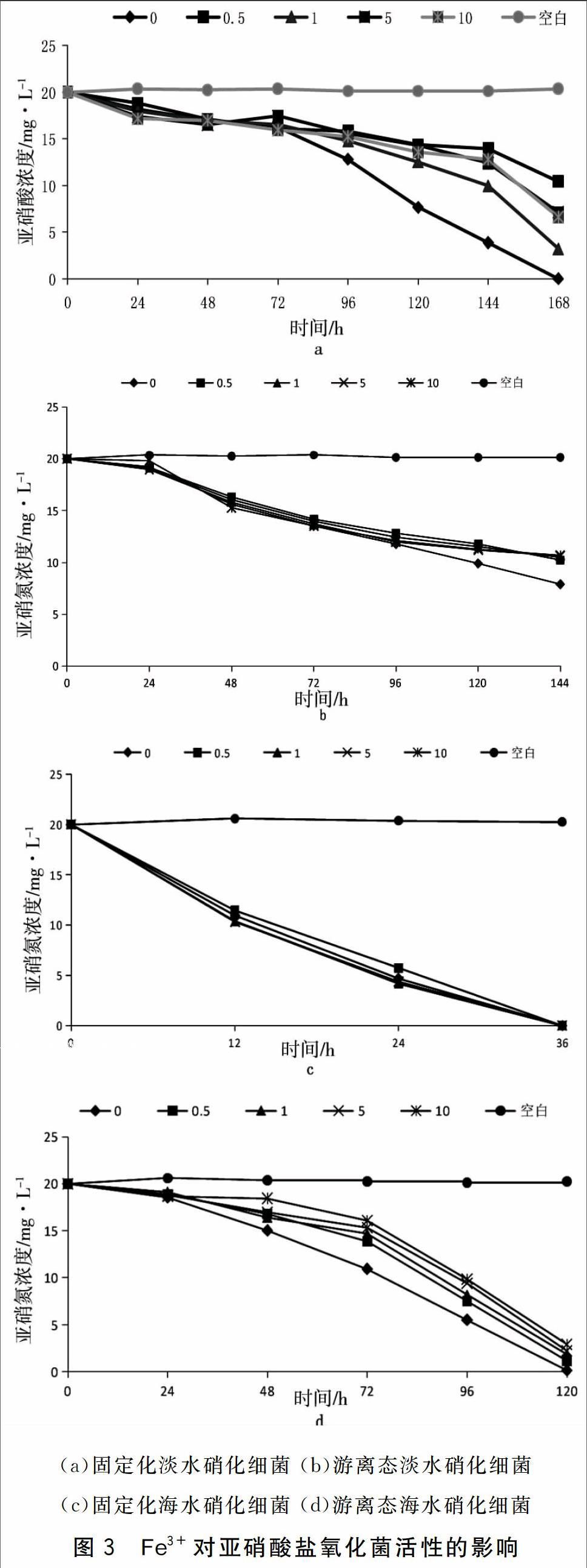
考察Fe3+对固定化和游离态硝化细菌菌剂中亚硝酸盐氧化菌活性的影响。结果见图3。
从图3中可以看出,Fe3+对固定化淡水硝化细菌亚硝酸盐氧化活性的影响较固定化海水硝化细菌大,前期固定化淡水亚硝酸盐氧化菌活性明显降低,72 h后1 mg·L-1浓度组亚硝酸盐氧化菌活性略有提高;在不同Fe3+浓度条件下,固定化海水亚硝酸盐氧化菌的活性均较高,仅36 h,亚硝酸盐氮去除率均达到100%。
Fe3+对游离态淡水和海水亚硝酸盐氧化菌的活性影响较小,游离态淡水组不加Fe3+的亚硝酸盐去除率达到61%,其它组去除率在50%左右;而游离态海水亚硝酸盐氧化菌活性随Fe3+浓度增加而略有降低,24 h后,亚硝酸盐氧化菌的活性明显降低,经120 h处理,不加Fe3+组亚硝酸盐去除率为100%,其余组分别为94.5%、910%、891%、85.6%。
3 讨论
微生物固定化可以极大限度地保护菌剂活性,提高硝化细菌的抗冲击能力和载体中的微生物密度,维持系统稳定运行。
本研究考察了不同浓度Fe3+对固定化淡水型和海水型硝化细菌氨氧化和亚硝酸盐氧化活性的影响,并与游离态硝化细菌进行了对比分析。从结果上看,Fe3+对游离态硝化细菌活性的影响大于固定化硝化细菌,游离态硝化细菌活性随Fe3+浓度的增大而降低,可能与Fe3+能与微生物中的酶结合,使酶失去活性有关。Fe3+对游离态硝化细菌具有毒害作用,从而影响硝化作用[12]。杨维等[13]研究地下水中铁锰等对氮转化的影响,结果证明低含量的铁对硝化有促进作用,高含量铁则对硝化作用有抑制作用,与本研究结果一致。
Fe3+对固定化淡水型和海水型硝化细菌的活性影响较小,尤其是对亚硝酸盐氧化菌活性影响最小。固定化硝化细菌的氨氧化和亚硝酸盐氧化速率大于游离态硝化细菌,分析原因可能为Fe3+与包埋材料中聚乙二醇会发生络合反应[14],减少系统中铁离子浓度,从而减小了对硝化细菌活性的影响。对于淡水硝化细菌来说,Fe3+对固定化小球的影响大于游离态硝化细菌,但对海水硝化细菌活性影响相对较小,可能是由于海水pH较高,Fe3+可与OH-发生反应产生沉淀,降低了Fe3+的浓度[15]。
4 结论
Fe3+对游离态硝化细菌的影响大于固定化硝化细菌。Fe3+浓度为1 mg·L-1时固定化淡水型硝化细菌氨氧化活性最大,亚硝酸盐氧化活性受Fe3+影响较小;游离态淡水型氨氧化活性受Fe3+影响较大,在120 h后明显降低,亚硝酸盐去除率则与不加Fe3+组相差不大。
在不同Fe3+浓度条件下,固定化海水硝化细菌氨氧化活性和亚硝酸盐氧化活性与不加Fe3+组基本相同;而游离态海水型氨氧化和亚硝酸盐氧化活性均随Fe3+浓度增大而略有降低。
参考文献:
[1] 刘少敏,储磊,朱敬林.固定化硝化细菌去除生活污水中的氨氮[J].环境工程学报,2014(10):4261-4266
[2] 罗小溪,高建忠,陈再忠.硝化细菌富集培养及应用研究进展[J].水产科技情报,2013(6):320-323
[3] 南晓梅,宋新山,赵晓祥.硝化细菌包埋固定化条件的研究[J].应用化工,2014(02):200-202
[4] M Fourquez,A Devez,A Schaumann,et al.Effects of iron limitation on growth and carbon metabolismin oceanic and coastal heterotrophic bacteria[J].Limnology & Oceanography,2014,52(9):349-353
[5] 劉少敏,储磊,朱敬林.固定化硝化细菌去除生活污水中的氨氮[J].环境工程学报,2014(10):4261-4266
[6] Ahmed J Mugwar,Michael J Harbottle.Toxicity effects on metal sequestration by microbially-induced carbonate precipitation[J].Journal of Hazardous Materials,2016,314:237-248
[7] 刘伶俐.硝化细菌固定化方法研究[D].青岛,青岛理工大学,2012
[8] 国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法,第四版[M].北京:中国环境科学出版社,2002
[9] Yongxiang Luo,Guilin Luo,Michael Gelinsky,et al.3D bioprinting scaffold usialginate/Polyvinyl alcohol bioinks[J].Materials Letters,2017,189:295-298
[10] Yuwei Dong,Yanqiu Zhang,Baojun Tu,et al.Immobilization of ammonia-oxidizing bacteria by calcium alginate[J].Ecological Engineering,2014,73:809-814
[11] E Priyadarshini,N Pradhan.Gold nanoparticles as efficient sensors in colorimetric detection of toxic metal ions:A review[J].Sensors and Actuators B:Chemical,2017,238:888-902
[12] LI Tao,JI Xiaojun,WU Na,et al.Progress on effects of metal ions on lipid accumulation of oleaginous microorganism[J].Chemical Industry & Engineering Progress,2016,4:324-327
[13] 杨维,王泳,郭毓,等.地下水中铁锰对氮转化影响的实验研究[J].沈阳建筑大学学报(自然科学版),2008(02):286-290
[14] 李亞峰,张驰,王健.重金属离子对亚硝化的影响研究[J].水处理技术,2016(02):96-99.
[15] Xiaoming Zou,Xiaoyu Xiao,Yu He,et al.Hormetic effects of metal ions upon V.fischeri and the application of a new parameter for the quantitative assessment of hormesis[J].Journal of Hazardous Materials,2017,322:454-460
Abstract:In order to study the effects of ferric ion on the activity of immobilized and free ammonia-oxidizing and nitrite-oxidizing bacteria,the polyethylene glycol-algin-CaCl2 was used to embed freshwater and marine nitrifying bacteria.The results showed that compared with immobilized nitrifying bacteria,Fe3+ had a greater effect on free nitrifying bacteria.Immobilized freshwater nitrifying bacteria was expected to show the highest activity when the concentration of Fe3+ was 1 mg·L-1,after 120 h,the activity of free ammonia-oxidizing bacteria in freshwater decreased significantly,greatly affected by Fe3+ ,but it had a little effect on ammonia-oxidation activity.Under the different concentration of Fe3+ ,the activity of immobilized marine ammonia-oxidizing and nitrite-oxidizing bacteria was similar to that of without Fe3+ ,but the activity of free marine nitrifying bacteria decreased slightly with the increase of Fe3+ concentration.
Key words:ferric ion;immobilization;nitrifying bacteria;nitrification activity
(收稿日期:2017-04-02)