金鱼腐皮病病原菌的分离鉴定及药敏试验
2017-07-25康雪微胡秀彩孙金辉孙敬锋吕爱军通信作者宋亚娇YEONGYiksung石洪玥郭立
康雪微,胡秀彩,孙金辉,孙敬锋,吕爱军,通信作者,宋亚娇,YEONG Yiksung,石洪玥,郭立
(1. 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2. 河南师范大学 水产学院,河南 新乡 453007)
金鱼腐皮病病原菌的分离鉴定及药敏试验
康雪微1,胡秀彩1,孙金辉1,孙敬锋1,吕爱军1,通信作者,宋亚娇2,YEONG Yiksung1,石洪玥1,郭立1
(1. 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2. 河南师范大学 水产学院,河南 新乡 453007)
从患腐皮病金鱼肝脏中分离获得1株细菌,编号为KL-1,通过细菌形态观察、生理生化特性、16S rDNA克隆测序及构建发育树分析等系统鉴定,并进行动物感染试验、药敏特性研究。结果表明,KL-1菌株为革兰氏阴性短杆菌,可发酵葡萄糖产气,氧化酶、接触酶、赖氨酸脱羧酶等为阳性;进一步采用PCR方法扩增16S rDNA序列,将其亚克隆至pMD18-T载体中,测序获得长度为1 507 bp,与Aeromonas veronii模式菌株ATCC 35624(X74684)序列相似性为99.66%,构建系统进化树分析与其聚为一支,鉴定KL-1菌株为维氏气单胞菌(Aeromones veronii)。动物感染试验表明,对斑马鱼半数致死量LD50为1.4×107cfu/mL。药敏试验结果显示,该病原菌对头孢克肟、头孢哌酮、头孢噻肟、头孢氨苄、萘啶酸、恩诺沙星、左氟沙星、诺氟沙星、氟苯尼考和氯霉素等药物敏感。
金鱼;维氏气单胞菌;致病性;药敏试验
维氏气单胞菌(Aeromonas veronii)属于气单胞菌科(Aeromonuduceue)气单胞属(Aeromonas),普遍存在于水环境以及土壤中[1]。维氏气单胞菌可感染引起鱼类大量死亡,人类食用维氏气单胞菌污染的蔬菜、水产品等食物会导致腹泻、败血症以及食物中毒等病症[2]。近几年,该菌感染水产动物增多,流行范围逐步扩大,给水产养殖业造成了巨大的经济损失。已有报道维氏气单胞菌感染鳅(Misgurnus anguillicaudatus)、蟹(Eriocheir sinensis)、鲤(Cyprinus carpio)、罗非鱼(Oreochromis spp.)等多种水产动物发病[3-5]。关于观赏鱼感染维氏气单胞菌的分离鉴定,目前研究报道较少[6-7]。2016年3—5月,天津市某观赏鱼养殖基地金鱼暴发传染性腐皮病,病鱼主要出现皮肤溃烂、表皮发白,鳞片脱落、鳍基出血等症状,感染后期发生死亡现象。本研究从发病金鱼肝脏中分离得到1株细菌,对其进行细菌形态学观察、16S rDNA克隆测序、生理生化特征等鉴定研究,以期为观赏鱼类细菌性疾病防治提供科学参考。
1 材料与方法
1.1 材料
患腐皮病金鱼来自天津市某观赏鱼养殖基地。健康蓝斑马、红斑马鱼购自天津某花鸟鱼市场,室温饲养观察1周,确保健康无病后用于感染试验。LB培养基、细菌生化微量鉴定管和药敏纸片等均购自杭州微生物科技有限公司,Bio-TekeDNA胶回收试剂盒、pMD18-T载体、PCR Master Mix等均购自新乡智宝科仪仪器有限公司,大肠杆菌DH5α感受态细胞购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 细菌的分离纯化
无菌操作取患病金鱼肝脏组织,涂布接种于LB平板上,置于28 ℃恒温培养箱中24 h。挑取典型单个菌落进行2~3次分离纯化,得到纯菌种,30%甘油与菌液以 1:1比例混合,-80 ℃保存备用。
1.2.2 形态观察及生理生化试验
无菌操作挑取适量菌落接种于细菌生化微量鉴定管,28 ℃恒温培养7 d,进行观察并记录结果,参照《常见细菌鉴定手册》[8]对其进行形态观察及生理生化鉴定。
1.2.3 细菌DNA提取,16S rDNA基因克隆及序列分析
细菌总DNA提取采用煮沸法[9],经1.0%琼脂糖凝胶电泳检测后,-20 ℃保存备用。16S rDNA基因 PCR扩增,采用细菌通用引物 27F:5’-AGAGTTTGATCATGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’,反应体系(20 μL):Master Mix 10 μL,ddH2O 7 μL,DNA 模板1 μL,上下游引物各 1 μL。PCR反应条件:95 ℃预变性10 min,94 ℃变性5 min,55 ℃退火40 s,72 ℃延伸40 s,30个循环,72 ℃延伸10 min。用Bio-Teke胶回收试剂盒回收纯化16S rDNA目的片段,与 pMD18-T载体连接,转化大肠杆菌DH5α,采用引物M13-47:5’-CGCCAGGGTTTT CCCAGTC ACGAC-3’,RV-M:5’-GAGCGGATAA CAATTT CACACAGG-3’检测筛选阳性克隆,送至苏州金唯智生物科技有限公司测序,参照冯思玲[10]的方法,将16S rDNA序列通过NCBI的Blast检索序列同源性分析,采用 MEGA5.05软件邻接法构建系统发育树。
1.2.4 动物感染试验
参照张培等[11]方法进行,将分离菌接种于LB液体培养基中,28 ℃摇床培养18 h,用麦氏比浊仪测量菌液浓度,用无菌生理盐水稀释至 2.68×108cfu/mL。选取健康斑马鱼为试验对象,采用腹腔注射法,接种量为10 µL/尾,分5组浓度梯度(分别为 2.68×108、2.68×107、2.68×106、2.68×105、2.68×104cfu/mL),每组10尾鱼进行注射。对照组注射等量无菌生理盐水,连续观察7 d,记录死亡情况,Bliss法计算半数致死量LD50。
1.2.5 药敏试验
采用标准K-B纸片扩散法对分离菌株进行常用抗生素药物的敏感性检测,涂布法接种分离菌株于LB平板上,按分类贴好药敏纸片,28 ℃培养36 h后测量抑菌圈直径,重复3次计算平均值,按说明书判断分离菌株对药物的敏感性。
2 结果
2.1 分离菌的形态特征
从患腐皮病金鱼肝脏中分离纯化获得1株细菌,编号为KL-1,该菌在LB培养基上生长良好,呈圆形、透明、表面湿润、边缘整齐的小菌落;革兰氏染色显示阴性短杆菌(图1)。
图1 KL-1菌株革兰氏染色(标尺5 µm)
2.2 生理生化特征
KL-1菌株能利用葡萄糖产气,氧化酶、接触酶、苯丙氨酸酶、赖氨酸脱羧酶等试验为阳性,鸟氨酸、硫化氢、葡萄糖酸盐、尿素、木糖、侧金盏花醇等为阴性(表1),符合《常见细菌鉴定手册》等[8]描述气单胞菌属(Aeromonas)细菌特征。

表1 KL-1菌株生理生化反应结果
2.3 16S rDNA序列、系统发育树分析
采用PCR方法扩增KL-1菌株的16S rDNA基因序列,进行琼脂糖凝胶电泳,呈现出 1条大小约1 500 bp目的条带(图2,泳道1,2);将其亚克隆至pMD18-T载体,转化大肠杆菌DH5α,筛选阳性克隆(图2,泳道3~10),测得16S rDNA长度为1 507 bp。Blast比对与A.veronii模式菌株ATCC 35624(X74684.1)序列同源性为99.66%。从NCBI数据库选取10个气单胞菌属模式菌株,构建系统发育树,结果显示KL-1菌株与A.veronii模式菌株 ATCC35624(X74684.1)序列亲缘关系最近,自然聚类为一支(图 3),最终确定 KL-1菌株为维氏气单胞菌(A.veronii)。
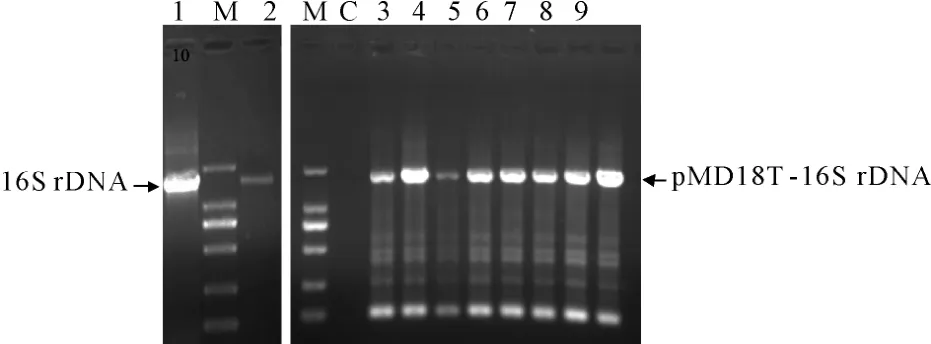
图2 KL-1菌株16S rDNA序列PCR扩增电泳及阳性克隆检测

图3 KL-1菌株16S rDNA系统发育树分析
2.4 动物感染与药敏试验结果
KL-1菌株人工腹腔注射斑马鱼,测定半数致死量(LD50)为1.4×107cfu/mL,其中以2.68×108cfu/mL菌液浓度感染斑马鱼 12 h后死亡率达80%,24 h后死亡率达100%,死亡斑马鱼主要出现体表出血,腹部膨胀、腐皮等临床症状(图4a,b),这与自然感染金鱼发病症状基本一致。患病金鱼主要表现为皮肤溃烂、表皮发白、鳞片脱落、鳍基部出血等腐皮病症状,解剖发现肝脏色淡、有腹水(图4c,d),从感染死亡斑马鱼肝脏中再次分离获得1株细菌,与KL-1菌株特征完全一致。感染鱼死亡率见表2,对照组无发病死亡现象。

图4 KL-1菌株人工感染斑马鱼、金鱼临床症状

表2 斑马鱼感染死亡情况
采用30种抗生素对KL-1菌株进行药敏试验,结果表明该菌株对头孢菌素类(头孢克肟、头孢哌酮、头孢噻肟、头孢氨苄)、喹诺酮类(萘啶酸、恩诺沙星、左氟沙星、诺氟沙星)、氨基糖苷类(庆大霉素、卡那霉素、链霉素)、氯霉素类(氯霉素、氟苯尼考)等20种药物敏感,对阿莫西林、氨苄西林、美罗培南、万古霉素、四环素、克林霉素、利福平等10种抗生素耐药(表3)。
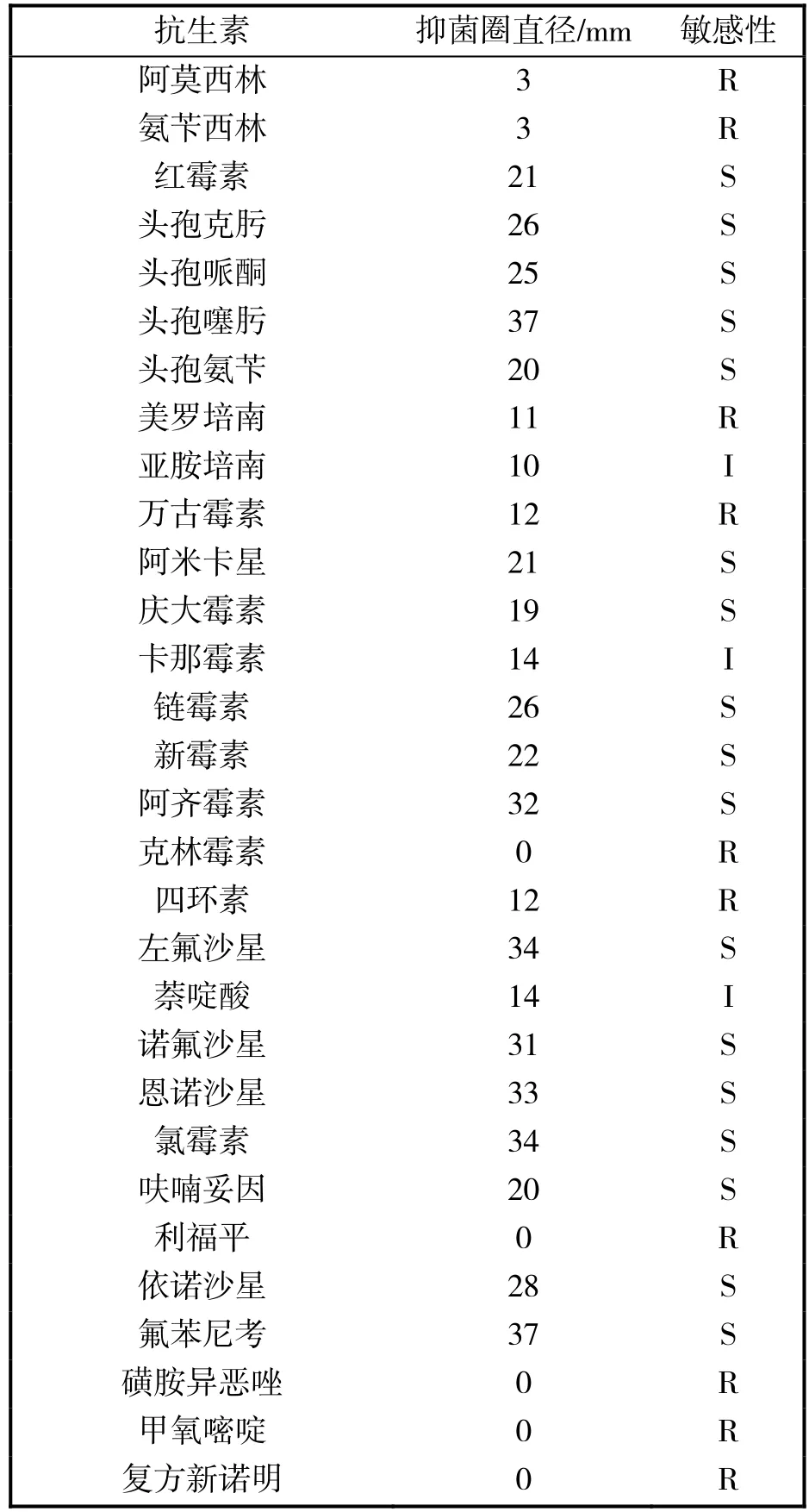
表3 KL-1菌株药敏试验结果
3 讨论
维氏气单胞菌广泛分布于水、土壤环境中,该菌成为一种重要的“人—兽—鱼”共患条件致病菌[2-3]。最近,Sun等[12]从患病的异育银鲫(Carassius auratus gibelio)中分离获得2株优势菌,通过对胞外酶、毒力基因PCR检测以及构建系统发育树等鉴定为致病性维氏气单胞菌。李聪等[4]从养殖场患病罗非鱼体内分离出优势菌,确定此次罗非鱼暴发型疾病的病原菌为维氏气单胞菌。高金伟等[13]从患病鳜肝脏中分离到维氏气单胞菌,通过人工感染回归试验确定为致病性维氏气单胞菌。汪开毓等[14]研究表明,斑点叉尾鮰(Ietalurus punetaus)维氏气单胞菌有较强致病性。贺扬等[1]报道致病性维氏气单胞菌胞外产物在入侵感染以及斑点叉尾鮰发病死亡过程中起重要作用。马志宏等[15]认为,维氏气单胞菌是引起养殖西伯利亚鲟(Acipenser baeri)鱼病害的主要致病菌之一。杨小强[6]从患病金鱼(Carassius auratus)脾脏中分离到维氏气单胞菌,人工感染试验动物陆续死亡,病变症状与养殖场自然发病金鱼相似。Sreedharan等[7]从患病淡水观赏鱼腹腔液以及内脏器官中分离获得维氏气单胞菌,感染病鱼临床症状主要表现为水肿、出血败血症以及尾鳍腐烂。本研究从患腐皮病金鱼肝脏中分离得到1株致病性维氏气单胞菌,主要引起金鱼皮肤溃烂、鳞片脱落、鳍基出血等临床症状。针对金鱼腐皮菌的发病机制,目前尚未见报道,值得进一步研究。
近年来,水产动物在养殖过程中大量使用抗生素等,造成病原菌耐药性不断增强,大大增加了鱼类疾病临床治疗的难度。Sun等[12]报道维氏气单胞菌对头孢菌素类、氨基糖甙类等抗生素敏感。Gashgari等[16]自患病金头鲷(Sparus aurata)中分离获得的维氏气单胞菌对羧苄青霉素、先锋霉素、卡那霉素、四环素、萘啶酸等敏感,尤其对环丙沙星高度敏感。秦国民等[17]进行药敏试验结果显示,锦鲤(Cyprinus carpio)维氏气单胞菌对诺氟沙星、哌拉西林、头孢哌酮、四环素等敏感,对氨苄西林、阿莫西林等耐药。金鱼(C. auratus)维氏气单胞菌对氯霉素、氟苯尼考、头孢氨苄、利福平和新生霉素等敏感[6]。本研究采用 30种抗生素进行药敏试验结果表明,KL-1菌株对头孢克肟、头孢哌酮、头孢噻肟、头孢氨苄、萘啶酸、恩诺沙星、左氟沙星、诺氟沙星、氯霉素、氟苯尼考等多种药物敏感。目前,联合国粮农组织(FAO)渔业委员会禁止氯霉素、克林霉素、四环素等药物用于鱼病防治[18],这在水产养殖中应该引起重视。以上报道鱼类维氏气单胞菌对头孢类、喹诺酮类、氨基糖甙类、氯霉素类等敏感特性与本研究结果基本一致,这为观赏鱼类感染维氏气单胞菌临床防治提供了科学参考。
[1] 贺扬,华丽,汪开毓,等. 高致病性维氏气单胞菌胞外产物对斑点鲖的致病性[J]. 水产学报,2016,40(3):458-465.
[2] 吴同垒,单晓枫,孟庆峰,等. 维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[3] Bomar L,Stephens W Z,Nelson M C,et al. Draft genome sequence of Aeromonas veronii Hm21,a symbiotic isolate from the medicinal leech digestive tract[J]. Genome Announc,2013,1(5):e00800-13.
[4] 李聪. 罗非鱼源维氏气单胞菌的分离鉴定及基因分型研究[D]. 海口:海南大学,2015.
[5] Sreedharan K,Philip R,Singh I S. Isolation and characterization of virulent Aeromonas veronii from ascitic fluid of oscar Astronotus ocellatus showing signs of infectious dropsy[J]. Dis Aquat Organ,2011,94(1):29-39.
[6] 杨小强. 金鱼维氏气单胞菌的分离鉴定与药敏分析[J].现代农业科技,2013(6):256-258.
[7] Sreedharan K,Philip R,Singh I S. Characterization and virulence potential of phenotypically diverse Aeromonas veronii isolates recovered from moribund freshwater ornamental fishes of Kerala,India[J]. Antonie Van Leeuwenhoek,2013,103(1):53-67.
[8] 蔡妙英,东秀珠. 常见细菌鉴定手册[M]. 北京:科学出版社,2001.
[9] 陈光丽,刘海林,马健. 煮沸法提取细菌DNA在布病病原检测中的应用[J]. 畜牧兽医科技信息,2015,1:28-29.
[10] 冯思玲. 系统发育树构建方法研究[J]. 信息技术,2009,3(6):38-41.
[11] 张培,朱爱华,胡秀彩,等. 金鱼类志贺邻单胞菌的分离鉴定及药敏试验[J]. 水产科学,2015,34(6):375-379.
[12] Sun J,Zhang X,Gao X,et al. Characterization of virulence properties of Aeromonas veronii isolated from diseased gibel carp(Carassius gibelio)[J]. Int J Mol Sci,2016,17(4):496.
[13] 高金伟,梁利国,王亚冰,等. 鳜源致病性维氏气单胞菌的鉴定及药敏试验[J]. 微生物学报,2004,26(32):256-273.
[14] 汪开毓,肖丹,范方玲,等. 鱼源维氏气单胞菌的生物特性和基因分型[J]. 中国兽医科学,2011,41(4):367-374.
[15] 马志宏,杨慧,罗琳,等. 西伯利亚鲟致病性维氏气单胞菌的分离鉴定[J]. 微生物学报,2009,49(10):1290-1293.
[16] Gashgari R M,Selim S A. Detection and characterization of antimicrobial resistance and putative virulence genes in Aeromonas veronii biovar sobria isolated from gilthead sea bream(Sparus aurata L.)[J]. Foodborne Pathog Dis,2015,12(9):806-811.
[17] 秦国民,张晓君,陈翠珍,等. 锦鲤维氏气单胞菌感染症及其病原生物学特性研究[J]. 安徽农业科学,2008,36(19):8115-8117.
[18] 张文革. 无公害养殖中的常用渔药及各类禁药简介[J].北京水产,2008,112(3):65-66.
责任编辑:张爱婷
Isolation, Identification and Antibiotics Susceptibility of the Pathogenic Bacteria Isolated from the Putrid Skin Diseased Carassius Auratus
KANG Xue-wei1, HU Xiu-cai1, SUN Jin-hui1, SUN Jing-feng1, LÜ Ai-jun1,CorrespondingAuthor, SONG Ya-jiao2,YEONG Yiksung1, SHI Hong-yue1, GUO Li1
(1. Tianjin Key Lab of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384,China; 2. College of Fisheries, Henan Normal University, Xinxiang 453007, Henan Province, China)
A bacterial strain was isolated from the liver of the Putrid Skin Diseased Carassius auratus, named KL-1. The morphological observation, physiological and biochemical characteristics, the cloning and sequencing of 16S rDNA and phylogenetic tree analysis, animal infection test and the antibiotic susceptibility analysis were carried out in this study. Results showed that KL-1 strain was a rod-shaped, gram-negative bacillus, it can produce acid and gas fromglucose, oxidase, catalase and lysine decarboxylase showed positive reaction; Furthermore, the 16S rDNA sequences was amplified by PCR method, and subcloned into pMD18-T vector, a product of sequencing was 1 507 bp in length. It had a 99.66% similarity of 16S rDNA sequence with Aeromonas veronii type strain ATCC 35624(X74684), and clustered into one group with A. veronii, so the KL-1 strain was identified as A. veronii. Artificial infection test showed that the median lethal(LD50)to zebrafish was 1.4×107cfu/mL.The susceptibility testing with different antibiotics showed that it was sensitive to cefixime, cefoperazone, cefotaxime, cephalexin,clindamycin, nalidixic acid, enrofloxacin, difloxacin, norfloxacin, and florfenicol, chloramphenicol etc.
goldfish; Aeromonas veronii; pathogenicity; drug sensitivity test
S943
:A
2016-09-14
国家自然科学基金项目“弹状病毒诱导斑马鱼皮肤和鳃免疫应答的蛋白质组研究”(31272692);天津市自然科学基金重点项目“黏蛋白在半滑舌鳎皮肤免疫应答过程中的功能研究”(16JCZDJC33500)及“半滑舌鳎肠道微生态与免疫力关系研究”(15JCZDJC34000);天津市水产产业技术体系创新团队“虾、贝类疾病防治”(ITTFRS2017009)
康雪微(1994-),女,黑龙江海伦人,本科在读,主要从事水族科学与技术方面研究。E-mail:2425173584@qq.com。
吕爱军(1973-),男,内蒙古太仆寺旗人,教授,博士,主要从事水产动物微生物与免疫学方面研究。E-mail:lajand@126.com。
1008-5394(2017)02-0053-05
