不同蒸制方法对人参愈伤组织中皂苷含量的影响
2017-07-25全雪丽李翔国吴松权
刘 佳, 汪 洋, 吕 爽, 全雪丽, 李翔国, 吴松权*
(1.延边大学 农学院;2.延边大学 长白山生物资源与功能分子教育部重点实验室:吉林 延吉 133002)
不同蒸制方法对人参愈伤组织中皂苷含量的影响
刘 佳1,2, 汪 洋1, 吕 爽1, 全雪丽1, 李翔国1, 吴松权1,2*
(1.延边大学 农学院;2.延边大学 长白山生物资源与功能分子教育部重点实验室:吉林 延吉 133002)
以人参愈伤组织为试材,采用高效液相色谱法,研究不同蒸制温度与时间对9种人参皂苷Rg1,Re,Rf,Rb1,Rc,Rb2,Rd,Rg3,Rh1含量的影响。结果表明:与对照组相比,人参皂苷Rg1,Re,Rf,Rb1,Rc,Rb2,Rd的含量在不同蒸制处理中均显著降低,但检测到对照组中几乎不存在的Rg3和Rh1,并在随后处理中呈现不同程度的增加,且均于115 ℃、2.0 h时出现峰值。表明可以通过适当的蒸制条件控制获取人参皂苷Rg3和Rh1。
人参;愈伤组织;人参皂苷;蒸制方法;高效液相色谱
人参(PanaxginsengC.A.Meyer),五加科人参属多年生药用草本植物,是我国传统的名贵中药材,素有“百草之王”之美誉。人参在历代本草中均有记载,始载于《神农本草经》,列为上品,其味甘且微苦、性温,具有大补元气、安神、生津止渴等功效[1-3]。人参的大多数药理作用归功于其次生代谢产物,人参皂苷是其中重要的生物活性物质之一[4]。人参皂苷属于三萜类皂苷,根据其糖苷配基结构的不同,被分为达玛烷型和齐墩果酸型人参皂苷[5],而达玛烷型人参皂苷根据其糖苷配基基团的不同又被分成原人参二醇型(PPD型,主要包括Rb1、Rb2、Rc、Rd、Rg3)和原人参三醇型(PPT型,主要包括Re、Rf、Rg1、Rh1)[6]。其中,人参皂苷Rg3、Rh1等在原人参中含量极低,通常经适当的转化方能检测到,为稀有人参皂苷[7]。研究认为Rg3、Rh1具有显著的抗肿瘤、抗癌等作用[8-9]。
红参是人参的最常见炮制品之一,即生人参经蒸制、烘干后的炮制品[10]。在蒸制过程中,人参部分皂苷类成分降解,同时合成具生理活性的新的次生物质。有研究表明,人参皂苷Rg3是蒸制成红参的过程中生成的次生皂苷[11]。且红参中Rg3和Rh1等在体内吸收率高,有较佳的生理功能[12-13],导致红参在药理活性方面与人参不同,其中抗肿瘤等活性尤为显著[14]。与植株栽培相比,愈伤组织培养具有操作简单、生长快、效率高、成本低等特点[15]。通过愈伤组织培养获得药用植物的次生代谢产物已被认为是一种行之有效的方法,Jiang等[16]研究表明,通过愈伤组织可获得7种主要人参皂苷,包括原人参二醇型皂苷Rb1、Rb2、Rc、Rd和原人参三醇型皂苷Re、Rf、Rg1。使用不同蒸制处理加工人参已被广泛研究,但在人参愈伤组织中的应用研究仍未见报道。本文以人参愈伤组织为试材,探究不同蒸制温度、蒸制时间对人参愈伤组织中上述7种主要人参皂苷和2种稀有人参皂(Rg3、Rh1)含量的变化,为利用人参愈伤组织生产Rg3、Rh1等稀有人参皂苷奠定初步的理论基础。
1 材料与方法
1.1 材料与仪器
1) 植物材料 人参植株采自吉林省汪清县,经由延边大学农学院植物学教研室石铁源教授鉴定为人参PanaxginsengC.A. Meyer。
2) 药品与试剂 人参皂苷标准品购自中国药品生物制品检定所;乙腈和甲醇购于Fisher公司;HPLC分析用水为三重蒸馏水;其它试剂均为国产分析纯。
3) 主要仪器 MJ-78A高压灭菌锅(上海施都凯仪公司);BAO-250A鼓风干燥箱(上海施都凯公司);C18色谱柱(5 μm,4.6 mm×250 mm,美国Theromo scientific公司);LC-10ATVP Plus高效液相系统(日本岛津公司),包括SIL-10A自动进样器、CTO-10ASVP Plus柱温箱、LC-10ADVP二元高压梯度泵、SPD-10AVP Plus紫外可见双波长检测器;RE-2000B旋转蒸发仪(上海豫康公司);DLSB-5/20低温冷却循环泵(上海豫康公司);SHB-ⅢA循环水式多用真空泵(上海豫康公司);OSB-2100恒温水浴锅(上海爱朗公司);CR22GⅢ高速离心机(日本日立公司)。
1.2 方法
1.2.1 人参愈伤组织的诱导与培养
人参愈伤组织的诱导和培养参照刘佳等[17]的方法。人参愈伤组织的诱导和继代培养基为1%琼脂,3%蔗糖和1.5 mg/L二氯苯氧乙酸(2,4-D)的MS培养基,pH值5.8。培养条件为25 ℃暗培养。
1.2.2 样品制备与人参皂苷的提取
选取培养3周的新鲜人参愈伤组织,将其分别置于105、115和125 ℃下蒸制1、1.5和2 h,未做处理的人参愈伤组织为对照组,随后于50 ℃的干燥箱内烘干至恒重后,用研钵研磨成粉末。人参皂苷的提取主要参照《中国药典》2010年版[18]和韩宵等人的方法[19]。精密称取0.3 g样品,加入70 mL MeOH-H2O (2∶1,v/v),置于恒温水浴锅中回流提取3 h,提取2次,再加入水饱和正丁醇萃取4次,浓缩挥干,并用色谱级的甲醇溶解(每0.3 g加3 mL),用0.45 μm滤膜过滤后用于高效液相色谱分析。每个样品重复3次。
1.2.3 色谱条件
采用高效液相色谱(HPLC)分离人参皂苷,流动相A为水,B为乙腈,流速为1.0 mL/min,二元梯度洗脱(表1);进样体积为10 μL;检测波长203 nm;柱温25 ℃。对照组及样品(115 ℃ 2.0 h)色谱图见图1。
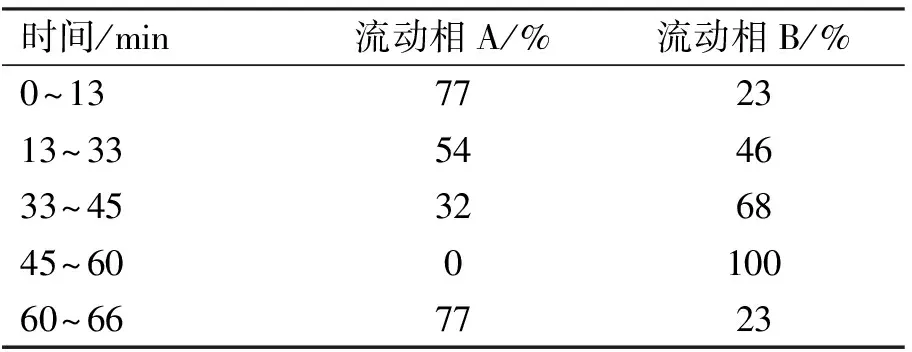
表1 流动相梯度洗脱
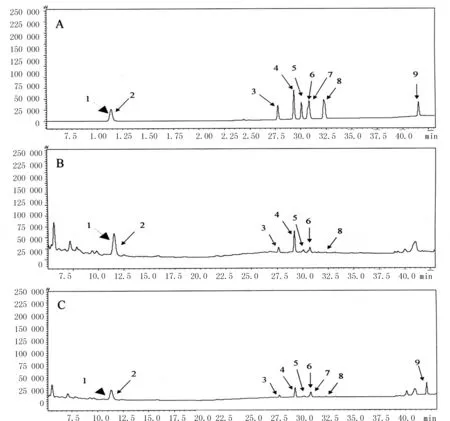
1-人参皂苷Rg1;2-人参皂苷Re;3-人参皂苷Rf;4-人参皂苷Rb1;5-人参皂苷Rc;6-人参皂苷Rb2;7-人参皂苷Rh1;8-人参皂苷Rd;9-人参皂苷Rg3
图1 混合标准品(A)、对照组(B)、115 ℃ 2 h(C)的HPLC图谱
Fig.1 HPLC chromatograms of the standard mixture (A), control group (B), and 115 ℃ 2 h (C)
1.2.4 人参皂苷标准曲线的建立
配制不同浓度的标准液,其中,主要人参皂苷(Rg1,Re,Rf,Rb1,Rc,Rd,Rb2)浓度梯度为0.02,0.05,0.08,0.10,0.20 mg/mL,稀有人参皂苷(Rg3,Rh1)浓度梯度为0.01,0.02,0.04,0.06,0.08 mg/mL。随后将各个浓度的标准液进行高效液相色谱分析,每个样品3次重复。以标准液浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制各个人参皂苷的标准曲线(表2)。

表2 人参皂苷标准曲线
1.2.5 稳定性、精密度及重复性试验
1) 稳定性试验 精密吸取混合标准品适量,分别于3,6,9,12 h进行HPLC检测。按2.3步骤色谱条件测定,结果显示混合标准品成分在12 h内无明显变化,峰面积标准差(RSD)均<2.1%,表明样品溶液在12 h内稳定。
2) 精密度试验 精密吸取同一供试样品(对照组),按2.3步骤色谱条件,重复进样6次。结果显示供试样品溶液各人参皂苷类成分峰面积标准差(RSD)均<1.2%,表明仪器精密度良好。
3) 重复性试验 取同一供试样品(115 ℃,2.0 h),稀释6份,按2.3步骤色谱条件进样后,计算供试样品溶液各人参皂苷类成分含量。结果显示供试样品溶液各人参皂苷类成分含量的RSD均<0.9%,表明该方法重复性良好。
2 结果与分析
2.1 不同蒸制方法对PPD、PPT型人参皂苷和总皂苷含量的影响
不同蒸制方法对人参愈伤组织中PPD、PPT型人参皂苷和总皂苷含量的影响如表3所示。人参愈伤组织中PPD、PPT型人参皂苷和总皂苷含量均随蒸制时间与蒸制温度的增加而急剧减少,并于125 ℃、2.0 h时出现最低值,此时总皂苷和PPD、PPT型人参皂苷含量分别为1.554、1.123、0.431 mg/g,分别相对于对照组降低了88%、85%、91%。对于PPD、PPT型人参皂苷含量计算结果表明,PPD型人参皂苷含量在蒸制前后均远高于PPT型。
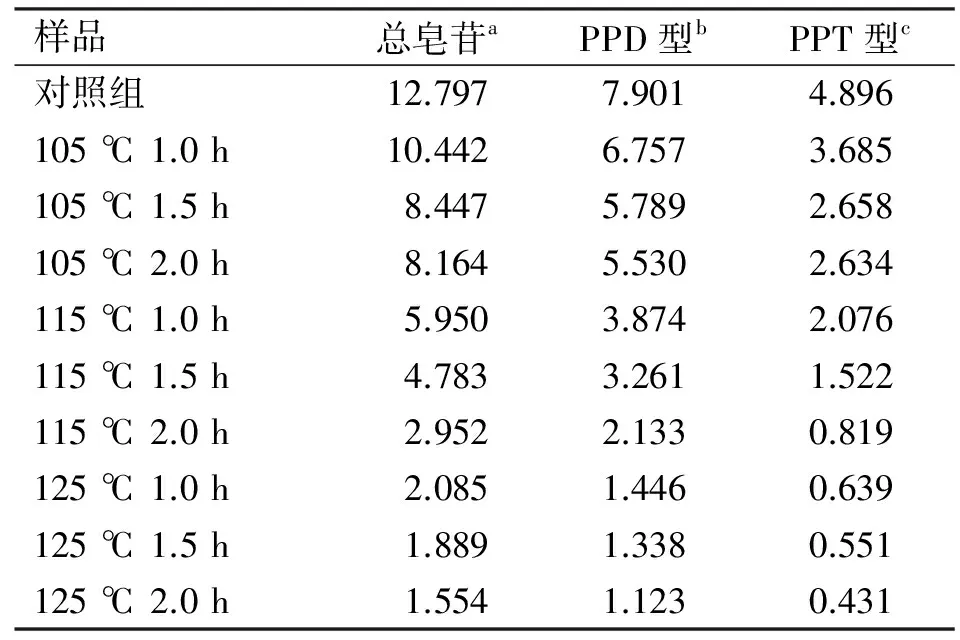
表3 不同蒸制方法对人参愈伤组织中PPD、PPT 型人参皂苷和总皂苷含量的影响
注: a:Rg1+Re+Rf+Rb1+Rc+Rb2+Rd;b:Rb1+Rc+Rb2+Rd;c:Rg1+Re+Rf
2.2 不同蒸制方法对人参愈伤组织中9种皂苷类成分含量的影响
利用HPLC法测定不同蒸制方法对人参愈伤组织中9种皂苷类成分含量的影响(表4)。人参皂苷Rg1,Re,Rf, Rb1,Rb2,Rd的含量均随蒸制温度与时间的增加而显著降低,且均在125 ℃、2.0 h处理中呈现最低值;人参皂苷Rc的含量则在105 ℃和115 ℃处理中略有提升,但仍在125 ℃处理中显著下降。在对照组中未检测到人参皂苷Rg3与Rh1在随后的蒸制处理中出现并表现出不同程度的增加,且均在115 ℃、2.0 h处理时出现峰值,此时含量分别为0.445和0.450 mg/g。
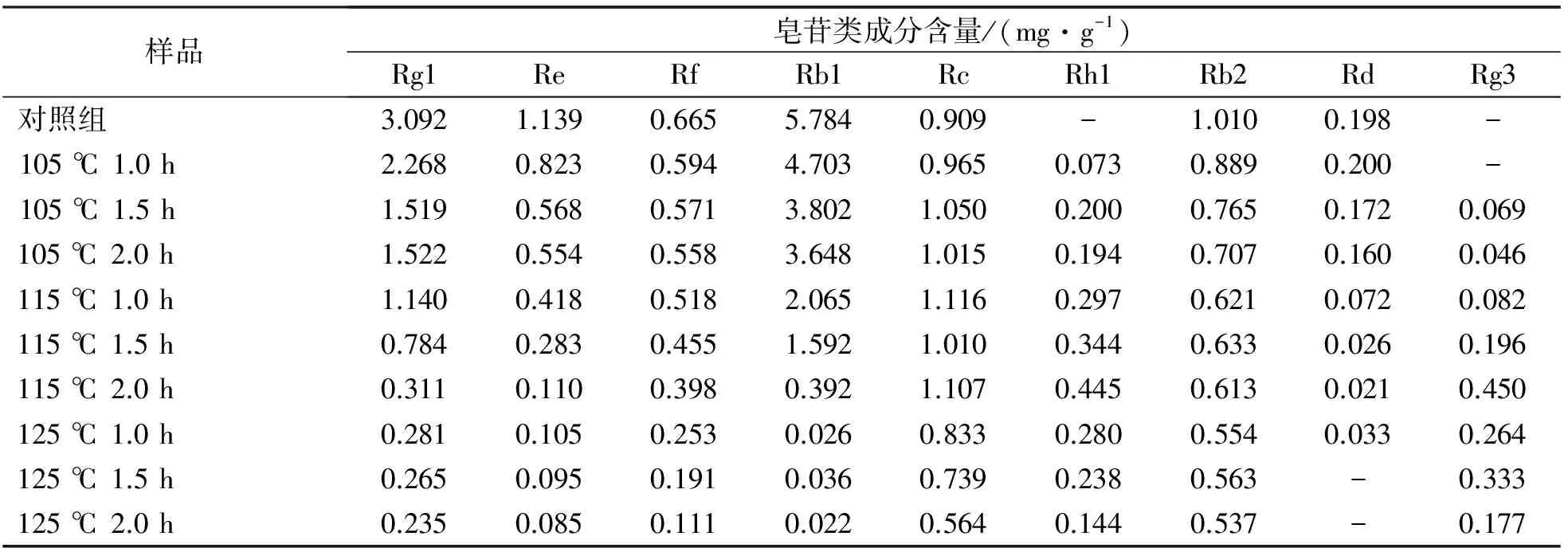
表4 不同蒸制方法对人参愈伤组织中9种皂苷类成分含量的影响
注:“-” 表示未检测到。
3 讨论与结论
近年来学者对人参蒸制的研究日益增多,多集中于蒸制时皂苷类成分含量、结构的变化以及蒸制后产生的部分微量次级皂苷的定性、鉴别[10-13],尚未见人参愈伤组织蒸制处理的报道。相对于植株栽培,愈伤组织培养具有操作简单、生长快、效率高、成本低等特点[15]。本文以人参愈伤组织为试材,探究不同蒸制温度、蒸制时间对人参愈伤组织中9种人参皂苷类成分以及总皂苷含量的变化。结果表明,人参愈伤组织中PPD、PPT型人参皂苷和总皂苷含量均随蒸制时间与蒸制温度的增加而急剧减少。武双等[20]研究不同蒸制法对三七主根中皂苷的影响时,总皂苷含量的变化呈现了类似的趋势,并于125 ℃、4.0 h的炮制品中出现最低值。推测在蒸制过程中,高温高压使主要人参皂苷发生降解和转化,从而生成稀有人参皂苷。有趣的是,在武双等[20]研究中,125 ℃、4.0 h的炮制品的总皂苷质量为38.01 mg,质量分数12.67%,相对于对照组(44.58 mg,14.86%)仅降低了15%左右。这与本实验结果具有较大差异,可能由于试验所用材料的不同所致,愈伤组织是未分化的原始细胞团,相对于植株没有复杂的结构,可能降低了转化的结构阻碍,使人参皂苷单体更易相互转化。
在对人参愈伤组织中9种人参皂苷成分的研究中发现,Rg1, Re, Rf, Rb1, Rb2, Rd的含量均随蒸制温度与时间的增加而显著降低;人参皂苷Rc的含量则在105 ℃与115 ℃处理中略有提升,但仍在125 ℃处理中显著下降。高越等[21]报道了不同加热时间对人参皂苷单体含量的影响,发现Rg1,Re和Rb2加热后含量降低。郑重等[14]研究认为,人参皂苷Rg1, Re, Rb1, Rb2, Rc的20位糖基极不稳定,易在蒸制过程中水解生成原人参二醇、原人参三醇或其他的次生苷。值得注意的是,人参皂苷Rg3出现于105 ℃、1.5 h处理中,略晚于Rh1(105 ℃、1.0 h)。类似地,张颖等[22]也报道了不同蒸制工艺对红参中人参皂苷类成分的影响,并发现人参皂苷Rh1与Rg3分别出现于80 ℃、2 h与100 ℃、4 h处理中。推测可能由于人参皂苷Rg3的转化过程相比于Rh1更为复杂(图2):在蒸制处理过程中,人参皂苷Rf可能直接降解为人参皂苷Rh1,人参皂苷Rg1与Re可降解原人参三醇并继续转化为人参皂苷Rh1;而人参皂苷Rb1, Rb2和Rc降解为人参皂苷Rd,并随温度与时间的增加,方可继续降解为人参皂苷Rg3[23]。
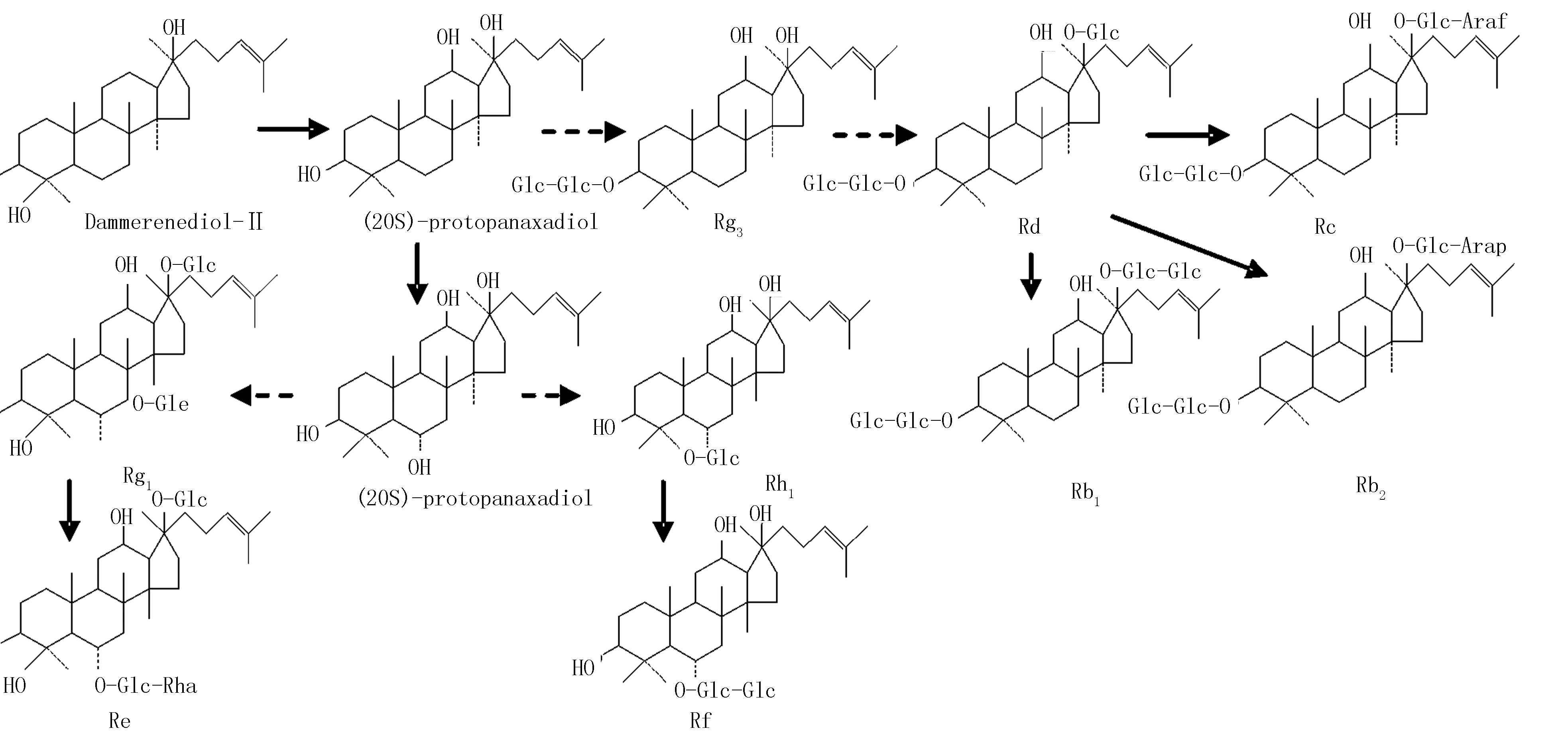
图2 推测的9种人参皂苷类成分的转化
综上所述,人参愈伤组织经蒸制处理可产生Rg3与Rh1等稀有人参皂苷,并且其含量与蒸制温度和时间密切相关。而进一步提高Rg3与Rh1的转化效率,则需优化蒸制方法。
[1] 金玉姬,赵洪颜,李翔国,等.人参基质栽培的可行性研究[J].安徽农业科学,2014,42(34):12087-12093.
[2] 肖丹,杨洪岩,吴昊.高效液相色谱法检测人参培养须根及内生菌中皂苷的含量[J].安徽农业科学,2014,42(17):5418-5421.
[3] 葛灵利.人参研究进展[J].世界最新医学信息文摘,2013(11):109-110.
[4] Zhan S Y,Guo W J,Shao Q,et al.A pharmacokinetic and pharmacodynamic study of drug-drug interaction between ginsenoside Rg1,ginsenoside Rb1 and schizandrin after intravenous administration to rats[J].J Ethnopharmacol,2014,152(2):333-339.
[5] Moses T,Papadopoulou K K,Osbourn A.Metabolic and functional diversity of saponins,biosynthetic intermediates and semi-synthetic derivatives[J].Crit Rev Biochem Mol Biol,2014,49(6):439-462.
[6] Kim Y J,Zhang D,Yang D C.Biosynthesis and biotechnological production of ginsenosides[J].Biotechnology Adv,2015,33(6):717-735.
[7] 钱静,康安,狄留庆,等.不同蒸制时间对人参活性成分及其药代动力学行为与抗炎作用的影响研究[J].中国中药杂志, 2015,40(19):3770-3774.
[8] 张翔,叶宝东,陈丹,等.人参皂苷Rg3抗肿瘤机制研究进展[J].中华中医药学刊,2013(2):328-330.
[9] 丁艳芬,李江霞,杨崇仁.人参皂苷Rh1的药理作用研究进展[J].中国现代中药,2013,15(4):282-285.
[10] 李卓艳,李德坤,周大铮,等.正交试验法优选红参加工工艺[J].中成药,2011,33(6):1005-1007.
[11] 程慧,宋新波,张丽娟.人参皂苷Rg3与Rh2的研究进展[J].药物评价研究,2010,33(4):307-311.
[12] 王肖冰, 刘春莹, 王上. 生物转化制备红参Rh1皂苷组及成分分析[J]. 大连工业大学学报, 2016, 35(1):11-14.
[13] Tawab M A,Bahr U,Karas M,etal.Degradation of ginsenosides in humans after oral administration[J].Drug Metab Dispos,2003,31(8):1065-1071.
[14] 郑重,宋凤瑞,刘淑英,等.人参、红参皂苷类成分指纹图谱研究[J].质谱学报,2012,33(6):327-333.
[15] 房慧勇,朱虹,丁海麦,等.影响愈伤组织中次生代谢产物含量的因素研究进展[J].中国中药杂志,2014,39(15):2846-2850.
[16] Jiang M L,Liu J,Quan X L,etal.Different chilling stresses stimulated the accumulation of different types of ginsenosides in Panax ginseng cells[J].Acta Physiol Plant,2016,38(8):1-8.
[17] 刘佳,全雪丽,姜明亮,等.低温胁迫对人参皂苷生物合成途径基因家族表达特性的影响研究[J].中草药,2016,47(11):1956-1961.
[18] 国家药典委员会. 《中华人民共和国药典》2010年版一部 [M].北京:中药医药科技出版社,2010.
[19] 韩宵,朱磊,闫春风,等.多指标综合加权评分法优选人参醇提工艺[J].中国现代中药, 2016,18(1):110-113.
[20] 武双,崔秀明,郭从亮,等.不同蒸制法对三七主根中皂苷的影响[J].中草药, 2015,46(22):3352-3356.
[21] 高越,于洋,牛淑静,等.不同加热时间对8种人参单体皂苷含量的影响[J].中国现代中药,2015,17(4):335-337.
[22] 张颖,郝颖,杨丽曼,等.不同蒸制工艺对红参中人参皂苷类成分的影响[J].中国实验方剂学杂志,2013,19(21): 16-20.
[23] 李向高,富力,鲁歧,等.红参炮制加工中的皂苷水解反应及其产物的研究[J].吉林农业大学学报,2000,22(2): 1-9.
Effects of different steaming methods on ginsenoside contents in callus ofPanaxginseng
LIU Jia1,2WANG Yang1, LV Shuang1, QUAN Xueli1, LI Xiangguo1, WU Songquan1,2*
(1.AgriculturalCollegeofYanbianUniversity;2.KeyLaboratoryofNaturalResourcesofChangbaiMountain&FunctionalMoleculesofMinistryofEducation,YanbianUniversity:Yanji,Jilin133002,China)
Callus of ginseng as the materials, the effects of different steaming methods on the contents of nine kinds of individual ginsenosides Rg1, Re, Rf, Rb1, Rc, Rb2, Rd, Rg3 and Rh1 were determined by HPLC. The results showed that the contents of Rg1, Re, Rf, Rb1, Rc, Rb2 and Rd were significantly reduced under different steaming treatments compared to the control. Rg3 and Rh1 were not detected in the control, but increased by different degrees in the subsequent treatments and reached peaks at 115 ℃ 2.0 h. It indicated that Rg3 and Rh1 could be obtained by controlling conditions of steaming methods.
Panaxginseng; callus; ginsenosides; steaming methods; HPLC methods
2017-03-25 基金项目:国家自然科学基金资助项目(21462044)
刘佳(1993—),女,吉林延吉人,在读硕士,研究方向为植物生物技术。吴松权为通信作者,
E-mail: arswsq@ybu.edu.cn
1004-7999(2017)02-0041-06
10.13478/j.cnki.jasyu.2017.02.007
R284
A
