玉米热激转录因子基因ZmHsf25的克隆、特性与耐热性功能分析
2017-07-25赵立娜段硕楠张华宁郭秀林李国良
赵立娜段硕楠张华宁郭秀林,*李国良,*
1河北省农林科学院遗传生理研究所 / 河北省植物转基因中心重点实验室, 河北石家庄 050051;2河北师范大学生命科学学院, 河北石家庄 050024
玉米热激转录因子基因ZmHsf25的克隆、特性与耐热性功能分析
赵立娜1,2,**段硕楠1,**张华宁1郭秀林1,*李国良1,*
1河北省农林科学院遗传生理研究所 / 河北省植物转基因中心重点实验室, 河北石家庄 050051;2河北师范大学生命科学学院, 河北石家庄 050024
植物热激转录因子(heat shock transcription factor, Hsf)对下游热激蛋白基因及耐热性相关基因的表达起关键调控作用。玉米中至少有30个Hsf家族成员, 其中B族有7个。在前期对玉米A1亚族热激转录因子基因ZmHsf06克隆及特性、抗旱耐热性功能分析的基础上, 从玉米幼叶中克隆到B族热激转录因子基因ZmHsf25的完整编码序列,序列全长957 bp, 编码318个氨基酸残基。蛋白质序列含有DNA结合结构域、核定位信号序列和核输出信号序列, 同源分析结果显示, ZmHsf25与高粱 Sb06g025710的相似性最高, 达 92%。荧光定量分析表明, 正常生长条件下, ZmHsf25在玉米多个组织器官中表达, 幼嫩花粉中高表达, 幼嫩根系和雌穗中表达量较低。42℃热胁迫能显著上调根系和叶片ZmHsf25的表达, 叶片中上升幅度高于根系, 处理50 min达到峰值; 正常条件下, 水杨酸和H2O2处理均使根系和叶片ZmHsf25表达下调, 而热激条件下却表现为显著上调。通过在洋葱表皮细胞中瞬时表达并观察GFP荧光,确定ZmHsf25定位在细胞核。通过转化酵母并进行热胁迫处理发现, 热胁迫同时降低正常和转ZmHsf25酵母的耐热性, 但与转空载体对照相比, 转基因酵母的耐热性更强。推测 ZmHsf25参与玉米热胁迫响应和花粉的发育过程, 可能是水杨酸热激信号转导途径的下游组分。研究结果为进一步探明玉米热激转录因子家族成员的特性与功能提供了依据。
玉米; 热激转录因子基因ZmHsf25; 表达; 亚细胞定位; 耐热性
许多研究已表明, 植物热激蛋白(Hsp, heat shock protein)与植株耐热性的提高密切相关, 而植物热激转录因子(Hsf, heat shock transcription factor)对下游热激蛋白基因及耐热性相关基因的表达起关键调控作用, 是植物对高温胁迫反应的关键因子。自 20世纪80年代后期首次克隆酵母Hsf以来, 相继获得动植物多个物种的 Hsf基因[1-3]。热激转录因子在植物中普遍存在, 首个植物 Hsf基因来自番茄[4]。与其他生物体相比, 植物中的Hsf基因是一个多基因家族, 依据结构分为 A、B、C三族, 细分为多个亚族。Hsf家族基因数目因作物品种不同差异较大, 果蝇和酵母中只有1个, 而小麦中至少有56个[5], 从数量上远远多于已知的其他生物体。相比于其他植物, 对模式植物番茄和拟南芥Hsf基因功能和调控机制研究得比较深入, 研究对象主要集中在A1和A2亚族[6-8]。
关于B族Hsf的研究报道不多, 该族基因因不含激活结构域而不能直接激活下游基因的表达, 早期研究认为其作用更多表现为抑制[9-10]。近年来, 越来越多的功能被逐渐报道。拟南芥中有5个B族Hsf,其中HsfB2a和HsfB2b属于热诱导型, 主要在热激反应后期起作用, 但其热激诱导表达的前提是与HsfA1a和HsfA1b结合。HsfB1和HsfB2b定位在细胞核, 正常生长和热恢复阶段直接抑制热激转录因子HsfA2的活性, 进而抑制一系列Hsp基因的表达,从而钝化热激反应。但在热激条件下, HsfB1和HsfB2b可能通过抑制某些干扰 HsfA1转位入核的Hsp基因的表达, 从而促进HsfA1入核而激活HsfA1,进而提高获得耐热性能力[10], 表现出正向调控功能。转鹰嘴豆CarHsfB2的拟南芥表现较强的抗旱和耐热性[11]。HsfB1和HsfB2b还参与pdf1.2的表达和抗病反应[12], 核中过表达 HsfB1可导致细胞死亡[13]。HsfB2b组成型表达可降低节律相关基因 Pseudo response regulator 7 (PRR7)的表达, 使得植株延迟开花, 下胚轴伸长, 因此在调控逆境条件下植株生物钟变化方面起重要作用[14]。番茄HsfB1作为共激活因子可增强HsfA1a和/或HsfA2的活性, 热激条件下可保持和恢复某些重要基因或持家基因的表达[15-16]。另外, 过表达拟南芥HsfB4可特异性诱导根系发育[17],水稻HsfB4b可通过结合特异HSE而调控病程防御反应[18]。可见, B族Hsf在植物抗逆、抗病过程中也发挥着重要的调控作用, 随着研究的逐步深入, 越来越多B族Hsf的特性和功能将得以解析。
通过生物信息学推测, 玉米中至少有30个Hsf成员, B族有7个, 其中4个基因同时含有核定位信号和胞质定位信号[3]。这些B族Hsf有什么样的特性和功能, 目前还没有相关报道。本实验室在研究玉米A1亚族基因的同时, 克隆了B族成员ZmHsf25,拟初步分析其结构、表达和亚细胞定位特性, 及其耐热性调控功能, 以期为全面深入研究玉米热激转录因子家族基因提供理论基础和技术支撑。
1 材料与方法
1.1 材料培养
供试材料为玉米(Zea mays L.)自交系H21 (实验室备)。精选种子, 经表面消毒后, 以自来水反复冲洗, 浸泡吸胀12 h后, 播至Hoagland营养液中, 于28℃培养箱中暗培养。待玉米长到二叶一心时, 进行不同处理, 取样进行定量表达分析。
于 2016年 5月上旬田间穴播试材, 常规种植,于开花盛期取功能叶、雌穗和花粉, 授粉 2周后取幼胚, 以液氮速冻, 用于组织器官中基因定量分析。
1.2 胁迫处理
将生长一致的幼苗分为 5组, 分别将幼苗根部浸入溶液, 进行如下处理, 参照李慧聪等[19]的方法略加修改。(1)浸入 42℃培养箱中预热的 Hoagland营养液进行热胁迫处理(HS), 处理时间分别为 10、20、30、40、50、60和240 min; (2)浸入含0.8 mmol L–1水杨酸(SA)的Hoagland溶液, 处理10、30、60、90、120和240 min; (3)浸入含10 mmol L–1H2O2的Hoagland溶液, 处理时间同水杨酸; (4)浸入含 0.8mmol L–1水杨酸(SA)的Hoagland溶液预处理1.5 h,然后移入新的含有SA的Hoagland溶液于42℃热处理50 min; (5)浸入含10 mmol L–1H2O2的Hoagland溶液预处理 1.5 h, 然后移入新的含有 H2O2的Hoagland溶液于42℃热处理50 min。取样并以液氮速冻, 同时取28℃下正常生长的幼苗作对照。
1.3 基因克隆与测序
采用上海华舜生物工程公司生产的 RNArose Reagent Systems试剂盒提取总 RNA, 经 DNaseI (TaKaRa, 大连)处理除去残留的基因组 DNA, 然后取1 μg合成cDNA第1链(反转录试剂盒, Invitrogen,美国)。依据玉米 B73基因组信息设计特异引物(正向引物5′-TCCGTTGCCTGATGGCGTTGCC-3′; 反向引物 5′-TCATTTCAGCCCTAGACTGAGGC-3′),利用高保真酶pyrobest (TaKaRa, 大连)进行PCR扩增。PCR反应体系(25 µL)含10×pyrobest buffer 2.5 µL、dNTP mixture (2.5 mmol L–1) 2 µL、1st strand cDNA 2 µL、20 µmol L–1正向引物0.25 µL、20 µmol L–1反向引物 0.25 µL、Pyrobest DNA polymerase 0.25 µL和ddH2O 17.75 µL。反应程序为98℃ 10 s, 55℃ 15 s, 72℃ 2 min, 30个循环。将扩增产物连接T载体后(pEasy-blunt simple cloning kit, TransGen Biotech, 北京), 送上海生工生物工程技术服务有限公司测序。
1.4 qRT-PCR分析
依据Lin等[20]对玉米Hsf的分析合成ZmHsf25的特异引物(正向引物 5'-AGTGAAGCCAATGCTG TTCG-3'; 反向引物 5′-CTTGTTCCTCGTCGTTGTC C-3′), 和玉米内参基因 β-actin的特异性引物(正向引物5′-TGTCCATCACTTGTGAAGCCTCCT-3′; 反向引物5′-ACGACCTTAGCCAATATCGCACCA-3′)。PCR体系(20 µL)含: SYBR Premix Ex TaqII 10 µL、10 µmol L–1正向引物 0.8 µL、10 µmol L–1反向引物0.8 µL、1st strand cDNA 1 µL和ddH2O 7.4 µL。反应在7500 Real-time PCR System (Applied Biosystems, USA)上进行, 反应程序: 预变性95℃ 10 min,变性 95℃ 5 s, 退火/延伸60℃ 1 min, 45个循环。反应结束后, 采用2–ΔΔCt分析数据。每组试验设3个生物学样本, 每个生物学样本设 3次技术重复。数据为3个生物学重复平均值±标准误, 组织表达试验以幼根表达量为1, 其余设置0 min的表达量为1。
1.5 ZmHsf25亚细胞定位观察
带有绿色荧光蛋白(GFP)基因的植物表达载体pJIT163-hGFP (中国科学院遗传与发育生物学研究所范仁春博士提供)通过35S启动子驱动目的基因和GFP基因的融合表达[21], 显示目的蛋白的亚细胞定位。扩增 ZmHsf25编码区, 产物经限制性内切酶Hind III和 BamH I消化后, 连接到表达载体pJIT163-hGFP上。参照李慧聪等[22]方法进行金粉包埋和基因枪转化。经转化的洋葱表皮细胞于22℃暗培养16 h, 然后放入浓度为10 µg mL–1的4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)染色液中染色3~5 min, 用生理盐水冲洗干净, 于激光共聚焦显微镜(Zeiss META510)下观察荧光。
1.6 酵母表达载体构建
酵母表达载体pYES2 (Invitrogen, 美国)用于酿酒酵母中目的蛋白的表达, 其特点在于 GAL1启动子能够在酿酒酵母中被半乳糖高水平诱导从而驱动目的蛋白表达, 同时能够被葡萄糖抑制表达, 可利用URA3基因筛选带有ura3基因型的酵母宿主菌株转化子。结合ClonExpress II重组反应系统(诺唯赞生物科技有限公司)设计扩增 ZmHsf25特异引物(ZmHsf25-F: 5′-GGGAATATTAAGCTTGGTACCAT GGCGTTGCCGGCGGCG-3′; ZmHsf25-R: 5′-TGAT GGATATCTGCAGAATTCTCATTTCAGCCCTAGAC T-3′), 利用高保真 PCR 聚合酶进行扩增, 获得ZmHsf25的PCR产物。利用限制性内切酶Kpn I和EcoR I (NEB)对载体pYES2进行酶切, 电泳后回收得到线性化载体。将PCR产物与线性化载体按1∶2的摩尔比混合, 利用ClonExpress II快速克隆技术进行重组反应。于冰水浴中配制如下反应体系即4 µL 5×ClonExpress II buffer, 50~200 ng线性化载体, 20~200 ng插入片段扩增产物, 2 µL Exnase II, 加无菌水至总体积2 µL。混匀各组分后, 于37℃反应30 min, 立即置冰浴中冷却 5 min, 然后利用热激法将反应产物直接转化大肠杆菌TOP10感受态细胞, 37℃倒置培养过夜。用无菌的牙签将单个菌落挑至100 µL新鲜的LB培养基中, 混匀, 取2 µL作为模板进行PCR扩增, 根据电泳条带大小选择正确的克隆进行序列测定。
1.7 ZmHsf25在酵母中转化及耐热性鉴定
参照 Gietz等[23]的方法, 将测序正确的重组载体转化酵母 INVSc1感受态细胞, 然后将细胞均匀涂抹在SC-Glu-Ura-筛选平板上, 30℃培养2~3 d。采用菌落PCR方法鉴定阳性克隆。
分别将重组载体 ZmHsf25-pYES2和空载体pYES2转化酵母细胞INVSc1, 筛选阳性酵母克隆。分别挑选2个菌系的阳性克隆, 以SC-Glu-Ura-液体培养基振荡(250转 min–1)培养过夜, 检测OD600值。用 SC-Glu-Ura-液体培养基将酵母菌液稀释到 0.2,重新振荡(200转 min–1)培养 2~3 h, OD600值达到0.4~0.8之间即酵母指数生长期, 离心收集菌体, 无菌水洗涤2遍, 除去培养基, 然后梯度稀释到0.10、0.05和0.01共3个OD值, 分成2组, 一组作为对照, 另一组用50℃水浴热激处理45 min。吸取8 μL,分别点在加入半乳糖的 SC-Gal-Ura-固体培养基上, 30℃生长2~3 d, 观察并照相。另外, 将指数生长期的酵母细胞稀释到SC-Gal-Ura-液体培养基中, 分成2组, 一组作为对照, 另一组用 50℃水浴中热激处理45 min, 振荡(200转 min–1)培养24 h, 期间每间隔 3 h测定一次 OD600值, 计算生长速率。采用Microsoft Excel分析数据, 计算标准误差。采用SPSS统计方法分析差异显著性。
2 结果与分析
2.1 玉米热激转录因子基因 ZmHsf25的克隆与结构分析
将二叶一心玉米幼苗于 42℃热胁迫处理 1 h,提取叶片总 RNA, 以此为模板, 利用特异性引物,扩增获得ZmHsf25基因的完整编码序列(图1), 序列全长957 bp, 编码318个氨基酸残基。ZmHsf25蛋白序列包含DNA结合结构域(DNA binding domain, DBD, NCBI网站分析, 下画线部分)、核定位信号序列(nuclear localization signal, NLS, NucPred软件分析)和核输出信号(nuclear export signal, NES, Net-NES软件分析)序列。DNA结合结构域是Hsf的典型结构特征; 根据核定位信号序列推测ZmHsf25被定位于细胞核; 核输出信号序列的存在表明在某些情况下 ZmHsf25可能会穿梭出核发挥功能。利用DNAMAN软件分析表明, ZmHsf25蛋白与高粱Sb060g025710 (序列号为 XP_002446950.1)、谷子SiHSFB-2a-like (序列号为 XP_004976526.1)和水稻OSIGBa0103M18.7 (序列号为 CAH66855.1)的相似性分别为92%、81%和77% (图2)。
2.2 ZmHsf25基因在玉米不同组织器官中的表达分析
通过分析玉米幼苗期和开花盛期不同组织器官中 ZmHsf25的定量表达发现, 正常生长条件下, ZmHsf25在玉米根系中表达最低, 幼嫩花粉中表达量最高, 显著高于其他器官, 达根系的 50倍, 其次是幼胚, 约为根系表达量的10倍(图3)。
2.3 不同逆境胁迫对ZmHsf25表达的影响

图1 玉米ZmHsf25的核苷酸和氨基酸序列Fig. 1 Nucleotide and amino acid sequences of ZmHsf25 from maize下画线部分: Hsf家族保守DNA结合域; NLS: 核定位信号序列; NES: 核输出信号序列。Underline: the conserved DNA binding domain of Hsf family; NLS: nuclear localization signal; NES: nuclear export signal.
42℃热胁迫能显著上调玉米幼苗叶片(图 4-A)和根系(图4-B) ZmHsf25的表达, 处理50 min时达到峰值, 之后逐渐降低, 叶片最大值超过根系的2倍。正常生长条件下, 0.8 mmol L–1SA处理下调玉米根系ZmHsf25的表达(图5-B), 对叶片基因表达影响不大(图5-A); 10 mmol L–1H2O2处理对根系(图6-B)和叶片(图6-A)基因表达均表现为下调, 根系在240 min时恢复至初始值; 如果用 0.8 mmol L–1SA或 10 mmol L–1H2O2分别预处理幼苗1.5 h, 然后热激50 min, 叶片 ZmHsf25的表达被大幅度上调(图 7)。表明在热激条件下ZmHsf25可能参与SA和H2O2介导的信号通路。
2.4 玉米ZmHsf25蛋白的亚细胞定位
构建瞬时表达载体 pJIT163-ZmHsf25-hGFP并转化洋葱内表皮, 通过融合基因表达显示目的蛋白的亚细胞定位。利用激光共聚焦显微镜观察荧光发现, 正常条件下, 观察到 GFP绿色荧光只分布在细胞核, 且与核特异染料DAPI荧光完全重合(图8)。表明ZmHsf25蛋白定位于细胞核。
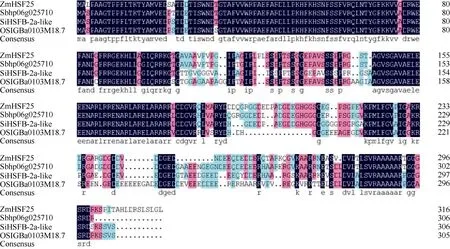
图2 玉米ZmHsf25蛋白与其他蛋白的相似性比较Fig. 2 Alignment of the putative amino acid encoded by ZmHsf25 and other proteins from different species

图3 正常生长条件下幼苗期和开花期不同组织器官中ZmHsf25的相对表达水平Fig. 3 Expression levels of ZmHsf25 in different tissues and organs at seedling and anthesis stages under normal growthconditions每个样本设3次重复, 数据为3个生物学重复平均值±标准误,组织表达试验以幼根表达量为1。There are three replicates for each sample and the data are mean±standard error. The expression level 1 is the expression level in roots.
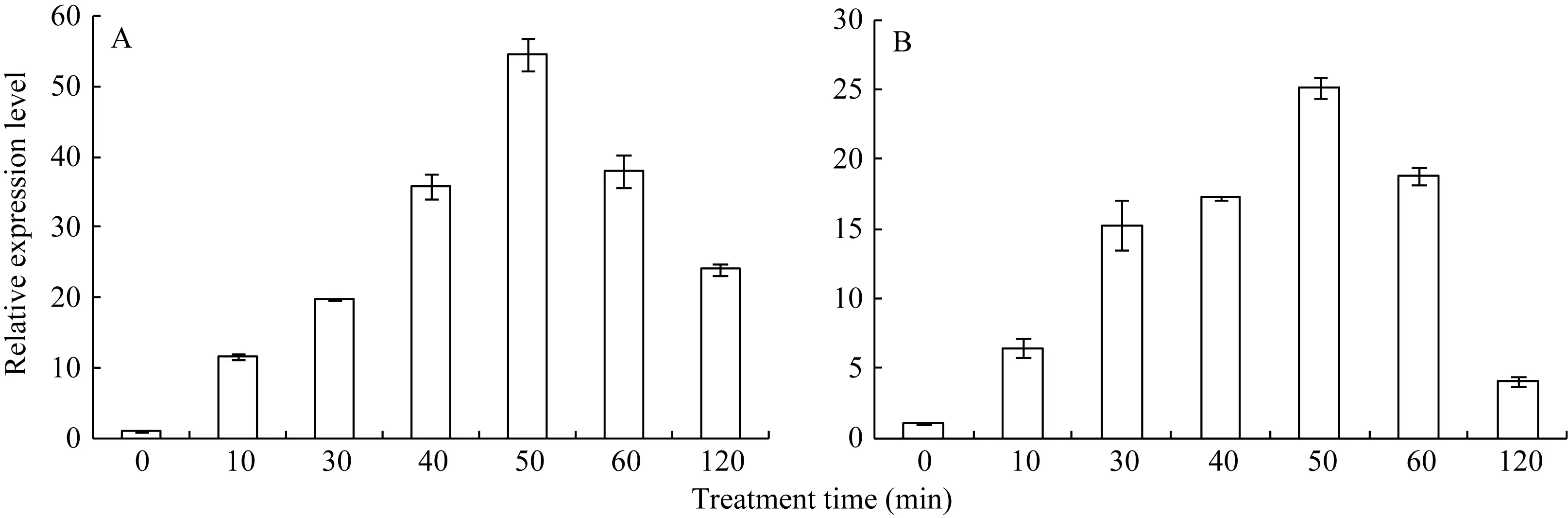
图4 42°C热处理对玉米ZmHsf25表达的影响Fig. 4 Expression levels of ZmHsf25 in leaves and roots of the maize seedlings subjected to heat shock at 42°CA: ZmHsf25在玉米叶片中的表达; B: ZmHsf25在玉米根系中的表达。A: ZmHsf25 expression levels in maize leaves; B: ZmHsf25 expression levels in maize roots.
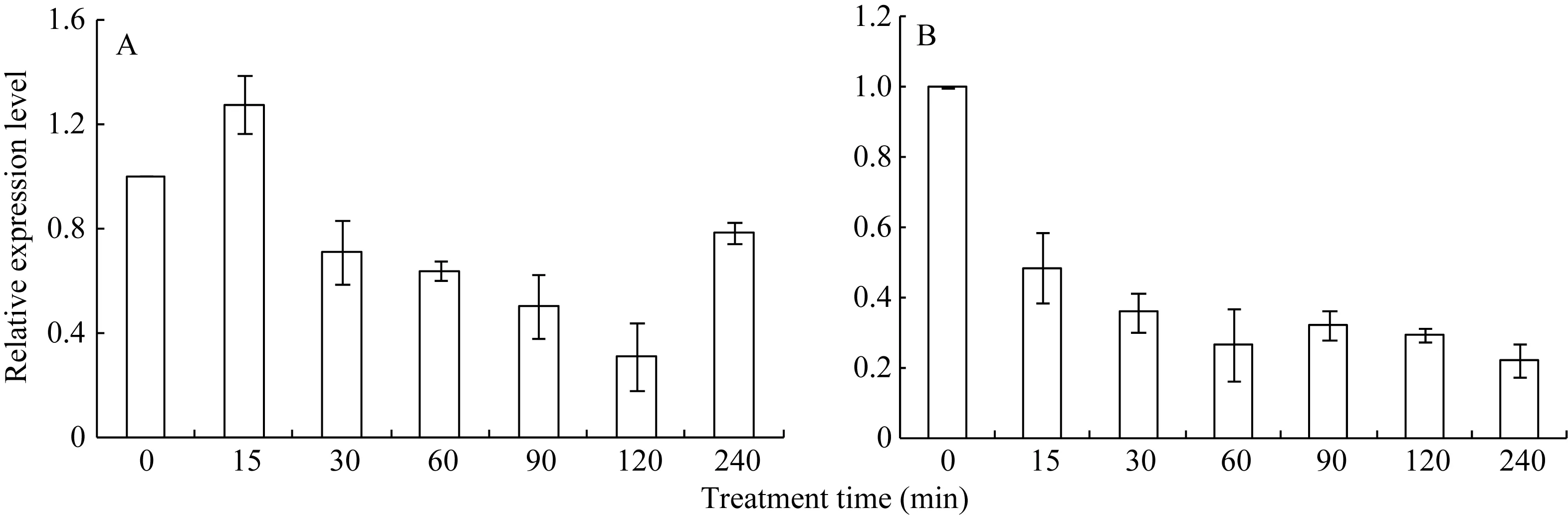
图5 0.8 mmol L–1水杨酸处理对玉米幼苗ZmHsf25表达的影响Fig. 5 Expression levels of ZmHsf25 in leaves and roots of maize seedlings treated with 0.8 mmol L–1SAA: ZmHsf25在玉米叶片中的表达; B: ZmHsf25在玉米根系中的表达。A: ZmHsf25 expression levels in maize leaves; B: ZmHsf25 expression levels in maize roots.
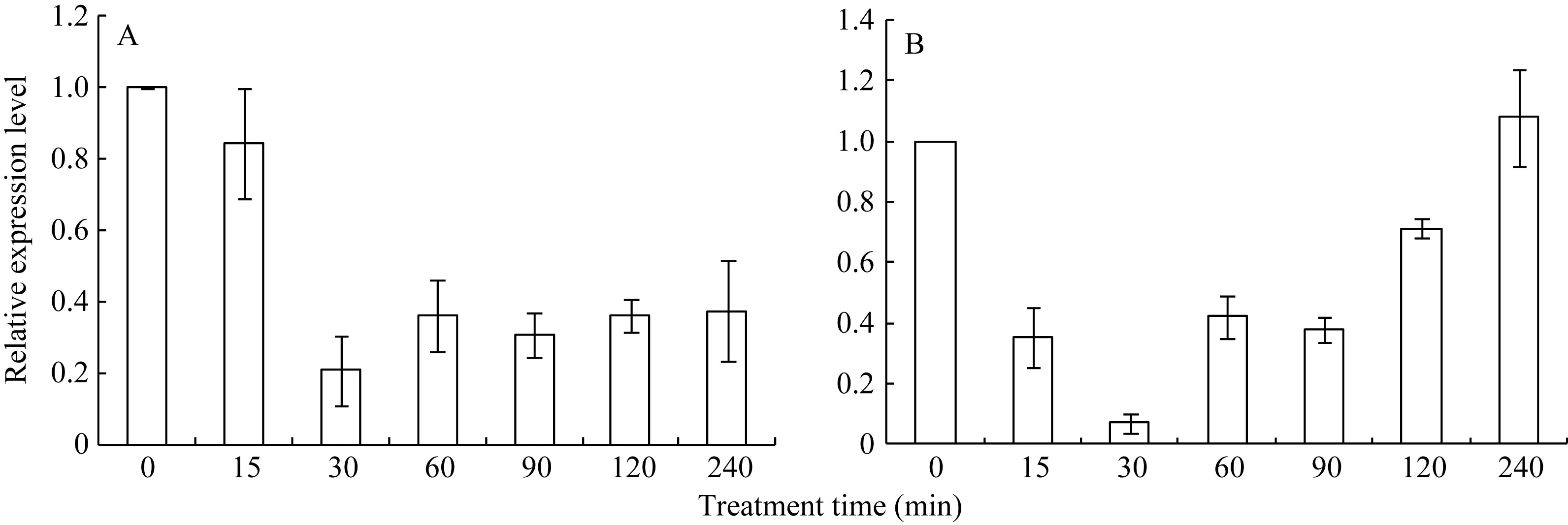
图6 10 mmol L–1H2O2处理对玉米幼苗ZmHsf25表达的影响Fig. 6 Expression levels of ZmHsf25 in leaves and roots of the maize seedlings treated with 10 mmol L–1H2O2A: ZmHsf25在玉米叶片中的表达; B: ZmHsf25在玉米根系中的表达。A: ZmHsf25 expression levels in maize leaves; B: ZmHsf25 expression levels in maize roots.

图7 热激条件下水杨酸和H2O2预处理对玉米叶片ZmHsf25表达的影响Fig. 7 Expression levels of ZmHsf25 in leaves of maize seedlings under heat shock at 42°C pretreated with 0.8 mmol L–1SA and 10 mmol L–1H2O2, respectively
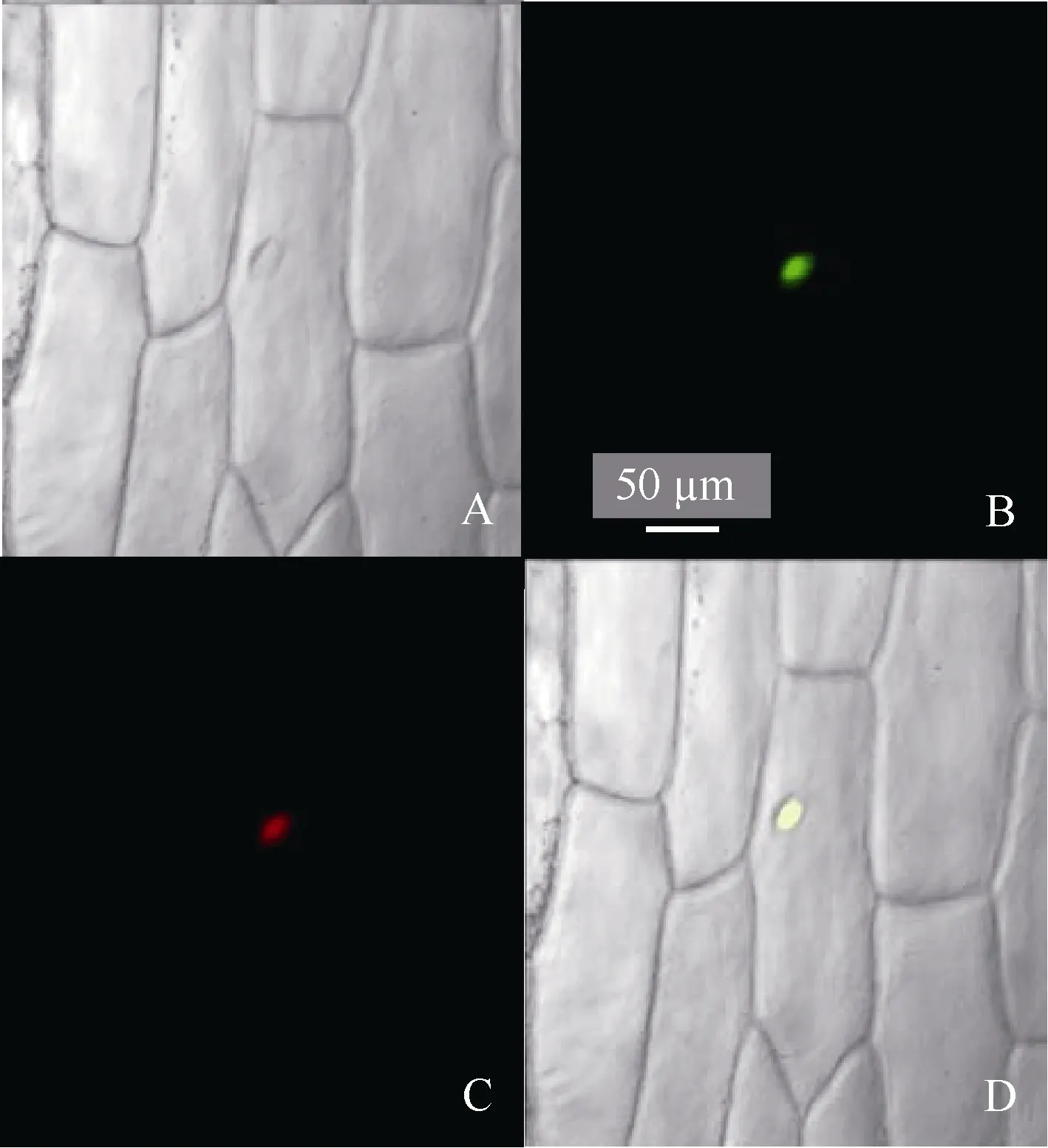
图8 玉米ZmHsf25蛋白质在洋葱表皮细胞中的亚细胞定位Fig. 8 Subcellular localization of ZmHsf25 in onion epidermal cells under normal conditionsA: 明场; B: GFP绿色荧光; C: 细胞核DAPI红色荧光; D: 叠加图像。A: bright field; B: green fluorescence of GFP; C: red fluorescence of DAPI; D: merged images.
2.5 玉米ZmHsf25在酵母中耐热性鉴定
通过将玉米ZmHsf25在酵母中转化并进行热激处理, 观察酵母生长发现, 在正常生长条件下, 在半乳糖诱导固体培养基上, 转化 ZmHsf25与转化空载体pYES2的酵母细胞的长势无明显差异(图9-A);经50℃热激处理45 min后, 转基因酵母细胞和转化空载体对照的生长速度均受到抑制, 但是前者的受抑制程度明显小于后者(图9-B)。酵母细胞生长速率实验结果也充分证明了上述观察结果(图10-A, B)。这表明, ZmHsf25能在酵母细胞中被诱导表达, 且能显著提高酵母细胞的耐热性。
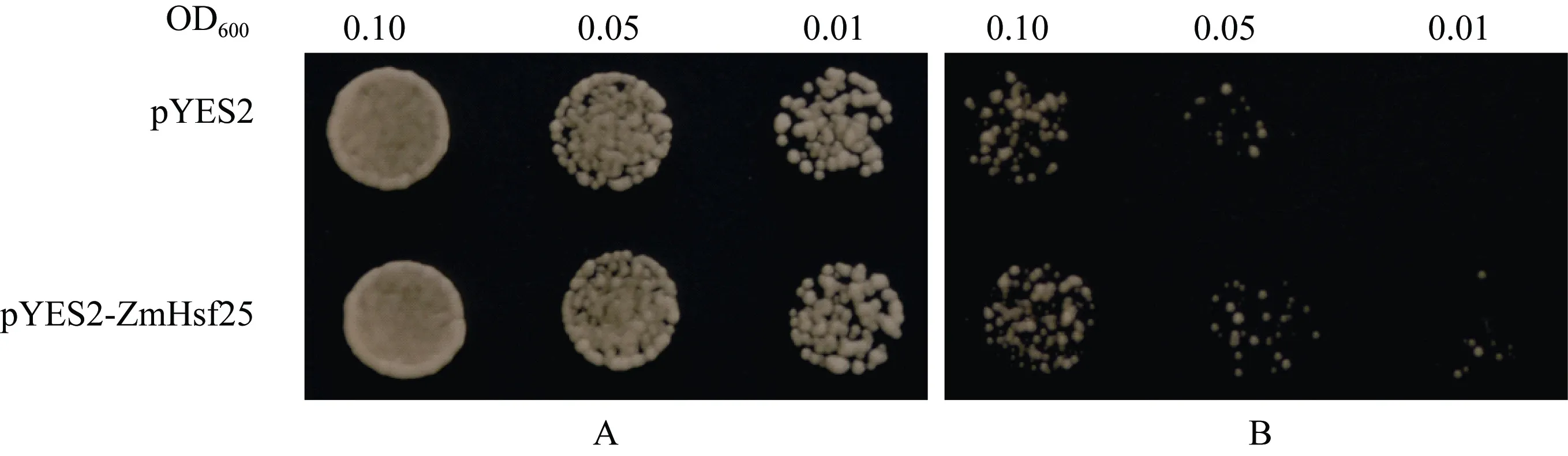
图9 50℃热激处理后转基因酵母耐热性观察Fig. 9 Thermotolerances assay of yeast harboring pYES2 or pYES2-ZmHsf25 after heat shock at 50°CA: 正常培养; B: 50°C热激35 min后正常培养。A: culture under normal conditions; B: culture under normal conditions after HS at 50°C for 45 min.
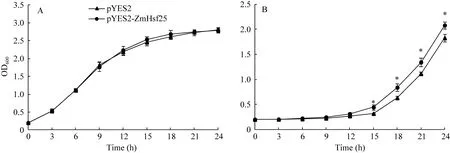
图10 50°C热激处理后转基因酵母生长速率比较Fig. 10 Comparison of growth ratios between yeast harboring pYES2 and pYES2-ZmHsf25 after heat shock at 50°CA: 正常培养; B: 50°C热激15 min后正常培养。A: culture under normal conditions; B: culture under normal conditions after HS at 50°C for 45 min.
3 讨论
植物热激转录因子属于多基因家族, 2011年, Lin等[20]通过生物信息学推测, 玉米有25个家族成员, 2016年, 数目增加为30个[3], 其中B族有7个。关于玉米个体 Hsf功能研究报道不多。本实验室在前期研究玉米A1亚族ZmHsf06的基础上[19,24], 从玉米幼叶中克隆到多个 Hsf, 通过结构分析并与前人推测结果比对, 其中一个属于B族, 为ZmHsf25。进一步分析表明, 该基因完整编码序列为 957个核苷酸, 编码 318个氨基酸残基。蛋白质结构含有完整的DNA结合结构域, 同时含有核定位信号和核输出信号序列, 但不含激活结构域。同源分析表明, ZmHsf25蛋白与高粱Sb060g025710、谷子SiHSFB-2a-like和水稻 OSIGBa0103M18.7的相似性分别为92%、81%和77%。拟南芥、番茄和大豆HsfB1的C末段均含有一段保守序列, 即11个氨基酸GEGLKLFGVWL的BRD抑制域, 为基因HsfB1抑制热诱导基因表达所必需[25-26]。但是, 作为 HsfA1共激活因子, 番茄HsfB1 依赖于 C 末段一段类组氨酸序列(GRGKMMK), 该序列为植物CBP/HAC1的结合位点[27]。可见, C末段氨基酸序列不同导致基因功能的差异性。比对表明, ZmHsf25与番茄和拟南芥HsfB1相似性较低, C末段既不含11个氨基酸的保守序列,也不含类组氨酸序列。那么, ZmHsf25的功能如何有待深入研究。
因B族Hsf不含激活结构域, 早期研究认为其主要起抑制作用[9-10]。随着研究的深入, 越来越多的研究发现, B族Hsf受多种逆境胁迫诱导表达, 从正反方面, 参与植株耐热、抗旱和抗病等多种生物和非生物胁迫及生长发育过程[10-13,28]。非胁迫条件下,拟南芥 HsfB1和 HsfB2b定位在细胞核, 直接抑制HsfA2、HsfA7a、HsfB1和 HsfB2b的表达[10]。从本研究基因定位和表达结果来看, 正常生长条件下, ZmHsf25定位在细胞核, ZmHsf25表达量在多数组织中不高, 但在幼嫩的花粉中显著高于在其他组织中。逆境胁迫下, 基因呈现不同表达谱, 热胁迫能显著上调根系和叶片ZmHsf25的表达, 水杨酸和H2O2处理对根系和叶片ZmHsf25的表达均表现为下调。如果水杨酸和H2O2预处理后再进行热激, 二者均能显著上调ZmHsf25的表达, 表明水杨酸和H2O2在热激条件下才能诱导ZmHsf25大幅度表达。前人研究认为, 水杨酸介导植物耐热性尤其是植株获得耐热性过程[29-30], 水杨酸可在上游调控拟南芥 AtHsfA2的表达, 该过程需要借助 H2O2信号途径, 同时依赖相关热激蛋白基因的表达[31]。这间接表明 ZmHsf25可能是水杨酸热激信号转导过程中的下游组分之一,初步显示出ZmHsf25在植株花粉发育和耐热过程中的调控作用。正常条件下, 水杨酸下调根系ZmHsf25表达, 可能是水杨酸处理浓度较大所致。作为信号分子, 水杨酸在植株体内的存在是极其微量的。
自20世纪80年代后期酵母Hsf被首次克隆以来, 越来越多动植物物种的 Hsf基因被相继获得和注释。酵母中只有1个Hsf, 相对简单, 以酵母为转化系统来验证 Hsf的功能越来越得到应用[32]。本研究通过转化酵母发现, 正常生长条件下, 转基因酵母和正常对照长势没有明显差异; 经 50℃热激处理45 min后, 转基因酵母细胞和转化空载体对照的生长速度均受到抑制, 但是前者的受抑制程度明显小于后者, 表明ZmHsf25能在酵母细胞中被诱导表达,且能显著提高酵母细胞的耐热性, 进一步验证了ZmHsf25的耐热性调控功能。目前正在通过转基因拟南芥植株对ZmHsf25的耐热性功能深入研究。
4 结论
玉米B族热激转录因子基因ZmHsf25的完整编码序列全长957 bp, 编码318个氨基酸残基。蛋白质序列含有DNA结合结构域、核定位信号序列和核输出信号序列。ZmHsf25与高粱Sb06g025710的相似性最高, 达92%。正常生长条件下, ZmHsf25在玉米多个组织器官中表达, 幼嫩花粉中表达量最高。42℃热胁迫能显著上调根系和叶片中ZmHsf25的表达; 正常条件下, 水杨酸和 H2O2处理下调根系和叶片ZmHsf25表达, 而热激条件下却表现为显著上调。ZmHsf25定位在细胞核。转ZmHsf25酵母具有较强的耐热性。ZmHsf25可能主要参与玉米植株花粉发育和热胁迫响应过程, 推测为水杨酸热激信号转导的下游组分之一。
[1] Nover L, Scharf K D, Gagliardi D, Vergne P, Czarnecka-Verner E, Gurley W B. The HSF world: classification and properties of plant heat stress transcription factors. Cell Stress Chaperones, 1996, 1: 215–223
[2] Nover L, Bharti K, Döring P, Mishra S K, Ganguli A, Scharf K D. Arabidopsis and the heat stress transcription factor world: how many heat stress transcription factors do we need. Cell Stress Chaperones, 2001, 6: 177–189
[3] Guo M, Liu H J, Ma X, Luo D X, Gong Z H, Lu M H. The plant heat stress transcription factors (HSFs): structure, regulation and function in response to aboitic stresses. Front Plant Sci, 2016, 7: 114
[4] Scharf K D, Rose S, Zott W. Three tomato genes code for heat stress transcription factors with a region of remarkable homology to the DNA-binding domain of the yeast HSF. EMBO J, 1990, 9: 4495–4501
[5] Xue G P, Sadat S, Drenth J, Mclntyre C L. The heat shock factor family from Triticum aestivum in response to heat and other major abiotic stresses and their role in regulation of heat shock protein genes. J Exp Bot, 2014, 65: 539–557
[6] Liu H C, Charng Y Y. Common and distinct functions of Arabidopsis class A1 and A2 heat shock factors in diverse abiotic stress responses and development. Plant Physiol, 2013, 163: 276–290
[7] Mishra S K, Tripp J, Winkelhaus S, Tschiersch B, Theres K, Nover L, Scharf K D. In the complex family of heat stress transcription factors, HsfA1 has a unique role as master regulator of thermotolerance in tomato. Genes Develop, 2002, 16: 1555–1567
[8] Kotak S, Port M, Ganguli A, Bicker F, von Koskull-Doüring P. Characterization of C-terminal domains of Arabidopsis heat stress transcription factors (Hsfs) and identification of a new signature combination of plant class A Hsfs with AHA and NES motifs essential for activator function and intracellular localization. Plant J, 2004, 39: 98–112
[9] Wunderlich M, Groß-Hardt R, Schöff F. Heat shock factor HSFB2a involved in gametophyte development of Arabidopsis thaliana and its expression is controlled by a heat-inducible long non-coding antisense RNA. Plant Mol Biol, 85: 541–550
[10] Ikeda M, Mitsuda N, Ohme-Takagi M. Arabidopsis HsfB1 and HsfB2b act as repressors for the expression of heat-inducible Hsfs but positively regulate the acquired thermotolerance. Plant Physiol, 2011, 157: 1243–1254
[11] Ma H, Wang C T, Yang B, Cheng H Y, Wang Z, Mijiti A, Ren C, Qu G H, Zhang H, Ma L. CarHSFB2, a Class B heat shock transcription factor, is involved in different developmental processes and various stress responses in chickpea (Cicer arietinum L.). Plant Mol Biol Rep, 2016, 34: 1–14
[12] Kumar M, Busch W, Birke H, Kemmerling B, Nürnberger T, Schöffl F. Heat shock factors HsfB1 and HsfB2b are involved in the regulation of Pdf1.2 expression and pathogen resistance in Arabidopsis. Mol Plant, 2009, 2: 152–165
[13] Zhu X, Thalor S K, Takahashi Y, Berberich T, Kusano T. An inhibitory effect of the sequence-conserved upstream open-reading frame on the translation of the main open-reading frame of HsfB1 transcripts in Arabidopsis. Plant Cell Environ, 2012, 35: 2014–2030
[14] Kolmos E, Chowa B Y, Pruneda-Pazb J L, Kay S A. Kolmos HsfB2b-mediated repression of PRR7 directs abiotic stress responses of the circadian clock. Proc Natl Acad Sci USA, 2014,111: 16173–16177
[15] Bharti K, Von Koskull-Döring P, Bharti S, Kumar P, Tintschlkörbitzer A, Treuter E, Nover L. Tomato heat stress transcription factor HsfB1 represents a novel type of general transcription coactivator with a histone-like motif interacting with HAC1/CBP. Plant Cell, 2004, 16: 1521–1535
[16] Hahn A, Bublak D, Schleiff E, Scharf K D. Crosstalk between Hsp90 and Hsp70 chaperones and heat stress transcription factors in tomato. Plant Cell, 2011, 23: 741–755
[17] Begum T, Reuter R, Schöff F. Overexpression of AtHsfB4 induces specific effects on root development of Arabidopsis. Mech Dev, 2012, 130: 54–60
[18] Mittal D, Chakrabarti S, Sarkar A, Singh A, Grover A. Heat shock factor gene family in rice: genomic organization and transcript expression profiing in response to high temperature, low temperature and oxidative stresses. Plant Physiol Biochem, 2009, 47: 785–795
[19] 李慧聪, 李国良, 郭秀林. 玉米热激转录因子基因 ZmHsf-like对逆境胁迫响应的信号途径. 作物学报, 2014, 40: 622–628
Li H C, Li G L, Guo X L. Signal transduction pathway of ZmHsf-like gene responding to different abiotic stresses. Acta Agron Sin, 2014, 40: 622–628 (in Chinese with English abstract).
[20] Lin Y X, Jiang H Y, Chu Z X, Tang X L, Zhu S W, Cheng B J. Genome-wide identifiation, classifiation and analysis of heat shock transcription factor family in maize. BMC Genomics, 2011, 12: 76–89
[21] Li H X, Fan R C, Li L B, Wei B, Li G L, Gu L Q, Wang X P, Zhang X Q. Identification and characterization of a novel copper transporter gene family TaCT1 in common wheat. Plant Cell Environ, 2014, 37: 1561–1573
[22] 李慧聪, 李国良, 郭秀林. 玉米热激转录因子基因(ZmHsf06)的克隆、表达和定位分析. 农业生物技术学报, 2015, 23: 41–51
Li H C, Li G L, Guo X L. Cloning, expression characteristics and subcellular-location of heat shock transcription factor ZmHsf06 in Zea mays. J Agric Biotechnol, 2015, 23: 41–51 (in Chinese with English abstract).
[23] Gietz D, Jean A S, Woods R A, Schiestl R H. Improved method for high transformation of intact yeast cells. Nucl Acids Res, 1992, 20: 1425
[24] Li H C, Zhang H N, Li G L, Liu Z H, Zhang Y M, Zhang H M. Expression of maize heat shock transcription factor gene ZmHsf06 enhances the thermotolerance and drought-stress tolerance of transgenic Arabidopsis. Funct Plant Biol, 2015, 42: 1080–1090
[25] Czarnecka-Verner E, Pan S, Salem T, Gurley W B. Plant class B HSFs inhibit transcription and exhibit affinity for TFIIB and TBP. Plant Mol Biol, 2004, 56: 57–75
[26] Ikeda M, Ohme-Takagi M. A novel group of transcriptional repressors in Arabidopsis. Plant Cell Physiol, 2009, 50: 970–975
[27] Bharti K, von Koskull-Döring P, Bharti S, Kumar P, Tintschl-Korbitzer A, Treuter E, Nover L. Tomato heat stress transcription factor HsfB1 represents a novel type of general transcription coactivator with a histone-like motif interacting with the plant CREB binding protein ortholog HAC1. Plant Cell, 2004, 16: 1521–1535
[28] Xiang J, Ran J, Zou J, Zhou X, Liu A. Heat shock factor OsHsfB2b negatively regulates drought and salt tolerance in rice. Plant Cell Rep, 2013, 32: 1795–1806
[29] Gaffney T, Friedrich L, Vernooij B, Negrotto D, Nye G, Uknes S, Ward E, Ryals J. Requirement of salicylic acid for the induction of systemic acquired resistance. Science, 1993, 261: 6
[30] Larkindale J, Hall J D, Knight M R, Vierling E. Heat stress phenotypes of Arabidopsis mutants implicate multiple signaling pathways in the acquisition of thermotolerance. Plant Physiol, 2005, 138: 882–886
[31] Snyman M, Cronjé M J. Modulation of heat shock factors accompanies salicylic acid-mediated potentiation of Hsp70 in tomato seedlings. J Exp Bot, 2008, 59: 2125–2132
[32] Ayarpadikannan S, Chung E, Cho C W, So H A, Kim S O, Jeon J M, Kwak M H, Lee S W, Lee J H. Exploration for the salt stress tolerance genes from a salt-treated halophyte, Suaeda asparagoides. Plant Cell Rep, 2012, 31: 35–48
Cloning, Characteristics and Regulating Role in Thermotolerance of Heat Shock Transcription Factor (ZmHsf25) in Zea mays L.
ZHAO Li-Na1,2,**, DUAN Shuo-Nan1,**, ZHANG Hua-Ning1, GUO Xiu-Lin1,*, and LI Guo-Liang1,*1Institute of Genetics and Physiology, Hebei Academy of Agriculture and Forestry Sciences / Plant Genetic Engineering Center of Hebei Province, Shijiazhuang 050051, China;2College of Life Science, Hebei Normal University, Shijiazhuang 050024, China
Heat shock transcription factors (Hsfs) are key components of signal transduction pathways involved in the activation of genes in response to heat shock (HS) stress in plants. There are at least 30 Hsf members in maize and seven of which belong to class B. In our previous work, we obtained ZmHsf06, which belongs to subclass A1, and investigated the characteristics of expression, subcellular localization, and regulating roles in thermotolerance and drought-stress tolerance of ZmHsf06. In the present study, ZmHsf25 was isolated from maize (Zea mays L.) young leaves treated with at 42°C for one hour using homologous cloning methods. The sequencing analysis showed that the coding sequence (CDS) of ZmHsf25 was 957 bp and encoded a protein of 318 amino acids. The amino acid sequence analysis demonstrated that ZmHsf25 contained a DNA-binding domain (DBD), a nuclear localization signal (NLS) of KRLR peptide and a nuclear export signal (NES) of VLTLSV peptide. The identity of amino acid between ZmHsf25 and Sb060g025710 of sorghum was the highest, which was 92%. ZmHsf25 was expressed in multiple tissuesand organs of maize, and transcription expression level of ZmHsf25 was the highest in pollens compared with root, stem, functional leaf, immature embryo and ear. qRT-PCR results showed that ZmHsf25 was up-regulated by 42°C heat shock in both leaves and roots. Under normal conditions, ZmHsf25 was down-regulated by both salicylic acid CSA and H2O2, but significantly up-regulated by heat stress at 42°C. Through transient reporter assay with onion (Allium cepa L.) epidermal cells, we found that ZmHsf25 was localized in nuclei. ZmHsf25 overexpressed yeast showed stronger thermotolerance than the controls after heat shock (HS), though yeast thermotolerances were also decreased by HS. The results revealed that ZmHsf25 perhaps is one of downstream elements of SA signal pathway to play a key role in regulating the response to heat stress and pollen development. These results provide a theoretical basis for analyzing biological characteristics and functions of maize Hsf members further.
Maize; ZmHsf25; Expression; Subcelullar-localization; Thermotolerance
(
): 2016-11-08; Accepted(接受日期): 2017-03-02; Published online(网络出版日期): 2017-03-17.
10.3724/SP.J.1006.2017.01021
本研究由河北省自然科学基金项目(C2017301065), 河北省博士基金项目(2017039349), 渤海粮仓科技工程项目(F16C14001)和河北省高层次人才项目(A201500130)资助。
This study was supported by the Natural Science Foundation of Hebei Province (C2017301065), the Doctoral Foundation of Hebei Province (2017039349), the Bohai Barn Science and Technology Project (F16C14001) and the High-level Talent Project of Hebei Province (A201500130).
*通讯作者(Corresponding authors): 李国良, E-mail: guolianglili@163.com, Tel: 0311-87652127; 郭秀林, E-mail: myhf2002@163.com, Tel: 0311-87269032
**同等贡献(Contributed equally to this work)
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170317.1938.004.html
