3株菌根真菌对海南钻喙兰幼苗生长的影响
2017-07-25陈金花黄素荣杨光穗
陈金花,王 存,黄素荣,杨光穗
(中国热带农业科学院热带作物品种资源研究所/海南省热带观赏植物种质创新利用工程技术研究中心/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州 571737)
3株菌根真菌对海南钻喙兰幼苗生长的影响
陈金花,王 存,黄素荣,杨光穗
(中国热带农业科学院热带作物品种资源研究所/海南省热带观赏植物种质创新利用工程技术研究中心/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州 571737)
为了解菌根真菌对海南钻喙兰(Rhynchostylis gigantea)无菌组培苗生长的影响,研究共生培养90 d后3株菌根真菌对组培苗的鲜重、根数、叶数、叶绿素、蛋白质、核酸、光合特性等指标的影响。结果表明,菌根真菌W01和W02对植株的生长均有促进作用,其中W02显著提高植株的鲜重增长量,W01显著提高了植株可溶性糖、可溶性蛋白与核酸含量,S01对植株有致病性;海南钻喙兰的光合途径含有CAM途径,为兼性CAM植物,接种W01处理的植株其叶绿素a+b含量显著高于对照,并提升了植株的光合能力。
菌根真菌;光合特性;海南钻喙兰
根据对碳源利用方式的不同,兰科植物常被划分为3种类型:光合营养型(Autotrophy,AT)、混合营养型(Mixotrophy,MX)和完全菌根异养型(Myco-hetero-trophy,MH)[1]。营养类型从自养到部分异养再到完全菌根异养的变化过程中,共生真菌的类群也从丝核菌逐渐变化成ECM菌(蜡壳耳目、红菇科、革菌科和灰珊瑚科等)[2-3]。目前兰科植物的营养策略研究越来越清晰,通过同位素追踪技术证实,菌根真菌可为植株提供大量的碳水化合物。此外,菌根真菌为植物提供营养还有另外一种途径即侵入植物细胞后被同化为植物生长发育的营养。研究显示,菌根真菌能利用更多种碳源,并在人工培养下利用可溶性碳水化合物,如单糖、蔗糖、麦芽糖;有些真菌还能产生水解酶分解比较复杂的碳水化合物,如淀粉、腐殖酸、木糖、纤维素、木质素、蛋白质及分解产物。针对兰科植物共生理论和应用学者们开展了许多研究,通过人为提供共生条件以提高兰科植物组培苗的成活率[1]和生长速度,增强幼苗的抗性,增加生长所需的营养物质、维生素和激素类物质等[4-9],提高对无机离子的利用、增强兰科植物的抗性和兰科群落的生态功能[10]。可见,在兰科植物的种苗繁育技术中加入菌根技术不但具有潜在的经济价值,还有巨大的生态价值[11]。
高等植物的碳同化途径分为C3、C4和CAM 三大途径,CAM途径最早在景天科植物中发现,是CAM植物对干旱环境的一种生理生态适应,因植物夜间气孔打开固定CO2的特殊性,一直被认为是碳同化途径中的少数形式[12]。CAM植物包括专性CAM和兼性CAM类型,因基因类型、个体发育、环境条件等不同而表现出不同的代谢特点[13-14]。对兼性CAM植物来说,其光合碳同化途径可在CAM和C3途径中转化,有的仅几个小时即可完成[15],如铁皮石斛、萼脊兰[16-17]。这种机制是植物利用其特色的光合途径转化以适应环境,有利于储藏水分,减少蒸腾作用,提高水分利用率。研究显示,兰科植物形态与光合特性有一定的相关性,但是品种和环境因子也会对其光合特性造成影响。叶片肉质厚的兰花多表现为CAM途径,如蝴蝶兰、五唇兰、美花石斛等[13,18-19],而叶片薄的兰花多表现为C3途径,如春兰、剑兰、春剑、墨兰、蕙兰、玫瑰石斛、流苏石斛[13,20]等。但是,在相同研究条件下报春石斛表现为CAM光合途径,鼓槌石斛表现为C3光合途径,金钗石斛表现为兼性CAM途径[21],而在其他研究中鼓槌石斛却表现出兼性CAM植物的特性[13]。
海南钻喙兰(Rhynchostylis gigantea)又称安诺兰、狐尾兰,是海南特有种,生长在约海拔1 000 m高的森林树干上,为热带气生兰。海南钻喙兰叶片翠绿,花色秀丽有香气,且其适应性强,易种植,又在春节开花,可作为新春贺岁花卉,深受人们喜爱。有关海南钻喙兰的研究报道不多,主要集中在资源调查、栽培技术、遗传特性、圆球茎形态建成和基因克隆等方面[22-26],在菌根学方面的研究还未见报道。本试验以海南钻喙兰无菌组培苗为材料,接种从热带兰植株上分离得到的3株菌根真菌,共生90 d后,以平均鲜重增长率、根数、叶数、核酸及蛋白质含量、叶绿素含量为考察指标,以期筛选出能促进其生长发育的最佳菌株,为海南钻喙兰及其他兰科植物的人工化栽培提供依据,为海南热带兰光合特性的研究提供参考。
1 材料与方法
1.1 试验材料
选取具1~3条根、2~4片叶的海南钻喙兰无菌组培苗;菌根真菌分别为W01、W02、S01。
1.2 试验方法
DE培养基的配制按照经典配方进行配制[27]。接种真菌的准备:将3株菌根真菌在PDA培养基26℃暗培养7 d后,用直径0.5 cm打孔器打孔备用。
组培苗菌根化:去除无菌组培苗根部的培养基和黄叶后,在电子天平上秤取鲜重,精确到0.0001 g,接种到培养基上,每瓶4株。培养7 d观察无污染后接种菌根真菌。用接种针轻轻挑取菌饼接种到植株中间,每瓶接种1个菌饼,以不接菌株为对照。25(±2)℃、3 000 lx条件下培养90 d后,对组培苗进行鲜重增长率、根数与叶数、可溶性糖、淀粉、可溶性蛋白含量、核酸和叶绿素的测定,光照时间12 h/d,每个处理30株植株。
海南钻喙兰鲜重增长量:海南钻喙兰鲜重增长量=处理后鲜重-处理前鲜重。
用蒽酮比色法[28]测定海南钻喙兰组培苗叶片中可溶性糖含量;用考马斯亮蓝染色法[29]测定海南钻喙兰组培苗叶片中可溶性蛋白含量;用80%乙醇加高氯酸测定海南钻喙兰组培苗叶片中核酸含量,用丙酮法测定海南钻喙兰组培苗叶片中的叶绿素含量[30]。光合作用日变化测定:采用Li-6400便携式光合测定仪,选择顶叶下的第2片叶(功能叶)对其光合速率、气孔导度、胞间CO2、蒸腾速率进行测定,每组处理选取具有代表性的植株2株,3次重复,在晴天上午8:00开始,每2 h测定1次。
1.3 统计分析
所测数据用Excel软件进行初步处理,采用SAS 9.0软件分析。
2 结果与分析
2.1 菌根真菌对海南钻喙兰组培苗鲜重和形态指标的影响
共生培养90 d后,发现3种真菌对海南钻喙兰组培苗的生长都有不同影响(图1,封二)。其中菌根真菌W01、W02对植株无致病性,并对幼苗的生长有积极促进作用,植株生长旺盛,而菌根真菌S01对海南钻喙兰却有明显的致病性,植株变黄并逐渐腐烂死亡。方差分析结果显示,菌根真菌W02对海南钻喙兰组培苗鲜重量达到显著水平,为0.70 g。接种W01的处理,增长量为0.45 g,虽然比对照增长量高,但并未达到显著水平(表1)。菌根真菌对植株根和叶片的影响不是很大,根的增加数和叶片增加数与对照之间均未达到显著水平。
2.2 菌根真菌对海南钻喙兰组培苗可溶性糖、可溶性蛋白和核酸含量的影响
从表1可以看出,接种菌根真菌W01、W02的植株除可溶性蛋白含量外,可溶性糖含量与核酸含量均显著高于对照,两者之间达到显著水平。接种W01的处理其可溶性糖含量、可溶性蛋白含量和核酸含量都最高,分别为1.3872、0.5135 mg/g和2.2244 μg/g,显著高于对照。接种W02的处理,其可溶性糖含量和核酸含量也显著高于对照,但可溶性蛋白含量却显著低于对照。

表1 菌根真菌对海南钻喙兰组培苗可溶性糖、可溶性蛋白和核酸含量的影响
2.3 菌根真菌对海南钻喙兰组培苗光合生理的影响
光合色素含量高低是植株光合能力大小的直接反映。在5%显著水平下,菌株W01可显著提高植株叶绿素a+b含量、达2.7052 mg/g,接种W02处理的叶绿素a+b含量为2.1624 mg/g,与对照间差异不显著。
海南钻喙兰是兼性CAM植物。从图2可以看出,海南钻喙兰组培苗的净光合速率均较低,其光合能力也较弱。接种菌根真菌后,植株的光合能力明显提高,以接种W01菌株的植株光合能力最强,其次是接种W02的植株。接菌处理除了提高植株光合能力外,对净光合速率的日变化趋势有一定影响。由图2、图3可知,净
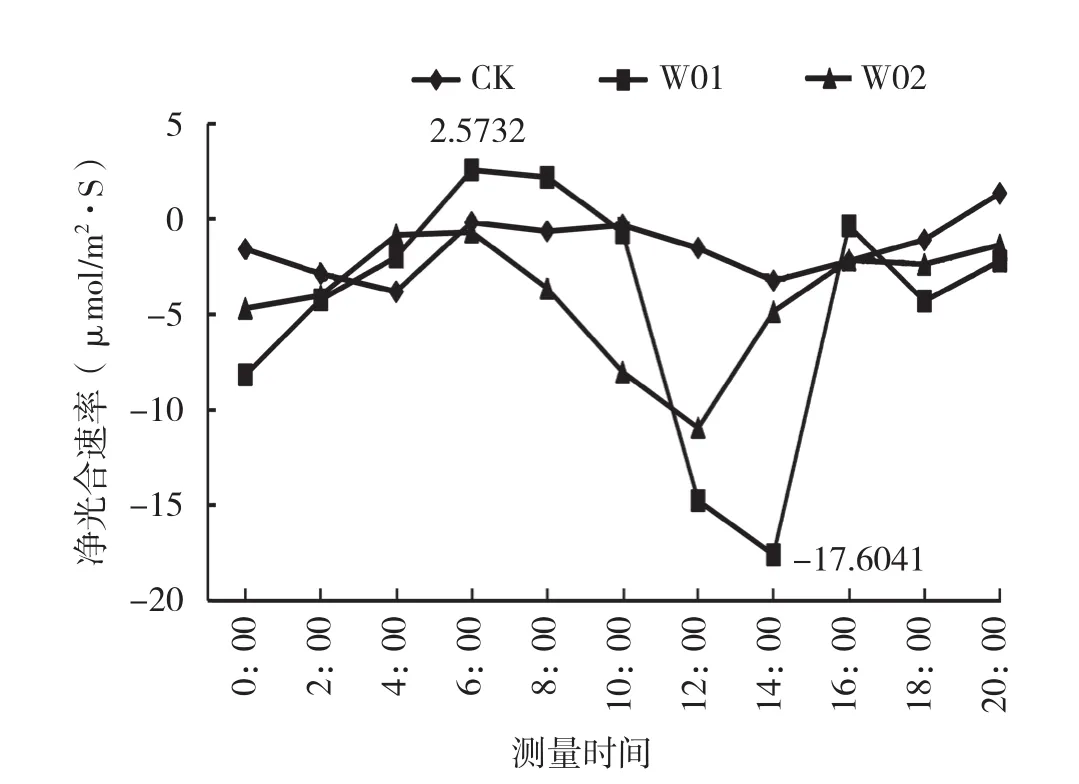
图2 接菌对海南钻喙兰组培苗净光合速率日变化的影响
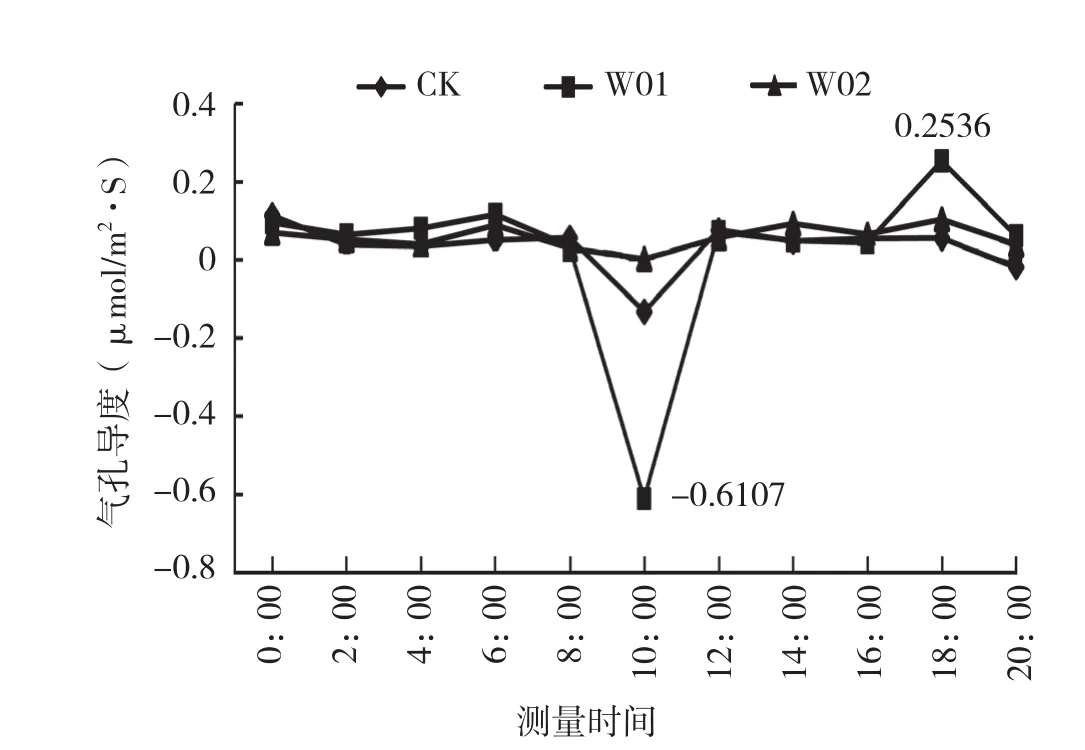
图3 接菌对海南钻喙兰组培苗气孔导度的影响
光合速率和气孔导度第1个高峰出现在6:00,此时接种W01处理的植株净光合速率达2.5732 μmol/m2·s,接种W02植株和对照的净光合速率分别为-0.6785、-0.1770 μmol/m2·s。6:00后,净光合速率下降后又回升,第2个高峰出现的时间不同,但都在16:00后。8:00组培室开灯后,由于光强抑制,植株的气孔关闭,净光合速率为负值。说明海南钻喙兰的光合途径应具有C3和属景天酸代谢两种途径。气孔导度在上午10:00达到最低,气孔的关闭阻碍了蒸腾,蒸腾速率也达到最低。胞间CO2浓度经过一段时间的积累,14:00达到最大,为5 454.8129 μg/g,胞间有大量的CO2积累(图4)。16:00以后,气孔导度逐渐增大,到18:00时达到最高,气孔打开,胞间CO2浓度急剧降低,蒸腾速度也增高(图5)。
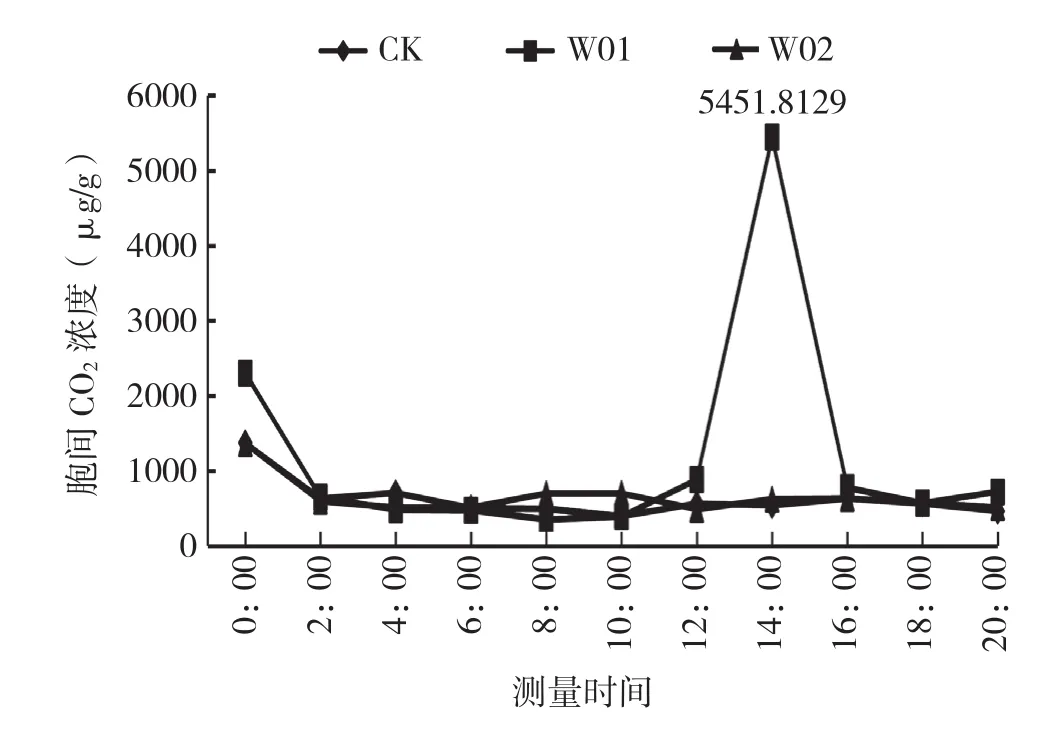
图4 接菌对海南钻喙兰组培苗胞间CO2浓度的影响
4 结论与讨论
4.1 菌根真菌的专一性
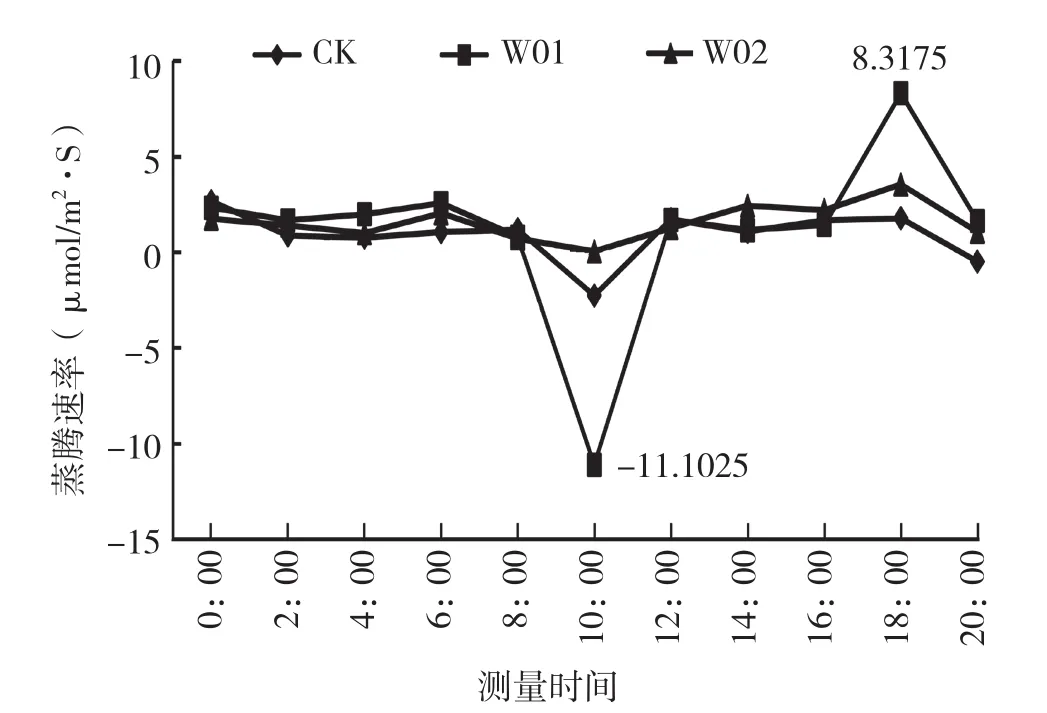
图5 接菌对海南钻喙兰组培苗蒸腾速率的影响
关于兰科菌根真菌专一性问题学术界经过了长期激烈的争论。目前公认专一性分为生态专一性和潜在专一性,真菌与兰科植物在自然条件和实验室条件下表现出不同的专一性:在自然条件下表现的专一性较高,而在实验室条件下专一性却不是特别严格[31]。已有研究证实,铁皮石斛幼苗在接种其他兰科植物的菌株后,生长旺盛,平均鲜重增长率均显著高于对照,对其生长有明显的促进作用[32-33]。
本试验中,W01、W02两种菌根真菌对海南钻喙兰组培苗的生长有积极的促进作用,而菌根真菌S01对海南钻喙兰组培苗有明显的致病性。其中菌根真菌W01分离自野生五唇兰,菌根真菌W02分离自黄花美冠兰,而S01分离自密花石斛,可见W01、W02与海南钻喙兰组培苗并未表现出高度的专一性。在墨兰菌根真菌的研究中也显示,并非所有的根菌真菌都能促进无菌的组培苗生长[34]。杨友联等[35]也得出相同结论:将独蒜兰的6株菌根真菌接种到环草石斛组培苗上发现,6株菌根真菌都能与环草石斛形成菌根结构,无严格的专一性;但仅有4株菌株能促进环草石斛的生长。
4.2 菌根真菌对海南钻喙兰生长的影响
据报道,部分兰科菌根真菌能不同程度地产生一种或几种植物激素或维生素促进植物生长,而不同激素在植物生长发育中的作用机制不同,这可能是不同菌株处理苗在增重率和根数、叶数增长等指标上存在差异的原因[36-37],当然菌根真菌对宿主细胞的侵染与菌根真菌的生理活性也有关[38]。本试验中,接种菌根真菌W01、W02可提高海南钻喙兰的的鲜重,但对根数、叶数与对照组相比没有明显差别,这可能是菌株本身的原因,也可能是培养时间太短的原因。除可溶性蛋白含量外,菌根真菌均显著提高了植株的可溶性糖和核酸含量,其中菌根真菌W01比菌根真菌W02作用效果更好,这与光合色素和光合速率的提高结果是一致的。对金钗石斛无菌苗的研究表明,4种内生真菌对金钗石斛的影响各不相同,有的抑制金钗石斛生长,有的促进生长,但促进的程度和能力也有差别[39]。
4.3 菌根真菌对海南钻喙兰组培苗光合生理的作用
叶绿素是植物光合作用的基础色素,植物通过叶绿素对光能的吸收、传递和转化来进行光合作用,叶绿素含量的高低也反映了植物光合能力强弱。研究发现,内生真菌可提高兰科植物的叶绿素含量,从而增强植物的光合作用,促进植物生长[40-43]。本研究中,接种W01、W02都可提高植株叶绿素含量,其中接种W01植株的叶绿素a+b含量达显著水平,光合速率的提高也很明显,该结论在五唇兰、铁皮石斛的研究上也得到了证实。李洪立等[44]将分离自野生五唇兰根部的菌根真菌接种到五唇兰无菌组培苗,发现光合能力也得到显著提高。在铁皮石斛的研究中,不仅证实了菌根真菌S01和S02能显著增强组培苗的光合能力,还通过同位素追踪技术观察到均根真菌侵染植株的过程[41]。有研究者还分析了添加硝酸镧后接种OM真菌对铁皮石斛幼苗叶绿素含量的影响,结果显示添加一定浓度的硝酸镧可显著增强OM真菌对叶绿素含量的促进作用[43]。在兰科植物与菌根真菌的共生研究中,通过添加稀土元素来提高微生物的生物活性,从而提高菌根真菌对植物生理生长特性的促进作用,将是未来研究的方向之一。
海南钻喙兰同时具有C3光合途径和CAM途径,是兼性CAM植物。在兰科植物中,这样的植物也有许多,如华石斛、五唇兰、香荚兰、萼脊兰等[25,27-29,45],除兰科植物外,景天科、番杏科、凤梨科植物中也有此类特性[46-48]。这与海南钻喙兰自身的特性相关,是其响应环境的机制之一。
[1] Dearnaley J D W,Martos F,Selosse M A.12 Orchid mycorrhizas:Molecular Ecology,Physiology,Evolution and Conservation Aspects[J]. Mycota,2012(9):207-230.
[2] 孙锐,李标,郭顺星. 腐生型兰科植物研究进展[J]. 广西植物,2017,37(2):191-203.
[3] Lee Y I,Yang C K,Gebauer G. The importance of associations with saprotrophic non-Rhizoctonia fungi among fully mycohetero-trophic orchids is currently under-estimated:novel evidence from sub-tropical Asia[J]. Annals of Botany,116(3):423-435.
[4] Zettler L W,Piskin K A,Stewart S L,et al. Protocorm mycobionts of the Federally threatened eastern praifie fringed orchid,Platanthera leucophaea(Nutt.) Lindley,and a technique to prompt leaf elongation in seedings[J]. Studies in Mycology,2005,53(1):163-171.
[5] Ramsay M M,Dixon K W. Opagation science,recovery and translocation of terrestrial orchids[M]//Dixon K W,Kell S P,Barrett R L,Cribb P J. Orchid Conservation. Kota Kinabalu Sabah:Natural History Publications(Bomeo),2003.
[6] Chang D C N,Chou L C. Seed germination of Haemaria discolor var.dawsoniana and the use of mycorrhizae[J]. Symbiosis,2001,30(1):29-40.
[7] Andersson S,Jensen P,Soderstrom B. Effects of mycorrhizal colonization by Paxillus involutus on uptake of Ca and P by Picea abies and Betula pendula grown in unlimed and limed peat[J]. New Phytologist,1996,133(4):695-704.
[8] Harvais G,Hadley G.The relation between host and endophyte in orchid mycorrhiza[J]. New Phytologist,1967,66(2):205-215.
[9] 吴静萍,钱吉,郑师章. 兰花菌根菌分泌物成分的初步分析[J]. 应用生态学报,2002,13(7):845-848.
[10] 刘润进,唐明,陈应龙. 菌根真菌与植物抗逆性研究进展[J]. 菌物研究,2014,15(1):70-87.
[11] 李景蕻,张丽华. 药用兰科植物组培苗菌根技术在种苗生产中的应用[J]. 种子,2015,34(8):133-134.
[12] Luttge U. Ecophysiology of Crassulacean Acid Metabolism(CAM)[J]. Ann Bot,2004,93(6):629-652.
[13] 刘张栋. 石斛属植物C3/CAM代谢转换中形态结构及生理生化转变研究[D]. 武汉:华中农业大学,2014.
[14] 张玲菊,高亭亭,章晓玲,等. 5个种源铁皮石斛的光合特性[J]. 浙江农林大学学报,2013,30(3):359-363.
[15] Gawronska K,Romanowska E,Miszalski Z,et al.Limitation of C3-CAM shift in the common ice plant under high irradiance[J]. Journal of Plant Physiology,2013,170(2):129-135.
[16] 苏文华,张光飞. 铁皮石斛叶片光合作用的碳代谢途径[J]. 植物生态学报,2003,27(5):631-637.
[17] 许申平,蒋素华,梁芳,等. 萼脊兰光合特性的初步研究[J]. 热带作物学报,2016,37(6):1081-1085.
[18] 许申平,曾兰婷,叶庆生. 长期增施CO2对蝴蝶兰生长于开花的影响[J]. 园艺学报,2015,42(8):1-7.
[19] 朱国鹏,李凤,宋希强,杨福孙. 五唇兰两种生态型的光合特性研究[J]. 热带作物学报,2010(12):2193-2197.
[20] 李鹏民,高辉远,邹琦,等. 5种国兰(Cymbidium)的光合特性[J]. 园艺学报,2005,32(10):151-154.
[21] 任建武,王兴枝,杨丽娜,等. 3种石斛叶绿素荧光、碳同化、气孔联动关系研究[J]. 北京林业大学学报,2011,33(6):166-172.
[22] 颜平,黄明忠,杨光穗,等. 海南钻喙兰种质资源现状调查[J]. 广东农业科学,2015,42(5):24-30.
[23] 张俊芳,李志英,徐立. 海南钻喙兰B类MADS-box基因的克隆与表达分析[J]. 分子植物育种,2013,11(4):571-574.
[24] Obsuwan K,Yoodee S,Uthairatanakij A,et al. Application of chitosan on in vitro growth of Rhynchostylis gigantea protocorms and seedlings.[J]. Acta Horticulturae,2010,878(878):283-288.
[25] Van L B,Anh Hong,L T ;Thanh V K,et al. High frequency shoot regeneration fromRhynchostylis gigantea(orchidaceae) using thin cell layers[J]. Plant Growth Regulation 1999,28(3):179-185.
[26] 颜平,黄明忠,陆顺教,等. 基于SRAP标记的海南钻喙兰种质资源遗传多样性分析[J]. 热带作物学报,2014,35(9):1677-1682.
[27] Dijk E,Eck N D. Effects of mycorrhizal fungi on in vitro nitrogen response of some Dutch indigenous orchid species[J]. Can J Bot,1995,73(8):1203-1211.
[28] 翁霞,辛广,李云霞. 蒽酮比色法测定马铃薯淀粉总糖的条件研究[J]. 食品研究与开发,2013(17):86-88.
[29] 杨正坤,王秀丽,龙施华,等. 考马斯亮蓝染色法测定大豆茎叶中蛋白质含量[J]. 湖北农业科学,2012(20):4610-4612.
[30] 高凤俊. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[31] Masuhara G,Katsuya K. In situ in vitro specificity betweenRhizoctoniaspp. AndSpiranthws sinensis(Persoon)Ames. Var.amoena(M. Bieberstein)Hara(Orchidaceae)[J]. New Phytologist,1997,127:711-718.
[32] 金辉,亢志华,陈晖,韩素芬. 菌根真菌对铁皮石斛生长和矿质元素的影响[J]. 福建林学院学报,2007,27(1):80-83.
[33] 郭顺星,曹文岑,高薇薇. 铁皮石斛及金钗石斛菌根真菌的分离及其生物活性测定[J]. 中国中药杂志,2000,25(6):338-340.
[34] 黄磊,贺筱蓉,郑立明,等. 促进兰花组培苗生长的墨兰菌根真菌研究初报[J]. 热带作物学报,2004(1):36-38.
[35] 杨友联,刘作易,朱国胜,等. 独蒜兰菌根真菌对环草石斛生长的影响[J]. 种子,2008(1):34-37.
[36] 张集慧,王春兰,郭顺星,等. 兰科药用植物的5种内生真菌产生的植物激素[J]. 中国医学科学院学报,1999,21(6):460-465.
[37] 吴静萍,钱吉,郑师章. 兰花菌根菌分泌物成分的初步分析[J]. 应用生态学报,2002,13(7):845-848.
[38] Labidi S,Calonne M,Jeddi F B,et al. Calcareous impact on arbuscular mycorrhiza developmengt and on lipid peroxidation in monoxenic roots[J]. Phytochemistry,2011,72(18):2335-2341.
[39] 陈晓梅,郭顺星. 4种内生真菌对金钗石斛无菌苗生长及其多糖和总生物碱含量的影响[J].中国中药杂志,2005,30(4):253-256.
[40] 罗在柒. 金钗石斛与环草石斛内生真菌的筛选及其对宿主的生理生态效应[D]. 贵阳:贵州师范大学,2005.
[41] Wang Q X,Yan N,Ji D G,et al. In vitro growth and carbon utilization of the green-leaved orchid Dendrobium officinale are promoted by mycorrhical associations[J]. Botanical Studies,2013,54(23):7-9.
[42] 周玉杰,杨福孙,宋希强,等. 菌根真菌对华石斛幼苗生长及光合性能的影响[J]. 北方园艺,2009(12):11-15.
[43] 魏明,杨超英,孔芳,等. 硝酸镧和兰科菌根真菌对铁皮石斛生理特性的影响[J]. 西北植物学报,2015,35(2):309-314.
[44] 李洪立,何云,申志斌,等. 菌根化五唇兰组培苗的光合生理特性[J]. 热带作物学报,2011,32(6):1060-1063.
[45] 梁斌. 光对香荚兰生理、生长的影响[D]. 昆明:云南大学,2001:4.
[46] Lin Z F,Peng C L,Lin G Z. Photooxidation in leaves of faculatative CAM plant sedum spectabile at C3 and CAM mode[J]. Acta Botanica Sinica,2003,45(3):301-306.
[47] Paul M J,Cockburm W. The stimulation of CAM activity inMesembryanthemum crystallinumin nitrate and phosphate-deficient conditions[J]. New Phytologist,1990,14(3):391-398.
[48] Aragón C,Carvalho L,González J,et al. The physiology of exbitro pineapple(Ananas comosusL. Merr. Var MD-2)as CAM or C3 is regulated by the environmental conditions[J]. Plant Cell Reports,2012,31(4):757-769.
(责任编辑 白雪娜)
Effects of three kinds of mycorrhizal fungi on growth of Rhynchostylis gigantea seedling
CHEN Jin-hua,WANG Cun,HUANG Su-rong,YANG Guang-sui
(Tropicl Crops Genetic Resoures Institute,Chinese Academy of Tropical Agricultural Sciences/ The Engineering Technology Research Center of Tropical Ornamental Plant Germplasm Innovation and Utilization,Hainanprovince/Key laboratory of Corp Gene Resources and Germplasm Enhancement in Southern China,Danzhou 571737,China)
In order to study the effects of three kinds of mycorrhizal fungi on growth ofRhynchostylis giganteaseedling,we analyzed the morphological index,nutrient content and photosynthetic capacity after inculating for 90 d. Results showed that,compared with the control group,mycorrhizal fungi increased the fresh weitht;W01 and W02 had promoting effect on the growth of plants,W02 significantly increased plant fresh weight;W01 significantly increased the soluble sugar,soluble protein and nucleic acid content. S01 had pathogenicity toR. giganteaseedling. Photosynthetic pathway ofR. giganteanwas Crassulacean acid metabolism. The chlorophyll a+b content of plant inoculated W01 was significantly higher than that of control. W01 enhanced the photosynthetic rate of seedling.
mycorrhizal fungi;photosynthetic characteristics;Rhynchostylis gigantean

S682.31
A
1004-874X(2017)04-0046-07
陈金花,王存,黄素荣,等. 3株菌根真菌对海南钻喙兰幼苗生长的影响[J].广东农业科学,2017,44(4):46-52.
2017-02-13
海南省自然科学基金(20153114);中央级公益性科技研院所基本科研业务费专项(1630032 014027);农业公益性行业科研专项(201203071)
陈金花(1982-),女,硕士,助理研究员,E-mail:13976076546@163.com
杨光穗(1972-),女,硕士,副研究员,E-mail:602590140@qq.com
