凝胶法测定脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液中的细菌内毒素
2017-07-25王文佳陈志明张纳敏周梦颖何华红李薇广州市药品检验所广州510160
王文佳,陈志明,张纳敏,周梦颖,何华红,李薇(广州市药品检验所,广州510160)
凝胶法测定脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液中的细菌内毒素
王文佳*,陈志明,张纳敏,周梦颖,何华红,李薇#(广州市药品检验所,广州510160)
目的:采用凝胶法测定脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液中的细菌内毒素。方法:依据2015年版《中国药典》(四部)“细菌内毒素检查法”项下凝胶法,通过干扰试验确定样品最大有效稀释倍数,并进行方法学验证;将检测结果与显色基质法比较。结果:凝胶法中供试品溶液稀释24倍或以下时对鲎试剂与细菌内毒素的凝集反应无干扰作用,而显色基质法则为稀释76倍或以下。结论:凝胶法可用于脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液的细菌内毒素检查。
脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液;细菌内毒素;凝胶法;干扰试验;显色基质法
脂肪乳氨基酸-葡萄糖注射液为国家基本药物之一,作为静脉补给能量制剂,应用越来越广泛[1]。目前,2015年版《中国药典》并未收录脂肪乳/氨基酸/葡萄糖注射液品种,尚无国家标准细菌内毒素法,也尚无行业标准,现企业多采用显色基质法(Kinetic chromogenic assay,KCA)进行测定。凝胶法虽灵敏度不如光度法[2],但操作简单、经济,适用范围广,受干扰小,是我国法定的仲裁检验方法。
脂肪乳作为脂溶性的药物载体[3],其离子对凝胶法有很强的干扰作用;氨基酸注射液的凝胶试验亦有干扰作用[4],十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)是助溶的表面活性剂[5],本试验拟使用SDS溶液对脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液进行稀释以增强脂肪乳的稳定性,消除干扰作用,并依据2015年版《中国药典》(四部)“细菌内毒素检查法”项下凝胶法测定该制剂中的细菌内毒素,以期为完善该制剂的质量控制提供参考。
1 材料
1.1 仪器
TW 12型水浴锅(德国Julabo公司);LK164-03型动态试管检测仪(英国Lab Kinetics Ltd公司)。
1.2 药品与试剂
脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液(英国Baxter SA公司,批号:13K06N20、13I19N20、13I18N40,规格:1 500m L∶10%脂肪乳注射液300m L+ 5.5%复方氨基酸600m L+20%葡萄糖注射液600m L);细菌内毒素工作标准品(中国食品药品检定研究院,批号:150601-201479,规格:60EU/支);细菌内毒素检查用水(BET水,湛江安度斯生物有限公司,批号:1502120,规格:50m L/支);鲎试剂[TAL,均通过鲎试剂灵敏度复核,凝胶法:湛江安度斯生物有限公司,批号:1503112、1503042、1501212,标示灵敏度(λ):0.25、0.25、0.03 EU/m L;福州新北生化工业有限公司,批号:14030312、14112212,λ:0.25、0.25、0.03EU/m L;KCA:湛江安度斯生物有限公司,批号:1507310,检测范围:50~0.005 EU/ m L]。
2 方法与结果
2.1 样品细菌内毒素限值(L)的确定
根据公式L=K/M计算L[6]。式中,K为人每1 kg体质量每1 h最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h);M为人每1 kg体质量每1 h最大供试品剂量[6-7]。
根据样品说明书静脉滴注1 h最大剂量为180m L,我国人均体质量按60 kg计,滴注时间按1 h计(不足1 h仍按1 h计),故M=180m L/(60 kg·1 h)=3m L/(kg· h)。则L=5 EU/(kg·h)/3m L/(kg·h)=1.7 EU/m L。厂家附录的质量标准中三元混合物L≤0.77 EU/m L,考虑老年患者及儿童用药,按企业标准定L=0.77EU/m L。
2.2 干扰试验最大有效稀释倍数(MVD)的确定
根据公式MVD=c·L/λ[6]计算MVD。式中,L=0.77 EU/m L;c为供试品溶液的浓度,当L以EU/m L表示时,则c=1.0m L/m L;λ为TAL的标示灵敏度(《中国药品检验标准操作规范》[7]建议干扰试验使用0.5EU/m L或0.25 EU/m L的TAL,本试验选择λ=0.25 EU/m L的TAL,MVD=[(1.0 m L/m L)·0.77(EU/m L)]/0.25(EU/ m L)=3,检测不同λ的TAL(市售TAL的λ分别为0.5、0.25、0.125、0.06、0.03 EU/m L)相对应的MVD为1.5、3、6、12和24倍。
2.3 TAL灵敏度复核
将细菌内毒素工作标准品用BET水溶解,制成2.0、1.0、0.5、0.25λ的溶液,按2015年版《中国药典》(四部)“通则1143法”[6]操作,以BET水做2支阴性对照管(NC),对2个厂生产的TAL进行λ复核。结果,5批TAL复核灵敏度均在0.5~2.0λ范围内,符合规定,详见表1(注:“+”表示阳性反应,“-”表示阴性反应,下同)。
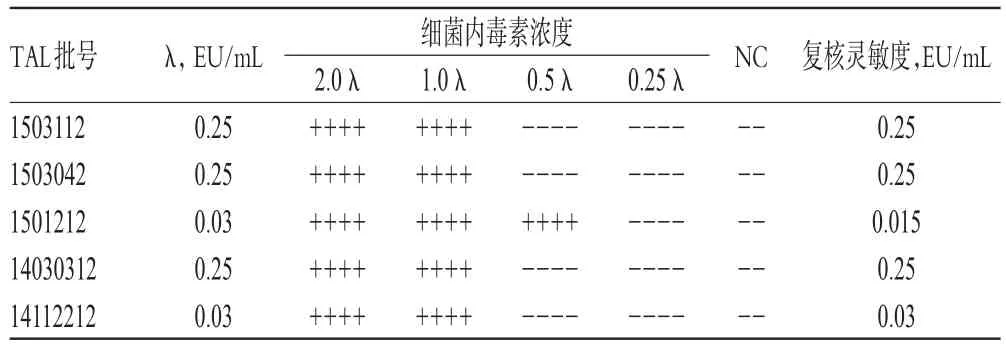
表1 TAL的λ复核结果Tab 1 Recheck resultsofλfor TAL
2.4 干扰预试验
取3批样品各适量,等体积混合得样品混合原液,用BET水将样品稀释成1.5、3、6、12倍溶液作为贮备液1~4,用0.002‰SDS溶液将样品混合原液稀释1.5倍得1.5倍供试品阴性对照溶液(NPC),再将贮备液1~4等比稀释为3、6、12和24倍的NPC;同时,每一稀释倍数下制备供试品阳性对照系列溶液[PPC,即用该浓度的供试品稀释液将细菌内毒素标准品制成2λ(0.5 EU/m L)浓度]。分别用上述不同稀释倍数的NPC和PPC反应,每一稀释倍数平行做2支管。另取2支管加入BET水作为NC,2支管加入2.0λ浓度的细菌内毒素标准溶液作为阳性对照(PC)。取以上4种溶液进行干扰预试验,结果见表2。

表2 样品干扰预试验结果Tab 2 Resultsof interference pretestof sam p les
由表2可见,3批样品均分别稀释24倍后,对2个厂家生产的λ=0.25 EU/m L的TAL与细菌内毒素的凝集反应无干扰作用。
2.5 干扰试验
根据干扰预试验结果,取3批样品用BET水分别稀释12倍后作为供试品溶液;用供试品溶液和BET水分别稀释细菌内毒素工作标准品,制成细菌内毒素浓度分别为0.5、0.25、0.125、0.162 5EU/m L的系列溶液,每个浓度平行做4支管,再进行TAL反应。另取供试品溶液和BET水做2支NC,参考相关文献[4]进行干扰试验,按公式Es=lg-1(∑Xs/4)和Et=lg-1(∑Xt/4)[式中,Es为用BET水制成的细菌内毒素标准溶液的反应终点浓度的几何平均值;Et为用供试品溶液或0.002‰SDS溶液制成的细菌内毒素的反应终点浓度的几何平均值;Xs和Xt分别为用BET水和供试品溶液或0.002‰SDS溶液制成的细菌内毒素(标准)溶液的反应终点浓度对应的对数值(lg)]计算各浓度溶液反应终点细菌内毒素浓度的绝对值,结果见表3。
由表3可知,Es在0.5~2.0λ范围内,Et在0.5~2.0 λEs范围内,表明样品稀释24倍后对TAL(λ=0.25 EU/ m L)与细菌内毒素的凝集反应无干扰作用,可用于细菌内毒素检查。
2.6 样品细菌内毒素检查
取“2.4”项的贮备液4用0.002‰SDS溶液等比稀释,得稀释24倍的溶液,用λ=0.03 EU/m L的TAL进行样品细菌内毒素检查,并按“2.4”“2.5”项下方法做PPC、PC、NPC、NC对照,详见表4。由表4可知,2组TAL的检查结果一致,均符合规定[6]。
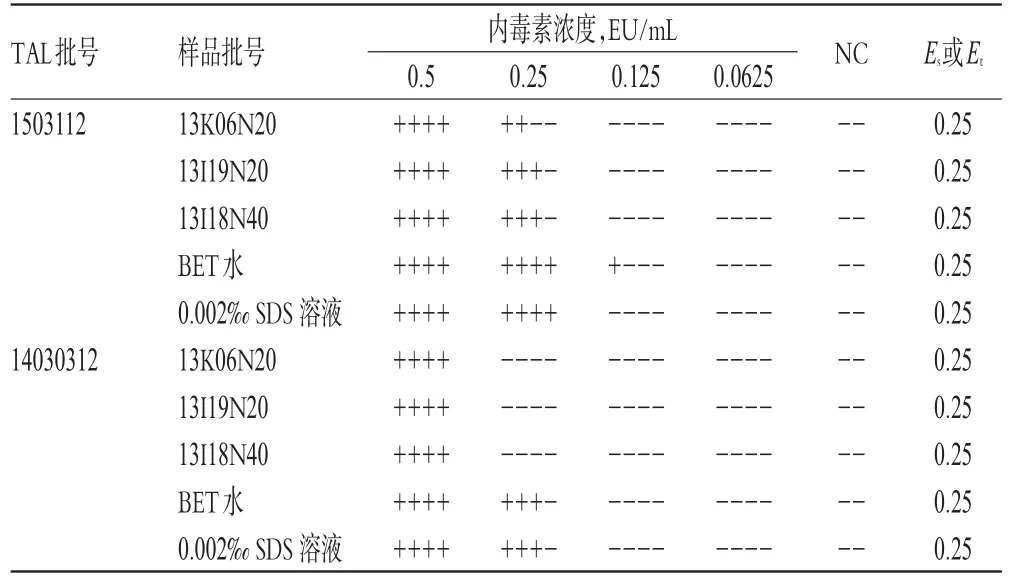
表3 干扰试验结果Tab 3 Resultsof interference test

表4 样品细菌内毒素检查结果Tab 4 Resultsofbacterialendotoxins testof samp les
2.7 KCA法(验证试验)
根据公式MVD=c·L/λ计算MVD。L=0.77EU/m L,KCA法的TAL灵敏度为50~0.005 EU/m L,因此选择λ=0.005 EU/m L。经计算,MVD=154。
根据可靠性试验将数据进行线性回归分析,得回归方程为lg T=2.739 7-0.292 3 lgc,式中T为反应时间(达限时间),单位为s;c为细菌内毒素浓度(EU/m L)。其中,阴性对照时间>3 600 s,其绝对值>0.98,故标准曲线成立。
2.8 两种方法检测样品中的细菌内毒素
按L=0.77 EU/m L用BET水稀释至76倍,加入KCA法TAL 0.1m L,作为供试品溶液[6];再把上述供试品溶液稀释2倍,等比加入用BET水制备的1 EU/m L细菌内毒素工作标准品溶液,再加入KCA法TAL 0.1m L,作为供试品干扰溶液;并按“2.4”“2.5”项下方法做NC对照。根据2015年版《中国药典》(四部)“细菌内毒素检查法”项下的KCA法和凝胶法进行检测[6],结果见表5 [回收率(%)=(供试品干扰溶液细菌内毒素含量-供试品溶液的细菌内毒素含量)/加入的细菌内毒素含量× 100%;表中“-”为未检出]。由表5可知,2种方法内毒素检测值均在规定限值以下[6]。
3 讨论
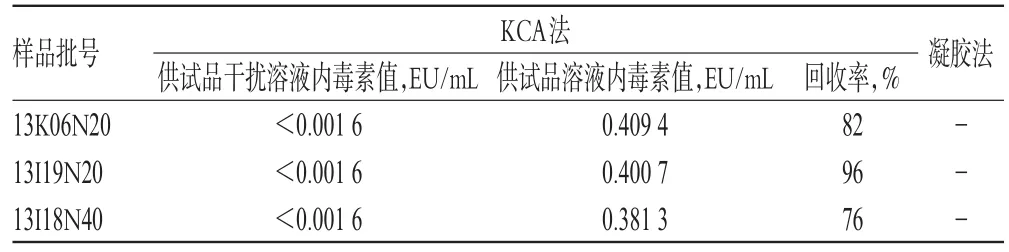
表5 两种方法检测结果比较Tab 5 Com parison of the resultsof 2 kindsofmethods
在日常检验中,脂肪乳注射液对TAL有干扰作用[7-8]。这可能与脂肪乳所带的电荷干扰TAL的凝集有关。SDS是阴离子表面活性剂和助溶剂,助溶剂能够增加难溶性物质的溶解度,增强稳定性,SDS在低浓度下能够发挥助溶作用且毒性较少[9]。由试验结果表明,SDS能消除样品的干扰作用。这可能与中和作用和其对脂肪乳的稳定作用有关。
本研究对脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液用0.002‰SDS溶液进行稀释,样品稀释至24倍后无干扰。本研究亦采用KCA法对样品进行测定,结果表明,样品在稀释了76倍及以下对试验无干扰作用,均符合药典要求[6]。
综上所述,凝胶法可用于脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液的细菌内检查。
[1]胡长缨,赵朋娟.脂肪乳氨基酸-葡萄糖注射液致静脉炎1例的分析[J].抗感染药学,2014,11(1):75-76.
[2]邓杰,张珂,袁涛,等.动态显色法检测白喉毒素突变体CRM 197的细菌内毒素含量[J].中国生物制品学杂志,2013,26(12):1835-1839.
[3]林巧平,周建平.药物载体脂肪乳的研究与应用[J].药学进展,2005,29(8):359-361.
[4]刘玲,周修森.复方氨基酸注射液(17AA-I)细菌内毒素检查法的建立[J].北方药学,2014,11(6):2-3.
[5]刘曦,陈惠丹,金凌洁.十二烷基硫酸钠辅助提取布渣叶中的黄酮类物质[J].生物加工过程,2012,10(4):42-43.
[6]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:157、1143.
[7]中国药品生物制品检定所.中国药品检验标准操作规范[S].2010年版.北京:中国医药科技出版社,2010:310-324.
[8]李雪兰,黄新兰,翟艳,等.脂肪乳注射液细菌内毒素检查法的可行性研究[J].中国医药指南,2010,8(11):53-54.
[9]李婷婷,李炜,高登莲,等.生物制品常用辅料及其限量检测方法研究进展[J].中国新药杂志,2014,23(24):2872-2880.
(编辑:刘柳)
Determination of Bacterial Endotoxin in Fat Emulsion(10%)/Am ino Acid(15)/Glucose(20%)Injection by Gel Method
WANG W enjia,CHEN Zhim ing,ZHANG Nam in,ZHOU M engying,HE Huahong,LIW ei(Guangzhou Institute for Drug Control,Guangzhou 510160,China)
OBJECTIVE:To adopt gelmethod for the determ ination of bacterial endotoxin in Fat emulsion(10%)/am ino acid(15)/glucose(20%)injection.METHODS:According to the gelmethod in term of“bacterial endotoxin testmethod”in Chinese Pharmacopeia(2015 edition),themaximal valid dilution(MVD)of sampleswere determined through interference test and the validated.The resultswere compared w ith chromogenic method.RESULTS:In gelmethod,the interference to agglutination reaction of TAL and bacterial endotoxin can be excluded when samples were diluted 24 times or less.In chromogenic method,the samples should be diluted 76 times or less.CONCLUSIONS:Gelmethod can be used for bacterial endotoxin test of Fat emulsion(10%)/ am ino acid(15)/glucose(20%)injection.
Fat emulsion(10%)/amino acid(15)/glucose(20%)injection;Bacterial endotoxin test;Gelmethod;Interference test;Chromogenicmethod
R 927
A
1001-0408(2017)18-2576-03
2016-06-30
2016-12-12)
*副主任药师,硕士。研究方向:药理毒理学、安全性评价。电话:020-81744947。E-mail:464114381@qq.com
#通信作者:主任药师。研究方向:药物分析、药理毒理学、安全性评价。电话:020-26283334。E-mail:Liw@gzfda.gov.cn
DOI10.6039/j.issn.1001-0408.2017.18.36
