高短肽得率羊骨酶解物的制备及其体外抗氧化活性
2017-07-24傅鑫森李秀华王凯霍乃蕊
傅鑫森,李秀华,王凯,霍乃蕊
(1.山西农业大学动物科技学院,山西太谷030801;2.阳泉市农业委员会,山西阳泉045000;3.山西农业大学食品科学与工程学院,山西太谷030801)
高短肽得率羊骨酶解物的制备及其体外抗氧化活性
傅鑫森1,李秀华2,王凯3,霍乃蕊1
(1.山西农业大学动物科技学院,山西太谷030801;2.阳泉市农业委员会,山西阳泉045000;3.山西农业大学食品科学与工程学院,山西太谷030801)
以短肽得率为指标,响应面法优化羊骨碱性蛋白酶水解工艺,对酶解物的抗氧化活性进行研究,为羊骨的高值利用奠定基础。结果表明,以所得最优工艺即骨粉浓度8.24%,pH值9,加酶量4.35%,46℃水解5 h制备酶解物,短肽得率达71.19%;酶解物对3种自由基的清除率随浓度的增加而增加,对3种活性氧的清除能力为DPPH·>O2-·>·OH;0.3 mg/mL酶解物对DPPH·,O2-·,·OH的清除率分别为46.21%,29.82%和24.16%。由此可见,以最优工艺制备的、富含短肽的羊骨碱性蛋白酶解物具有体外抗氧化活性,有望应用于饲料、食品、医药等领域。
羊骨;碱性蛋白酶;活性氧;自由基;抗氧化活性
我国现阶段利用羊骨的方式比较单一,食品上主要生产骨蛋白粉、骨精汤料等[1];在畜牧业中被加工成骨粉,用于非反刍动物饲料的生产。因此,如何充分利用羊骨资源,提高其经济价值,意义重大。羊骨蛋白质含量约25%,其中90%以上为分子量大于30 kDa、不易被机体直接吸收的胶原蛋白,但经酶解制成多肽后,胶原蛋白的营养价值和生理功能显著提高[2],具有了抗菌、抗氧化、增强免疫力、防治骨质疏松、抑制血管紧张素转移酶活性等作用[3-7]。水解羊骨使用的酶有中性蛋白酶[4]、胃蛋白酶[5]和木瓜蛋白酶[6-7]等,关于其他酶种的报道极少。多肽的分子量越小,生理活性越强[8],而多肽的分子量分布情况又受酶解条件的影响[9]。碱性蛋白酶对羊骨粉的水解效果优于中性蛋白酶等其他7种单酶[10]。本研究将以短肽得率为指标,利用响应面分析法优化羊骨的碱性蛋白酶水解条件,制备富含胶原短肽的羊骨酶解物,并对其体外抗氧化活性进行研究,旨在为羊骨的高值利用和相关产品开发奠定基础。
1 材料和方法
1.1 材料
新鲜羊骨经高压、脱脂、干燥、粉碎制成骨粉。碱性蛋白酶(活性≥200 000 U/g)购于太原科谷仪诚商贸有限公司;2,2-二苯基-1-苦味肼基自由基(DPPH)为Sigma公司产品,硫辛酸(纯度99%)购自常熟富士莱医药化工有限公司。三氯乙酸(TCA)、无水乙醇等其他试剂均为分析纯。丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所。
1.2 仪器设备
高速万能粉碎机(广州雷迈机械);722G可见分光光度计(上海精密仪器有限公司);台式高速冷冻离心机(Neofuge23R,上海力申科学仪器有限公司)等。
1.3 短肽得率的测定
三氯乙酸可溶性氮法(TCA法):将15%三氯乙酸与酶解液按体积比1∶1混合均匀,静置10 min,5 000 r/min离心15 min,福林-酚法测定上清液中的可溶性氮含量,短肽得率计算公式如下。
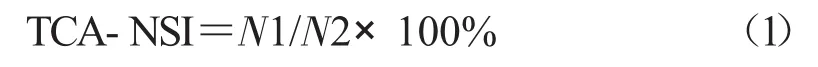
式中,TCA-NSI表示三氯乙酸可溶性氮得率(%);N1表示在15%TCA中的可溶性氮含量(mg);N2表示原料中的总氮含量(mg),用凯氏定氮法测定。
1.4 单因素试验
依次考察骨粉浓度(4%,6%,8%,10%,12%)、温度(40,45,50,55℃)、加酶量(2%,3%,4%,5%)、酶解时间(3,4,5,6 h)和pH值(8.0,8.5,9.0,9.5,10.0)对短肽得率的影响。首先称取2,3,4,5,6 g羊骨粉分别与50 mL蒸馏水混合,调节pH值至8.0,酶添加量为4%,50℃酶解5 h,高温加热终止反应,离心,取上清液测定短肽得率。
1.5 响应面分析
利用Box-Behnken实验设计原理,采用4因素3水平响应面分析法,以短肽得率(Y)为响应值对水解条件进行优化。各因素的-1,0,+1水平分别为骨粉浓度(A)6%,8%,10%,温度(B)40,45,50℃,发酵时间(C)4,5,6 h,加酶量(D)3%,4%,5%。试验设计如表1所示。为了验证试验的参数条件水解羊骨粉,酶解液经过离心、浓缩后真空冷冻干燥备用。
1.6 体外抗氧化能力测定
1.6.1 DPPH·清除能力用无水乙醇配制0.1 mmol/L的DPPH溶液。试管1中加1.5 mL DPPH溶液和等体积蒸馏水,试管2中加1.5 mL DPPH溶液和等体积酶解液,试管3中加1.5 mL无水乙醇和等体积的酶解物溶液,混合均匀后室温避光反应30 min,517 nm处测吸光度值。试管1,2,3的读数分别记作A0,A1,A2。
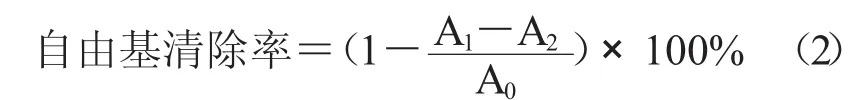
1.6.2 ·OH清除能力采用水杨酸法进行测定。试管1中加入等体积(1 mL)的6 mmol/L的FeSO4溶液(A),H2O2溶液(B),水杨酸溶液(C)和蒸馏水;试管2中加入A,B,C和酶解液;试管3加入A,B和蒸馏水、酶解液。试管1,2,3的吸光度值依次记录为A0,A1和A2。对·OH清除能力的计算公式同公式(2)。
1.6.3 O2-·清除能力其采用邻苯三酚法进行测定。3支具塞比色管中均加入4.5 mL 0.05 mol/L的Tris-HCl(pH值8.2)和2.0 mL无水乙醇,混匀后25℃水浴20 min。试管1加入0.3 mL经过25℃预热的3 mmol/L邻苯三酚,试管2同试管1一样加入邻苯三酚外,再加入经过25℃预热的0.2 mL酶解物;试管3加入0.2 mL酶解物;每个试管混匀后均置于室温准确反应4 min,然后立即用1.5 mL的HCl溶液(10 mmol/L)终止反应,于321 nm处测定吸光度值,试管1,2,3的读数分别记录为A0,A1,A2,按照1.6.1中的公式(2)计算清除率。
1.7 统计分析
对响应面试验中的各组试验数据采用Design-Expert软件进行回归拟合分析;抗氧化能力分析中的数据均用平均值±标准误表示,差异显著性分析使用Statistix 8.1软件。
2 结果与分析
2.1 单因素试验结果
从图1可以看出,各因素在不同水平下,短肽得率都经历了一个先增加后减少或趋于平缓的过程。pH值、骨粉浓度、温度、加酶量、酶解时间分别在9,8%,45℃,4%,5 h时短肽得率达到峰值。随着各因素的逐个优化,短肽得率逐步增加,说明工艺还可进一步优化。
2.2 响应面试验结果
对表1中的数据进行回归拟合,得到回归方程Y=+70.04+2.90A+5.47B-0.49C+3.81D-1.08AB+4.59AC+1.94AD+1.07BC-1.93BD-2.87CD-13.41A2-11.86B2-12.81C2-5.37D2。
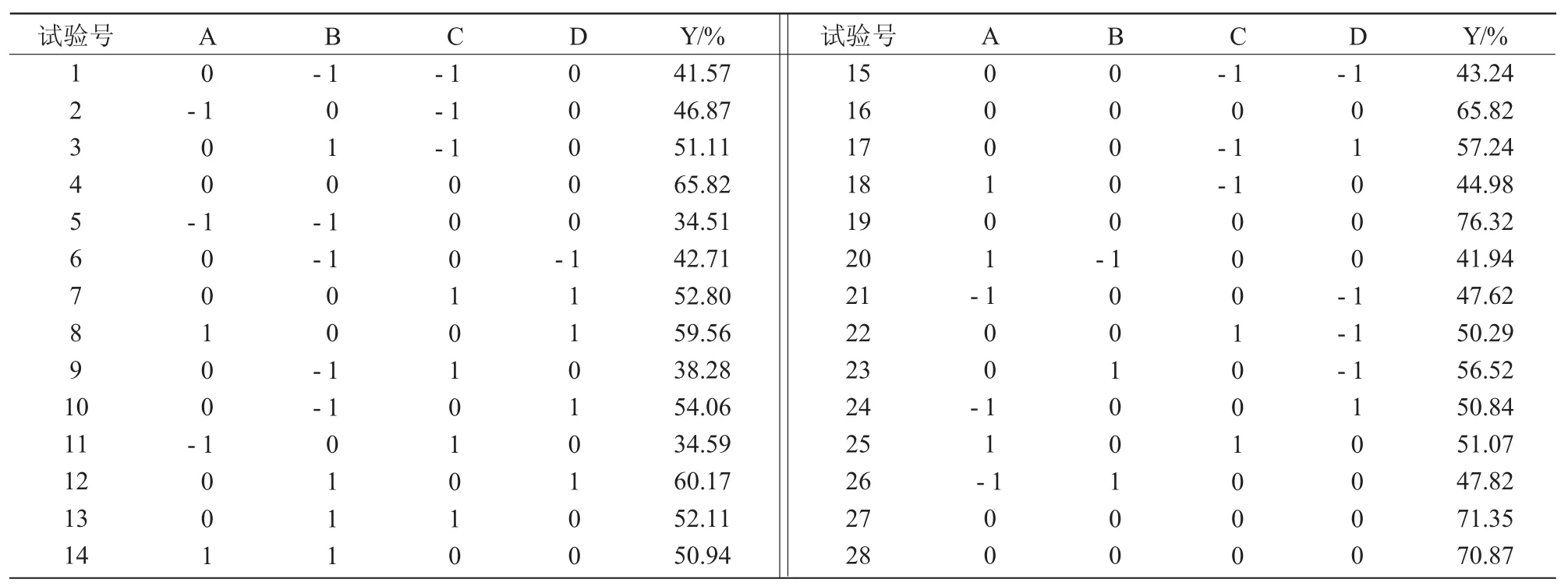
表1 碱性蛋白酶水解羊骨的响应面试验设计及结果
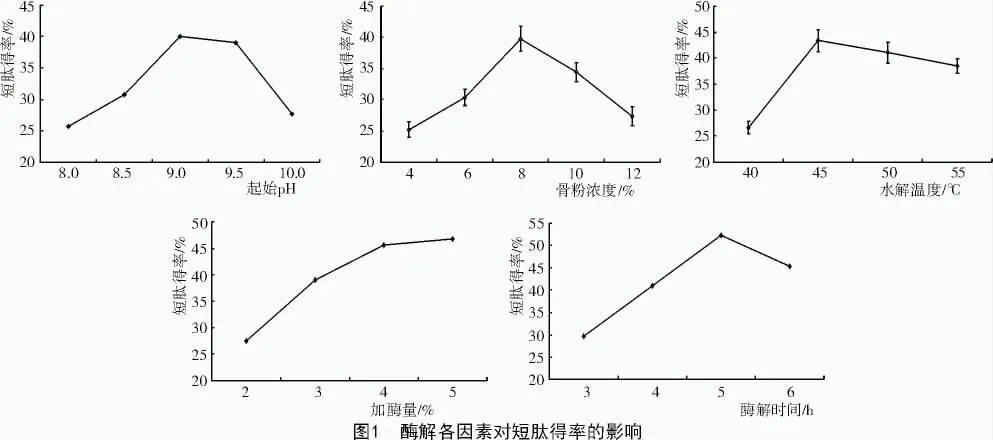
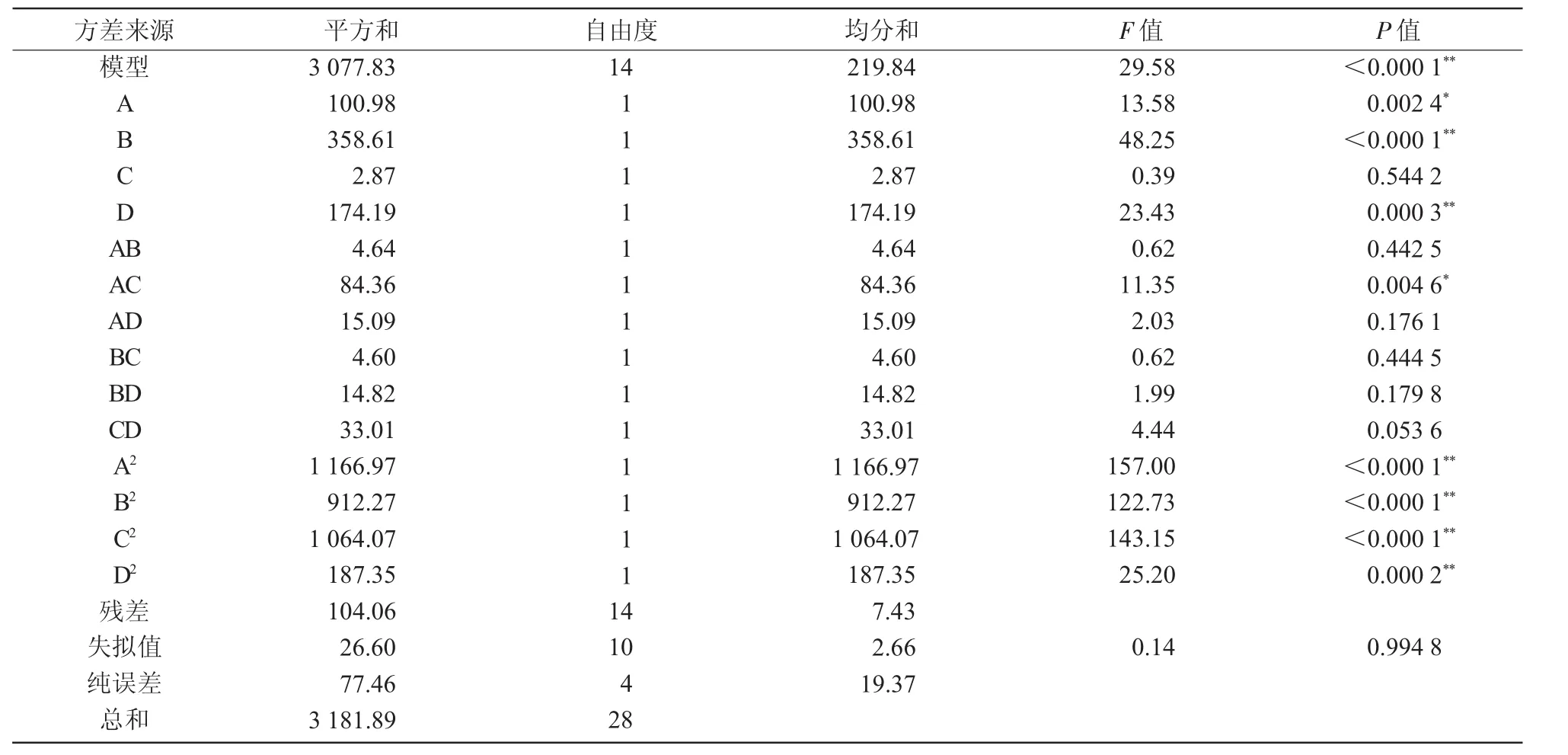
表2 回归方程的方差分析结果
由表2可知,模型极显著,失拟项不显著,表明试验数据与模型的相互拟合程度非常好,可用来进行参数优化、分析和预测碱性蛋白酶水解羊骨粉的工艺。模型的一次项对短肽得率的影响依次为温度>加酶量>骨粉浓度,而酶解时间对短肽得率无影响。说明延长水解时间并不能获得更多的短肽,这对生产实践有指导意义。模型的所有二次项对短肽得率影响极显著,AC项影响显著,其他不显著,表明各因素对短肽得率的影响是非线性关系[11]。
回归模型的相关系数R2为0.967 3,表明短肽得率的实际值和预测值之间有很好的拟合度,模型调整相关系数R2adj为0.934 6,因此,模型可以解释93.46%的响应值变化。说明所建立的二次模型能够拟合实际的试验结果,且误差小。
2.3 响应面分析
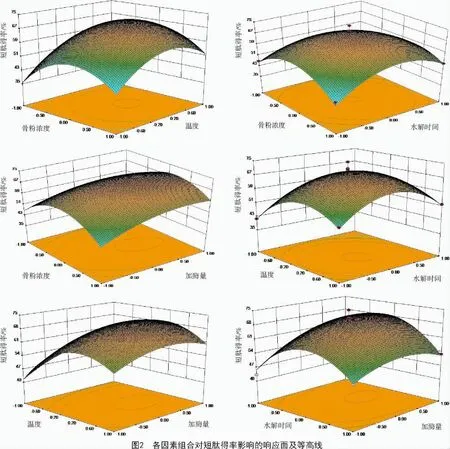
根据2.2中所得的回归方程,绘制三维曲面及等高线图(图2),可见骨粉浓度和温度、骨粉浓度和水解时间、温度和水解时间之间的交互对短肽得率的影响表现为先上升后下降;对短肽得率的影响,温度大于加酶量,加酶量大于骨粉浓度,骨粉浓度大于水解时间;骨粉浓度和水解时间之间的交互作用极显著,其他交互作用不显著。
2.4 最优参数及模型验证试验
利用Design-Expert软件计算得到酶解物最佳制备参数为:骨粉浓度8.24%,温度45.98℃,加酶量4.35%,水解时间4.97 h,短肽得率的预测值为71.42%。为检验响应面法所得结果的可靠性,验证试验时将参数调整为:骨粉浓度8.24%,温度46℃,水解时间5 h,加酶量4.35%,实际短肽得率为71.19%,与预测值接近,进一步说明该模型可靠。
2.5 体外抗氧化试验结果
由表3可知,酶解物对·OH,DPPH·和O2-·的清除率随酶解物质量浓度的增加而增强,呈剂量反应关系,对3种活性氧的清除能力为DPPH·>O2-·>·OH。0.3 mg/mL酶解物对DPPH·,O2-·,·OH的清除率分别为46.21%,29.82%和24.16%。

表3 羊骨碱性蛋白酶解物的自由基清除能力
3 讨论
蛋白酶种类繁多,酶种不同,作用于肽键的专一性不同,得到的多肽生物活性也不相同[12]。山西农业大学动物科技学院畜骨资源利用课题组前期比较了7种蛋白酶对羊骨粉的水解效果,证实碱性蛋白酶水解度最高[13],詹萍等[14]也研究证实,受试的6种酶中,碱性蛋白酶对羊骨粉的水解度最大。在制备水产品来源的胶原多肽时,研究者们也比较了多种酶的水解活性,均表明碱性蛋白酶是活性很强的酶种[15],而且碱性蛋白酶水解物的抗氧化能力最强[16-17]。因此,碱性蛋白酶水解羊骨胶原及其他来源的胶原蛋白时,不仅水解度大,且胶原多肽的抗氧化活性等生理活性亦强。
自由基是引起人体衰老和慢性疾病的主要原因之一[18],对皮肤和骨骼健康产生显著负面影响[3]。自由基具未配对电子,氧化能力很强。长期高能膳食及高能代谢可使自由基的生成量大于清除量,从而引起氧化应激和氧化损伤。体内抗氧化剂的耗竭将进一步导致机体抗氧化能力降低和细胞功能受损,使更多自由基在体内积累,造成恶性循环。
本研究制备的羊骨酶解物对3种活性氧自由基均具有清除能力,该酶解物除具有抗氧化作用外,已经证明还具有促进骨生长和抑制骨吸收的作用,可能还有免疫增强作用、神经内分泌调节作用,从而对机体的健康具有全面维护作用。
[1]林波,于秀玲,王欣,等.双酶酶解制备羊骨多肽工艺研究[J].食品科技,2014,39(10):147-150.
[2]李亚欣.酶解制备骨胶原肽及其对小鼠抗氧化能力与钙利用的影响[D].无锡:江南大学,2009.
[3]朱琳玲.骨胶原肽对高脂膳食小鼠抗氧化能力及皮肤和骨骼胶原代谢的影响[D].无锡:江南大学,2012.
[4]冯雅蓉,马俪珍.羊骨降血压肽制备工艺的研究[J].山西农业大学学报(自然科学版),2011,31(3):253-256.
[5]霍乃蕊,马俪珍,忻欣,等.羊骨酶解发酵液钙鳌合物对骨质疏松大鼠骨密度和骨代谢生化指标的影响[J].中国实验动物学报,2010,18(3):216-220.
[6]杨华,刘玉花,马俪珍,等.羊骨蛋白酶解物免疫活性及酶解条件的研究[J].中国农业科学,2008,41(10):3214-3221.
[7]霍乃蕊,岳文斌,刘玉花,等.羊骨木瓜蛋白酶水解物对小鼠免疫功能的影响[J].中国实验动物学报,2010,18(5):417-420.
[8]杨莉莉,申锋,熊善柏,等.木瓜蛋白酶制备草鱼磷胶原肽的工艺优化及产物特性分析[J].食品科技,2012,37(2):61-64.
[9]贾建萍,周彦钢,鲁健章,等.凝胶渗透色谱法测定胶原肽分子质量及其分布[J].中国卫生检验杂志,2010,20(5):968-970.
[10]甄守艳,霍乃蕊,王凯,等.碱性蛋白酶制备高水解度羊骨胶原肽的工艺研究[J].山西农业大学学报(自然科学版),2015,35(6):655-659.
[11]刘永,李夏欣,刘玲,等.鱼鳞胶原蛋白肽钙螯合物制备工艺的优化[J].食品工业科技,2013,34(20):235-240.
[12]刘峰,刘春娥,李亚,等.利用鳕鱼皮制备饲用胶原肽添加剂及其抗氧化研究[J].饲料工业,2011,32(22):30-32.
[13]韩克光,甄守艳,高文伟,等.单酶水解羊骨粉效果比较及水解指标相关性分析[J].食品科技,2016(1):110-114.
[14]詹萍,张晓鸣,田洪磊.二次旋转正交组合设计优化羊骨蛋白酶解工艺[J].食品工业科技,2012,33(19):182-186,190.
[15]王东,蒲训,陈明凯,等.鲑鳟鱼骨提取胶原肽工艺与产品生物活性研究[J].中兽医医药杂志,2010(4):15-19.
[16]刘春娥,刘峰,刘苏瑶,等.鳕鱼皮胶原活性多肽的制备研究[J].食品研究与开发,2012,33(12):161-163.
[17]陈日春,熊文飞,蔡一楠,等.鲢鱼鱼鳞胶原蛋白肽抗氧化作用研究[J].食品科学技术学报,2013,31(6):28-35.
[18]陈金玉,张鑫,吴祖芳,等.EGCG磷脂复合物抗氧化活性的研究[J].现代食品科技,2015,31(5):137-143.
Preparation and Antioxidative Activity of Sheep Bone Hydrolysate with High Yield of Short Peptides
FUXinsen1,LI Xiuhua2,WANGKai3,HUONairui1
(1.College ofAnimal Science and Veterinary Medicine,Shanxi Agricultural University,Taigu 030801,China;2.Agricultural Committee ofYangquan City,Yangquan 045000,China;3.College ofFood Science and Engineering,Shanxi Agricultural University,Taigu 030801,China)
Optimizing the sheep bone alcalase hydrolyzing parameters via responsive surface methodology and evaluating the antioxidative activity ofthe resulted enzymatic hydrolysate was carried out in this paper for the future high-value utilization ofsheep bone. The result showed that short peptides obtaining rate reached to 71.19%under the resulted optimized condition,that was,8.24%bone powder,4.35%alcalase,46℃for 5 h at pH 9.In vivo study suggested that the higer concentration of hydrolysates,lipoic acid and Vc, the stronger their ability to scavenge the tested three free radicals.The hydrolysates showed higher efficient in clearing DPPH·than clearing O2-·and·OH.0.3 mg/mLhydrolysates demonstrated 46.21%,29.82%and 24.16%scavenging ability for DPPH·,O2-·and·OH. It can be concluded that the prepared sheep bone hydrolysate riched in short collagen peptides has in vitro antioxidative activity,which can be used in the field offood,feed and medicine industry and other areas.
sheep bone;alcalase;reactive oxygen species;free radical;antioxidative ability
S879.9
:A
:1002-2481(2017)07-1157-05
10.3969/j.issn.1002-2481.2017.07.29
2017-02-15
国家自然科学基金项目(31201347);山西省回国留学人员科研资助项目(2014-042)
付鑫森(1996-),男,山西太谷人,在读本科,研究方向:动物检疫。霍乃蕊为通信作者。
