少棘蜈蚣候选毒素多肽κ-SLPTX-Ssm1b的原核表达与纯化
2017-07-24吴茜吴慧吴磊孟尔
吴茜,吴慧,吴磊,孟尔
(国防科学技术大学理学院生物信息研究中心,湖南长沙410073)
少棘蜈蚣候选毒素多肽κ-SLPTX-Ssm1b的原核表达与纯化
吴茜,吴慧,吴磊,孟尔*
(国防科学技术大学理学院生物信息研究中心,湖南长沙410073)
κ-SLPTX-Ssm1b是从少棘蜈蚣的cDNA文库中获得的一类功能未知的毒素,它与钾通道抑制剂κ-SLPTX-Ssm1a高度同源,由50个氨基酸残基构成,含有3对二硫键的多肽分子.利用pET-43-His-SUMO原核表达载体,通过E.coli SHuffleTM菌种自动诱导表达,随后利用镍柱和RP-HPLC纯化,并通过MALDI-TOF质谱鉴定其分子量为5532.1870 Da,与理论值5532.3 Da相符.其产量为1 mg/L,为进一步鉴定其电生理活性奠定了基础.
原核表达;少棘蜈蚣;蛋白纯化;E.coli SHuffleTM
电压门控钾通道(voltage-gated K+channels,Kv)是细胞膜上钾离子通道的重要组成部分,可分为许多种类,功能不尽相同,对应的病变也会导致多种多样的疾病,例如神经麻痹、糖尿病、肿瘤增殖等[2-3].因此,对Kv通道的研究能够促进现代医学的发展,为进一步开发的相关药物提供理论研究基础.蝎子、蜘蛛、蜈蚣等有毒动物的毒素是电压门控离子通道靶向药物的重要来源.动物毒素可作用于受体和通道,且作用的灵敏性极高、选择性极高,具有极高的成药率[4-6].有不少研究表明,动物毒素可以作用于多种细胞膜的离子通道[7-8],并且对细菌、真菌等微生物有非常强效的杀灭作用[9-10].这些毒素可以作为研究工具来研究人类的生理机制.例如少棘蜈蚣毒液的毒素κ-SLPTX-Ssm4a、海葵毒素ShK-192均可专一结合并抑制淋巴细胞中广泛分布的Kv1.3通道,后者可用于治疗自身免疫疾病,目前正在临床试验阶段[11-12].另一种少棘蜈蚣毒腺的毒素κ-SLPTX-Ssm1a在1 μm的低浓度下即可完全抑制大鼠背神经节中的钾通道电流[13],也是一种潜在的神经药物.
κ-SLPTX-Ssm1b(以下简称κ1b)是产自少棘蜈蚣(Scoropendra subspinipes mutilans)的毒素,是其cDNA文库中未被研究的毒素多肽,存在三对二硫键.毒素κ-SLPTX-Ssm1a(以下简称κ1a)与κ1b的序列高度同源,存在有相同位置的三对二硫键[13],因此与κ1b可能存在有类似的空间结构和相似的生理活性.本文使用大肠杆菌SHuffleTM菌株作为受体菌,其优势在于可表达富含二硫键的多肽,有利于这类多肽的正确折叠.文章中使用pET-43a(+)作为原核表达载体,在T7启动子后面有His标签,使得重组蛋白可以被镍柱吸附,从而达到纯化的作用.His标签后、在毒素序列前加入SUMO标签,不仅可以提高毒素的可溶性[14-15],还可以通过SUMO激酶(ULP1)切除标签,进一步通过反相高效液相色谱(RP-HPLC)纯化得到完整的κ1b毒素,从而避免了该多肽富含二硫键可溶性较差,易形成包涵体的问题[16].最终,4 mL培养基表达后分离纯化得到4 mgκ1b毒素,产量为1 mg/L,得到的纯化后毒素为后续电生理活性检测及药物研究打下了基础.
1 材料与方法
1.1 实验材料与试剂
E.coli DH5α菌种和KODFXPCR酶体系购于日本东洋纺,E.coli SHuffleTM菌株菌种购于美国纽英伦生物技术公司,pET-43a(+)载体购于Novagen公司,BDS HYPERSILC18柱、蛋白质分子量标准和DpnI酶体系购于赛默飞世尔科技公司.DNA纯化回收试剂盒与质粒小提试剂盒由天根生化科技(北京)有限公司提供.DNA序列和引物合成以及其余试剂均生工生物工程(上海)股份有限公司提供.ULP1激酶由实验室自制.
1.2 重组表达载体pET-43-His-SUMO-κ1b的构建
从NCBI数据库中下载κ1b序列(UniProt蛋白接收号:251420),根据E.coli strain K12密码子偏好性,JCat软件(http://www.jcat.de/)优化得到DNA序列为GCTAACGATAAACCAATCGGTAAATGTGGTGATGCTA AACGTAACAAACCATGTCTGGCTTGTTCTCACCGTTCT TCTATCGCTGATTTCTACTCTAAATGTTGTACCTACGA TGCTGTTTACAACGGTTGTCTGGATAAACTGCGTCAC,并送到公司进行合成.根据RF-cloning(Restriction Free cloning)[17]引物设计原则,设计上下游引物分别为κ1b-F:GCTCACCGTGAACAGATCGGTGGTGCTAACGATAA ACCAATCGGT,κ1b-R:GATGGTACCGTCGACGTCCTG CAGTTAGTGACGCAGTTTATCCAGAC.在κ1b之后加入终止密码子TAA.通过RF-cloning将κ1b的DNA序列插入到改造后的pET-43a(+)载体的SUMO标签序列之后.PCR产物通过纯化回收试剂盒回收后用DnpI酶进行消化,后转入大肠杆菌DH5α,挑取阳性克隆提取质粒并测序.
1.3 κ1b的表达与纯化
将测序正确的重组质粒转化进SHuffleTM菌株,在LB平板(含100 μg/mL氨苄青霉素)37℃培养过夜.挑取单克隆接种于3 mLZYM-505培养基(含100 μg/mL氨苄青霉素),置于37℃摇床以220 rpm转速摇菌8 h,随后以1:1000的比例吸取500 μL菌液接种于500 mL ZYM-5051培养基(含100 μg/mL氨苄青霉素),在摇床中以30℃,220 rpm培养16 h.4000 rmp,15 min离心收集细菌后用1M磷酸缓冲液(PBS)重悬细菌(每500 mL菌液用100 mLPBS),均质机破碎后离心收集上清.上清过Ni-NTA柱,以200 mM咪唑洗脱.洗脱液以10KD超滤管进行超滤,随后以ULP1激酶4℃过夜酶切.酶切后样品以0.45 μm滤头过滤,13 000 rpm离心5 min后,以H2O(0.1%TFA)/乙腈(0.1%TFA)为流动相,用C18反相纯化柱(4.6×250 mm,5 μm)进行反相液相色谱,流速1 mL/min进行梯度洗脱,收集紫外光215 nm吸收下单峰样品,冻干.
1.4 κ1b的MALDI-TOF/TOF质谱鉴定
反相高效液相色谱分离纯化所收集的单峰样品采用MALDI-TOF/TOF进行检测.去离子水溶解冻干后样品,分别取1 μL样品与1 μL基质CCA(α-Cyano -4-hydroxycinnamic acid)的饱和液(由0.1%TFA-50%乙腈-49.9%去离子水配置)混合,再取0.5 μL混合液点样于样品盘,室温干燥后检测样品的分子量.
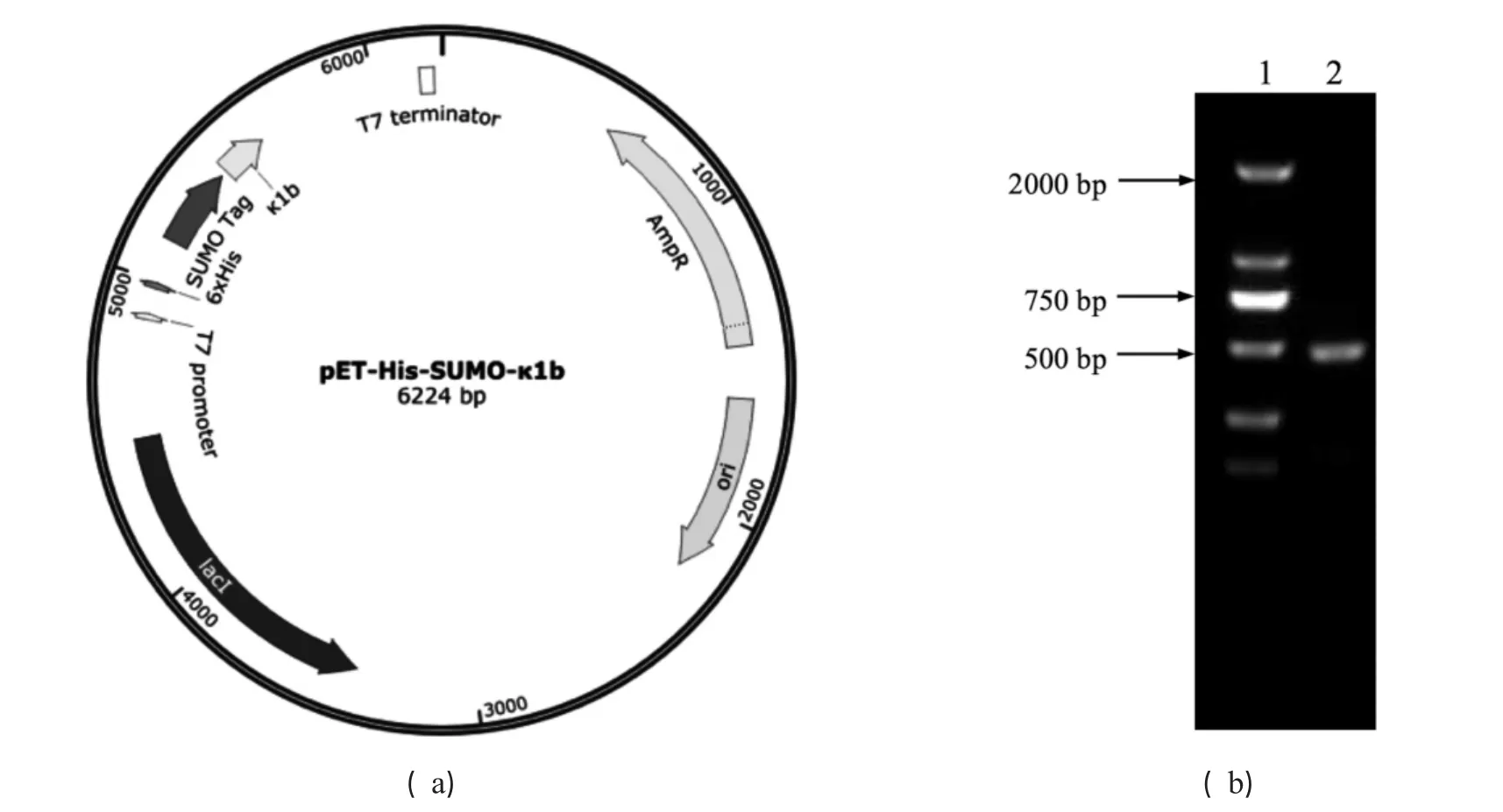
图1 重组质粒的构建
2 实验结果
2.1 重组表达质粒pET-43-His-SUMO-κ1b的构建
通过SOE-PCR技术将目的片段κ1b成功插入到载体上,其紧接于SUMO标签的DNA序列之后,位于His标签的框架内.使用DnpI酶消化后的PCR产物转化进DH5α过夜培养,挑取阳性单克隆进行菌落PCR.引物为F:GTCTGGCTTGTTCTCACCGTT,R:CACCACCAC CACCACTAATGTTAATT.PCR产物琼脂糖凝胶电泳如图1所示,有一条很亮的条带大小约为400 bp,与预期结果一致,证明该基因插入到表达载体上.挑取阳性克隆提取质粒测序结果也与目的片段DNA序列一致,说明表达载体构建成功.
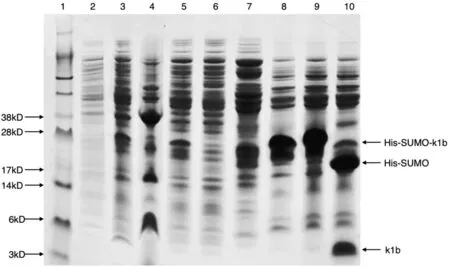
图2 κ1b的诱导表达与纯化SDS-PAGE图
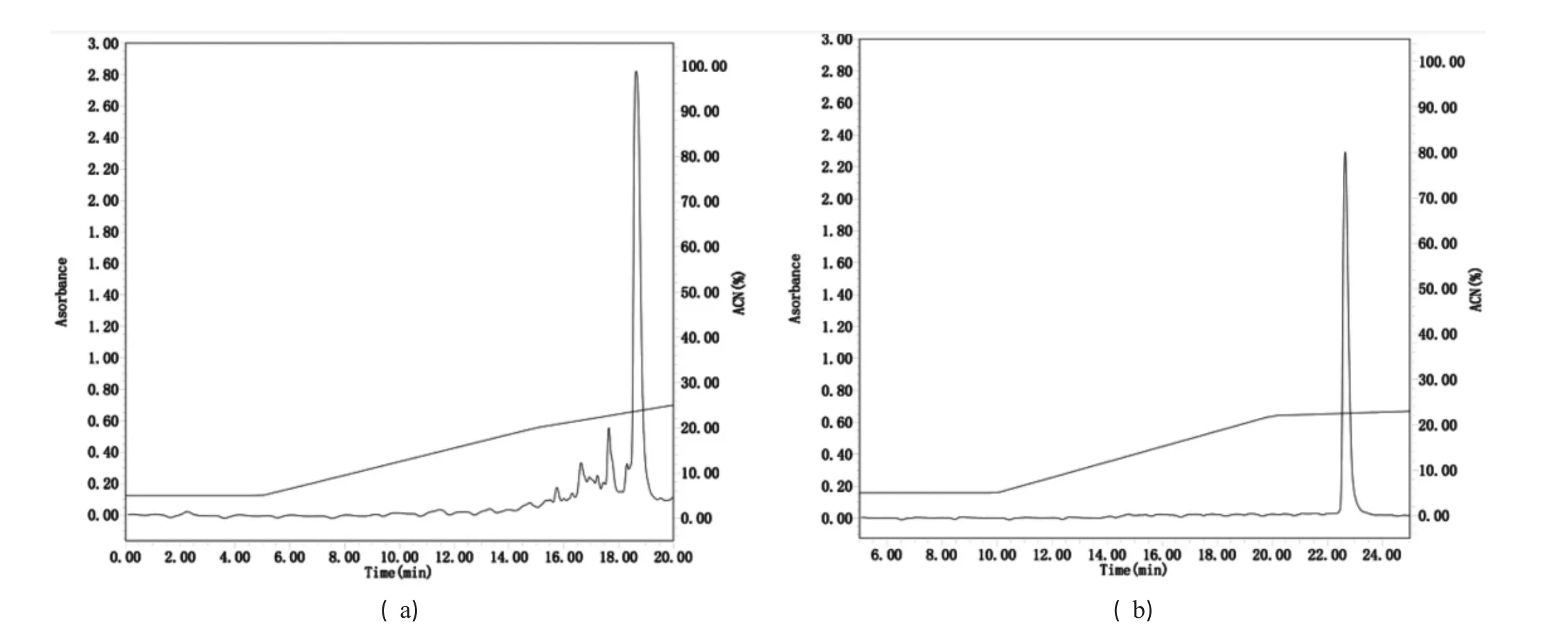
图3 κ1b的RP-HPLC纯化图
2.2 κ1b的表达与Ni柱纯化
重组质粒转化进SHuffleTM菌株进行培养,分别收集ZYM-505培养基培养8 h后菌液、ZYM-5051培养基16 h后菌液、菌体破碎离心后沉淀和上清液、过两遍Ni柱后流穿液、PBS洗脱液(含50 mM咪唑)、PBS洗脱液(含200 mM咪唑)、10 kDa超滤管超滤后内管液、ULP1激酶酶切液进行SDS-PAGE电泳,结果见图2.由图2可知,在28 kDa左右大小处,ZYM-5051诱导后比未诱导时多出一条明显的条带,与融合蛋白大小相符,说明目的蛋白诱导表达成功.由泳道3和4可知,融合蛋白存在于上清液中,可溶性好.过Ni柱两次后融合蛋白绝大多数已挂柱,50 mM咪唑洗脱下多数与Ni柱非亲和结合的杂蛋白,融合蛋白在200 mM咪唑浓度下被洗脱.泳道9显示,融合蛋白酶切成功,多出一条3~6 kDa大小的条带,与目的蛋白κ1b大小5532.3 Da一致.
2.3 κ1b的RP-HPLC纯化与MALDI-TOF/TOF质谱鉴定
酶切产物通过反相液相色谱进行进一步分离纯化.以50 min的溶液梯度线性洗脱,乙腈浓度由15%梯度变化至65%.收集215 nm紫外光波长检测下单峰进行冻干后质谱鉴定,结果见图3.图3a所示目的峰在18.5 min左右出现,此时乙腈浓度约为23%.冻干后样品以水溶解,通过反相液相色谱进行二次纯化.图3b显示梯度洗脱下仅有一个单峰,图3b显示冻干后进行SDS-PAGE电泳分析,仅有一个条带在6 kDa左右.图4b所示的质谱结果5 532.1870 Da与理论值5532.3 Da相符,说明制备所得目的蛋白κ1b纯度较高.其产量为1.0 mg/L.
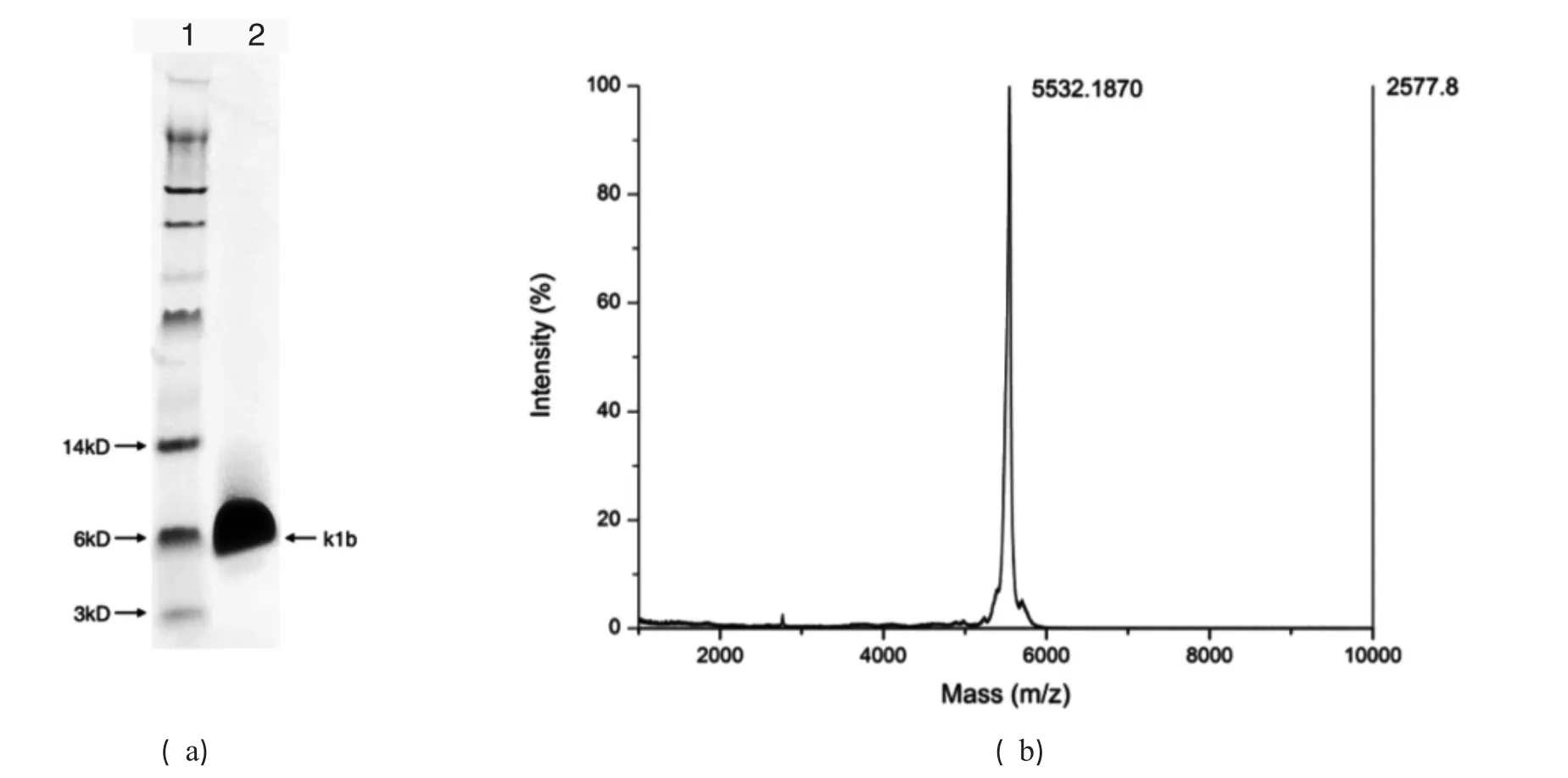
图4 κ1b的质谱鉴定分析图
3 结果与讨论
电压门控钾通道广泛分布于哺乳动物多种细胞的细胞膜上,在有机体中参与了许多重要的生理功能,如细胞膜兴奋性,神经去极化等.同时它的病变也会引发许多的疾病,包括难以治愈的肿瘤、糖尿病等热点疾病.因此,钾通道药物的开发显得极其重要.研究发现,蜈蚣等有毒动物毒腺是离子通道活性多肽的重要来源.并且动物毒素成药率高,已有多种离子通道靶向毒素多肽来源药物上市或处于临床试验阶段,因此从蜈蚣毒腺中分离具有药用价值的毒素多肽十分必要.
本文选取了与对钾通道电流有抑制作用的毒素κ1a同源性高且未知活性的毒素κ1b,由于毒素κ1a对钾离子通道的抑制作用,因此对该毒素的研究对于筛选获得钾通道活性多肽毒素显得尤为重要.获得大量κ1b毒素的方法有多种,如直接分离、化学合成,异源表达等.本文选用在利于富含二硫键多肽正确折叠的菌株E. coli SHuffleTM中表达,使得大量获得该毒素成本较低且易大量生产.避免了从蜈蚣毒腺直接分离毒素所得量少且过程繁琐的缺陷以及使用化学合成使得复性困难而难以形成正确的有活性的结构的缺陷.通过构建His-SUMO-κ1b的表达载体在E.coli SHuffleTM菌株中来融合表达毒素κ1b.ULP1激酶可以识别并切割SUMO标签获得初步纯化的κ1b毒素多肽.经过反相高效液相色谱纯化获得高纯度的κ1b毒素多肽质谱鉴定确定正确且纯度达到后续生理活性试验的要求.本文的研究为后续的κ1b的电生理活性检测试验起了重要的作用,也为将来更多的为将来富含二硫键毒素的原核表达奠定了基础.
参考文献:
[1]Rossenbacker T,Mubagwa K,Jongbloed R J,et al.Novel mutation in the Per-Arnt-Sim domain of KCNH2 causes a malignant form oflong-QTsyndrome[J].Circulation,2005,111(8):961.
[2]Gutman G A,Chandy K G,Grissmer S,et al.International Union of Pharmacology.LIII.Nomenclature and Molecular Relationships ofVoltage-GatedPotassiumChannels[J].Pharmacological Reviews,2005,57:473-508.
[3]Desantis C E,Lin C C,Mariotto A B,et al.Cancer treatment and survivorshipstatistics,2014.[J].CaACancerJournalfor Clinicians,2012,62(4):220.
[4]ZhangY.Whydowe studyanimal toxins?[J].Zoological Research,2015,36(4):183-222.
[5]Casewell N R,Wüster W,Vonk F J,et al.Complex cocktails:the evolutionary novelty of venoms.[J].TrendsinEcology& Evolution,2012,28(4):219-229.
[6]Prashanth J R,Brust A,Jin A H,et al.Cone snail venomics:from novel biology to novel therapeutics[J].Fut Med Chem,2014,6
(15):1659-1675.
[7]Kalia J,Milescu M,Salvatierra J,et al.From foe to friend:using animal toxins to investigate ion channel function[J].J Mol Biol,2015,427(1):158-175.
[8]Lera Ruiz M,Kraus R L.Voltage-gated sodium channels:structure,function,pharmacology,and clinical indications[J].J Med Chem,2015,58(18):7093-7118.
[9]Bordon K C,Wiezel G A,Amorim F G,et al.Arthropod venom Hyaluronidases:biochemical properties and potential applications in medicine and biotechnology[J].J Venom Anim Toxins Incl Trop Dis,2015,21:43.
[10]Van Dessel N,Swofford C A,Forbes N S.Potent and tumor specific:arming bacteria with therapeutic proteins[J].Ther Deliv,2015,6(3):385-399.
[11]赖刃,容明强,杨仕隆,等.少棘蜈蚣多肽毒素kappa-SLPTX -Ssm4a及其基因和应用[P].CN102993289A,2013.
[12]Chi V,Pennington MW,Norton R S,et al.Development of a sea anemonetoxinasanimmunomodulatorfortherapyof autoimmune diseases[J].Toxicon,2012,59(4):529-546.
[13]Yang S,Liu Z,Xiao Y,et al.Chemical punch packed in venoms makes centipedes excellent predators.[J].Molecular&Cellular Proteomics,2012,11(9):640-650.
[14]Satakarni M,Curtis R.Production of recombinant peptides as fusions with SUMO.[J].Protein Expression&Purification,2011,78(2):113-119.
[15]Malakhov M P,Mattern M R,Malakhova O A,et al.SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J].Journal of Structural and Functional Genomics,2004,5(1):75-86.
[16]Ke N,Berkmen M.Production of Disulfide-Bonded Proteins in Escherichia coli[M]//Current Protocols in Molecular Biology. John Wiley&Sons,Inc.2014:240-251.
[17]Ent F V D,L觟we J.RF cloning:A restriction-free method for inserting target genes into plasmids[J].Journal of Biochemical& Biophysical Methods,2006,67(1):67-74.
Prokaryotic Expression and Purification of κ-SLPTX-Ssm1b,a Candidate of Toxin from Centipede Scolopendra Subspinipes Mutilans
WU Xi,WU Hui,WU Lei,MENG Er*
(Research Center of Biological Information,National University of Defense Technology,Changsha,Hunan 410073)
The κ-SLPTX-Ssm1b is a class of unknown toxins obtained from the cDNA library of the the centipede Scolopendra subspinipes mutilans,which is highly homologous to the potassium channel inhibitor,κ-SLPTX-Ssm1a.It consists 50 amino acid residues and 3 disulfide bonds.The coding sequence was obtained by gene synthesis after codon optimization and was inserted to an expression vector pET-43-His-SUMO expressed with auto-induction method in the cytoplasm of E.coli strain SHuffleTM.And it was then purified by Ni-NTA column and RP-HPLC.The molecular weight was 5532.1870 Da by MALDI-TOF mass spectrometry,with consistent of the theoretical value,5532.3 Da.The yield of expression is 1 mg/L,which lays the foundation for the identification of its electrophysiological activity.
prokaryotic expression;scolopendra subspinipes mutilans;protein purification;E.coli SHuffleTM
Q812
A
1671-9743(2017)05-0062-05
2017-04-02
国防科学技术大学校预研“离子通道抑制因子的作用机制”(JC13-02-16).
吴茜,1994年生,女,湖北天门人,硕士研究生,研究方向:生物效应;
*通讯作者:孟尔,1983年生,湖南长沙人,讲师,博士,研究方向:生物效应.
