糖尿病住院患者颈动脉及下肢动脉血管斑块危险因素分析
2017-07-24周谢达肖黄梦林健才李延兵肖海鹏曹筱佩
周谢达,陈 妍,肖黄梦,林健才,李延兵,肖海鹏,曹筱佩
(1.中山大学附属第一医院内分泌科,广州510080;2.江门市中心医院内分泌科,广东江门529030)
糖尿病住院患者颈动脉及下肢动脉血管斑块危险因素分析
周谢达1,2,陈 妍1,肖黄梦1,林健才2,李延兵1,肖海鹏1,曹筱佩1
(1.中山大学附属第一医院内分泌科,广州510080;2.江门市中心医院内分泌科,广东江门529030)
目的 分析2型糖尿病患者颈动脉及下肢动脉血管斑块发生率及其相关因素,并探讨其与糖尿病其他并发症之间的关系。方法 329例住院糖尿病患者,根据颈部及下肢血管彩色超声结果,分为非斑块组(A组,n=99)、单纯颈动脉或下肢动脉斑块组(B组,n=115)以及颈动脉和下肢动脉复合斑块组(C组,n=115),分析临床因素及生化指标与颈动脉及下肢动脉血管斑块之间的相关性,分析其与心脑血管并发症及微血管并发症的相关性。结果 糖尿病颈动脉及下肢动脉血管斑块发病率达69.9%,与年龄(OR=2.065,P=0.000)、收缩压(OR=1.465,P=0.088)、舒张压(OR=0.698,P=0.093)、尿微量白蛋(OR=1.5815,P=0.05)相关。复合斑块组糖尿病足、脑血管事件发生率均大于其他两组,差异有统计学意义(P<0.05);主要心血管不良事件发生率大于非斑块组,差异有统计学意义(P<0.05)。结论 糖尿病外周大血管病变发病率高,且在早期糖尿病患者中广泛存在,并随着年龄增长而加重。同时合并颈动脉及下肢动脉血管斑块者发生心脑事件风险明显增加。
2型糖尿病;糖尿病大血管病变;血管斑块;动脉粥样硬化
动脉粥样硬化是以动脉内膜脂质沉积及钙化(即斑块形成)为特征的血管炎症性病变,主要侵犯大血管,并且严重危害人类健康,能引起缺血性心肌梗死、脑卒中、下肢动脉硬化闭塞等严重血管并发症。目前,心血管疾病仍然是全球人类的主要死因之一[1],并且糖尿病患者发生动脉粥样硬化心脑血管事件的风险更高。英国前瞻性糖尿病(UK⁃PDS)研究表明,当糖化血红蛋白(HbA1c)每升高1%时,发生缺血性心肌梗死的风险升高14%[2]。因此,早期监测及发现动脉粥样硬化高危风险人群对于糖尿病患者而言显得极为重要。本研究回顾性分析糖尿病患者颈部及下肢血管斑块发生情况,探讨其相关因素及与心脑血管事件的关系,为寻找有效的干预措施,降低不良后果提供临床数据。
1 资料和方法
1.1 一般资料
选择2015年4月至2015年11月在中山大学附属第一医院住院的2型糖尿病患者329例,其中男183例,女147例;年龄(58.7±12.1)岁。均符合世界卫生组织糖尿病诊断标准。根据颈部及下肢血管彩色超声结果,将329例患者分为分为非斑块组(A组,n=99)、单纯颈动脉或下肢动脉斑块组(B组,n=115)以及颈动脉和下肢动脉复合斑块组(C组,n=115)。排除标准:1型糖尿病和继发性糖尿病患者,排除有糖尿病酮症酸中毒、糖尿病非酮症高渗性昏迷等糖尿病急性并发症患者,排除孕妇及哺乳期患者,排除有免疫性疾病史、肝炎、心功能不全、肾功能不全患者。
1.2 记录患者人口学资料
基本信息包括性别、年龄、病程、用药史、吸烟史、饮酒史、原发性高血压(高血压)病史、心血管疾病病史、脑血管事件病史;体格检查包括身高、体质量、腰围、臀围、血压。
1.3 记录患者入院时实验室检查资料
包括空腹血糖(FPG)、糖化血红蛋白(HbA1C)、三酰甘油(triacylglycerol,TG)、总胆固醇(total cho⁃lesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、肌酐(Cr)、尿微量白蛋白等。
1.4 诊断标准
糖尿病和糖尿病并发症的诊断标准参照《中国2型糖尿病防治指南》(2013年版)[3]。高血压诊断标准为收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg。心血管事件(cardiovas⁃cular events,CVEs)包括心绞痛、心肌梗死、缺血性心脏病等;脑血管事件(cerebrovascular events,CBVEs)包括短暂性脑缺血、缺血性或出血性脑卒中等。CVEs、CBVEs的诊断主要依据既往或现有影像学资料以及病史诊断等。
1.5 颈动脉及下肢动脉超声检查
使用Philips公司IU22型彩色超声仪和C12-5超宽频带线阵探头,采用8~10 MHz进行颈动脉及下肢动脉超声检查。颈动脉测定部位为双侧颈总动脉、颈动脉分叉处、颈内动脉、锁骨下动脉;下肢动脉测定部位为双侧股总动脉、径前动脉、径后动脉、腓动脉。选择超声束与血流夹角小于60°,测量血管内径、内膜-中层的厚度(intimamedia thickness,IMT),观察有无斑块、管腔狭窄影或管腔闭塞情况。当IMT≥1.5 mm或IMT比相邻部位增厚>50%者为血管斑块[5]。
1.6 统计学分析
所有数据采用SPSS 19.0软件进行统计处理。正态分布计量资料应用()表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;偏态资料以M(P25~P75)表示,不同组间比较用秩和检验。计数资料用率表示,组间比较采用卡方检验。两变量间相关性分析用Pearson相关或Spearman秩相关进行分析。影响因素分析采用多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组临床资料比较
329例患者中单纯颈动脉斑块69例,单纯下肢动脉斑块46例,同时有颈动脉斑块与下肢动脉斑块115例。非斑块组年龄、病程、收缩压、尿微量白蛋白均低于其他两组,差异有统计学意义(P<0.05)。与其他两组相比,复合斑块组年龄更大、病程更长,糖化血红蛋白、尿微量白蛋白、血清肌酐更高,而舒张压、体质量、体质量指数更低,差异有统计学差异(P<0.05)。其余指标如性别、吸烟史、饮酒史、空腹血糖、空腹C肽、血清尿酸、TC、TG、HDL-C、LDL-C在各组间比较,差异均无统计学意义(P>0.05),详见表1、表2、表3。
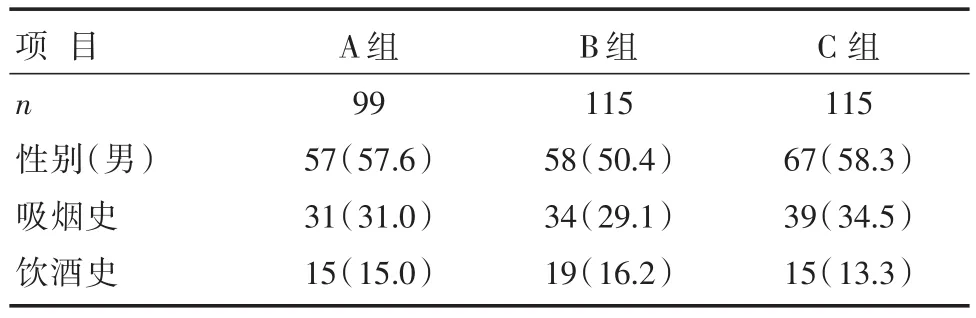
表1 3组计数临床资料比较 [n(%)]
表2 3组正态分布计量临床资料比较 [±s]
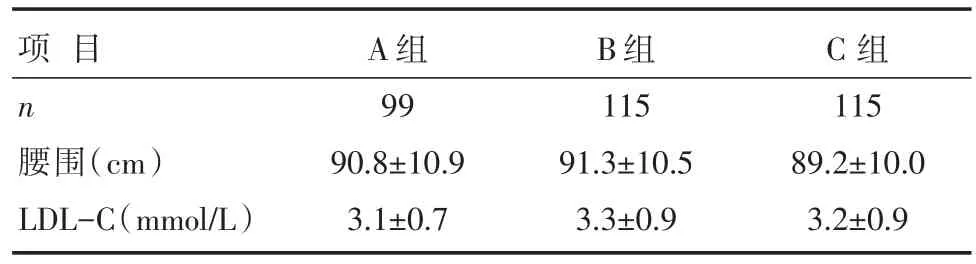
表2 3组正态分布计量临床资料比较 [±s]
项目n腰围(cm)LDL-C(mmol/L)A组99 90.8±10.9 3.1±0.7 B组115 91.3±10.5 3.3±0.9 C组115 89.2±10.0 3.2±0.9

表3 3组非正态分布计量临床资料比较 [M(P25~P75)]
2.2 3组糖尿病并发症发生率比较
3组糖尿病并发症发生率比较,见图1、图2。两斑块组糖尿病视网膜病、糖尿病肾病、高血压患病率均大于非斑块组,差异有统计学意义(P<0.05)。联合斑块组糖尿病足、CVEs、CBVEs患病率均大于非斑块组,差异有统计学意义(P<0.01),其发生风险分别增加1.7倍(95%CI:1.3~2.2)、1.5倍(95%CI:1.2~1.9)、1.6倍(95%CI:1.3~2.0)。联合斑块组与单纯斑块组相比,糖尿病足及CBVEs患病率进一步升高,差异有统计学意义(P<0.05),其发生风险分别增加1.7倍(95%CI:1.3~2.2)、1.5倍(95%CI:1.2~1.9)。单纯斑块组与非斑块组相比,糖尿病足、CVEs、CBVEs患病率比较,差异无统计学意义(P>0.05)。3组周围神经病变患病率比较,差异无统计学意义(P>0.05)。

图1 3组糖尿病并发症发生率比较图1(DR:糖尿病视网膜病变;DKD:糖尿病肾病;DPN:糖尿病外周神经病变;DF:糖尿病足)

图2 3组糖尿病并发症比较图2(Hypertension:高血压)
2.3 3组颈动脉血管内中膜厚度及股动脉血管内中膜厚度比较
联合斑块组颈动脉IMT显著高于非斑块组及单纯斑块组,差异有统计学意义[(1.27±0.21)mmvs.(0.91±0.28)mmvs.(1.13±0.26)mm,P<0.01]。同样地,联合斑块组颈动脉IMT显著高于非斑块组及单纯斑块组,差异有统计学意义[(1.21±0.09)mmvs.(0.96±0.23)mmvs.,(1.14±0.18)mm,P<0.01]。
2.4 年龄与患者血管斑块及血管并发症的相关分析结果
参考GBD2000[4]年龄划分标准,将患者按年龄≤44岁,45~60岁,60~69岁以及≥70岁分成4个亚组,各亚组分别42、132、88、66例,各年龄亚组糖尿病患者血管斑块患病率及心脑血管意外发生率所占比例见图3~图6。由图可知随着年龄的增加,患者外周血管病变患病率不断增加,而心脑血管病事件的发生率亦同步增加。在同一年龄亚组中,对不同斑块组心脑血管事件的发生率进行比较,结果发现,45~60岁亚组患者中,复合斑块组患者CBVEs发生率高于其他两组,差异有统计学意义(P<0.05),见图7。

图3 各年龄亚组糖尿病患者血管斑块患病率所占比例统计图
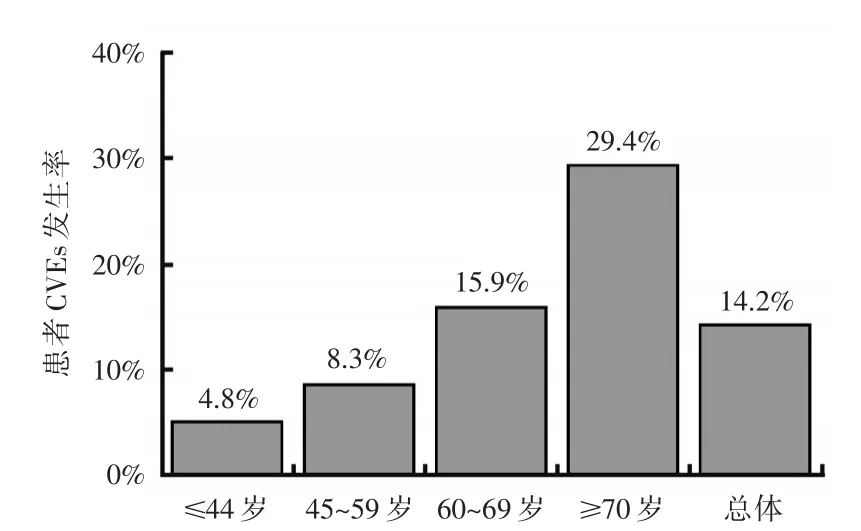
图4 各年龄亚组糖尿病患者CVEs发生率统计图

图5 各年龄亚组糖尿病患者CBVEs发生率统计图
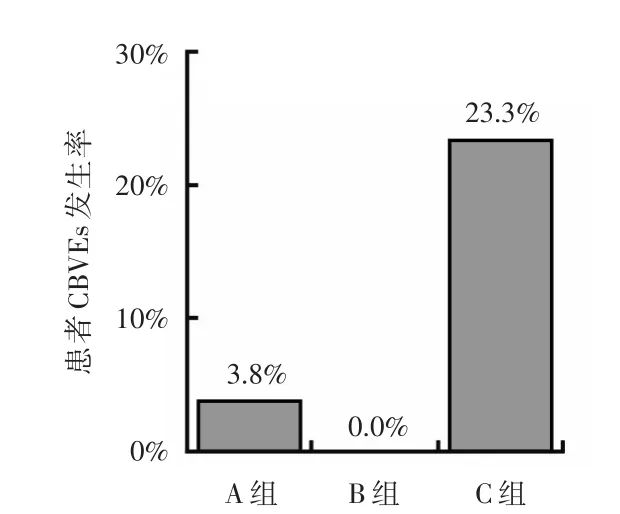
图6 45~59岁年龄亚组糖尿病患者CBVEs发生率统计图
2.5 病程与患者血管斑块及血管并发症的关系
按照总体患者糖尿病病程的四分位数,将患者按病程分为<2年,2~6年,7~13年以及>13年4个亚组,各亚组分别为69、83、82、95例,各病程亚组糖尿病患者血管斑块患病率所占比例见图7。由图7可知随着病程增加,患者外周血管病变患病率不断增加。与年龄因素相似,患者发生心脑血管事件的发生率同样随着病程增加而增加。

图7 各病程亚组糖尿病患者血管斑块患病率所占比例统计图
2.6 多因素Logistic回归分析
以年龄、病程、收缩压、舒张压、体质量、体质量指数、血清肌酐、尿微量白蛋白为自变量,以糖尿病血管斑块为因变量,进行多因素逐步Logistic回归分析。结果发现,糖尿病动脉斑块变与患者年龄、血压、尿微量白蛋白相关,见表4。
3 讨 论
由于血管彩色超声技术的普及,颈部或下肢血管彩色超声检查现已常用于糖尿病患者动脉粥样硬化的筛查及随访。大量临床研究表明,颈部或下肢动脉粥样硬化能很好地用作评估不同患者发生心脑血管事件的风险。然而,国内外大多数研究集中于单一使用颈动脉IMT对于心脑血管事件发生风险的预测。很少有研究能够涉及到颈部血管彩色超声与下肢血管彩色超声联合评估患者动脉粥样硬化与糖尿病大血管病变之间的关系。为此,本研究回顾性分析了本院住院的糖尿病患者颈部及下肢血管斑块发生情况,在329例患者中,单纯颈动脉斑块、单纯下肢动脉斑块、颈动脉及下肢联合斑块的患病率分别为21.0%、14.0%、34.9%,总体斑块患病率69.9%。本研究进一步比较了各组患者糖尿病微血管病变(糖尿病肾病、糖尿病视网膜病变)及糖尿病大血管病变(糖尿病足、心脑血管事件)之间的关系,结果发现无论是单纯斑块组或联合斑块组的患者发生微血管病变的患病率均比非斑块组高,但是联合斑块的出现能进一步增加患者发生糖尿病足及心脑血管意外等大血管并发症的风险。
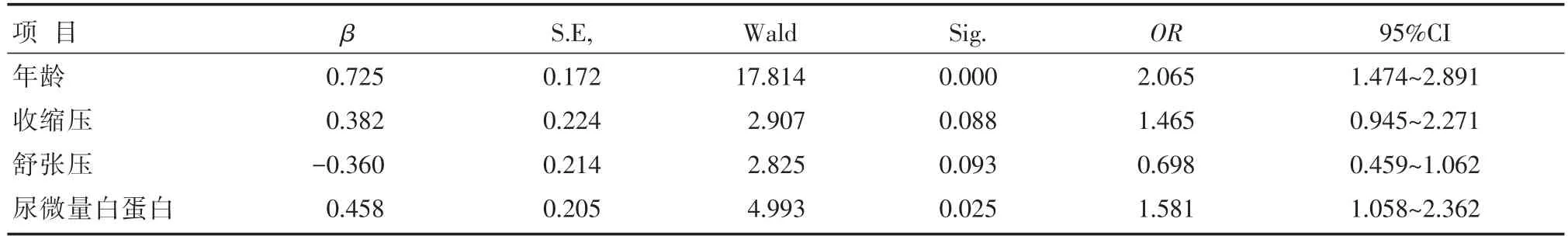
表4 多因素Logistic回归分析结果
糖尿病患者本身存在多种复杂的能促进动脉粥样硬化的有害代谢异常,如高血糖、胰岛素作用受损或胰岛素缺乏、血脂异常以及高血压、肥胖、微量蛋白尿等。这些有害代谢异常长期累积作用能使血管内皮细胞功能紊乱,继而导致一氧化氮及前列环素缺乏。此外,血管内皮下富含载脂蛋白B(apoB)的脂蛋白沉淀能激活由单核-巨噬细胞主导的一系列炎症反应。而这些炎症细胞与增殖的平滑肌细胞、细胞外基质共同促进了血管内皮病变以及血管斑块的形成[5]。若斑块破裂和血栓形成时可引起急性心肌梗死、缺血性或出血性脑卒中、肢端缺血性坏疽等严重不良后果。
众所周知,年龄是影响动脉粥样硬化的重要因素。随着年龄及病程的增长,动脉粥样硬化似乎是不可逆转的趋势。本研究结果显示,在不同年龄亚组的患者中,患者外周血管斑块及心脑血管事件患病率明显不同。然而,糖尿病患者血管斑块的患病率很高,在年轻糖尿病患者(年龄<45岁)中,业已有将近50%患者发现颈部或下肢血管斑块,而在高龄亚组(年龄>70岁)中其比例亦超过90%。相似地,在糖尿病病程<2年的患者中外周血管病变患病率超过50%,随着病程增加,外周血管病变的患病率也同样不断增加。本研究结果说明糖尿病患者外周血管斑块患病率很高,总体斑块患病率接近70%,并且即使在相对年轻、糖尿病病程较短的患者中其患病率可达50%。
国内有研究报道,在校正性别、年龄、病程后,有外周血管斑块的患者发生CBVEs的风险是无外周血管斑块患者的4.7倍[6]。在英国老年人群中,下肢血管斑块患者发生缺血性心脏病的风险增加1.7倍[7]。在本研究中还进一步发现,若患者仅有单纯颈动脉或下肢动脉出现血管斑块时,与无血管斑块患者相比其发生心脑血管意外及糖尿病足等血管并发症的风险并没有显著提高。然而,若患者同时合并颈部及下肢血管斑块时,则发生血管并发症的风险显著升高。此外,在中老年亚组(年龄45~59岁)中,联合斑块组发生脑血管意外风险仍高于其他两组,这说明即使在校正年龄因素后,若患者同时合并颈部及下肢血管斑块则仍会进一步升高发生动脉粥样硬化血管并发症的风险。
有许多临床研究表明,颈动脉IMT能作为预测不良大血管后果的强力指标[7]。然而,近年来更多研究表明,测量血管斑块比IMT更能有效预测心脑血管事件的发生[8-10]。如在 Brook[9]的挪威大规模人群研究中,颈动脉斑块总面积是预测冠状动脉事件的强有力的手段,相反,通常作为测量颈总动脉远端腔壁厚度的IMT则不能预测冠状动脉事件。而在本研究中,虽然单纯斑块组及联合斑块组颈动脉IMT及下肢动脉IMT均比单纯斑块组高,但是单纯斑块组发生CVEs的风险并没有明显升高,而联合斑块组发生心脑血管的风险却显著升高,说明联合血管斑块的出现能更好地预测CVEs的发生。
糖尿病是动脉粥样硬化的独立危险因素。有研究表明,糖尿病患者高血糖与动脉粥样硬化呈正相关[10],即使在空腹血糖及糖耐量异常人群中,随着糖化血红蛋白的升高,患者发生动脉粥样硬化的风险也随着升高[11]。在本研究中,联合斑块组糖化血红蛋白浓度亦比其他两组高,同样说明长期高血糖状态能促进动脉粥样硬化。另外,高血压是另一促进动脉粥样硬化进展的重要危险因素。在本研究中,无论单纯斑块组还是联合斑块组高血压患病率均高于非斑块组。UKPD研究证实严格血压控制能明显降低2型糖尿病患者大血管事件发生的危险性,结果显示收缩压平均下降10 mmHg,糖尿病患者病死率下降5%,心肌梗死病死率下降11%[2]。糖尿病可以引起致动脉粥样硬化的血脂异常,如TG升高、HDL-C降低。而他汀类药物一直被认为是治疗动脉粥样硬化的重要手段。如在日本的急性冠脉综合征研究[12]中,在8~12个月的强化降脂过程中,匹伐他汀使原有的冠状动脉血管斑块缩小16.9%,阿托伐他汀能缩小18.1%。由于他汀类药物的广泛应用,并且联合斑块组曾发生心脑血管意外的患病率比其他两组高,其长期应用他汀类药物的比例更高,所以,本研究未能观察到3组患者血脂之间的差异有统计学意义。除以上危险因素外,同时合并颈部及下肢血管斑块患者与其他两组患者相比有更多促进动脉粥样硬化的危险因素。除年龄更大、病程更长外,联合斑块组块患者糖化血红蛋白、尿微量白蛋白、收缩压、血清肌酐也更高。除增龄外,本研究发现尿微量白蛋白也是发生外周大血管病变的独立危险因素。
本研究的不足,作为一个对于住院患者的回顾性分析,并不能很好地反映总体糖尿病患者的实际情况,越是高年龄亚组患者其住院原因更多是为了治疗糖尿病或血管并发症,所以本研究对于无血管并发症或病情较轻的高龄患者入组较少,但是这样从另一方面来说合并血管斑块的患者更容易发生心脑血管事件。此外,本研究样本量相对仍较小,需要大规模临床队列研究进一步证明。
总而言之,糖尿病外周血管病变患病率很高,总体患病率可达70%;即使在早期糖尿病患者中亦常可发现外周血管斑块,随着年龄及病程增长,外周血管病变不断加重,若由单纯的颈部或下肢血管斑块进展至联合斑块时,患者发生心脑血管事件等血管并发症风险明显增加。因为未经治疗的糖尿病患者合并外周血管病变比血糖正常并发外周大血管病变患者病死率更高[13]。所以,糖尿病患者早期发现颈部或下肢血管斑块时,应当采取积极的综合治疗,控制血糖、血压、尿酸,纠正血脂紊乱等,以减缓并预防动脉斑块进一步发展,避免不良后果发生。
[1]GBD 2015 Mortality and Causes of Death Collaborators.Glob⁃al,regional,and national life expectancy,all-cause mortali⁃ty,and cause-specific mortality for 249 causes of death,1980-2015:a systematic analysis for the Global Burden of Disease Study 2015[J].Lancet,2016,388(10053):1459-1544.
[2]UK Prospective Diabetes Study(UKPDS) Group.Intensive blood-glucose control with sulphonylureas or insulin compared with conventionaltreatment and risk of complications in patients with type 2 diabetes(UKPDS 33).UK Prospective Diabetes Study(UKPDS)Group[J].Lancet,1998,352(9131):837-853.
[3]中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,22(8):2-42.
[4]SHIBUYA K,MATHERS C D,BOSCHI-PINTO C,et al.Global and regional estimates of cancer mortality and incidence by site:II.Results for the global burden of disease 2000[J].BMC Cancer,2002,2:37.
[5]TABAS I.2016 Russell ross memorial lecture in vascular biolo⁃gy molecular-cellular mechanisms in the progression of athero⁃sclerosis[J].Arterioscler Thromb Vasc Biol,2017,37(2):183-189.
[6]LI M F,ZHAO C C,LI T T,et al.The coexistence of carotid and lower extremity atherosclerosis further increases cardiocerebrovascular risk in type 2 diabetes[J].Cardiovasc Diabe⁃tol,2016,15:43.
[7]LORENZ M W,PRICE J F,ROBERTSON C,et al.Carotid intima-media thickness progression and risk of vascular events in people with diabetes:results from the PROG-IMT collabora⁃tion[J].Diabetes Care,2015,38(10):1921-1929.
[8]SPENCE J D,HACKAM D G.Treating arteries instead of risk factors:a paradigm change in management of atherosclerosis[J].Stroke,2010,41(6):1193-1199.
[9]BROOK R D,BARD R L,PATEL S,et al.A negative carotid plaque area test is superior to other noninvasive atherosclerosis studies for reducing the likelihood of having underlying signifi⁃cant coronary artery disease[J].Arterioscler Thromb Vasc Biol,2006,26(3):656-662.
[10]JOHNSEN S H,MATHIESEN E B,JOAKIMSEN O,et al.Carotid atherosclerosis is a stronger predictor of myocardial infarction in women than in men:a 6-year follow-up study of 6226 persons:the Tromso Study[J].Stroke,2007,38(11):2873-2880.
[11]HENRY R M,KOSTENSE P J,SPIJKERMAN A M,et al.Ar⁃terial stiffness increases with deteriorating glucose tolerance sta⁃tus:the Hoorn Study[J].Circulation,2003,107(16):2089-2095.
[12]RUBIN J,NAMBI V,CHAMBLESS L E,et al.Hyperglyce⁃mia and arterial stiffness:the Atherosclerosis Risk in the Com⁃munities Study[J].Atherosclerosis,2012,225(1):246-251.
[13]HIRO T,KIMURA T,MORIMOTO T,et al.JAPAN-ACS In⁃vestigators Effect of intensive statin therapy on regression of cor⁃onary atherosclerosis in patients with acute coronary syndrome:a multicenter randomized trial evaluated by volumetric intravas⁃cular ultrasound using pitavastatin versus atorvastatin(JAPANACS[Japan assessment of pitavastatin and atorvastatin in acute coronary syndrome]study)[J].J Am Coll Cardiol,2009,54(4):293-302.
[14]GOLLEDGE J,QUIGLEY F,VELU R,et al.Association of impaired fasting glucose,diabetes and their management with the presentation and outcome of peripheral artery disease:a co⁃hort study[J].Cardiovasc Diabetol,2014,13:147.
Analysis on risk factors of carotid and lower limb atherosclerotic lesions in hospitalized patients with type 2 diabetes mellitus
ZHOU Xie-da1,2,CHEN Yan1,XIAO Huang-meng1,LIN Jiang-cai2,LI Yan-bing1,XIAO Hai-peng1,CAO Xiao-pei1,
(1.Department of Endocrinology,The first Affilated Hospital,Sun Yat-sen University,Guangzhou 510080,China;2.Department of Endocrinology,Jiangmen Central Hospital,Jiangmen ,Guangdong 529030,China)
Objectives To analyze the incidence of carotid and lower limb atherosclerotic lesions in type 2 diabetic patients and the relationship of that with other diabetes complications.MethodsA total of 329 hospitalized diabetic patients were assigned to non-atherosclerotic plaque group(n=99,30.1%),either carotid or lower limb atherosclerotic plaque group(n=115,35.0%),and carotid with lower limb atherosclerotic plaque group(n=115,34.9%)according to the vessel ultrasound results.The risk factors associated with atherosclerotic plaque were evaluated via binary Logistic regression in patients with diabetes.ResultsAtherosclerosis was significantly associated with age(OR=2.065,P=0.000),systolic pressure(OR=1.465,P=0.088),diastolic pressure(OR=0.698,P=0.093),urine microalbumin(OR=1.5815,P=0.05).Prevalence of diabetic foot,cerebrovascular events were significantly higher in carotid with lowerlimb atherosclerotic plaque group than in the othergroups(P<0.05).Prevalence of cardiovascular events in carotid with lower limb atherosclerotic plaque group was significantly higher than that in the non-atherosclerotic plaque group(P<0.05).ConclusionsPrevalence of atherosclerosis was very high in Chinese inpatients with type 2 diabetes,and atherosclerosis was obviously related to age and diabetes duration.Besides,it is widely detected in early diabetes and progress along with age and diabetes duration.The concomitant presence of carotid and lower extremity atherosclerosis further increases cardio-cerebrovascular risk in patients with type 2 diabetes.
type 2 diabetes;diabetic macrovascular disease;atherosclerotic plaque;atherosclerosis
R587.1
A
1007-9688(2017)03-0308-06
10.3969/j.issn.1007-9688.2017.03.17
2017-01-11)
周谢达(1989-),男,在读硕士研究生,研究方向为糖尿病大血管病变。
曹筱佩,E-mail:caoxp@mail.sysu.edu.cn