2型糖尿病合并肺癌瘤组织中COX-2的表达及意义
2017-07-24穆维新王耀贤闫立曼
穆维新 王耀贤 闫立曼
·论著·
2型糖尿病合并肺癌瘤组织中COX-2的表达及意义
穆维新 王耀贤 闫立曼
目的 通过检测COX-2在2型糖尿病合并肺癌癌组织与单纯肺癌癌组织中的表达,探讨其在2型糖尿病合并肺癌癌组织发生发展中的作用及临床意义。方法 收集2型糖尿病合并肺癌(试验组)与单纯肺癌(对照组)2组手术切除的癌组织病理石蜡切片各50例。采用免疫组化的方法检测COX-2在2组癌组织中的表达差异。结果 2型糖尿病合并肺癌及单纯肺癌瘤组织中COX-2的表达积分光密度值分别为173.6±11.5,125.4±10.9,差异有统计学意义(P<0.05)。结论 2型糖尿病合并肺癌癌组织中COX-2表达升高,可能是2型糖尿病合并肺癌愈后差的原因之一。
2型糖尿病合并肺癌;单纯肺癌;免疫组化;COX-2
恶性肿瘤和2型糖尿病在世界范围内成为主要两大慢性非传染性疾病,是常见病、多发病及终生性疾病,恶性肿瘤中肺癌成为当今发病率及病死率增长最快的疾病,是严重威胁人类健康的恶性肿瘤之一。迄今,肺癌是最主要的肿瘤相关性死因之一,随着对肺癌发病机制的不断深入研究,在肺癌的诊断及治疗方面取得了一些成果,但是肺癌的5年生存率和患者的生活质量仍然没有大的提高,在今天的我国,肺癌的患病率及病死率已升至恶性肿瘤之冠[1],在肺癌病理分型中,以非小细胞肺癌(NSCLC)为多见,因此也是当前研究的热点。当前,研究者急需解决的难题是怎样提高肺癌的诊治水平,改善患者的生存率及生活质量。同样,糖尿病随着人民生活的改善,膳食传统模式的改变,尤其是摄入高脂肪、高糖类、高蛋白类、高热量的食物等,糖尿病也成了多发病及常见病。其中2型糖尿病占据本病群体95%。近年来研究认为2型糖尿病患者并发恶性肿瘤的危险性增加,发病率比正常人群高达两倍甚至还多[2,3]。2型糖尿病合并恶性肿瘤病人多在中晚期,且愈后较差[4]。其中,肺癌发病率在2型糖尿病并发恶性肿瘤中位居前三位[5]。流行病学调查显示2型糖尿病和肺癌有许多共同的危险因素,比如吸烟、老年、环境因素、生活方式等等,另外2型糖尿病造成的代谢免疫功能紊乱、高血糖、肺损伤、肺部感染、高胰岛素血症等均可能增加肺癌的危险度,但具体原因不详,国内外研究较多。从动物实验研究认为炎性因子环氧合酶-2(COX-2)参与了2型糖尿病大鼠的肺炎性损伤,一些研究证明人类的非小细胞肺癌中COX-2表达水平增高[6],是否参与了2型糖尿病并发肺癌的发生发展并导致愈后差未见报道。
1 资料与方法
1.1 一般资料 选取河北医科大学第四医院2004年1月至2014年1月所有临床资料比较完整的肺癌标本石蜡包埋癌组织,所有病例均外科手术或其他方式病理检查证实为肺癌,其中共计10 618例,其中单纯肺癌10 012例,2型糖尿病合并肺癌575例。我们选取2014年2型糖尿病合并肺癌(试验组,选取病例均为腺癌)与单纯肺癌(对照组,选取病例均为腺癌)患者100例。其中试验组男28例,女22例;年龄39~76岁,平均年龄56.20岁;其病程2型糖尿病均在2年以上,其中Ⅰ期5例,Ⅱ期35例,Ⅲ10例,以上病例均无合并其他疾病。对照组男31例,女19例;年龄43~78岁,平均年龄58.40岁,其中Ⅰ期6例,Ⅱ期33例,Ⅲ11例,以上病例均无合并其他疾病。2组手术切除的癌组织病理石蜡切片各50例,做免疫组化检测COX-2的表达。2组一般资料具有可比性。
1.2 2型糖尿病诊断标准 肺癌临床分期按照国际TNM标准 (UICC 2009)。2型糖尿病诊断标准按照1999年世界卫生组织发布标准。满足下面条件任意一项:(1)有糖尿病症状+任意时间血浆葡萄糖浓度≥11.1 mmol/L;(2)空腹血浆葡萄糖浓度≥7.0 mmol/L; (3)餐后2 h血糖浓度≥11.1 mmol/L。
1.3 试剂及仪器设备
1.3.1 试剂:兔抗人COX-2多克隆抗体(Santa Cruz公司);链霉素抗生物素蛋白-过氧化物酶(SP)免疫组化试剂盒(福州迈新生物技术公司);二氨基联苯胺(DAB)显色试剂盒(福州迈新生物技术公司);PBS缓冲液等(福州迈新生物技术公司)。
1.3.2 仪器设备:显微镜:日本奥林巴斯IX71荧光倒置显微镜;CCD:Discovery C15;IS Capture成像软件采集系统;切片机:德国莱卡RM2015;离心机:北京离心机厂LDZ5-2型;电子天平:瑞士METTER AE100型;移液器:德国EPPENDORF;干燥箱:日本三洋MIR-153型;低温冰箱:日本三洋MDF-382E型;恒温水浴箱:江苏太仓医用仪器厂DSHZ-300型;医用微波炉:浙江临安爱迪仪器厂YWY781B型。
1.4 免疫组化方法
1.4.2 显微镜观察:选择试验组和对照组的阳性和阴性组织相、进行200×和400×的显微照相。
1.4 3 图像分析:计算机图像处理系统由CMOS(日本OLYMPUS公司)及专用软件(美国Media Cybernetics 公司Image-Pro Plus)组成。依据阳性免疫反应的图像灰度选择合适的灰度分割阈值,实现双阈值分割,得到样品的半灰度目标图像,以人机交互方式测定阳性免疫染色强度及面积。每组取50例,每例测5个视野。由计算机计算出所测阳性反应物相对含量的灰度值及面积。选择有意义的组织相,经登录、编号、采集、分析、读取数据、最后存盘。
2 结果
2.1 COX-2阳性染色 其主要定位在核膜,位于肺癌癌细胞的胞浆中,胞浆呈棕黄色弥漫性分布。2型糖尿病合并肺癌组较单纯肺癌组棕黄色颗粒比较粗大。试验组随着患者TNM分期的增加,棕黄色颗粒染色更加深染,Ⅰ期、Ⅱ期、Ⅲ期免疫染色强度及面积积分光密度值分别为(162.4±8.9),(171.3±9.6),(180.4±10.3)。对照组同样随着TNM分期不同,棕黄色颗粒染色变化随分期增加而加深,Ⅰ期、Ⅱ期、Ⅲ期免疫染色强度及面积积分光密度值分别为(119.6±7.9),(121.8±10.5),(128.7±11.5),2组差异无统计学意义(P>0.05)。见表1,图1、2。

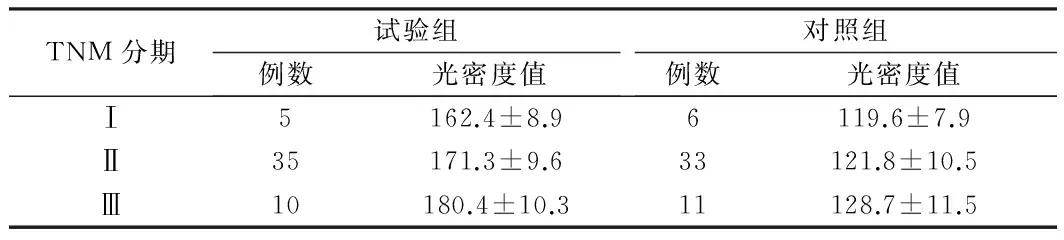
TNM分期试验组例数光密度值对照组例数光密度值Ⅰ5162.4±8.96119.6±7.9Ⅱ35171.3±9.633121.8±10.5Ⅲ10180.4±10.311128.7±11.5
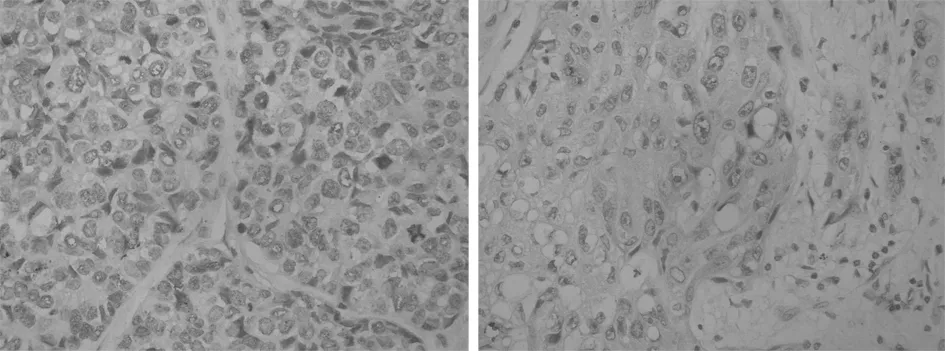

图1 试验组HE染色(×200)图2 对照组HE染色(×200)
2.2 免疫荧光染色成绿色 经测定阳性免疫染色强度及面积,COX-2积分光密度值试验组与对照组分别为(173.6±11.5),(125.4±10.9),试验组表达COX-2明显高于对照组,且随着分期的增加,其表达的积分光密度值有增加,2组差异有统计学意义(P<0.01)。见表2,图3、4。


项目试验组对照组光密度值173.6±11.5125.4±10.9
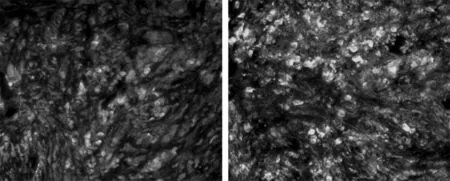

图3 试验组免疫荧光 染色(×200)图4 对照组免疫荧光 染色(×200)
3 讨论
肺癌是美国最常见的恶性肿瘤之一,在男性和女性中均为肿瘤死亡的首要原因,在美国每年死亡人数超过乳腺癌、结肠癌、前列腺癌和胰腺癌的总和[7]。在世界范围内,肺癌同样是肿瘤死亡的首要原因,估计每年有150万人死于肺癌[8]。糖尿病跟癌症同样是快速增长的慢性非传染性疾病之一,随着糖尿病发病率的快速增加,其并发症的研究越来越广泛越来越深入,国内外关于糖尿病合并肺癌的流行病学研究认为2型糖尿病增加肺癌的风险,且发现时多为中晚期[4],具体发病机制不详。肿瘤的发生、进展和转移是在宿主反应的情况下进行的,越来越多的证据证明肿瘤生成的炎性反应在机体免疫系统与恶性肿瘤相互作用中起了重要作用。虽然基因的改变在正常机体细胞转化成恶性肿瘤细胞的过程中特别重要,但是恶性肿瘤微环境中的炎性反应在恶性肿瘤发展到转移癌的过程中也是非常重要,所以炎性反应、宿主的免疫系统及恶性肿瘤之间的关系越来越广泛的被大家所接受[9]。
恶性肿瘤与炎症/免疫系统之间的作用通过免疫监视、免疫编辑、肿瘤形成中宿主机体细胞网络的共同调控、肿瘤介导的免疫抑制等方面交互作用的。其中炎性因子环氧化酶(COX)起重要作用,COX也称前列腺素内过氧化酶或是前列腺素G氢化氧化物,具有脂肪酸环氧合酶及前列腺素(PG)氢过氧化物酶两种活性,COX有三种形式,其中COX-1分布在多数机体细胞和组织中,它能够促使花生四烯酸(AA)生成前列腺素(PG),其在体内起着抑制胃酸分泌以保护胃黏膜和维持肾脏血流的作用。其活性完全依赖于底物,而COX-2是一种诱导型的同工酶, COX-2是由花生四烯酸合成前列腺素和血栓烷素的限速酶,是一种双功能酶,正常人机体内几乎不能检测到,仅仅在当人体机体细胞受到刺激因素如外伤、感染、生长因子、促癌剂、细胞因子等刺激后开始迅速合成,在静息状态下并不表达,可参与包括肿瘤在内的多种生理病理过程[10]。COX-2长约8.3 kb,是由10个外显子及 9个内含子构成,其位于第1号染色体的 q25.2~q25.3, 其中 5′端含有 CpG 岛,内有多个转录因子结合位点,可编码 604个氨基酸,COX-2主要定位在细胞核膜上,分布在内质网的胞质侧和细胞膜上。在病理情况下,可能参与炎症、疼痛、发热及肿瘤的形成,COX-3被认为是保留了内含子和突变因子的COX-1遗传变异体,因此又称COX-1B。所有COX的存在形式也就是亚型在结构特征上是相似的,它们有一个疏水性的通道,这个通道可以使花生四烯酸带着发夹构型进入COX的催化区域。当机体受刺激诱导产生COX-2后,使AA大量转变为PG和血栓素,促进白三烯及羧基环氧素等炎性介质产生,引起严重的炎性反应,同时吸引大量炎性细胞及因子共同发生炎性反应,在临床中使用的非甾体抗炎药正是抑制COX-2的活性降低PG的合成发挥抗炎作用。国内外相关研究认为患者长期使用非甾体抗炎药物,胃肠道肿瘤相对危险度为0.57,也就是用药后胃肠道肿瘤的发生率下降了43%,同时还发现使用超过5年患者其胃肠道肿瘤患病的相对危险度为0.21,并得出服用年限与肿瘤发生危险度呈负相关关系[11]。据上述报道,非甾体抗炎药是否能明确降低癌症的发生率及其机制备受关注。国外一些学者研究证明人类非小细胞癌(NSCLC)中组成性环氧化酶-2(COX-2)的表达水平增高[12],在肺癌形成过程中有重要作用。Khuri等用原位杂交的方法检测了160例NSCLCI期患者的标本中COX-2的表达,并观察到了COX-2过表达预示了患者更短的生存期,COX-2高表达降低了总生存率并且减少了无瘤生存率[13]。Tsubochi等[12]研究在Ⅰ期肺腺癌患者中COX-2的表达和预后不良相关。另外有研究显示在癌前病变中COX-2表达增加[14]。COX-2在肿瘤形成的机制可能是:(1)通过增加肿瘤组织血管生成,炎性反应和酪氨酸激酶受体通路构成了由许多对恶性表型有贡献的调节因子组成的复杂网络。其中COX-2和表皮生长因子受体(EGFR)的交互信号是这些通路中被研究最深入之一。研究认为COX-2和EGFR可以相互作用来调控细胞的增殖、转移及入侵[15],这引起了研究者使用COX-2和EGFR抑制剂联合治疗NSCLC的兴趣,EGFR抑制剂可以减少血管生成因子比如白介素-8(IL-8)和血管内皮生长因子(VEGF)的产生,这也是COX-2抑制剂抑制血管生成的机制之一[16]。Toamey等[17]研究报道COX-2可能通过产生降解细胞外基质(ECM)的蛋白诱导新生血管的生成。基质金属蛋白酶(MMPs)是降解ECM的一种酶,其可促进肿瘤细胞向周围浸润,并可帮助内皮细胞向远处迁移,增强肿瘤细胞转移能力,当COX-2转录受抑制时,MMP-7基因的转录和翻译也受到限制,这样,COX-2通过上调MMP-7的表达降解ECM。(2)增强侵袭力,在COX-2代谢产物中前列腺素E2(PGE2)在肿瘤微环境中广泛大量存在,是一个重要的调控免疫因子,同时也调控着内皮细胞的生长、浸润和上皮细胞的存活[15]。前列腺受体属于G蛋白耦联受体(GPCR)超家族,是通过EP1、EP2、EP3、EP4这4个GPCR发挥多种作用,PGE2通过EP4受体的信号通路在介导NSCLC的浸润,且抑制肿瘤COX-2可以降低MMP-2、CD44和EP4受体的表达和浸润,提示PGE2在NSCLC患者中通过EP受体信号通路调控COX-2依赖的、CD44和MMP-2介导的浸润[18]。(3)降低宿主免疫力,在肺癌及其他恶性肿瘤中,肿瘤诱导的免疫抑制是公认的,以前的研究证实在NSCLC中肿瘤细胞过表达COX-2是导致肺癌免疫抑制网络的原因,在一些恶性肿瘤中COX-2的同工酶活性在恶性肿瘤组织中较其正常组织明显增高,且在肺癌中COX-2同样会过表达[19]。在肺癌小鼠模型,特异基因或药物抑制COX-2可以明显的缩小肿瘤的大小。(4)促进肿瘤细胞增殖及抗凋亡等方式参与了多种肿瘤发生发展,Thiel等[20]学者研究发现,COX-2能够延长细胞周期的G1期,其能通过降低细胞周期蛋白含量从而抑制细胞凋亡,并增加正常细胞发生突变的几率。
我们的本课题的研究证明了2型糖尿病合并肺癌患者的COX-2比单纯肺癌组患者有更高的表达,并且发现肿瘤TNM分期级别越高,其表达越高,可能是2型糖尿病合并肺癌患者预后更差的原因之一。一些研究显示在肺癌的前期病灶COX-2表达增高,于是许多学者开始研究着眼COX-2抑制剂在化学预防方面可能存在的治疗作用。Mao等[21]学者通过口服6个月的塞来昔布(celecoxib)给予重度吸烟者,进行肺泡灌洗液和活检等支气管检查,结果显示了应用该药作为预防用药的可行性。最新研究Sung等[22]研究人员通过MTT实验检测药物处理肿瘤的敏感性,采用二乙酸二氯荧光素测量活性氧的产生,该研究显示celecoxib联合化疗药物5-氟尿嘧啶可能增强抗鳞状细胞癌的疗效。并且认为这种联合治疗的可能主要机制是阻断AKT通路产生活性氧增强抗癌疗效。更大的以安慰剂作为对照组的随机临床研究也在进行中,以检测COX-2抑制剂在肺癌预防中的疗效[21]。国内学者王玲婵等[23]通过将肺腺癌A549细胞接种BALB/c雄性裸鼠右侧腋部皮下组织,建立了移植瘤动物模型,研究探讨了COX-2抑制剂艾瑞昔布是否能抑制转移瘤侵袭及转移,结果发现艾瑞昔布能抑制非小细胞肺癌侵袭和转移,他们研究作用机制可能与上调PTEN蛋白和下调cortactin蛋白的表达有关。应用COX-2抑制剂是否能改善2型糖尿病合并肺癌患者的预后,尚待我们以后进一步研究。
1 Alharbi KK.Clinical efficacy and possible applications of genomics in lung cancer.Asian Pac J Cancer Prev,2015,16:1693-1698.
2 Hemminki K,Li X,Sundquist J,et al.Risk of cancer following hospitalization for type 2 diabetes.Oncologist,2010,15:548-555.
3 Zhan YS,Feng L,Tang SH,et al.Glucose metabolism disorders in cancer patients in a Chinese population. Med Oncol,2010,27:177-184.
4 Ellis LM,Hicklin DJ.VEGF-targeted therapy:methanisms of antitumour activity.Nat Rev Cancer,2008,8:579-591.
5 滕家安,秦俭梁,王仁生,等.老年2型糖尿病合并恶性肿瘤252例临床分析.中国老年学杂志,2008,10:2007-2009.
6 Tsuochi HN,Sato M,Hiyama M,et al.Combined analysis of cyclooxygenase-2 expression with p53 and Ki-67 in nonsmall cell lung cancer.Ann Thorac Surg,2006,82:1198-1204.
7 Jemal A,Siegel R,Ward E,et al.Cancer statistics.CA Cancer J Clin,2009,59:225-249.
8 Youlden DR, Cramb SM,Baade PD.The international epidemiology of lung cancer:geographical distribution and secular trends.J Thorac Oncol,2008,3:819-831.
9 DeNardo DG,Johansson M,Coussens LM.Immune cells as mediators of solid tumor metastasis.Cancer Metastasis Rev,2008,27:11-18.
10 陈昕晟,陈真.环氧化酶-2与肝纤维化的关系研究.安徽医药,2013,7:1081-1082.
11 Rothwell PM,Wilson M,Elwin CE,et al.Long term effect of aspinin on colorectal cancer incidence and mortality,20-year follow-up offive randomized trials.Lancet,2010,376:1741-1750.
12 Tsubochi HN,Sato M,Hiyama M,et al.Combined analysis of cyclooxygenase-2 expression with p53 and Ki-67 in nonsmall cell lung cancer.Ann Thorac Surg,2006,82:1198-1204.
13 Khuri FRH,Wu JJ,Lee BL,et al.Cyclooxygenase-2 over expression is a marker of poor prognosis in stage I non-small cell lung cancer.Clin Cancer Res,2001,7:861-867.
14 Hosomi YT,Yokose Y.Increased cyclooxygenase-2(COX-2)expression occurs frequently in precursor lesions of human adenocarcinoma of the lung.Lung Cancer,2000,30:73-81.
15 Krysan KK,Reckamp S,Sharma M,et al.PGE2 activates MAPK/Erk pathway in non-small cell lung cancer cells in an EGF receptor-independent manner.Cancer Res,2005,65:6275-6281.
16 Williams CSM,Tsujii J,Reese SK,et al.Host cyclooxygenase-2 modulates carcinoma growth.J Clin Invest,2000,105:1589-1594.
17 Toamey DP,Murphy JF,Conlon KJ.COX-2,VEGF and tumor angiogenesis.The Surgeon,2009,7:174-180.
18 Dohadwala MJ,Luo L,Zhu Y,et al.Non-small cell lung cancer cyclooxygemase-2 dependent invasion is mediated by CD44.J Biol Chem,2001,276:20809-20812.
19 Huang MM,Stolina S,Sharma J,et al.Non-small cell lung cancer cyclooxygenase-2-dependent regulation of cytokine balance in lymphocytes and macrophages:up-regulation of interleukin 10 and down-regulation of interleukin 12 production.Cancer Res,1998,58:1208-1216.
20 Thiel A,Heinonen M,Rintahaka J,et al.Expression of cyclooxygenase-2 is regulated by glycogen synthase kinase-3beta in gastric cancer cells.Biol Chem,2006,281:4564-4569.
21 Mao JT,Fishbein MC,Adams B,et al.Celecoxib decreases Ki-67 proliferative index in active smokers.Clin Cancer Res,2006,12:314-320.
22 Sung MW,Lee DY,Park SW,et al.Celecoxib enhances the inhibitory effect of 5-Fu on human squamous cell carcinoma proliferation by ROS production.Laryngoscope,2016,26:26309.
23 王玲婵,崔立静,王东昌,等.艾瑞昔布抑制肺腺癌A549细胞裸鼠移植瘤侵袭和转移及机制.中国癌症杂志,2017,27:1-6.
10.3969/j.issn.1002-7386.2017.14.015
项目来源:河北省医学科学研究重点课题计划(编号:ZD20140272)
050100 河北省石家庄市井陉矿区医院(穆维新);河北医科大学第四医院东院急诊科(王耀贤、闫立曼)
王耀贤,050011 石家庄市,河北医科大学第四医院东院急诊科;
E-mail:mmllcc36@sina.com
R 578.1,R 734.2
A
1002-7386(2017)14-2139-04
2017-01-12)
