14-3-3σ基因表达下调促进肾癌细胞增殖
2017-07-24仇炜沈永青张爱莉
仇炜 沈永青 张爱莉
·论著·
14-3-3σ基因表达下调促进肾癌细胞增殖
仇炜 沈永青 张爱莉
目的 检测14-3-3σ在肾癌(renal cell carcinoma,RCC)及相应正常肾组织(normal tissue,NT)中的mRNA及蛋白表达情况,探讨14-3-3σ在RCC中的作用及其作用机制。方法 随机选择47例经肾肿瘤根治性手术治疗的肾癌患者,提取肾癌组织及正常肾组织mRNA及蛋白,使用RT-PCR法检测肾癌及正常肾组织中14-3-3σ mRNA的表达情况,使用Western blot方法检测14-3-3σ蛋白在肾癌及正常肾组织中的表达水平,统计肾癌组织及正常肾组织中14-3-3σ基因的表达差异。转染肾癌786-O细胞,分别使用质粒过表达或siRNA敲低14-3-3σ基因的表达,使用CCK-8法检测786-O细胞在过表达和敲低14-3-3σ基因后的增殖变化。结果 肾癌组织较正常肾组织14-3-3σ基因mRNA表达水平明显降低(P<0.01),且该基因在肾癌组织中的蛋白表达水平也较正常肾组织明显降低 (P<0.01)。在786-O细胞内过表达14-3-3σ基因能够明显抑制786-O细胞的增殖(P<0.05),敲低该基因的表达能够明显促进786-O细胞增殖(P<0.01)。结论 肾癌组织较正常肾组织14-3-3σ基因的表达水平明显下降,14-3-3σ与肾癌细胞的增殖有关。
肾肿瘤;14-3-3σ;增殖;RT-PCR
肾癌是泌尿系统最常见的恶性肿瘤之一。全球每年有超过350 000人的新发肾癌病例,占恶性肿瘤发病率的第7位,每年超过140 000人因肾癌而死亡[1]。随着我国人口老龄化、环境因素、生活方式和饮食结构的改变,肾癌的发病率呈现逐年上升的趋势。在我国,肾癌的5年患病率(2006至2011年)已上升至所有恶性肿瘤的第11位[2]。尽管目前已有多种治疗手段用于晚期肾癌患者的治疗,但其疗效对于不同患者往往有较大差异,还有许多问题尚未解决。14-3-3蛋白是一类广泛存在于真核生物细胞的高度保守蛋白,通过与靶蛋白相互作用,14-3-3蛋白能够改变其活性、构型及胞内定位,参与调控多种细胞内的信号转导[3]。14-3-3蛋白的主要功能可以划分为两方面:一、细胞周期调控及凋亡;二、细胞内蛋白质的转运,该蛋白对于细胞维持其正常生理功能具有重要的作用和意义[3,4]。14-3-3蛋白家族具有多种亚型,目前已经发现了10个以上的该蛋白家族成员。在这些14-3-3蛋白家族成员中,14-3-3σ蛋白与肿瘤的关系最为密切,可能是潜在的抑癌基因,具有一定的临床应用前景[5]。已有研究证实,14-3-3σ蛋白在结肠癌[6]、食管癌[7]、膀胱癌[8]、肝癌[9]等多种恶性肿瘤中表达水平发生了改变,并进一步参与了肿瘤的发生与治疗抵抗,而该基因在肾癌中的表达情况尚不十分清楚。基于此,本研究拟从肾癌患者入手,检测患者肿瘤及对应正常肾组织中14-3-3σ基因及蛋白的表达水平,并从细胞水平探讨该基因对肾癌细胞增殖的作用,为进一步明确14-3-3σ基因与肾癌的关系提供实验依据。
1 资料与方法
1.1 一般资料 肾癌患者随机取自于2015年6月至2016年7月在河北医科大学第四医院泌尿外科住院患者47例,其中男34例,女13例;年龄40~82岁,平均年龄 (61.5±8.5) 岁。所有患者经肾肿瘤根治性切除术,术后病理均证实为肾透明细胞癌,所有病例术前均未接受任何化学及放射治疗。取材标准如下:(1)癌组织:患者于术后切取的肿瘤组织标本;(2)正常组织:距离癌组织5 cm以上的肾组织。患者均于术后即刻采集肾癌及正常肾组织,取材后立即保存于液氮中备用。本研究遵循伦理学标准并得到河北医科大学第四医院伦理委员会批准及受试者的知情同意。
1.2 实验试剂 人肾透明细胞癌786-O细胞系购自国家实验细胞资源共享平台;反转录试剂盒购买自宝生物工程(大连)有限公司,PCR试剂及DEPC水购买自北京康为世纪生物科技有限公司,本研究所使用引物均由上海生工生物工程技术公司提供。14-3-3σ真核细胞过表达载体pcDNA3.1-14-3-3σ质粒及14-3-3σ siRNA购自上海吉玛制药技术有限公司;Lipofectamine 2000购自美国Invitrogen公司;RPMI-1640培养基、胎牛血清、PBS、Opti-MEM培养基、胰蛋白酶为美国Gibco公司产品;CCK-8购自日本东仁化学研究所;鼠抗14-3-3σ抗体、鼠抗β-actin抗及羊抗鼠二抗体购自美国Abcam公司。
1.3 方法
1.3.1 RNA提取、RT-PCR及PCR扩增:采用Trizol法提取组织总RNA,取30-50mg组织置于玻璃均浆器中,加入1 ml Trizol后研磨,研磨至组织破裂后,离心取上清,加入氯仿抽提,离心取上清,加入异丙醇充分混匀后离心,弃上清,70%乙醇洗涤,晾干后DEPC水充分溶解,紫外分光光度计测定RNA的浓度及纯度。取等量RNA,依照反转录试剂盒说明使用配置反应体系,进行反转录。反转录后取等量cDNA分别使用14-3-3σ及β-actin引物进行PCR扩增,引物序列如下:14-3-3σ上游引物GAGCGAAACCTGCTCTCAGT,下游引物CTCCTTGATGAGGTGGCTGT;β-actin上游引物CCTTCCTGGGCATGGAGTCCTG,下游引物GGAGCAATGATCTTGATCTTC。PCR反应体系为20 μl,包括1 μl逆转录产物,上下游引物 (10 pmol) 各取1 μl,dNTP (2.5 mmol/L) 1 μl,10×PCR反应缓冲液2 μl,Taq DNA聚合酶 (5 U/μl) 0.2 μl,无菌水补齐至20 μl。PCR扩增条件:95℃预变性3 min,95℃变性15 s,58℃退火15 s,72℃延伸20 s,37个循环。37个循环结束后,72℃再延伸6 min,扩增片段长度为213 bp。以β-actin为内参照,扩增长度为202 bp。PCR产物电泳分离后,扫描成像,用凝胶成像分析系统进行密度分析。
1.3.2 Western blot:组织从液氮中取出,切取30~50 mg 组织块放入RIPA裂解液,用电动匀浆器冰上研磨组织,直至无肉眼可见组织为止,裂解后离心取上清,使用BCA法进行蛋白定量,并按比例加入SDS 上样缓冲液至终浓度为1×,沸煮变性,取等量蛋白上样进行SDS-PAGE电泳,之后将蛋白300 mA恒流电转移至硝酸纤维素膜上,根据所需检测蛋白分子量不同,转膜时间在1~1.5 h不等。5%脱脂奶粉室温封闭1 h,TBST溶液漂洗数次后,分别使用鼠抗14-3-3σ及鼠抗β-actin一抗4℃下孵育过夜,一抗封闭浓度均为1∶1 000。次日TBST洗膜后,用辣根过氧化物酶标记的羊抗鼠二抗室温封闭1 h,二抗封闭浓度为1∶5 000,TBST洗膜数次后,使用ECL化学发光法及化学发光仪(美国Bio-rad公司)检测蛋白表达,并拍照存档。
1.3.3 质粒的转染:786-0细胞传代,待细胞生长至70%~80%汇合时进行质粒转染操作。转染前日把细胞培养基换为无血清、无抗生素的细胞培养基培养。依照Lipofectamine 2000使用说明将质粒转染入细胞。37℃培养箱内培养6 h,去掉转染培养基。并更换为含1%胎牛血清的细胞培养基。转染后48 h进行后续实验。
1.3.4 siRNA的转染:786-O细胞传代生长至40%~50%汇合时进行siRNA转染操作。首先把细胞培养基换为无血清、无抗生素的细胞培养液培养24 h,按Lipofectamine 2000使用说明将siRNA转染入细胞,siRNA转染的终浓度为100 nmol/L。转染后48 h进行后续实验。
1.3.5 CCK-8细胞增殖试验:选择对数生长期的细胞,消化并吹打成单细胞悬液,96孔板每孔接种100 μl细胞悬液,约6 000个细胞/孔,置37℃、5% CO2培养箱内培养,待细胞贴壁后,依不同分组分别转染入pcDNA3.1-14-3-3σ过表达质粒及对照质粒,或14-3-3σ siRNA及对照siRNA,48 h 或72 h后每孔分别加入10 μl CCK-8,置于细胞培养箱内继续孵育,2 h后终止反应,450 nm酶标仪比色测定吸光度值(OD值)。按如下公式计算增殖抑制率:细胞增殖抑制率(%)=(对照组OD值-试验组OD值)/对照组OD值×100%。
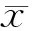
2 结果
2.1 肾癌及相应正常肾组织中14-3-3σ mRNA的表达情况 将临床收集的肾癌及正常肾组织标本的总RNA使用Trizol法提取,之后应用反转录试剂盒,依照试剂盒说明对所获取组织总RNA进行RT-PCR实验,获得cDNA,以之为模板,分别使用14-3-3σ及β-actin的引物进行PCR扩增,各组PCR产物经琼脂糖凝胶电泳后拍照存档并进行光密度扫描分析。在47例肾癌患者中,37例患者癌组织(RCC)14-3-3σ基因mRNA表达水平较自身正常肾组织(NT)降低(37/47),占总病例数的78.7%。而其他10例患者肾癌组织(RCC)中14-3-3σ基因的表达与相应正常肾组织(NT)相比变化不明显。在本研究所采集的47例肾癌患者标本中,肾癌组织14-3-3σ基因mRNA表达强度为 (0.24±0.06),而相对应的正常肾组织中14-3-3σ基因mRNA的表达强度为(0.59±0.16)。对上述结果进行统计,结果显示肾癌组织与正常肾组织相比14-3-3σ基因mRNA表达水平显著降低,结果有统计学意义 (P<0.01)。见图1A~B,表1。
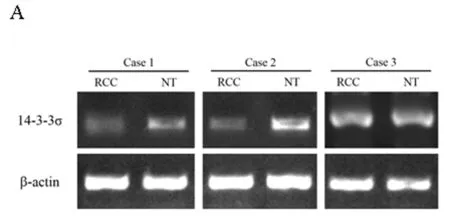
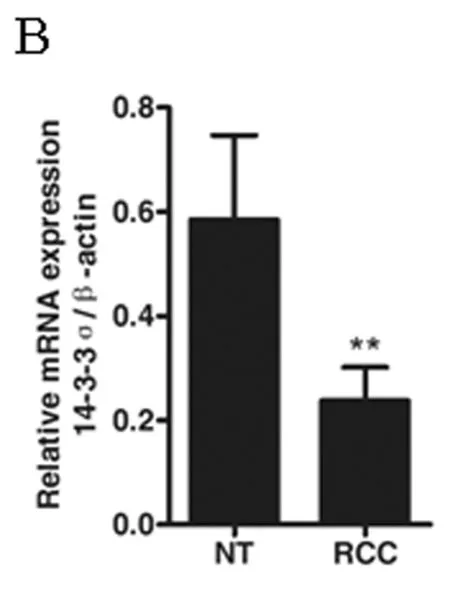
图1 肾癌组织(RCC)及相应正常肾组织(NT)中14-3-3σ mRNA的表达水平
注:A 14-3-3σ mRNA在肾癌组织及相应正常肾组织中的表达量(结果未完全展示);B 14-3-3σ mRNA在肾癌组织及相应正常肾组织中表达情况的统计图
2.2 肾癌组织及相应正常肾组织中14-3-3σ蛋白的表达情况 对本研究所取47例患者的肾癌组织及相应正常肾组织使用RIPA裂解液裂解后,使用Western blot法检测14-3-3σ蛋白的表达情况,结果同14-3-3σ mRNA的表达情况相类似,14-3-3σ蛋白在肾癌组织(RCC)中表达较对应正常肾组织(NT)明显下降,在47例肾癌患者中,35例患者肾癌组织(RCC)14-3-3σ蛋白的表达水平较自身正常肾组织(NT)降低(35/47),占总病例数的74.5%,12例患者肾癌组织(RCC)中14-3-3σ蛋白的表达与相应正常肾组织(NT)相比无明显变化(图2A)。14-3-3σ蛋白在肾癌组织中的表达强度为 (0.33±0.08),而在相应的正常肾组织中的表达强度为(0.71±0.13)。差异有统计学意义(P<0.01)。见图2A~B,表2。
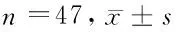

组织14-3-3σmRNA表达量肾癌组织 0.24±0.06正常肾组织0.59±0.16*
注:与肾癌组织比较,*P<0.05
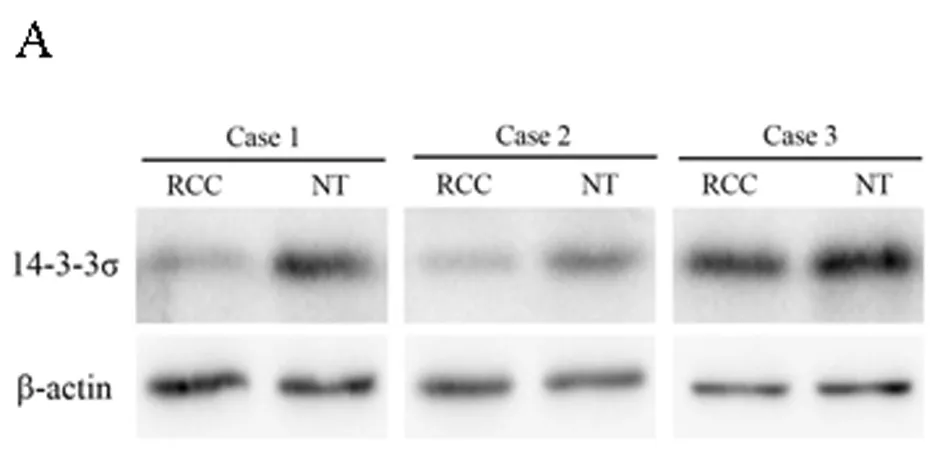

图2 肾癌组织(RCC)及对应正常肾组织(NT)中14-3-3σ蛋白的表达水平
注:A 14-3-3σ蛋白在肾癌组织及相应正常肾组织中的表达量(结果未完全展示);B 14-3-3σ蛋白在肾癌组织及相应正常肾组织中表达情况的统计图
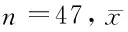
表2 肾癌组织及相应正常肾组织中14-3-3σ蛋白的表达情况 ±s
注:与肾癌组织比较,*P<0.05
2.3 过表达14-3-3σ基因后肾癌786-O细胞的增殖变化 为了进一步明确14-3-3σ基因在肾癌中的作用,我们使用14-3-3σ基因的过表达载体pcDNA3.1-14-3-3σ在肾透明细胞癌786-O细胞中过表达14-3-3σ基因,之后检测了786-O细胞的增殖变化。在过表达该基因48 h及72 h后,14-3-3σ蛋白的表达量出现了明显上升,说明过表达有效。之后我们使用CCK-8法检测了786-O细胞的增殖活力,结果发现过表达14-3-3σ基因48 h及72 h后,786-O细胞的增殖受到了明显的抑制(P<0.05)。上述结果说明14-3-3σ基因在肾癌中与肿瘤细胞的增殖有关,肾癌中该基因表达的上调能够抑制肾癌细胞的增殖。见图3A~B,表3。
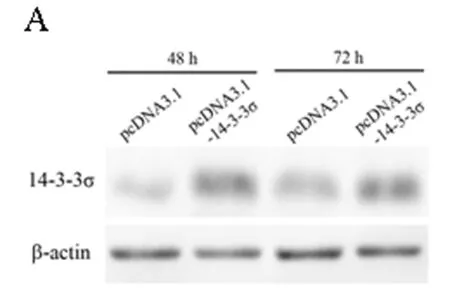
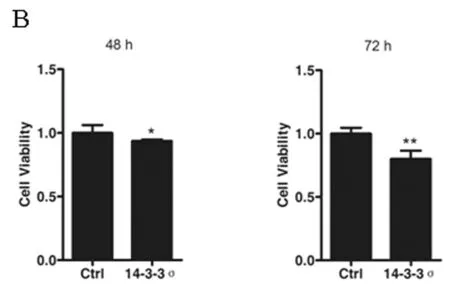
图3 786-O细胞过表达14-3-3σ基因后细胞的增殖变化情况
注:A 14-3-3σ基因过表达质粒转染786-O细胞后过表达效果验证图;B 14-3-3σ基因过表达后786-O细胞增殖活力显著下降

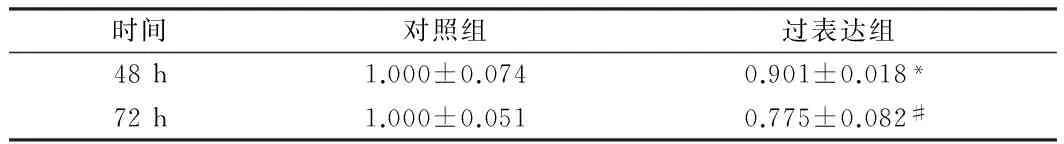
时间对照组过表达组48h1.000±0.0740.901±0.018*72h1.000±0.0510.775±0.082#
注:与对照组比较,*P<0.05,#P<0.01
2.4 敲低14-3-3σ基因后肾癌786-O细胞的增殖变化 上述结果证明14-3-3σ能够抑制肾癌786-O细胞的增殖,为了进一步明确14-3-3σ基因对肾癌增殖的影响,我们再次在肾癌786-O细胞中,使用siRNA敲低14-3-3σ基因后检测该细胞的增殖变化。在使用si 14-3-3σ转染786-O细胞48 h及72 h后,14-3-3σ蛋白的表达量明显下降,说明该siRNA能够有效的敲低靶基因,敲低效果良好。之后我们使用CCK-8法检测了敲低14-3-3σ基因后786-O细胞的增殖活力,发现敲低14-3-3σ(48 h、72 h)基因能够显著促进786-O细胞的增殖 (P<0.01)。上述结果说明14-3-3σ蛋白能够调控肾癌细胞的增殖,肾癌中该基因表达的下调能够显著促进肾癌细胞增殖。见图4A~B,表4。
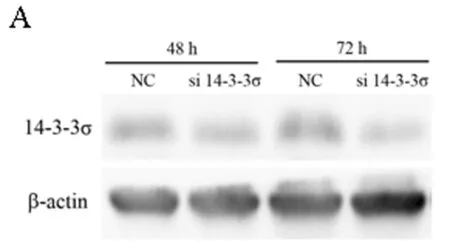
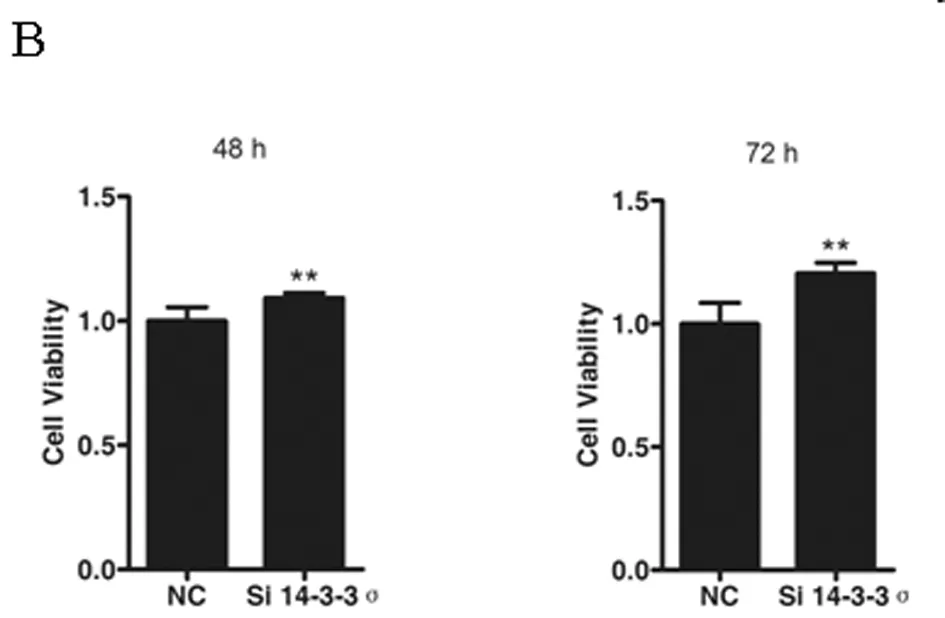
图4 786-O细胞敲低14-3-3σ基因后细胞的增殖变化情况
注:A 14-3-3σ基因siRNA转染786-O细胞后敲低效果验证图;B 14-3-3σ基因敲低后786-O细胞增殖活力显著上升(**P<0.01)


时间对照组敲低组48h1.000±0.0761.108±0.006*72h1.000±0.1030.235±0.048*
注:与对照组比较,*P<0.01
3 讨论
研究表明,14-3-3σ蛋白是一种重要的细胞周期调控蛋白,它能够抑制Cdc/cyclin B1复合体的功能,促使细胞停滞在G2期[10]。越来越多的研究表明,在多种实体肿瘤中,14-3-3σ蛋白的表达明显下降甚至缺失,如直肠癌[11]、乳腺癌[12]及卵巢癌[13]等,我们在肾癌组织中进行的检测结果与上述结果一致,该基因的表达量在肾癌组织中呈明显下降的趋势。然而,也有一些相反的研究结果报道,如在胃癌[14]、头颈部鳞状上皮癌[15]及胰腺癌[16]组织中,该蛋白的表达却呈明显上升。因此14-3-3σ基因的功能可能在不同种类的肿瘤中存在差异,需要进一步的研究和明确。14-3-3σ基因也与肿瘤的化疗耐药有着密切的关系,14-3-3σ参与胰腺癌细胞对吉西他滨的耐药,该蛋白也乳腺癌细胞对多西他赛的耐药有关[17,18]。近年来的研究结果也表明14-3-3σ蛋白还参与了肿瘤细胞代谢谱的重编程[19],同时在肿瘤的放疗抵抗、转移和侵袭中发挥着重要的作用[20-22]。这些研究的发现表明14-3-3σ蛋白与肿瘤的关系十分密切,在肿瘤中的作用多样。14-3-3σ蛋白与肾癌的关系目前研究较少,已有的研究表明,肾癌组织中14-3-3σ基因启动子CpG区高度甲基化,进而导致14-3-3σ基因的表达下调,甚至造成该基因的表达缺失,而该基因亦可在癌旁组织及正常肾组织中出现高甲基化从而使癌旁组织或正常肾组织14-3-3σ基因表达下降或缺失[23]。本研究中,我们发现肾癌组织中14-3-3σ基因的表达水平较正常肾组织明显降低 (P<0.01),有78.7%的患者肿瘤组织14-3-3σ基因mRNA表达较正常肾组织降低,且14-3-3σ蛋白在肾癌组织中的表达水平也较正常肾组织呈降低的趋势,其表达量差异较为明显。有2例患者的肾癌14-3-3σ mRNA表达量明显降低,但是蛋白水平未出现明显变化,推测可能与基因的转录后调控有关。为了进一步说明该基因在肾癌中的作用,我们继续在肾透明细胞癌786-O细胞中过表达14-3-3σ基因后进行实验发现,14-3-3σ能够明显抑制786-O细胞的增殖,而在786-O细胞中敲低14-3-3σ基因的表达后,得到了与之前相反的变化,肾癌细胞的增殖明显加快。上述结果说明14-3-3σ基因表达水平的变化在肾癌的发病机制中起到了重要作用,14-3-3σ参与了肾癌细胞的增殖调控,该基因的表达下调或缺失可能是肾癌发生发展的重要因素,14-3-3σ可能是肾癌的潜在抑癌基因,有望成为肾癌临床诊断和治疗的新靶点,针对该基因进行相应研究、开发和利用,有益于进一步开拓思路,促进肾癌的诊断和治疗。
1 Capitanio U,Montorsi F. Renal cancer. Lancet,2016,387:894-906.
2 Zheng R,Zeng H,Zhang S,et al. National estimates of cancer prevalence in China,2011. Cancer letters,2016,370:33-38.
3 Aghazadeh Y,Papadopoulos V. The role of the 14-3-3 protein family in health,disease,and drug development. Drug Discov Today,2016,21:278-287.
4 Emami S. Interplay between p53-family,their regulators,and PARPs in DNA repair. Clin Res Hepatol Gastroenterol,2011,35:98-104.
5 Li Z,Liu JY,Zhang JT. 14-3-3sigma,the double-edged sword of human cancers. Am J Transl Res,2009,1:326-340.
6 Shao Z,Cai Y,Xu L,et al. Loss of the 14-3-3σ is essential for LASP1-mediated colorectal cancer progression via activating PI3K/AKT signaling pathway. Sci Rep,2016,6:25631.
7 Lai KK,Chan KT,Choi MY,et al. 14-3-3σ confers cisplatin resistance in esophageal squamous cell carcinoma cells via regulating DNA repair molecules. Tumour Biol,2016,37:2127-2136.
8 Moreira JM,Gromov P,Celis JE. Expression of the tumor suppressor protein 14-3-3 sigma is down-regulated in invasive transitional cell carcinomas of the urinary bladder undergoing epithelial-to-mesenchymal transition. Mol Cell Proteomics,2004,3:410-419.
9 Reis H,Pütter C,Megger DA,et al. A structured proteomic approach identifies?14-3-3 Sigma?as a novel and reliable protein biomarker in panel based differential diagnostics of liver tumors. Biochim Biophys Acta,2015,1854:641-650.
10 Hermeking H,Lengauer C,Polyak K,et al. 14-3-3 sigma is a p53-regulated inhibitor of G2/M progression. Mol Cell,1997,1:3-11.
11 Ide M,Nakajima T,Asao T,et al. Inactivation of 14-3-3σ by hypermethylation is a rare event in colorectal cancers and its expression may correlate with cell cycle maintenance at the invasion front. Cancer Lett,2004,207:241-249.
12 Nakamura Y,Oshima K,Naoi Y,et al. 14-3-3σ expression is associated with poor pathological complete response to neoadjuvant chemotherapy in human breast cancers. Breast Cancer Res Treat,2012,134:229-236.
13 Mhawech-Fauceglia P,Herrmann FR,Anderws C,et al. 14-3-3σ expression and prognostic value in patients with epithelial ovarian carcinoma:a high throughput tissue microarray analysis. Eur J Surg Oncol,2009,35:763-767.
14 Zhou WH,Tang F,Xu J,et al. Aberrant upregulation of 14-3-3o expression serves as an inferior prognostic biomarker for gastric cancer. BMC Cancer,2011,11:397.
15 Erovic BM,Pelzmann M,Grasl MCH,et al. Mcl-1,vascular endothelial growth factor-R2,and 14-3-3σ expression might predict primary response against radiotherapy and chemotherapy in patients with locally advanced squamous cell carcinomas of the head and neck. Clin Cancer Res,2005,11:8632-8636.
16 Li Z,Dong Z,Myer D,et al. Role of 14-3-3σ in poor prognosis and in radiation and drug resistance of human pancreatic cancers. BMC Cancer,2010,10:598.
17 Qin L,Dong Z,Zhang JT. 14-3-3σ regulation of and interaction with YAP1 in acquired gemcitabine resistance via promoting ribonucleotide reductase expression. Oncotarget,2016,7:17726-17736.
18 Liu Y,Liu H,Han B,et al. Identification of 14-3-3sigma as a contributor to drug resistance in human breast cancer cells using functional proteomic analysis. Cancer Res,2006,66:3248-3255.
19 Phan L,Chou PC,Velazquez-Torres G,et al. The cell cycle regulator 14-3-3σ opposes and reverses cancer metabolic reprogramming. Nat Commun,2015,6:7530.
20 Raychaudhuri K,Chaudhary N,Gurjar M,et al. 14-3-3σ Gene Loss Leads to Activation of the Epithelial to Mesenchymal Transition Due to the Stabilization of c-Jun Protein. J Biol Chem,2016,291:16068-16081.
21 Shao Z,Cai Y,Xu L,et al. Loss of the 14-3-3σ is essential for LASP1-mediated colorectal cancer progression via activating PI3K/AKT signaling pathway. Sci Rep, 2016,6:25631.
22 Chen Y,Li Z,Dong Z,et al. 14-3-3σ Contributes to Radioresistance By Regulating DNA Repair and Cell Cycle via PARP1 and CHK2. Mol Cancer Res,2017,15:418-428.
23 Liang S,Xu Y,Shen G,et al. Gene expression and methylation status of 14-3-3sigma in human renal carcinoma tissues. IUBMB Life,2008,60:534-540.
Effects of down-regulation of gene expression of 14-3-3σ on proliferation of renal cancer cells
QIUWei*,SHENYongqing,ZHANGAili.
*DepartmentofUrinarySurgery,BeijingFriendshipHospital,Beijing100050,China
Objective To investigate the expressions of 14-3-3σ in renal cell carcinoma tissues (RCC) and in normal renal tissues (NT),and to explore the role of 14-3-3σ and its action mechanism in RCC.Methods Forty-seven patient with renal cancer who enderwent radical nephrectomy were enrolled in the study. The RNA and protein were extracted from RCC tissues and normal renal tissues,and the expression levels of 14-3-3σ were detected by RT-PCR and Western blot, respectively. The changes of cell proliferation were detected by CCK-8 assays in 786-O cells after overexpression or knockdown of gene expressions of 14-3-3σ.Results As compared with those in normal renal tissues,the expression levels of 14-3-3σ mRNA and protein in renal cancer tissues were significantly decreased (P<0.01),moreover, the overexpression of 14-3-3σ gene could significantly inhibit the proliferation of 786-O cells (P<0.05),however, the knockdown of 14-3-3σ gene expression could increase the cell proliferation (P<0.01).Conclusion The expression levels of 14-3-3σ gene are significantly down-regulated in RCC tissues,which may be correlated to the the proliferation of renal cancer cells.
renal carcinoma; 14-3-3σ; proliferation; RT-PCR
10.3969/j.issn.1002-7386.2017.14.001
100050 北京市,首都医科大学附属北京友谊医院泌尿外科(仇炜);河北中医学院护理学院(沈永青);河北医科大学第四医院泌尿外科(张爱莉)
张爱莉,050011 石家庄市,河北医科大学第四医院泌尿外科;
E-mail: youyiminiao@126.com
R 737.11
A
1002-7386(2017)14-2085-05
2017-02-09)
