黄芪多糖对糖尿病大鼠视网膜病变的保护作用
2017-07-24刘俊辉李春江李玉涛河北省唐山市冀东眼科医院眼科河北唐山063000华北理工大学附属医院眼科河北唐山063000
刘俊辉,李春江,李玉涛,2*(.河北省唐山市冀东眼科医院眼科,河北 唐山 063000;2.华北理工大学附属医院眼科,河北 唐山 063000)
·论 著·
黄芪多糖对糖尿病大鼠视网膜病变的保护作用
刘俊辉1,李春江1,李玉涛1,2*
(1.河北省唐山市冀东眼科医院眼科,河北 唐山 063000;2.华北理工大学附属医院眼科,河北 唐山 063000)
目的观察黄芪多糖(Astragalus polysaccharides,APS)对糖尿病大鼠视网膜病变的治疗作用并探讨相关机制。方法将清洁级健康雄性SD大鼠45只随机分为正常对照组、糖尿病模型组和APS组各15只。使用链脲佐菌素腹腔注射制作糖尿病大鼠模型。造模后1周,APS组大鼠给予400 mg/kg APS灌胃,1次/d,连续治疗8周。治疗结束后,测量各组大鼠的血糖、体质量,ELISA法检测大鼠视网膜中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和细胞间黏附分子1(intercellular adhesion molecule 1 ICAM-1)的含量,免疫印迹方法检测大鼠视网膜血管内皮生长因子(vascular endothelial growth factor,VEGF)和p-Akt蛋白表达。结果模型组和APS组血糖高于对照组,体质量低于对照组(P<0.05)。模型组和APS组大鼠TNF-α、ICAM-1、VEGF和p-Akt表达明显高于对照组,APS组TNF-α、ICAM-1、VEGF和p-Akt表达低于模型组,差异有统计学意义(P<0.05)。结论APS可降低糖尿病大鼠视网膜中TNF-α、ICAM-1、VEGF和Akt的水平,通过抗炎、减少白细胞在糖尿病病变的视网膜黏附、影响Akt-VEGF信号通路起到对视网膜的保护作用。
糖尿病视网膜病变;黄芪多糖;大鼠
糖尿病是一种以高血糖为特征的慢性、进行性代谢疾病,发病率呈逐年增加的趋势。糖尿病患者的糖、脂类、蛋白质代谢混乱,引起多种并发症,严重影响患者生活质量[1]。糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病眼部的主要并发症,为糖尿病患者常见的微血管病变之一[2],随着生活水平的提高和生活方式改变,发病率呈逐年上升的趋势[3],且出现眼部并发症的病程逐渐缩短。病程>20年的糖尿病患者75%以上都伴随着不同程度的DR。DR导致患者的视力急剧下降,并可能导致失明,给患者带来极大痛苦,亦有患者出现抑郁[4],不利于患者的治疗,同时给家庭和社会带来巨大的经济压力。有研究表明,早期DR表现为血管的神经炎症、细胞凋亡、血-视网膜屏障的破坏[5]。因此,早期进行糖尿病患者的抗炎治疗可能是预防DR的一种非常有效的方法。黄芪多糖(Astragalus polysaccharides,APS)具有抗氧化、抗炎和抗凋亡的作用,但是APS对于DR抗炎作用的相关机制尚不十分清楚。本研究旨在探讨APS对于糖尿病大鼠DR抗炎方面的作用及相关机制,从而为临床治疗DR提供重要的理论依据。报告如下。
1 材料与方法
1.1 动物模型及分组 清洁级健康雄性SD大鼠45只,体质量200~240 g,由天津市实验动物中心提供。所有SD大鼠随机分为正常对照组(15只)、糖尿病模型组(15只)和APS组(15只),所有大鼠进行适应性喂养7 d。模型组和APS组大鼠接受链脲佐菌素左下腹腹腔注射建立糖尿病模型(链脲佐菌素溶于生理盐水中,按60 mg/kg进行注射),对照组注射等量的生理盐水。链脲佐菌素注射72 h后尾静脉测量血糖(血糖仪测定),若血糖>16.7 mmol/L视为糖尿病模型制作成功。造模后1周,APS组大鼠给予400 mg/kgAPS灌胃,1次/d,连续治疗8周。对照组和糖尿病组大鼠每日给予等量生理盐水灌胃。
1.2 试剂 APS购自上海士峰生物科技有限公司。链脲佐菌素购自美国sigma公司。细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)及肿瘤坏死因子α(tumor necrosis factor,TNF-α)ELISA试剂盒购自Abcam公司。血管内皮生长因子(vascular endothelial growth factor,VEGF)、p-Akt、actin抗体及其他试剂均购自于北京博奥森生物技术有限公司。
1.3 实验方法 APS治疗结束后每只大鼠称体质量,尾静脉取血,血糖仪测量空腹血糖。大鼠腹腔注射10%水合氯醛(3 mL/kg)进行腹腔麻醉,去双侧眼球,显微镜下分离视网膜,-80 ℃冰箱保存备用。
1.3.1 ELISA法检测大鼠视网膜TNF-α和ICAM-1含量 视网膜加入组织裂解液,超声粉碎后离心,取上清液蛋白定量,按ELISA试剂盒说明书检测视网膜组织中TNF-α和ICAM-1的含量。
1.3.2 免疫印迹法检测大鼠视网膜VEGF和p-Akt表达 视网膜超声粉碎离心,测量蛋白浓度,SDS-PAGE进行蛋白电泳,后转移至PVDF膜上,BSA封闭后加入相应抗体4 ℃过夜,漂洗后加入二抗孵育,显影,采集图像。目的蛋白和actin比值为相对蛋白表达。
1.4 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较分别采用单因素方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血糖与体质量情况 模型组和APS组血糖高于对照组,差异有统计学意义(P<0.05);模型组与APS组血糖差异无统计学意义(P>0.05)。模型组和APS组体质量低于对照组,差异有统计学意义(P<0.05);模型组与APS组体质量差异无统计学意义(P>0.05)。见表1。
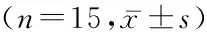
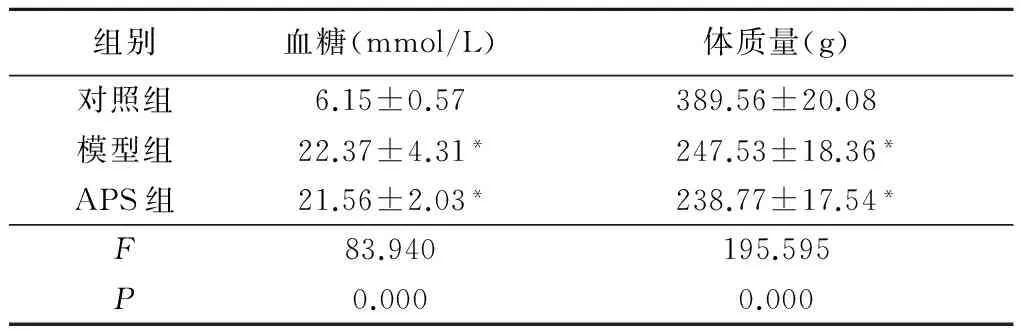
组别血糖(mmol/L)体质量(g)对照组6.15±0.57389.56±20.08模型组22.37±4.31*247.53±18.36*APS组21.56±2.03*238.77±17.54*F83.940195.595P0.0000.000
*P<0.05与对照组比较(LSD-t检验)
2.2 ELISA法检测各组大鼠视网膜TNF-α和ICAM-1的表达 模型组和APS组大鼠TNF-α和ICAM-1表达明显高于对照组, APS组TNF-α和ICAM-1表达低于模型组,差异有统计学意义(P<0.05),见表2。

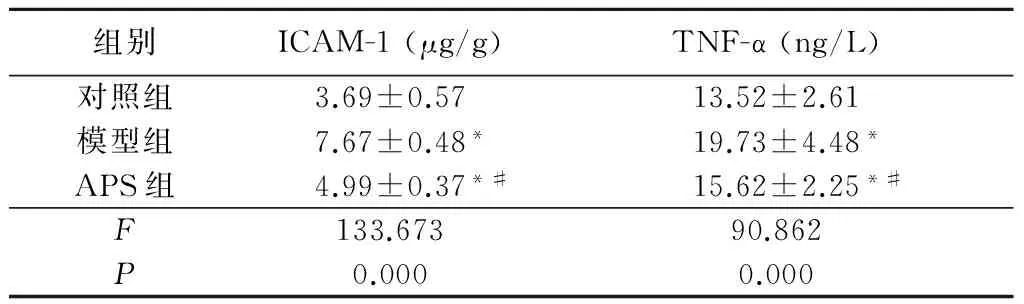
组别ICAM-1(μg/g)TNF-α(ng/L)对照组3.69±0.5713.52±2.61模型组7.67±0.48*19.73±4.48*APS组4.99±0.37*#15.62±2.25*#F133.67390.862P0.0000.000
*P<0.05与对照组比较 #P<0.05与模型组比较(LSD-t检验)
2.3 免疫印迹法检测各组大鼠视网膜VEGF和p-Akt表达 模型组和APS组大鼠VEGF和p-Akt表达明显高于对照组,APS组VEGF和p-Akt表达低于模型组,差异有统计学意义(P<0.05)。见图1,表3。

图1 免疫印迹法检测大鼠视网膜VEGF和p-Akt表达
Figure 1 Expression of VEGF and p-Akt detected by western blot


组别VEGFp-Akt对照组0.28±0.040.23±0.07模型组0.83±0.09*0.94±0.21*APS组0.49±0.08*#0.45±0.09*#F97.637126.255P0.0000.000
*P<0.05与对照组比较 #P<0.05与模型组比较(LSD-t检验)
3 讨 论
DR是糖尿病常见的一种微血管并发症,同时也是全世界人群失明的一个主要原因[6]。DR对自尊心造成极大的影响并且给社会和家庭造成严重的负担。目前DR的主要治疗方法是疾病早期行激光光凝术以及疾病晚期使用玻璃体手术,该方法对患者的视力造成损害并且会带来不适的感觉。因此,对DR有效治疗药物的研究就显得至关重要。
DR的发病机制非常复杂,包括了血管、炎症、神经等方面的机制[7]。近年来越来越多的研究证实DR是一种与炎症密切相关的疾病,炎症过程导致DR结构和功能的改变[8]。炎症过程促进了DR的病理结构改变,包括血-视网膜屏障的破坏、视网膜新生血管的形成、视网膜谷氨酸代谢障碍、视网膜神经元凋亡等[9]。糖尿病患者的高血糖状态导致了视网膜组织中白细胞的增多,从而引发了炎症因子的过度表达。所以,控制DR的炎症反应是治疗DR的重要策略之一。
APS是中药黄芪三大药效成分中含量最多且活性最强的一种多糖类物质。大量研究表明,APS具有抗氧化应激、抗肿瘤、抗炎症反应、免疫调节、抗病毒、预防衰老等作用[10]。陈红霞等[11]将APS应用于糖尿病大鼠,APS发挥抗氧化、抗炎等功效,从而达到保护心肌的作用。有研究发现,APS对CLP诱导的脓毒症小鼠急性肝损伤具有保护作用,APS有效减少了MDA、ICAM-1的表达并提高了caspase-3的表达,通过抗氧化应激、抗炎和抗凋亡机制起到保护肝脏的作用[12]。同时也有APS改善认知功能障碍的相关研究。费洪新等[13]应用APS治疗AD模型小鼠,APS降低了AD模型小鼠血脑屏障破坏程度,改善了AD模型小鼠的认知功能并保护了海马神经元形态结构,通过抑制Aβ沉积、降低白细胞介素6蛋白水平(发挥抗炎作用)而在AD治疗中发挥作用。另有研究发现,APS对脑外伤大鼠的学习记忆能力也有作用,APS能够提高SOD的活性,清除氧自由基,通过抗机体氧化应激提高脑外伤大鼠学习记忆能力[14]。
高血糖导致糖尿病视网膜的氧化应激,并且与细胞炎症和炎性细胞因子的释放密切相关[15]。炎性细胞因子在DR的新生血管形成过程中起到了重要作用,在DR的发展过程中,视网膜炎症和白细胞黏附微血管(白细胞淤滞)促进血-视网膜屏障的破坏[16]。TNF-α是由巨噬细胞或单核细胞活化后产生的一种多功能的炎症因子,与血视网膜屏障的破坏和血管细胞死亡呈正相关,被认为是炎症反应的触发器[17]。ICAM-1在DR患者中升高,ICAM-1表达的增多促进白细胞在糖尿病视网膜的黏附。白细胞黏附是糖尿病视网膜炎症早期的变化之一,导致内皮细胞的减少和血-视网膜屏障破坏[16]。若ICAM异常表达,可能引起内皮细胞的损伤,也能够造成白细胞释放更多细胞因子或炎性介质。由于TNF-α和ICAM-1在DR 病理生理方面的重要性,本研究探讨了APS对于糖尿病大鼠视网膜内TNF-α和ICAM-1表达的影响,结果显示APS能够抑制DR大鼠视网膜中TNF-α和ICAM-1的表达。因此,推断抑制炎症反应可能是APS治疗DR的分子机制之一。
慢性高血糖刺激VEGF的合成和分泌,VEGF由低氧诱导因子(hypoxia-inducible factor-1α,HIF-1α) 转录调控,是调节视网膜血管渗漏和新血管形成主要的一种生长因子[18]。VEGF是一种血管内皮生成和血管渗透性因子,被认为是导致DR以及其他视网膜疾病视网膜渗透性和血-视网膜屏障完整性的关键分子[19]。VEGF表达的调节过程是十分复杂的,HIF-1α是调节高血糖状态下VEGF表达的一种转录因子[18]。此外,Akt的激活是HIF-1α表达的上游调节因子,故Akt-VEGF信号通路的启动可影响视网膜新生血管形成的发生[20]。本研究结果显示,糖尿病大鼠的视网膜内VEGF和p-Akt表达增多,APS治疗后VEGF和p-Akt表达减少。因此,推断APS通过抑制Akt的激活降低VEGF的表达,从而改善糖尿病视网膜的血管病变。
综上所述,APS可降低糖尿病大鼠视网膜中TNF-α、ICAM-1的表达,通过抗炎、减少白细胞在糖尿病病变的视网膜黏附起到对视网膜的保护作用。同时APS也影响了Akt-VEGF信号通路,从而减少了糖尿病大鼠视网膜中VEGF和p-Akt两者的表达,可能通过此机制影响视网膜新生血管的形成。APS具有抗氧化应激、抗肿瘤、抗炎症反应、免疫调节、抗病毒、改善认知功能等作用,今后将继续深层次探讨APS的药理作用,尤其是在眼科疾病中的基础和临床研究,从而为糖尿病视网膜病变乃至其他眼部疾病的患者的治疗提供理论依据。
[1] 尹艳华,孙海燕,赵立,等.老年2型糖尿病住院患者糖脂代谢、慢性并发症及临床用药的现状分析[J].中国糖尿病杂志,2015,23(3):390-393.
[2] Madonna R,Balistreri CR,Geng YJ,et al. Diabetic microangiopathy:Pathogenetic insights and novel therapeutic approaches[J]. Vascul Pharmacol,2017[Epub ahead of print].
[3] 陈淑惠,孟佳丽,张敏,等.2型糖尿病视网膜病变与糖尿病其他并发症的相关性[J].国际眼科杂志,2016,16(2):309-312.
[4] Trento M,Charrier L,Salassa M,et al. Cognitive function may be a predictor of retinopathy progression in patients with type 2 diabetes[J]. Eur J Ophthalmol,2016[Epub ahead of print].
[5] Mozetic V,Freitas CG,Riera R. Statins and fibrates for diabetic retinopathy:protocol for a systematic review[J]. JMIR Res Protoc,2017,6(2):e30.
[6] Cheung N,Mitchell P,Wong TY. Diabetic retinopathy[J]. Lancet,2010,376(9735):124-136.
[7] Semeraro F,Cancarini A,Dell'Omo R,et al. Diabetic retinopathy:vascular and inflammatory disease[J]. J Diabetes Res,2015,2015:582060.
[8] Wang LL,Chen H,Huang K,et al. Elevated histone acetylations in Müller cell contribute to inflammation:a novel inhibitory effect of minocycline[J]. Glia,2012,60(12):1896-1905.
[9] Ogura S,Kurata K,Hattori Y,et al. Sustained inflammation after pericyte depletion induces irreversible blood-retina barrier breakdown[J]. JCI insight,2017,2(3):e90905.
[10] Luo T,Qin J,Liu M,et al. Astragalus polysaccharide attenuates lipopolysaccharide-induced inflammatory responses in microglial cells:regulation of protein kinase B and nuclear factor-κB signaling[J]. Inflamm Res,2015,64(3/4):205-212.
[11] 陈红霞,曹霞,卢红,等.黄芪多糖对糖尿病大鼠心肌的保护作用[J].山东医药,2015,55(7):31-33.
[12] 罗成,沈娜.黄芪多糖对CLP诱导的脓毒症小鼠急性肝损伤MDA、caspase-3和ICAM-1的影响研究[J].重庆医科大学学报,2014,39(11):1641-1646.
[13] 费洪新,高音,孙丽慧,等.黄芪多糖对阿尔茨海默病小鼠海马组织的影响[J].中国老年学杂志,2015,35(16):4426-4429.
[14] 郑波,陈涛,毛华.黄芪多糖对脑外伤大鼠学习记忆能力影响的研究[J].中医临床研究,2016,8(33):24-26.
[15] El-Asrar AM. Role of inflammation in the pathogenesis of diabetic retinopathy[J]. Middle East Afr J Ophthalmol,2012,19(1):70-74.
[16] Rangasamy S,Mcguire PG,Das A. Diabetic retinopathy and inflammation:novel therapeutic targets[J]. Middle East Afr J Ophthalmol,2012,19(1):52-59.
[17] Sharma S,Purohit S,Sharma A,et al. Elevated Serum Levels of Soluble TNF Receptors and Adhesion Molecules Are Associated with Diabetic Retinopathy in Patients with Type-1 Diabetes[J]. Mediators Inflamm,2015,2015:279393.
[18] Yan HT,Su GF. Expression and significance of HIF-1α and VEGF in rats with diabetic retinopathy[J]. Asian Pac J Trop Med,2014,7(3):237-240.
[19] Fogli S,Mogavero S,Egan CG,et al. Pathophysiology and pharmacological targets of VEGF in diabetic macular edema[J]. Pharmacol Res,2016,103:149-157.
[20] Kim YG,Lim HH,Lee SH,et al. Betaine inhibits vascularization via suppression of Akt in the retinas of streptozotocin-induced hyperglycemic rats[J]. Mol Med Rep,2015,2(2):1639-1644.
(本文编辑:赵丽洁)
The protective effects of Astragalus polysaccharide on diabetic rats with retinopathy
LIU Jun-hui1, LI Chun-jiang1, LI Yu-tao1,2*
(1.DepartmentofOphthalmology,JidongOphthalmologyHospital,TangshanCity,HebeiProvince,Tangshan063000,China; 2.DepartmentofOphthalmology,NorthChinaUniversityofScienceandTechnologyAffiliatedHospital,Tangshan063000,China)
Objective To study the therapeutic effects of Astragalus polysaccharide(APS) on diabetic rats with retinopathy, and to explore its mechanism. Methods Forty-five cleaning degree healthy male SD rats were randomly divided into 3 groups, normal control group, diabetic model group and APS group(n=15/group). The diabetic rats were made by streptozotocin intraperitoneal injection. One week after modeling, rats in APS group was administrated orally with APS(400 mg/kg) once daily for consecutive 8 weeks. After treatment, the blood glucose and body weight of different groups were measured. The expression of tumor necrosis factor alpha(TNF-α) and intercellular adhesion molecule 1(ICAM-1) in retina of different groups were detected by ELISA. The relative expression of vascular endothelial growth factor (VEGF) and p-Akt in retina of different groups were tested by western blot. Results The blood glucose of model group and APS group was higher than control group, body weight of model group and APS group was lower than control group(P<0.05). The expression of TNF-α, ICAM-1, VEGF and p-Akt in model group and APS group was higher than that of control group. The expression of TNF-α, ICAM-1, VEGF and p-Akt in APS group was lower than that of model group(P<0.05). Conclusion APS could decrease the expression of TNF-α, ICAM-1, VEGF and p-Akt in retina of diabetic rats. Its protective effect on the retina may be through anti-inflammatory effect, reducing Leukocyte adhere to diabetic retina and affecting Akt- VEGF signaling pathways.
diabetic retinopathy; astragalan; rats
2017-03-02;
2017-03-22
刘俊辉(1978-),女,河北唐山人,河北省唐山市冀东眼科医院主治医师,医学学士,从事眼科疾病诊治研究。
R587.26
A
1007-3205(2017)07-0797-04
10.3969/j.issn.1007-3205.2017.07.013
*通讯作者
