间充质干细胞联合白藜芦醇对实验性自身免疫性脑脊髓炎小鼠炎症的影响
2017-07-24庞晓璐张立红河北医科大学第二医院神经内科河北石家庄050000河北医科大学诊断学教研室河北石家庄05007河北省石家庄市中医院肛肠科河北石家庄050000
王 东,庞晓璐,王 梁,张立红,王 烨(.河北医科大学第二医院神经内科,河北 石家庄 050000;.河北医科大学诊断学教研室,河北 石家庄 05007;.河北省石家庄市中医院肛肠科,河北 石家庄 050000)
·论 著·
间充质干细胞联合白藜芦醇对实验性自身免疫性脑脊髓炎小鼠炎症的影响
王 东1,庞晓璐2,王 梁1,张立红1,王 烨3
(1.河北医科大学第二医院神经内科,河北 石家庄 050000;2.河北医科大学诊断学教研室,河北 石家庄 050017;3.河北省石家庄市中医院肛肠科,河北 石家庄 050000)
目的研究间充质干细胞联合白藜芦醇治疗缓解实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠模型疾病进程的机制,探讨联合治疗对EAE小鼠炎症的作用。方法正常健康C57BL/6雌性小鼠经髓鞘少突胶质细胞糖蛋白35-55多肽(MOG35-55)诱导构建EAE小鼠模型,通过观察EAE小鼠的临床评分,判断EAE小鼠使用间充质干细胞联合白藜芦醇处理的效果。通过HE 染色和抗CD4的免疫组织化学检测单核细胞和T淋巴细胞对于脊髓组织的浸润。应用ELISA检测白藜芦醇和间充质干细胞处理后EAE小鼠血清中Th1型细胞因子γ干扰素(Interferon-γ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和Th2型细胞因子白细胞介素(interleukin,IL)-4、IL-10的表达量。结果4组平均临床评分、最大临床评分、细胞浸润、CD4+T细胞浸润、IFN-γ、TNF-α mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组低于PBS处理组,mBM-MSCs联合白藜芦醇处理组低于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05);IL-4、IL-10 mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组高于PBS处理组,mBM-MSCs联合白藜芦醇处理组高于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05)。结论间充质干细胞联合白藜芦醇治疗可以显著延缓EAE疾病进程,同时联合治疗能够显著降低小鼠EAE模型的疾病严重性,从而改善EAE疾病的临床评分;可以降低EAE小鼠脊髓中的炎症细胞数目,并促进EAE小鼠Th1型向Th2型细胞因子的转变。
脑脊髓炎,自身免疫性,实验性;间质干细胞;白藜芦醇
多发性硬化是一种中枢神经系统的炎性脱髓鞘疾病,呈现出多种神经系统的病变。主要表现为脱髓鞘现象和中枢神经系统的轴突缺失[1]。多发性硬化表现出缓解和进展2个疾病过程[2]。虽然导致多发性硬化发生的原因现在还不甚清楚,免疫系统破坏和产生髓鞘细胞的衰竭可能是其中潜在的机制。遗传因素和环境因素如感染、环境污染也被认为是其中潜在的诱因[3]。到目前为止,多发性硬化还没有有效的治疗方法。现有的治疗仅限于在疾病发生之后改善机体功能或是预防新的疾病发生。化学药物治疗是最有效的方法但存在不良反应[4-5]。EAE模型是中枢神经系统免疫性脱髓鞘疾病的模型,是一个脑部炎症的动物模型,表现为 T细胞介导的自身免疫疾病特征[6]。这一模型由于能够模拟多发性硬化等某些疾病的特征,所以被作为人类中枢神经系统免疫疾病包括多发性硬化等的动物模型而广泛研究[7]。干细胞移植能够诱导神经元的再生,是多发性硬化的一个潜在有效的治疗方法。干细胞能够分化成多种细胞群族并且能够通过新的细胞重建修复损伤的组织,最终恢复失去的功能[8]。间充质干细胞(mesenchymal stem cells,MSC)和神经干细胞(neural stemcells,NSCs)[9]2种类型的干细胞可以应用于EAE的干细胞治疗。MSC来源于成熟组织,能够抑制介导神经元细胞损伤和炎症的T细胞,因此降低多发性硬化的症状。研究显示MSC能够调节EAE的免疫病理,也同样能够促进神经细胞的保护作用[10]。NSCs是存在于大脑中多能干细胞的一个特殊的细胞类型。NSCs可以迁移到中枢神经系统里同时经过神经元分化,分化的细胞可以作为细胞代替治疗的潜在来源[11]。实验研究显示神经干细胞在EAE模型中是有治疗效果的,在其他神经退行性疾病中也可见治疗效果。神经干细胞能够分化成少突细胞并且降低脊髓和大脑中炎症病灶的炎症效应,而且可以修复EAE小鼠中受损的髓鞘组织[12]。目前应用2种干细胞治疗多发生硬化均已经进入到了临床试验阶段。本研究旨在探讨MSC联合白藜芦醇对EAE模型的免疫调节作用。
1 材料与方法
1.1 实验动物 实验用C57BL/6 雌性近交系小鼠40只,18~20 g,6~8周。购于北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2012-0001。动物饲养于室温 (24±2) ℃的环境中,维持光-暗12 h循环交替,并给予足量的食料和洁净饮水。从小鼠股骨和胫骨中分离骨髓细胞贴壁持续培养后经流式抗体标记,显示Sca-1+、CD44+、CD45-、CD34-和 CD14-。确定培养细胞带有MSC的表面标记蛋白。
1.2 EAE小鼠模型的建立、分组及处理 将抗原MOG35-55用生理盐水稀释成5 mg/mL,并按1∶1等体积加入完全弗氏佐剂 (其中结核杆菌H37Ra终浓度为4 mg/mL)混合,乳化后按每只0.1 mL于小鼠脊柱两侧分四点皮下注射,第0 h及第48 h腹腔注射500 ng 0.5 mL百日咳毒素,建立EAE模型。免疫在乙醚麻醉和充分固定下进行。将EAE小鼠随机分为4组(每组n=10):sham-EAE对照组(PBS处理组)、mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组。mBM-MSCs在免疫后第7天采用尾静脉注射(1.5×106个/ 200 mL PBS/每只小鼠)。白藜芦醇治疗则使用腹腔注射(30 mg/kg,在EAE免疫后每天1次连续注射7 d)。而对照小鼠尾静脉注射等量PBS。用Knoz 5分评分法从免疫后的第5天开始对实验小鼠评分。具体评分标准如下:0分无症状;1分尾部失去张力;2分尾部无力伴随后肢力弱;3分后肢瘫痪;4分后肢及前肢瘫痪,被动翻身后不能复原;5分濒临死亡或死亡。以±0.5分计算症状介于两者标准之间者。“每日积分均值”由当日组内所有动物神经功能评分的分值总和除以该组动物数量所得。 4组小鼠年龄、体质量均具有可比性。
1.3 观察指标 在免疫后第21天 取材。每组各取6只小鼠,经水合氯醛麻醉后,4%多聚甲醛灌注固定,取腰膨大处脊髓石蜡包埋,5 μm连续切片制成石蜡切片。采用HE法观测炎症浸润情况,应用CD4抗体检测免疫细胞聚集情况。
1.4 检测指标 免疫后21 d将EAE小鼠处死,从心脏采血3 mL置于离心管中,静置后3 000 r/min离心10 min,取上层血清。应用小鼠ELISA试剂盒检测血清中IFN-γ、TNF-α、 IL-4、IL-10水平。ELISA实验操作按照试剂盒提供的操作规程。
1.5 统计学方法 应用SPSS 18.0软件进行统计分析。实验所测得数据进行正态性检验和方差齐性检验,计量资料方差齐时采用F检验分析,方差不齐时采用非参数秩和检验分析。P<0.05为差异有统计学意义。
2 结 果
2.1 4组临床评分比较 4组平均临床评分与最大临床评分mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组低于PBS处理组,mBM-MSCs联合白藜芦醇处理组低于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05),见表1。
2.2 4组炎症细胞表达比较 4组细胞浸润和CD4+T细胞浸润mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组低于PBS处理组,mBM-MSCs联合白藜芦醇处理组低于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05),见表2。
2.3 4组炎症因子水平比较 4组IFN-γ、TNF-α mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组低于PBS处理组,mBM-MSCs联合白藜芦醇处理组低于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05)。4组IL-4、IL-10 mBM-MSCs处理组、白藜芦醇处理组、mBM-MSCs联合白藜芦醇处理组高于PBS处理组,mBM-MSCs联合白藜芦醇处理组高于mBM-MSCs处理组和白藜芦醇处理组,差异均有统计学意义(P<0.05)。见表3。

表1 实验组临床评分情况Table 1 Clinical score of the experimental group 分)
*P<0.05与PBS处理组比较 #P<0.01与mBM-MSCs处理组比较 △P<0.05与白藜芦醇处理组比较(秩和检验)
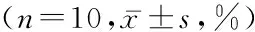

组别细胞浸润CD4+T细胞浸润PBS处理组100100mBM-MSCs处理组68.50±7.70*57.80±6.80*白藜芦醇处理组56.60±7.80*65.30±6.40*mBM-MSCs联合白藜芦醇处理组26.40±4.10*#△22.50±3.60*#△F6.5796.146P0.0000.000
*P<0.05与PBS处理组比较 #P<0.01与mBM-MSCs处理组比较 △P< 0.05与白藜芦醇处理组比较(q检验)
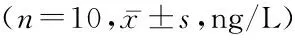
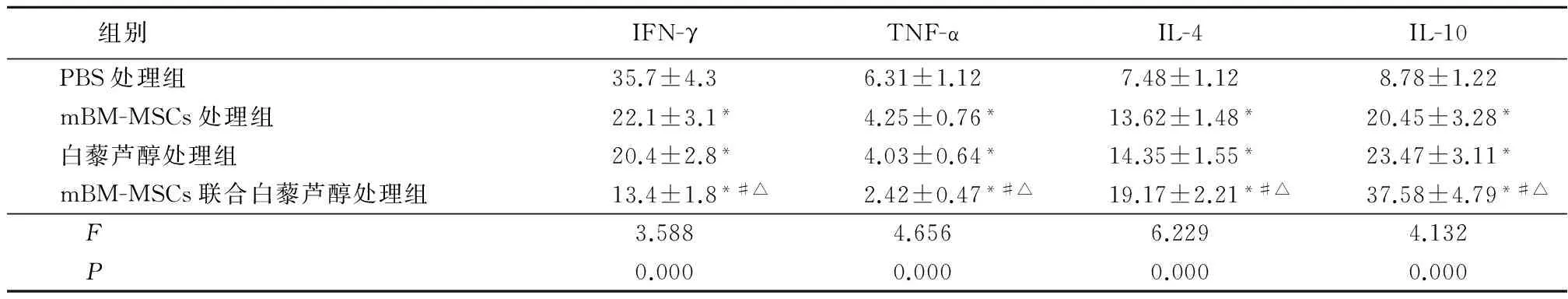
组别IFN-γTNF-αIL-4IL-10PBS处理组35.7±4.36.31±1.127.48±1.128.78±1.22mBM-MSCs处理组22.1±3.1*4.25±0.76*13.62±1.48*20.45±3.28*白藜芦醇处理组20.4±2.8*4.03±0.64*14.35±1.55*23.47±3.11*mBM-MSCs联合白藜芦醇处理组13.4±1.8*#△2.42±0.47*#△19.17±2.21*#△37.58±4.79*#△F3.5884.6566.2294.132P0.0000.0000.0000.000
*P<0.05与PBS处理组比较 #P<0.01与mBM-MSCs处理组比较 △P<0.05与白藜芦醇处理组比较(q检验)
3 讨 论
多发性硬化是最常见的影响中枢神经系统的自身免疫疾病之一[13]。目前临床急需改善多发性硬化的治疗方法。将现有的治疗方法联合新的药物针对疾病的不同阶段进行治疗是一个新的研究方向[14]。越来越多的实验表明白藜芦醇在多种免疫相关疾病如自身免疫性心肌炎、骨关节炎、胰腺炎和视神经炎等中发挥着潜在的治疗效果[15]。骨髓来源的MSC具有免疫调节活性,能够抑制T淋巴细胞的活化和增殖,并且诱导免疫反应[16]。MSC能够选择性地迁移并靶向受损伤的组织,为保护神经元和EAE小鼠的轴突损伤治疗提供了一个特殊的方法。而白藜芦醇和MSC联合使用的治疗效果在多发性硬化中的应用还不多见。
根据既往报道和笔者前期的研究,MSC或是白藜芦醇单独使用能够改善EAE小鼠的疾病严重情况;联合使用MSC和白藜芦醇更能保护小鼠的脑部完整性,延缓疾病进程[17-18]。笔者进一步研究发现,联合治疗可以有效降低炎性细胞浸润,并且增强免疫调节活性。而潜藏在这一效果中的机制有很多种可能。
联合治疗的免疫调节效果可能是由于改变了EAE小鼠炎症因子IL-4、IL-10、IFN-γ、TNF-α的表达。中枢神经系统中Th1和Th2的相互平衡关系是决定EAE小鼠发病进程的一个关键因素。而细胞因子的平衡能够决定自体免疫中的耐受性和敏感性。最近的研究表明,髓鞘特异性的T细胞介导了多发性硬化的发生,其中Th2与Th1的比例决定了炎症的部位[19]。两者的比例大于1会导致脑脊髓实质中的炎症[20]。在起始的免疫原性多肽的活化下,初始T细胞能够分化成为2种辅助性T淋巴细胞,即Th1和Th2细胞[21]。Th1细胞产生IL-2和IFN-γ等细胞因子,诱导巨噬细胞活化,并且调控胞内抗原的感染。Th2细胞分泌IL-4、IL-5和IL-13等细胞因子,帮助B细胞产生抗体,并且在根除蠕虫和寄生虫中发挥着必需的作用[22]。另外,还有其他的CD4+T细胞亚群存在并分泌高水平的IL-10和TGF-β,起着抑制Th1和Th2细胞反应的作用。 EAE的敏感性与TNF-α和IFN-γ相关,这两种都是Th1细胞的初始促炎症细胞因子[23]。然而Th2细胞因子如IL-4和IL-10是抗炎细胞因子。TNF-α、IFN-γ、 IL-4、IL-10在EAE的病理过程中极其重要,是指导Th1和Th2细胞发育的标志性细胞因子[24]。MSC能够抑制T淋巴细胞活化和增殖,诱导Th2细胞极化的免疫反应,促进内源性的修复,因此发挥着免疫调节的作用。而MSC和白藜芦醇联合使用改善了单独治疗的效果,表现出了协同的治疗作用[25]。
另一个可能的机制就是抑制炎症。炎症是一个牵涉到免疫细胞、血管的保护性反应,是组织遭受损伤刺激时的一个复杂的生物学反应。免疫炎症消除了早期的细胞损伤成因,清除了坏死细胞和损伤组织并且起始组织修复,但是在复发缓解型EAE模型中炎症能够造成组织损伤。因此,抵抗炎症成了治疗最初始的一个目的[26]。多发性硬化及它的EAE动物模型是由活化的免疫细胞如T和B淋巴细胞和巨噬细胞、小胶质细胞介导的自身免疫疾病,是中枢系统的免疫疾病[27]。淋巴细胞是被外周组织中的抗原激活,并且克隆扩增浸润到中枢神经系统中。它们产生大量的炎症细胞因子和氮氧化物,从而导致髓鞘脱失和轴突退化。影响中枢神经系统的抗炎症的药物通过降低炎症治疗疼痛[28],大半是止痛药。非甾体抗炎药能够中和环氧合酶的活性减轻疼痛。环氧合酶能够通过合成前列腺素促进炎症的发生,而非甾体抗炎药能够防止合成前列腺素,从而减轻疼痛[29]。本研究结果显示,MSC或是白藜芦醇单独使用,或是联合使用都能显著地降低T细胞的浸润。最近的研究表明白藜芦醇能够与多种细胞中的分子相互作用,如信号转导分子和细胞周期相关的蛋白等[30]。通过这种方式,白藜芦醇活化一系列转录因子,抑制抗凋亡基因,抑制多种蛋白激酶和血管生成相关基因的表达,并且下调炎症生物分子的表达[31]。本研究与以往的关于白藜芦醇抗炎活性的研究结果一致。
当然,MSC联合白藜芦醇所起到增强效果的具体机制还有待于进一步深入探讨。
[1] Bjelobaba I,Savic D,Lavrnja I. Multiple sclerosis and neuroinflammation:The overview of current and prospective therapies[J]. Curr Pharm Des,2017,23(5):693-730.
[2] Borjini N,Fernandez M,Giardino L,et al. Cytokine and chemokine alterations in tissue,CSF,and plasma in early presymptomatic phase of experimental allergic encephalomyelitis (EAE),in a rat model of multiple sclerosis[J]. J Neuroinflammation,2016,13(1):291.
[3] Briken S,Rosenkranz SC,Keminer O,et al. Effects of exercise on Irisin,BDNF and IL-6 serum levels in patients with progressive multiple sclerosis[J]. J Neuroimmunol,2016,299:53-58.
[4] Biller A,Pflugmann I,Badde S,et al. Sodium MRI in Multiple Sclerosis is Compatible with Intracellular Sodium Accumulation and Inflammation Induced Hyper-Cellularity of Acute Brain Lesions[J]. Sci Rep,2016,6:31269.
[5] 朱毅,朱一飞,李世平,等.α硫辛酸酸对实验性自身免疫性脑脊髓炎大鼠轴索损伤的保护作用[J].河北医科大学学报,2015,36(8):874-877.
[6] Comi G,Radaelli M,Soelberg Sorensen P. Evolving concepts in the treatment of relapsing multiple sclerosis[J]. Lancet,2017,389(10076):1347-1356.
[7] Cordiglieri C,Baggi F,Bernasconi P,et al. Identification of a gene expression signature in peripheral blood of multiple sclerosis patients treated with disease-modifying therapies[J]. Clin Immunol,2016,173:133-146.
[8] Covacu R,Brundin L. Endogenous spinal cord stem cells in multiple sclerosis and its animal model[J]. J Neuroimmunol,2016,16:30403-30409.
[9] Cross AH,Song SK. A new imaging modality to non-invasively assess multiple sclerosis pathology[J]. J Neuroimmunol,2017,304:81-85.
[10] Jeong SI,Shin JA,Cho S,et al. Resveratrol attenuates peripheral and brain inflammation and reduces ischemic brain injury in aged female mice[J]. Neurobiol Aging,2016,44:74-84.
[11] Jiang L,Zhang L,Kang K,et al. Resveratrol ameliorates LPS-induced acute lung injury via NLRP3 inflammasome modulation[J]. Biomed Pharmacother,2016,84:130-138.
[12] Kakalij RM,Kumar BD,Diwan PV. Comparative evaluation of nephro- protective potential of resveratrol and piperine on nephrotic BALB/c mice[J]. Indian J Pharmacol,2016,48(4):382-387.
[13] Lancon A,Frazzi R,Latruffe N. Anti-Oxidant,Anti-Inflammatory and Anti-Angiogenic Properties of Resveratrol in Ocular Diseases[J]. Molecules,2016,21(3):304.
[14] Lannan KL,Refaai MA,Ture SK,et al. Resveratrol preserves the function of human platelets stored for transfusion[J]. Br J Haematol,2016,172(5):794-806.
[15] Lee HY,Kim IK,Yoon HK,et al. Inhibitory Effects of Resveratrol on Airway Remodeling by Transforming Growth Factor-beta/Smad Signaling Pathway in Chronic Asthma Model[J]. Allergy Asthma Immunol Res,2017,9(1):25-34.
[16] Lee JA,Ha SK,Cho E,et al. Resveratrol as a Bioenhancer to Improve Anti-Inflammatory Activities of Apigenin[J]. Nutrients,2015,7(11):9650-9661.
[17] Li A,Zhang S,Li J,et al. Metformin and resveratrol inhibit Drp1-mediated mitochondrial fission and prevent ER stress-associated NLRP3 inflamm-asome activation in the adipose tissue of diabetic mice[J]. Mol Cell Endocrinol,2016,434:36-47.
[18] Li D,Liu N,Zhao L,et al. Protective effect of resveratrol against nigrostriatal pathway injury in striatum via JNK pathway[J]. Brain Res,2017,1654(Pt A):1-8.
[19] Limagne E,Lancon A,Delmas D,et al. Resveratrol Interferes with IL1-beta-Induced Pro-Inflammatory Paracrine Interaction between Prim- ary Chondrocytes and Macrophages[J]. Nutrients,2016,8(5):E280.
[20] Liu PL,Chong IW,Lee YC,et al. Anti-inflammatory Effects of Resveratrol on Hypoxia/Reoxygenation-Induced Alveolar Epithelial Cell Dysfunction[J]. J Agric Food Chem,2015,63(43):9480-9487.
[21] Luo G,Li Z,Wang Y,et al. Resveratrol Protects against Titanium Particle-Induced Aseptic Loosening Through Reduction of Oxidative Stress and Inactivation of NF-κB[J]. Inflammation,2016,39(2):775-785.
[22] Maepa M,Razwinani M,Motaung S. Effects of resveratrol on collagen type Ⅱ protein in the superficial and middle zone chondrocytes of porcine articular cartilage[J]. J Ethnopharmacol,2016,178:25-33.
[23] McGill MR,Du K,Weemhoff JL,et al. Critical review of resveratrol in xenobiotic-induced hepatotoxicity[J]. Food Chem Toxicol,2015,86:309-318.
[24] Monserrat Hernandez-Hernandez E,Serrano-Garcia C,Antonio Vazquez-Roque R,et al. Chronic administration of resveratrol prevents morphol-ogical changes in prefrontal cortex and hippocampus of aged rats[J]. Synapse,2016,70(5):206-217.
[25] Ni ZH,Tang JH,Chen G,et al. Resveratrol inhibits mucus overproduction and MUC5AC expression in a murine model of asthma[J]. Mol Med Rep,2016,13(1):287-294.
[26] Nohr MK,Kroager TP,Sanggaard KW,et al. SILAC-MS Based Characterization of LPS and Resveratrol Induced Changes in Adipocyte Proteomics-Resveratrol as Ameliorating Factor on LPS Induced Changes[J]. PLoS One,2016,11(7):e0159747.
[27] Ornstrup MJ,Harslof T,Sorensen L,et al. Resveratrol increases Osteoblast Differentiation In Vitro Independently of Inflammation[J]. Calcif Tissue Int,2016,99(2):155-163.
[28] Pan S,Li S,Hu Y,et al. Resveratrol post-treatment protects against neon-atal brain injury after hypoxia-ischemia[J]. Oncotarget,2016,7(48):79247-79261.
[29] Park D,Jeong H,Lee MN,et al. Resveratrol induces autophagy by directly inhibiting mTOR through ATP competition[J]. Sci Rep,2016,6:21772.
[30] Pektas MB,Sadi G,Koca HB,et al. Resveratrol Ameliorates the Components of Hepatic Inflammation and Apoptosis in a Rat Model of Streptozotocin-Induced Diabetes[J]. Drug Dev Res,2016,77(1):9-12.
[31] Rai G,Mishra S,Suman S,et al. Resveratrol improves the anticancer effects of doxorubicin in vitro and in vivo models:a mechanistic insight[J]. Phytomedicine,2016,23(3):233-242.
(本文编辑:刘斯静)
Effects of mesenchymal stem cells combined with resveratrol on inflammation in mice with experimental autoimmune encephalomyelitis
WANG Dong1, PANG Xiao-lu2, WANG Liang1, ZHANG Li-hong1, WANG Ye3
(1.DepartmentofNeurology,theSecondHospitalofHebeiMedicalUnivesity,Shijiazhuang050000,China;2.DepartmentofDiagnostics,HebeiMedicalUnivesity,Shijiazhuang050017,China; 3.DepartmentofProctology,theTraditionalChineseMedicineHospitalofShijiazhang,Shijiazhuang050000,China)
Objective To study in depth the machenism underlying the therapeutic efficiency of mesenchymal stem cell combined with resveratrol in encephalomyelitis(EAE), and to investigate the effect of mesenchymal stem cell combined with resveratrol on immune inflammation in EAE mice. Methods We investigate the therapeutic efficiency of bone marrow mesenchymal stem cell combined with resveratrol in experimental autoimmune encephalomyelitis by clinical score. The infliteration of immune cells such as monocytes and lymphocytes into brain was observed using HE staining and immunohistochemistry with anti-CD4 antibody. ELISA was conducted to detect the secretion of IFN-γ/TNF-α and IL-4/IL-10 inserum. Results The average clinical score, maximal clinical score, CD4+T cell infiltration, IFN-γ, TNF-α were lower in mBM-MSCs group, resveratrol group, mBM-MSCs combined resveratrol group than that in PBS group. The mBM-MSCs combined resveratrol treatment group was lower than the mBM-MSCs treatment group and the resveratrol treatment group(P<0.05); The levels of IL-4 and IL-10 were higher in mBM-MSCs group, resveratrol group, mBM-MSCs combined resveratrol group than that in PBS group. Combination treatment group was higher than mBM-MSCs group or resveratrol group. The differences were statistically significant(P<0.05). Conclusion Combination treatment with mBM-MSCs and resveratrol can significantly delay the progression of EAE disease. Combined treatment can reduce the number of infla- mmatory cells in EAE mouse spinal cord and promote the transition of type Th1 to type Th2 cytokines in EAE mice.
encephalomyelitis, autoimmune, experimental; mesenchymal stem cells; resveratrol
2017-02-15;
2017-05-25
河北省医学科学研究重点课题(20170534)
王东(1982-),男,河北霸州人,河北医科大学第二医院主治医师,医学博士,从事神经内科疾病诊治研究。
R744.3
A
1007-3205(2017)07-0745-05
10.3969/j.issn.1007-3205.2017.07.001
