基于形变配准剂量累加法的自适应放疗剂量学研究
2017-07-24王琳婧张书旭雷怀宇谭剑明张国前王锐濠
王琳婧,张书旭,雷怀宇,谭剑明,张国前,王锐濠
广州医科大学附属肿瘤医院放疗中心,广东 广州 510095
基于形变配准剂量累加法的自适应放疗剂量学研究
王琳婧,张书旭,雷怀宇,谭剑明,张国前,王锐濠
广州医科大学附属肿瘤医院放疗中心,广东 广州 510095
目的 采用混合形变图像配准方法实现胸腹部和盆腔肿瘤自适应放疗中靶区和危及器官的剂量累加,并与三维适形和调强放疗计划的剂量分布进行剂量学比较。方法 选取10例肺癌和6例宫颈癌接受放射治疗的患者,在分次治疗20次后,重新采集CT图像,与计划CT图像进行形变配准,得到修改后的累加剂量,并与3D-CRT和IMRT计划进行靶区及双肺、脊髓、膀胱、直肠等器官的剂量体积直方图比较。结果 累加剂量后的CI和HI值明显优于3D-CRT和IMRT(P<0.05)。累加剂量的靶区D95、D98及双肺V20、V30、Dmean,心脏V30、V40,脊髓Dmax,膀胱V30、V40、V50、Dmean,直肠的V40、V45、V50、Dmean均<3D-CRT和IMRT计划(P<0.05)。小肠V40、Dmean和股骨头V40、Dmean有所降低,但差异无统计学意义。结论 放疗20次后重新修改放疗计划对胸腹部肿瘤和盆腔肿瘤在提高靶区受照剂量的同时能减少危及器官的实际照射量,降低放疗副作用的发生。
肺癌;宫颈癌;自适应放疗;剂量学;形变图像配准
引言
放射治疗是胸腹部肿瘤和盆腔肿瘤主要治疗手段之一。由于受呼吸频率或肠道蠕动、膀胱充盈等影响,胸腹部和盆腔的靶区和周围正常组织的形态和位置变化较大,靶区漏照和危及器官误照明显[1]。分次治疗过程中根据患者的解剖结构变化,及时再计划成为精准放疗当前需要解决的关键[2]。本研究采用基于灰度和结构的混合形变配准方法在分次治疗过程中对靶区和危及器官进行空间剂量累加,并与三维适形计划与常规调强放疗计划的剂量分布进行比较,分析靶区和危及器官的解剖结构改变及剂量学变化。
1 材料与方法
1.1 病例选择
回顾性分析2015年3月~2015年9月我院收治的10例肺癌患者和6例宫颈癌患者,年龄39~65岁,中位年龄为52岁。其中左肺癌2例、右肺癌4例,中央型肺癌4例;非小细胞肺癌8例,小细胞肺癌2例;宫颈鳞癌Ⅱ期3例,Ⅲ期3例。选取病例均有明确放疗适应症。
1.2 体位固定及C T扫描
采用美国GE 公司生产的Lightspeed 16排螺旋CT进行体位固定和扫描。患者在平静呼吸状态下,仰卧于体架上,采用热塑体膜固定,激光灯标定中心后行CT增强扫描,层厚5 mm,层间距5 mm,横断面图像分辨率为512×512。肺癌扫描范围由肺尖至肺底(第12胸椎下缘);宫颈癌图像采集前告知患者排空直肠,适当充盈膀胱,扫描范围从髂骨嵴水平到耻骨联合下5 cm。复位CT扫描采用西门子Oncor自适应放疗系统的滑轨大孔径CT,复位体位和扫描条件均与之前固定方式相同。
1.3 靶区勾画
放射治疗科医生利用Philips Pinnacle3 V8.2计划系统,根据ICRU第62号报告相关要求勾画靶区。
肺癌勾画区域包括:① 肿瘤体积(Gross Tumor Volume,GTV):肺窗中所见肺内原发病灶及阳性区域淋巴结;② 临床靶区(Clinical Target Volume,CTV):原发灶周围的亚临床病灶及预防照射的区域淋巴引流区;③ 计划靶区(Planning Target Volume,PTV):在CTV基础上再加考虑靶区移动及摆位误差,外放范围为5~10 mm;④ 危及器官(Organ At Risk,OAR):GTV外肺组织、心脏和脊髓。
宫颈癌勾画区域包括:① 肿瘤体积(GTV):原发灶及转移淋巴结;② 临床靶区(CTV):GTV外肿瘤可能侵犯的区域,上界从左右髂总血管分叉处,下界至闭孔下缘,其中包括髂总、髂内、髂外、骶前淋巴结区;③ 计划靶区(PTV):考虑摆位误差等因素,在CTV基础上外放7~10 mm;④ 危及器官(OAR):直肠、小肠、膀胱。
1.4 放疗计划设计
每个入选病例均设计3种放射治疗计划,射线能量选用6 MV X线。肺癌总剂量为60 Gy,分次剂量为2 Gy/次,5次/周,共30次。宫颈癌总剂量为50 Gy/25次(2 Gy/次)。
(1)3D-CRT计划设计。将定位CT图像传输至Prowess 计划系统进行计划设计。根据肿瘤的位置和形状设野,肺癌采用2~4野,包括前后野对穿照射、斜野对穿照射和3野交角照射,设野时尽量避开脊髓、心脏和两侧肺组织。宫颈癌采用2野前后对穿或左、右、前、后4野方式布野。剂量参考点为GTV中心。
(2)IMRT计划设计。利用RayStation系统进行IMRT计划设计。肺癌采用5野或7野照射,照射野设计以避开脊髓和肺部卷入射野内体积最少为原则,处方剂量限制条件为95%PTV>60 Gy,危及器官剂量限制条件:双肺V30<20%、V20<30%、V5<55%,心脏V40<30%、V30<40%,脊髓<40 Gy。宫颈癌采用7野照射,靶区剂量权重最大,直肠和膀胱权重次之,PTV限量为95%PTV>50 Gy,OAR限量:膀胱V45<50%,直肠V40<50%、V30<60%,小肠V40<40%、V30<50%,股骨头V50<5%。
(3)ART计划设计。利用RayStation计划系统,使用相同约束条件将首次治疗前制定的放疗计划IMRT-Plan1和放疗20次后重新扫描CT图像制定的计划IMRT-Plan2(其中IMRT_plan 2中的靶区和OAR由勾画IMRT_plan 1的同一位医生按相同标准进行勾画),通过形变配准得到IMRTPlan 3,将IMRT-Plan 1计划的20次剂量与IMRT-Plan 2计划的10次(肺癌)或5次(宫颈癌)剂量进行累积得到累加剂量后的IMRT-Plan3,根据IMRT-Plan3(即ART计划)的DVH图,评价靶区和危及器官的剂量与体积参数。
1.5 形变配准剂量累加
本研究采用RayStation系统基于灰度和结构的混合形变配准方法对剂量进行形变。将放疗前的计划CT图像设为“浮动图像”,放疗20次时获取的图像设为“参考图像”,建立两个图像的形变栅格,以体素强度、肿瘤轮廓为限定区域,通过形变栅格将“浮动图像”映射到“参考图像”上,用混合形变配准得到的变形场将剂量矩阵从“浮动图像”图像空间映射到“参考图像”图像空间上,进行剂量叠加。
1.6 剂量体积评价指标
待3组放疗计划完成后,对每组方案的靶区和OAR分别进行剂量体积参数的评估。
肺癌:① 靶区剂量参数D2、D95、D98、Dmean。靶区均匀性指数HI=(D2-D98)/Dmean,HI值越小,靶区内剂量分布越均匀,靶区适形指数CI=(VPTV95%/VT)×(VPTV95%/VPTV),其中VPTV95%为95%的等剂量曲线包绕的PTV体积,VT为靶区体积,VPTV为靶区PTV的体积,CI值越接近1,靶区适形度越好;② 肺组织的受照剂量>5、10、20、30 Gy的体积(V5、V10、V20、V30)。③ 心脏的受照剂量>30、40 Gy的体积(V30、V40)。④ 脊髓的最大受照剂量Dmax。
宫颈癌:① 肿瘤靶区的靶区剂量参数D2、D95、D98、Dmean、HI值和CI值;② 膀胱的平均剂量Dmean、受照剂量>30、40、50 Gy的体积(V30、V40、V50);③ 直肠的平均剂量Dmean、受照剂量>40、45、50 Gy的体积(V40、V45、V50);④ 小肠的平均剂量Dmean、受照剂量>40 Gy的体积(V40);⑤ 股骨头的平均剂量Dmean、受照剂量>40 Gy的体积(V40)。
1.7 统计学分析
采用SPSS 19.0统计软件进行数据分析,用x-±s表示,应用配对t检验对各参数进行每两组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 靶区C I值和H I值
通过对每例患者的CI值和HI值进行计算, 结果见表1。3种照射方式靶区CTV的CI值和HI值两两比较均有显著差异。肺癌ART组的CI值比IMRT组增加了3.2%、HI值降低45.8%,比3D-CRT组CI值增加了27.5%、HI值降低53.8%。IMRT组的CI值比3D-CRT组增加了25.1%,HI值降低14.7%。宫颈癌ART组的CI值比IMRT组增加了3.0%、HI值降低12.2%,比3D-CRT组CI值增加了48.4%、HI值降低了27.1%。IMRT组的比3D-CRT组CI值增加了46.7%、HI值降低了17.0%。数据表明ART组的靶区适形度和均匀性均优于IMRT组和3D-CRT组,IMRT组的CI值和HI值优于3D-CRT组,见图1。

图1 3种方案的靶区CTV的CI值(a)和HI值(b)
2.2 靶区剂量
肺癌靶区CTV的D2、Dmean结果显示ART组>IMRT组>3D-CRT组,但差异无统计学意义。D95、D98结果两两比较有统计学差异,其中ART 组CTV的D95比IMRT组增加了2.9%、比3D-CRT组增加了4.5%,IMRT组比3D-CRT组增加了1.7%。CTV的D98值ART 组比IMRT组增加了1.4%、比3D-CRT组增加了3.7%,IMRT组比3D-CRT组增加了2.4%,见表2。
宫颈癌靶区CTV的D95、D98、Dmean结果两两比较有统计学差异,ART组中CTV的D95比IMRT组增加了2.9%、比3D-CRT组增加了4.5%,IMRT组比3D-CRT组增加了1.7%。CTV的D98值ART组比IMRT组增加了1.4%、比3D-CRT组增加了3.7%, IMRT组比3D-CRT组增加了2.4%。平均剂量ART组比3D-CRT组增加了3.1%,IMRT组比3D-CRT组增加了1.7%,见表3。
表1 3种方案的靶区CTV的CI值和HI值分布
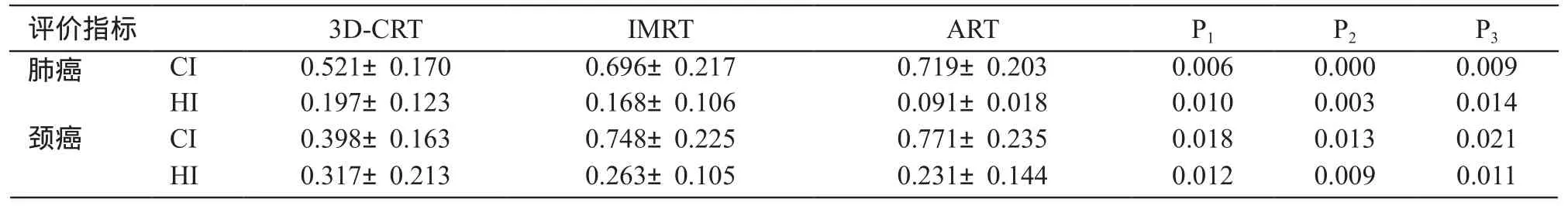
表1 3种方案的靶区CTV的CI值和HI值分布
注:P1为3D-CRT组与IMRT组;P2为3D-CRT组与ART组;P3为IMRT组与ART组比较结果。
评价指标 3D-CRT IMRT ART P1 P2 P3肺癌 CI 0.521±0.170 0.696±0.217 0.719±0.203 0.006 0.000 0.009 HI 0.197±0.123 0.168±0.106 0.091±0.018 0.010 0.003 0.014颈癌 CI 0.398±0.163 0.748±0.225 0.771±0.235 0.018 0.013 0.021 HI 0.317±0.213 0.263±0.105 0.231±0.144 0.012 0.009 0.011
表2 3种方案的肺癌靶区剂量学分布

表2 3种方案的肺癌靶区剂量学分布
注:P1为3D-CRT组与IMRT组;P2为3D-CRT组与ART组;P3为IMRT组与ART组比较结果。
评价指标 3D-CRT IMRT ART P1 P2 P3肺癌 D2 6329.26±231.68 6321.20±215.27 6411.31±241.56 0.298 0.316 0.367 D95 5821.62±165.20 5924.99±167.14 6098.10±153.51 0.026 0.022 0.030 D98 5715.44±209.21 5854.03±265.22 5935.46±229.90 0.019 0.013 0.023 Dmean 6076.84±121.28 6113.54±117.37 6218.63±176.91 0.120 0.061 0.087
表3 3种方案的宫颈癌靶区剂量学分布

表3 3种方案的宫颈癌靶区剂量学分布
注:P1为3D-CRT组与IMRT组;P2为3D-CRT组与ART组;P3为IMRT组与ART组比较结果。
评价指标 3D-CRT IMRT ART P1 P2 P3宫颈癌 D2 5362.84±236.64 5371.61±142.97 5383.58±217.45 0.397 0.378 0.431 D95 4812.70±197.80 4952.53±178.13 5091.62±159.34 0.021 0.014 0.019 D98 4735.38±215.72 4871.11±246.43 4963.45±279.17 0.017 0.009 0.013 Dmean 5020.13±168.47 5109.21±134.27 5178.37±143.59 0.047 0.035 0.071
2.3 危及器官剂量
2.3.1 肺癌危及器官剂量
全肺V5的体积ART组>IMRT组和3D-CRT组,差异无统计学意义。全肺V10、V20、V30的体积ART组<IMRT组<3D-CRT组,V20、V30体积的两两比较有统计学意义。全肺平均剂量ART组比IMRT组减少了11.3%、比3D-CRT组减少了16.2%,IMRT组比3D-CRT组减少了6.6%,差异有统计学意义。心脏V30、V40的体积ART组<IMRT组<3D-CRT组,差异有统计学意义。脊髓的最大受量ART组比IMRT组减少了5.0%,比3D-CRT组减少了9.8%,IMRT组比3D-CRT组减少了5.1%,差异有统计学意义,见表4。
2.3.2 宫颈癌危及器官剂量
膀胱V30、V40、V50的体积ART组<IMRT组<3D-CRT组,且两两比较均有统计学意义。膀胱的平均剂量ART组比IMRT组减少了3.4%,比3D-CRT组减少了23.8%,IMRT组比3D-CRT组减少了21.1%,差异有统计学意义。直肠的V40、V45、V50体积ART组均比IMRT组和3D-CRT组有所降低,且两两比较有统计学意义。直肠的平均剂量ART组比IMRT组减少了11.1%,比3D-CRT组减少了17.2%,IMRT组比3D-CRT组减少了6.8%,差异有统计学意义。小肠的V40、Dmean和股骨头V40、Dmean均有所降低,但差异无统计学意义,见表5。
3 讨论
现阶段3D-CRT和IMRT广泛应用于放射治疗,通过提高患者摆位精度,使照射剂量同靶区的分布保持一致,然而,伴随治疗的持续进行, 靶区和周围正常组织的位置形状发生改变,导致靶区漏照和危及器官受照过量,影响了放疗准确性,增加了放疗副反应。自适应放疗(ART)是由Yan等[3]提出,通过放疗过程中获取患者图像来判断靶区解剖体积变化,为后续分次治疗期间的重新设计放疗计划提供依据,使得靶区受照剂量达到最大,并有效的保护周围正常组织。本研究在分次治疗过程中重新采集患者CT图像,通过变形配准方法进行剂量叠加,优化成新放疗计划,评价患者在整个放疗过程的靶区和危及器官的实际受照剂量,并比较自适应放疗与3D-CRT和IMRT计划的剂量学差异。
3.1 A R T对靶区剂量影响
肿瘤局控率同靶区实际受照剂量密切相关,当靶区受照剂量增加,肿瘤局控率也随之提高[4],治疗过程中胸腹部肿瘤和盆腔肿瘤,因形态和位置变化较大,导致肿瘤靶区实际剂量与原计划不相符[5],需要及时根据图像信息调整放疗计划,以提高肿瘤局部控制率。Guckenberger等[6]对13例非小细胞肺癌患者研究显示,采用ART技术可以提高40%的肿瘤局部控制率。侯勇等[7]对5例肺癌患者进行ART与3D-CRT比较,结果显示ART计划的Dmax、Dmin均高于3D-CRT计划,Dmean,D95所受剂量相似。Ramsey等[8]采用自适应放疗对肺癌患者进行研究,结果表明肿瘤靶区缩小60%~80%,肿瘤照射剂量提高。Stewart等[9]将33名宫颈癌患者分成两组,一组不再重新计划,一组每周重新扫CT或MRI制定新放疗计划。不重新计划组有27%患者CI不可接受,并且CTV D98受照不足D95的处方剂量。重新计划后,所有患者CTV D98受照高于D95的处方剂量。莫玉珍等[10]采用宫颈癌离线自适应放疗,在治疗进行到15次后重新扫描CT和制定计划,结果证实修改计划后肿瘤体积退缩率为51.4%
表4 3种方案的剂量学分布

表4 3种方案的剂量学分布
注:P1为3D-CRT组与IMRT组;P2为3D-CRT组与ART组;P3为IMRT组与ART组比较结果。
评价指标 3D-CRT IMRT ART P1 P2 P3全肺 V5 65.47±10.13 65.12±11.46 66.26±16.12 0.236 0.189 0.259 V10 56.24±9.31 53.07±6.79 50.21±6.59 0.079 0.065 0.083 V20 30.12±6.89 27.14±5.25 25.97±6.33 0.016 0.010 0.021 V30 20.80±2.35 19.17±2.57 17.43±2.15 0.008 0.005 0.011 Dmean 1786.33±262.25 1668.13±231.83 1479.08±245.51 0.009 0.006 0.013心脏 V30 30.56±12.03 23.24±11.04 19.23±11.13 0.012 0.009 0.015 V40 20.12±9.40 16.75±9.81 12.56±7.92 0.018 0.013 0.023脊髓 Dmax 4224.13±126.35 4009.45±154.12 3809.54±156.26 0.015 0.011 0.021
表5 3种方案的剂量学分布
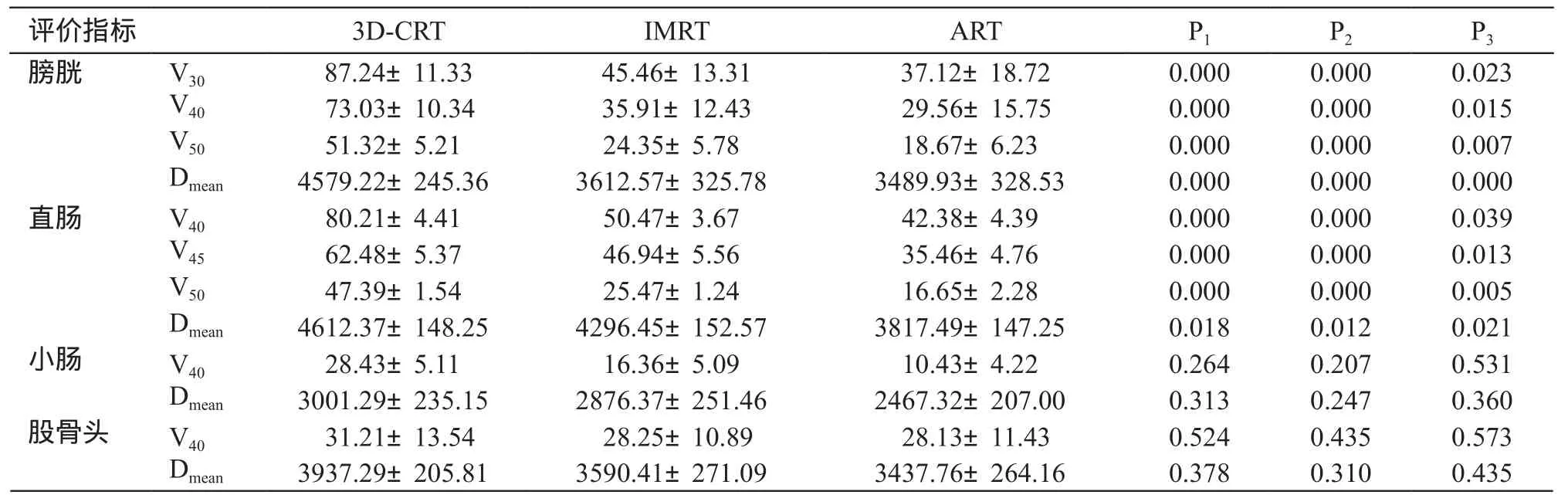
表5 3种方案的剂量学分布
注:P1为3D-CRT组与IMRT组;P2为3D-CRT组与ART组;P3为IMRT组与ART组比较结果。
评价指标 3D-CRT IMRT ART P1 P2 P3膀胱 V30 87.24±11.33 45.46±13.31 37.12±18.72 0.000 0.000 0.023 V40 73.03±10.34 35.91±12.43 29.56±15.75 0.000 0.000 0.015 V50 51.32±5.21 24.35±5.78 18.67±6.23 0.000 0.000 0.007 Dmean 4579.22±245.36 3612.57±325.78 3489.93±328.53 0.000 0.000 0.000直肠 V40 80.21±4.41 50.47±3.67 42.38±4.39 0.000 0.000 0.039 V45 62.48±5.37 46.94±5.56 35.46±4.76 0.000 0.000 0.013 V50 47.39±1.54 25.47±1.24 16.65±2.28 0.000 0.000 0.005 Dmean 4612.37±148.25 4296.45±152.57 3817.49±147.25 0.018 0.012 0.021小肠 V40 28.43±5.11 16.36±5.09 10.43±4.22 0.264 0.207 0.531 Dmean 3001.29±235.15 2876.37±251.46 2467.32±207.00 0.313 0.247 0.360股骨头 V40 31.21±13.54 28.25±10.89 28.13±11.43 0.524 0.435 0.573 Dmean 3937.29±205.81 3590.41±271.09 3437.76±264.16 0.378 0.310 0.435
本研究对10例肺癌患者和6例宫颈癌患者进行再计划变形配准剂量叠加后,发现进行再计划调整后的CI值和HI值均优于IMRT和3D-CRT组,肺癌靶区受照剂量相较于IMRT和3D-CRT平均提高了0.182 Gy和0.277 Gy,宫颈癌癌靶区受照剂量相较于IMRT和3D-CRT平均提高了0.139 Gy和0.279 Gy。因此,自适应放疗能有效增加靶区受照剂量,提高肿瘤局控率。
3.2 A R T对危及器官受量影响
肺炎的发生与V5、V10、V20、V30有关[11],当正常肺组织受过量剂量照射时,引发急性放疗副反应机率增高[12],而脊髓最大受照剂量则是判断放射性脊髓炎发生的重要指标[13]。Kataria等[14]对15例肺癌患者进行IMRT和ART治疗,结果显示ART组,双肺、心脏和脊髓的受照剂量更小,并且能减少对正常组织的毒性损伤。侯勇等[7]对5例肺癌患者进行ART与3D-CRT比较,结果显示ART计划中双肺Dmean、V5、V10、V20、V30以及脊髓Dmax均低于3D-CRT计划。Ramsey等[8]采用肺部肿瘤自适应放疗,每周更新治疗计划,正常肺组织V20较之前减少2l%。
本研究发现肺组织V10、V20、V30较于IMRT和3D-CRT平均降低了5.66%、7.40%、11.76%和10.71%、13.33%、15.00%,心脏V30、V40较于IMRT和3D-CRT平均降低了17.13%、25.01%和33.32%、37.57%,脊髓Dmax分别降低了0.200 Gy 和0.415 Gy。本研究表明ART放疗后,肺、心脏、脊髓的受照剂量不同程度减少,降低了放射性肺炎、脊髓炎的发生。
膀胱、直肠等正常组织伴随肿瘤退缩及自身体积、位移改变,而受到过量照射,易引发放射性膀胱炎、直肠炎、肠穿孔等放疗副作用[15]。Jadon等[16]对12例宫颈癌患者研究发现,受膀胱充盈程度和直肠充盈程度影响,采用自适应方案,可以保证OAR不受过量照射。庞皓文等[17-18]通过采集多分次间患者的CBCT 图像,发现膀胱、直肠在放疗过程中体积和受照剂量有较大变化,及时调整放疗计划对保护膀胱、直肠等危及器官是非常有必要的。张宁等[19]采用自适应放疗,分次间修改计划,结果显示膀胱、直肠的V40、V50、V45和Dmean逐渐降低,小肠的V40和Dmean亦逐渐降低,并且受照剂量少于剂量限制要求。
本研究发现膀胱V30、V40、V50较于3D-CRT和IMRT平均降低了57.45%、59.52%、63.60%和18.34%、17.68%、23.32%,Dmean分别降低了1.089 Gy 和0.123 Gy。直肠V40、V45、V50较于3D-CRT和IMRT平均降低了47.16%、43.24%、64.80%和16.02%、24.45%、34.62%,Dmean分别降低了0.795 Gy 和0.479 Gy。小肠和股骨头剂量均有降低,但数据无统计学意义。本研究显示治疗过程中修改放疗计划,膀胱、直肠等受照剂量均有大幅减少,及时进行自适应放疗对降低放疗副反应是非常有必要的。
综上所述,自适应放疗技术通过分次治疗期间获取患者解剖图像,重新优化放疗计划,在提高肿瘤靶区受照剂量的同时,最大限度地减少周围正常组织的受照剂量,降低了放射性并发症的发生概率,提高了患者的生存质量。本研究因病例数较少,对最终的肿瘤局控率及放疗预后效果仍需进一步通过大量的病例研究得到验证。
[1] Greco C,Ling CC.Broadening the scope of image-guided radiotherapy (IGRT)[J].Aela Oncol,2008,47:1193-1200.
[2] Jaffray OA,Siewetdsen JH,Wang JW,et al.Flat-panel cone-beam computed tomography for image-guided radiation therapy[J]. Int J Radial Oncol Biol Phys,2002,53:1337-1349.
[3] Yan D,Vicini F,Wong J,et al.Adaptive radiation therapy[J].Phys Medal Biol,1997,42(1):123-132.
[4] Rosenzweig KE,Fox JL,Yorke E,et al.Results of a phase I dose-escalation study using three-dimensional conformal radiotherapy in the treatment of inoperable nonsmall cell lung carcinoma[J].Cancer,2005,103(10):2118-2127.
[5] Jadon R,Pembroke CA,Hanna CL,et al.A systematic review of organ motion and image-guided strategies in external beam radiotherapy for cervical cancer[J].Clin Oncol,2014,26(4):185-196.
[6] Guckenberger M,Richter A,Wilbert J,et al.Adaptive radiotherapy for locally advanced non-small-cell lung cancer does not under dose the microscopic disease and has the potential to increase tumor control[J].Int J Radiat Oncol Biol Phys,2011,81:275-282.
[7] 侯勇,尹勇,王鹏程,等.基于KVCBCT形变配准的肺癌自适应计划与静态3DCRT计划的比较研究[J].中华放射肿瘤学杂志,2012,21(3):267-270.
[8] Ramsey CR,Langen KM,Kupelian PA,et al.A technique for adaptive mage-guided helical tomotherapy for lung cancer[J].Int J Radiat Oncol Biol Phys,2006,64(4):1237-1244.
[9] Stewart J,Lim K,Kelly V,et a1.Automated weekly replanning for intensity-modulated radiotherapy of cervix cancer[J].Int J Radiat Oncol Biol Phys,2010,78(2):350-358.
[10] 莫玉珍,龙雨松,付江萍,等.宫颈癌IMRT过程中调整放疗计划对靶区和正常危及器官受照剂量的影响[J].山东医药,2013,53(6):48-49.
[11] Kim TH,Cho KH,Pyo HR,et a1.Dote-volumetric paraneterm for predicting severe radiation pneumonitis after threedimensional conformal radiation therapy for lung cancer[J]. Radiology,2005,235:208-215.
[12] Piotrowski T,Matecka-Nowak M,Milecki P.Prediction of radiation pneumonitis: dose-volume histogram analysis in 62 patients with non-small cell lung cancer after three-dimensional conformal radiotherapy[J].Neoplasma,2005,52(1):56-62.
[13] Bradley JD,Hope A,Naqa EI,et al.A nomogram to predict radiation pneumonitis, derived from a combined analysis of RTOG 9311 and institutional data[J].Int J Radiat Oncol Biol Phys,2007,69(4):985-992.
[14] Kataria T,Gupta D,Bisht SS,et al.Adaptive radiotherapy in lung cancer:dosimetric benefits and clinical outcome[J].Br J Radiol,2014,87(1038):20130643.
[15] Bondar ML,Hoogeman MS,Mens JW,et al.Individualized nonadaptive and online-adaptive intensity-modulated radiotherapy treatment strategies for cervical cancer patients based on pretreatment acquired variable bladder filling computed tomography scans[J].Int J Radiat Oncol Biol Phys,2012,83(5):1617-1623
[16] Jadon R,Pembroke CA,Hanna CL,et al.A systematic review of organ motion and image-guided strategies in external beamradiotherapy for cervical cancer[J].Clin Oncol,2014,26(4): 185-196.
[17] 庞皓文,邱杰,孙帅,等.宫颈癌调强放疗中直肠体积与位置变化及对吸收剂量影响[J].中华放射肿瘤学杂志,2012,21(3):218-221.
[18] 庞皓文,邱杰,全红,等.宫颈癌调强放疗中膀胱解剖结构变化及对其吸收剂量影响研究[J].中华放射肿瘤学杂志,2011,20(3):258-61.
[19] 张宁,王凡,童铸廷,等.图像引导宫颈癌体外自适应放疗的剂量学研究[J].安徽医科大学学报,2015,50(5):699-701.
本文编辑 袁隽玲
Dosimetric Study of the Deformable Image Registration Based on Dose Accumulation in Adaptive Radiation Therapy
WA N G L in-jin g, Z H A N G S h u-x u, L E I H u a i-y u, T A N J i a n-mi n g, Z H A N G G u o-q i a n, WA N G R u i-h a o
Radiotherapy Center, Cancer Center of Guangzhou Medical University, Af fi liated Tumor Hospital of Guangzhou Medical University, Guangzhou Guangdong 510095, China
O b j e c t i v e To compare and evaluate the dosimetric difference of adaptive radiation therapy (ART) over conventional intensity modulated radiation therapy (IMRT) and 3D conformable radiation therapy (3D-CRT) when using hybrid deformable image registration (DIR) for dose accumulation in thoracic and pelvic cancer patients. Me t h o d s CT images of 10 lung cancer patients and 6 cervical cancer patients who
radiation therapy were obtained for twenty treatment fractions. Then, the ART plan was generated by applying the hybrid DIR to register the fractional and planning CT images to calculate the accumulative dose distribution. Dosimetric parameters of the tumor and the organs at risk (OARs) such as lungs, spinal cord, bladder and rectum were compared with the ART and the conventional 3D-CRT and IMRT plan. R e s u l t s The CI and HI values in ART plan were statistically significantly (P<0.05) better than the 3D-CRT and IMRT plans. The D95, D98, the lung V20, V30, Dmean, the heart V30, V40, the spinal cord Dmax, the bladder V30, V40, V50, Dmeanand the rectum V40, V45, V50, Dmeanwere all smaller than those in 3D-CRT and IMRT plans (P<0.05). While the intestine V40, Dmeanand the caput femoris V40, Dmeandecreased in ART plan, but the difference was not statistically signi fi cant. C o n c l u s i o n Replanning after 20 times can achieve better target coverage and OARs sparing, it can potentially reduce the radiation side effect and increase the local control rate in thoracic and pelvic cancer patients.
lung cancer; cervical cancer; adaptive radiation therapy; dosimetric; deformable image registration
R737.33
B
10.3969/j.issn.1674-1633.2017.07.019
1674-1633(2017)07-0068-06
2017-04-14
广东省教育厅特色创新项目(2016KTSCX116);广东省医药科学技术研究基金项目(A2017349)。
张书旭,教授/主任技师,博士生导师,主要研究方向为肿瘤放射物理学和医学图像应用研究。
作者邮箱:gthzsx@163.com
