HBV DNA一步法定量检测性能验证及评价
2017-07-24应葳李万春宋涛王珏莫伏根汪亦品程茂良
应葳 李万春 宋涛 王珏 莫伏根 汪亦品 程茂良
210029,南京医科大学附属逸夫医院病理与临床检验中心
·技术方法·
HBV DNA一步法定量检测性能验证及评价
应葳 李万春 宋涛 王珏 莫伏根 汪亦品 程茂良
210029,南京医科大学附属逸夫医院病理与临床检验中心
目的 评估一步法HBV DNA定量检测试剂的分析性能及其临床应用价值。方法 采用江苏省临床检验中心室间质控品和南京医科大学附属逸夫医院收集的高浓度临床标本,对一步法HBV DNA定量检测试剂的精密度、标本携带污染、正确度、功能灵敏度、分析测量范围等性能参数进行方法学性能验证和评价。结果 低浓度和高浓度标本的批内CV均≤5%,且重复性精密度<3/5TEa,中间精密度<4/5TEa;无标本携带污染;正确度符合江苏省室间质评要求;功能灵敏度可以达到100 IU/ml,天间重复CV值≤20%;在7.58×101~7.58×108IU/ml分析测量范围线性关系良好。结论 定量检测项目在正式用于患者标本检测前必须对检测系统的分析性能做详细充分的评价,通过验证一步法HBV DNA定量检测试剂可以满足目前乙肝筛查和临床疗效监测的需求,并且经济简便,适用于临床常规检测。
乙型肝炎病毒感染呈世界性流行,尤其在发展中国家。据世界卫生组织报道,全球约20亿人曾感染HBV,其中2.4亿人为慢性HBV感染者,每年约有65万人死于HBV感染所致的肝功能衰竭、肝硬化和肝细胞癌(HCC)[1,2]。我国肝硬化和HCC患者中,由HBV感染引起的比例分别为60%和80%[3]。HBV DNA定量检测主要用来检测HBV在血液中的含量,从而了解病毒的传染性强弱以及病情的严重程度,是HBV感染最直接、特异性强、灵敏性高的指标[4]。乙肝检测指南建议在确认HBsAg阳性的检测结果后,首选使用定量或定性核酸检测(Nucleic acid amplification technique, NAT)来检测HBV-DNA,并为是否进行治疗提供指导[5]。本研究通过自建临床实验室HBV-DNA定量检测系统性能验证方法,评估并分析免核酸浓缩、提取过程的一步法HBV-DNA定量检测试剂的分析性能及其临床应用价值[6]。
1 材料与方法
1.1 质控品与血清 验证实验准确度所用质控品为2014年4月江苏省临床检验中心室间质控品;HBV DNA高值阳性血清为本院收集的高浓度临床标本(7×108IU/ml);HBV DNA阴性血清为标准小牛血清;均保存于-20 ℃冰箱。
1.2 仪器与试剂 罗氏LightCycler Z480荧光定量PCR仪;湖南圣湘生物科技有限公司HBV一步法检测试剂盒(批号:2016024)。
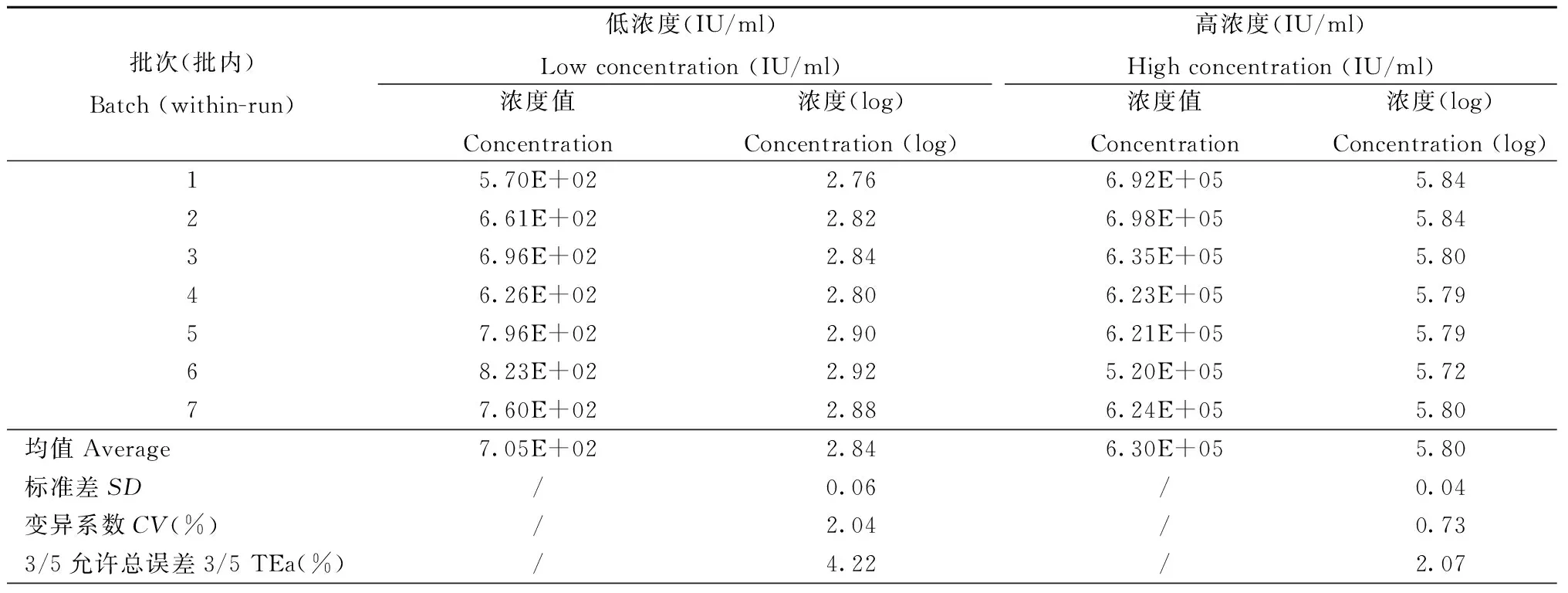
表1 重复性精密度验证结果
1.3 HBV-DNA抽提及扩增 参照圣湘HBV一步法检测试剂盒说明书手工抽提HBV DNA;扩增程序:50 ℃ 2 min,1个循环;94 ℃ 2 min,1个循环;94 ℃ 5 s,57 ℃ 30 s,45个循环;25 ℃ 10 s,1个循环。57 ℃采集FAM、VIC通道的荧光信号。
1.4 性能验证指标及验证方法
1.4.1 精密度:重复性精密度(批内精密度):将高值阳性血清梯度稀释至浓度范围为105IU/ml和102IU/ml的高、低两个水平,在同一批试验中重复检测7次;中间精密度(批间精密度):将高、低浓度105IU/ml和102IU/ml两个水平的标本,在同一批试验中重复检测4次,连续检测4 d,每个水平共收集16个数据;分别统计两个水平标本检测值的均值和标准差,再计算CV值。批内精密度应符合检测浓度对数值的变异系数(CV)≤5%,且以能力验证/室间质评评价界限(靶值±0.4对数值)作为允许总误差(TEa),重复性精密度<3/5TEa,中间精密度<4/5TEa[7,8]。
1.4.2 标本携带污染:将高值阳性标本(7.58×108IU/ml)和阴性标本进行穿插排列,同时提取核酸,验证试剂抗污染能力及重复性。要求高浓度标本一致性好,且不会造成相邻阴性标本孔的污染。
1.4.4 功能灵敏度:将高值阳性标本(7.58×108IU/ml)用阴性血清进行梯度稀释至浓度接近试剂盒定量检测下限,分别为100 IU/ml和150 IU/ml、300IU/ml,对稀释后的标本重复检测5 d以上,要求检出率100%,CV≤20%。
1.4.5 分析测量范围:将高值阳性标本(7.58×108IU/ml)用阴性血清进行系列梯度稀释(1∶101~1∶107)至75.8 IU/ml,对高值阳性标本和稀释后的标本进行同批次检测,每个标本重复检测3次,对测定值和理论值进行线性回归分析,要求满足b在1±0.05范围内,a接近于0,R2≥0.95[9,10]。
2 结果
2.1 精密度验证结果 采用经梯度稀释的低浓度和高浓度标本进行精密度的验证,两个标本浓度范围分别为7.58×102IU/ml和7.58×105IU/ml。实验结果统计如表1和表2所示,低浓度和高浓度标本批内CV均≤5%,且重复性精密度<3/5TEa,中间精密度<4/5TEa。
表 2 中间精密度验证结果
Tab.2 Verified results of inter-assayCV
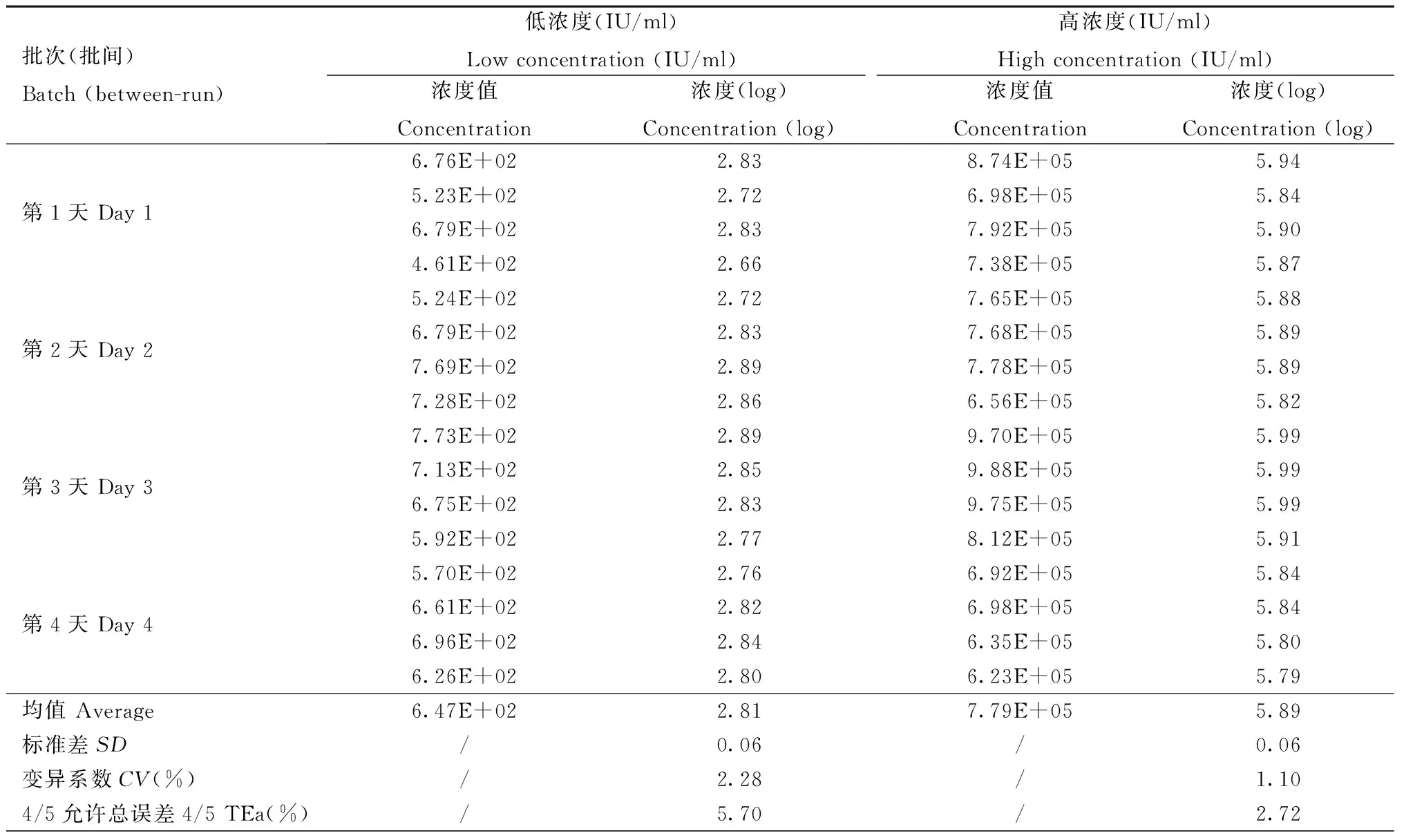
批次(批间)Batch(between-run)低浓度(IU/ml)Lowconcentration(IU/ml)高浓度(IU/ml)Highconcentration(IU/ml)浓度值Concentration浓度(log)Concentration(log)浓度值Concentration浓度(log)Concentration(log)第1天Day16.76E+022.838.74E+055.945.23E+022.726.98E+055.846.79E+022.837.92E+055.904.61E+022.667.38E+055.87第2天Day25.24E+022.727.65E+055.886.79E+022.837.68E+055.897.69E+022.897.78E+055.897.28E+022.866.56E+055.82第3天Day37.73E+022.899.70E+055.997.13E+022.859.88E+055.996.75E+022.839.75E+055.995.92E+022.778.12E+055.91第4天Day45.70E+022.766.92E+055.846.61E+022.826.98E+055.846.96E+022.846.35E+055.806.26E+022.806.23E+055.79均值Average6.47E+022.817.79E+055.89标准差SD/0.06/0.06变异系数CV(%)/2.28/1.104/5允许总误差4/5TEa(%)/5.70/2.72
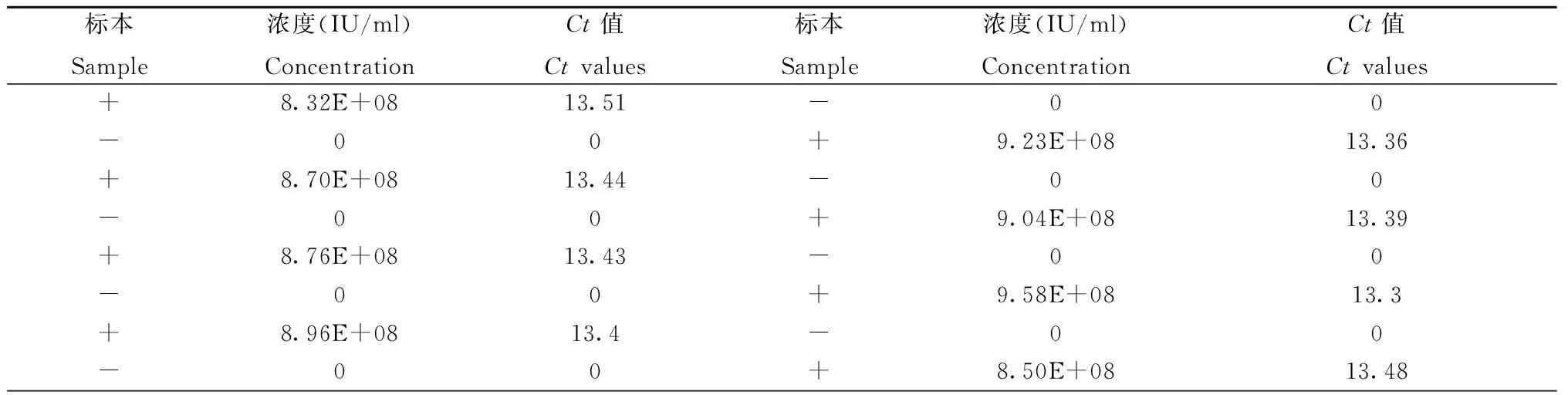
表3 标本携带污染验证结果
2.2 标本携带污染验证结果 将高值阳性标本和阴性标本共16个进行穿插排列,同时进行核酸提取和PCR扩增,均无交叉污染,结果如表2所示。
2.3 正确度验证结果 采用江苏省室间质控品162001-162005,实验结果统计如表4所示,绝对偏差≤±0.4log值。
2.4 功能灵敏度验证结果 将高值阳性标本梯度稀释至定量检测下限浓度100 IU/ml、150 IU/ml、300 IU/ml,样品重复检测5 d以上,结果如表4所示,功能灵敏度为100 IU/ml,阳性检出率100%,天间重复CV值≤20%。厂家公布的定量检测下限100 IU/ml验证合格。
2.5 分析测量范围验证结果 将高值阳性标本7.58×108IU/ml梯度稀释至7.58×101IU/ml,结果如表6和图1所示,实际值与理论值的直线回归方程为y=0.998x-0.012,R2=0.99,满足b在1±0.05范围内,a接近于0,R2≥0.95,线性范围为7.58×101~7.58×108IU/ml。试剂说明书声称的定量线性范围1.0×102~5.0×109IU/ml验证合格。
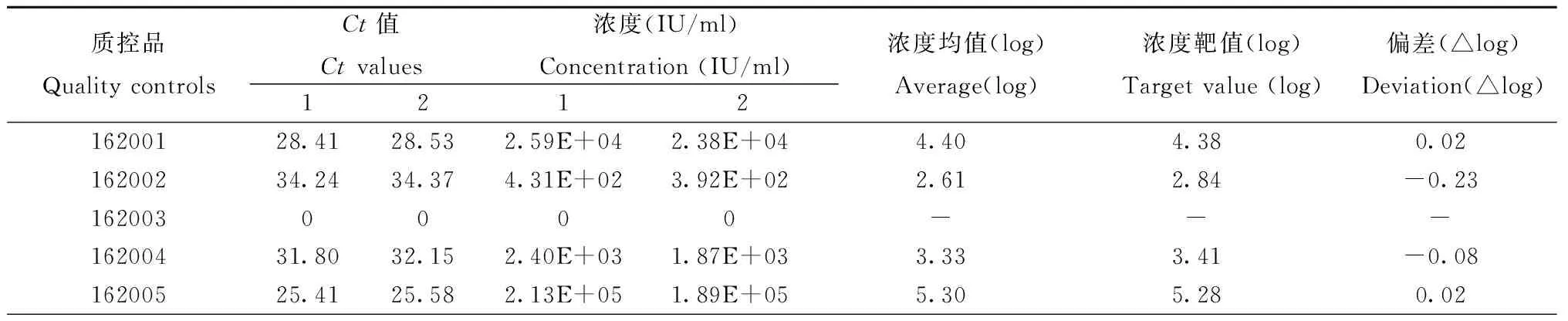
表4 正确度验证结果
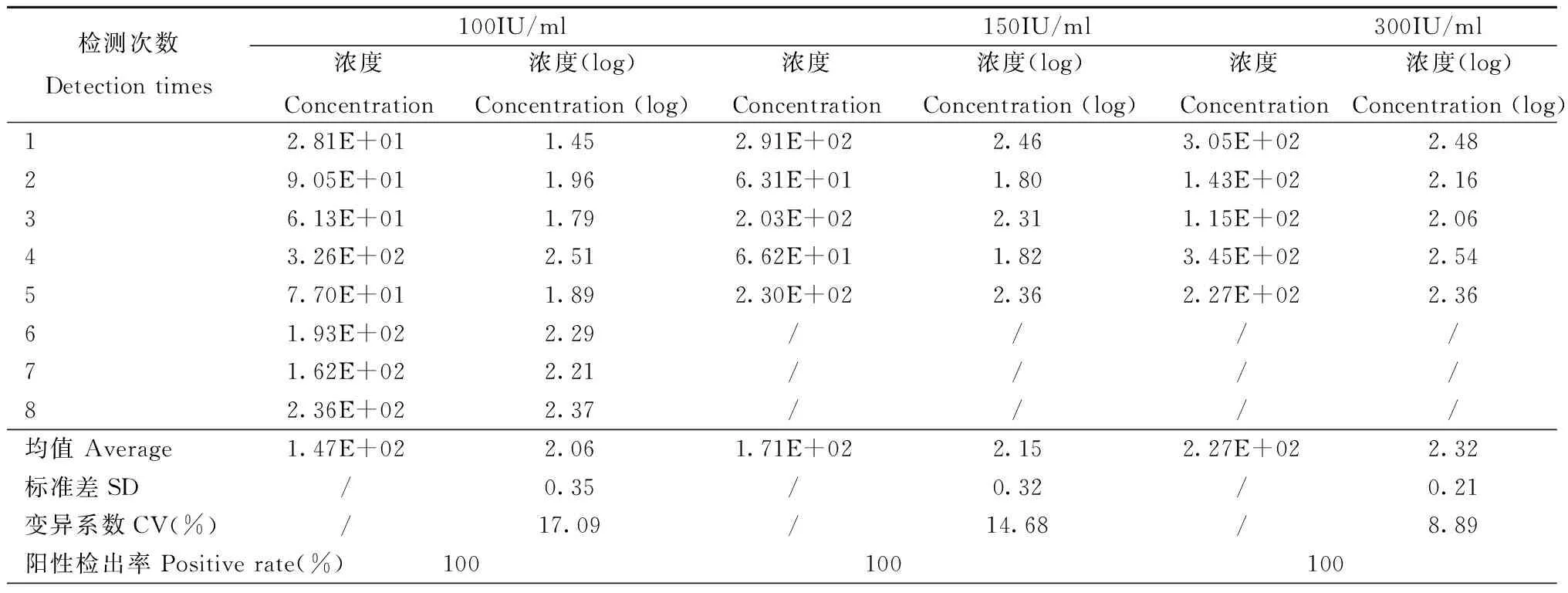
表5 功能灵敏度验证结果
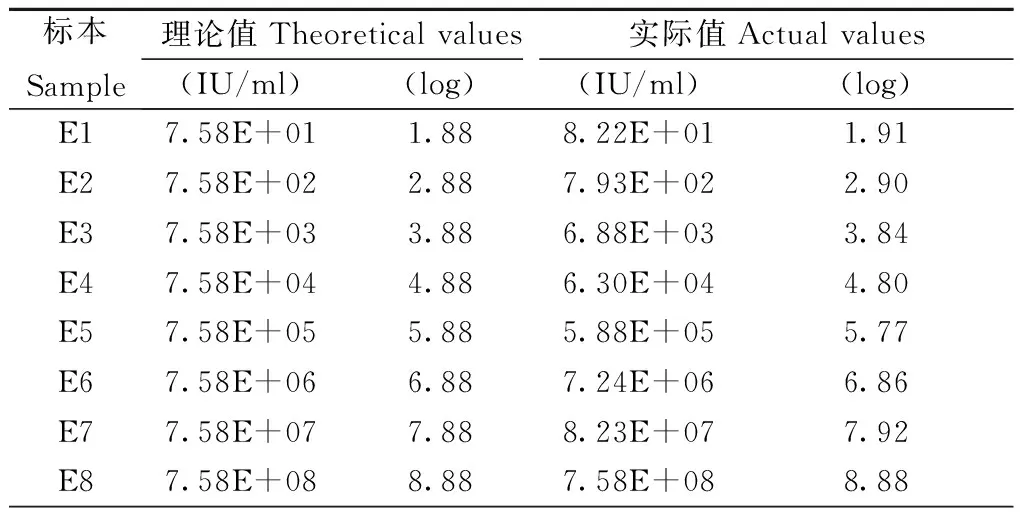
表6 实际值与理论值

图1 实际值与理论值线性关系Fig.1 Linear relation between actual values and theoretical values
3 讨论
通过对一步法HBV-DNA定量检测试剂的精密度、标本携带污染、正确度、功能灵敏度以及分析测量范围进行验证,评估试剂的分析性能。验证结果表明,在7.58×102IU/ml和7.58×105IU/ml浓度范围具有较好的重复性精密度和中间精密度,符合CNAS-CL36的要求;无标本携带污染;正确度符合江苏省室间质评要求;功能灵敏度可以达到100 IU/ml,天间重复CV值≤20%;在7.58×101~7.58×108IU/ml分析测量范围线性关系良好。
根据美国《临床实验室改进法案修正案》规定,要求参加认可的实验室在开展某一检测项目前需提供并保留相关的方法学验证实验数据[11]。专家认为临床实验室应合理选择方法学验证实验,对于使用厂商提供的原检测系统(即封闭系统)进行检测的检验项目,由于厂商能够提供详细性能资料,实验室在使用这样的检测系统作患者标本检测前,只需要做基本性能验证实验,即精密度验证实验、可报告范围验证实验、正确度验证实验和参考区间验证实验。实验室在进行方法学验证实验前应对所需进行的验证实验项目进行系统设计,形成一套合理的评价方案,需先完成精密度验证实验和标本携带污染实验,检测系统的良好的重复性和无携带污染是进行其他方法学验证实验的前提;在确认精密度和无携带污染后,进行正确度验证实验,只有通过了正确度的验证,方能进行其他后续的方法学验证实验;在检测系统的精密度和正确度经过验证后,依次可进行功能灵敏度验证实验、分析测量范围验证实验[12]。通过对某些定量检测项目的灵敏度评价,为分析测量范围和临床科报告范围的低限值确定做参考;对于低值特别有意义的检测项目,必需进行功能灵敏度验证实验[12]。
2015年新版《慢性乙型肝炎防治指南》首次提出乙肝临床治愈概念,即持续性病毒应答(停止治疗后血清HBV DNA持续低于检测下限)且HBsAg阴转或伴有抗-HBs阳转、ALT正常、肝组织病变轻微或无病变[13]。最新的临床研究显示,HBeAg阳性患者接受核苷酸类似药物(NAs)治疗1~3年后达到HBV DNA < 200 IU/ml及HBeAg转阴者,再接受Peg-IFN 序贯治疗48 周可将HBsAg清除率和血清转换率提高到16.2%和12.5%,基本可达到临床治愈[14]。因此,精准有效的HBV DNA检测结果对于慢乙肝治疗过程中的疗效和治疗终点的判断、停药时机把握以及治疗的动态评估起到了重要的指导作用。指南建议HBV DNA定量检测采用灵敏度和精确度高的实时定量聚合酶链反应(real-time quantitative PCR)法[14]。大部分国产试剂定量检测下限是500~1 000 IU/ml,而高灵敏度试剂基于磁珠法自动化核酸提取平台可以达到20 IU/ml。一步法HBV DNA定量检测试剂检测下限为100 IU/ml,操作简便,成本较高灵敏度的磁珠法低,可以满足乙肝筛查和临床疗效的监测、随访。
综上所述,定量检测项目在正式用于患者标本检测前必须对检测系统的分析性能做详细充分的评价,确认检测系统符合临床要求方可准予常规检测。本研究通过合理建立实验室HBV DNA定量检测系统性能验证方法,确认一步法HBV DNA定量检测试剂可以满足目前乙肝筛查和临床疗效监测的需求,并且经济简便,适用于临床常规检测。
[1] Ott JJ,Stevens GA,Groeger J, et al. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity [J]. Vaccine, 2012, 30(12): 2212-2219. doi: 10.1016/j.vaccine.2011.12.116.
[2] Lozano R,Naghavi,Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the global burden of disease study 2010 [J]. Lancet, 2012, 380(9859): 2095-2128. doi: 10.1016/S0140-6736(12)61728-0.
[3] Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China [J]. Hepatology, 2014, 60(6):2099-2108. doi: 10.1002/hep.27406.
[4] 黄素钦,吴秋芳. HBV感染者血清HBV DNA定量检测临床价值的探讨[J]. 中华实验和临床病毒学杂志,2004,18(1):79. doi:10.3760/cma.j.issn.1003-9279.2004.01.029.
[5] Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection [R]. Geneva: World Health Organization 2015.
[6] 陆金春,冯瑞祥,张敏,等. 一种新型快速定量检测HBV DNA试剂的评价[J]. 临床检验杂志,2012,30(12):976-977.
[7] Clinical and Laboratory Standards Institute. EP15-A2: User verification of performance for precision and trueness, approved guideline-second edition [Z];USA: CLSI, 2005.
[8] 中国合格评定国家认可委员会. CNAS-CL36 医学实验室质量和能力认可准则在基因扩增检验领域的应用说明[S]. 北京:中国标准出版社,2014.
[9] NCCLS. EP6-A: Evaluation of the linearity of quantitative measurement procedures: a statistical approach: approved guideline [Z]. USA: NCCLS, 2003.
[10] 国家食品药品监督管理局. 核酸扩增检测用试剂(盒). 中华人民共和国医药行业标准YY/T 1182-2010 [S]. 2010.
[11] Department of Health and Human Services, Centers for Medicare & Medicaid Services. Clinical laboratory improvement amendments of 1988: final rule [S]. 2003, 3704.
[12] 毕波,吕元. 定量检测方法学性能验证的系统设计[J]. 中华检验医学杂志,2007, 30(2):143-145. doi:10.3760/j:issn:1009-9158.2007.02.006.
[13] 中华医学会肝病分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志,2015,31(12):1941-1960.
[14] Hu P, Jia S, Zhang W, et al. A multi-center randomized study on the efficacy and safety of switching to peginterferon alpha-2a (40KD) for 48 or 96 weeks in HBeAg positive CHB patients with a prior NUC history for 1 to 3 years: an interim analysis of NEW SWITCH study [J]. Hepatology, 2014, 60(6):1273a-1274a.doi:
(本文编辑:唐浏英)
Performance verification and evaluation of a one-step HBV DNA quantitative detecting system
Ying Wei, Li Wanchun, Song Tao, Wang Jue, Mo Fugen, Wang Yipin, Cheng Maoliang
Center of Pathology and Laboratory Medicine, Sir Run Run Hospital, Nanjing Medical University, Nanjing 210029, China
s:Wang Yipin, Email:yipin698@163.com; Cheng Maoliang, Email:yw959687@163.com
Objective To evaluate analytical performance and clinical application value of a one-step HBV DNA quantitative detecting system. Methods Analytical performance of the one-step HBV DNA quantitative detecting reagents included precision, residual contamination, accuracy, functional sensitivity and analytical measurement range were verified by collecting high concentration samples and external quality control samples from Jiangsu provincial clinical test center. Results The within-run coefficient of variation (CV) of both low and high concentration samples were below 5%, meanwhile the intra-assay CV was below 3/5 TEa and inter-assay CV was below 4/5 TEa. There was no residual contamination and the analytic accuracy met the requirement of external quality assessment (EQA). Functional sensitivity was able to attain 100 IU/ml, while the day to day CV was below 20%. It exhibited a benign linear relation from 7.58×101to 7.58×108IU/ml. Conclusions The analytic performance of a new testing system must be evaluated particularly before detecting samples of patients by quantitative tests. This study proves that the one-step HBV DNA quantitative detecting reagents can meet requirement of hepatitis B screening and clinical therapy monitoring, which is economic and simple for clinical routine tests.
Hepatitis B virus; Quantitative detecting system; Performance verification; Fluorescence quantitative PCR
汪亦品,Email:yipin698@163.com;程茂良,Email:yw959687@163.com
10.3760/cma.j.issn.1003-9279.2017.03.017
肝炎病毒,乙型;定量检测;性能验证;荧光定量PCR
2017-03-07)
