主动脉右冠窦起源室性心律失常患者的电生理特征及射频消融效果
2017-07-24王云龙王芸梁卓韩智红汪烨任学军李学斌
王云龙,王芸,梁卓,韩智红,汪烨,任学军,李学斌
• 论著 •
主动脉右冠窦起源室性心律失常患者的电生理特征及射频消融效果
王云龙1,王芸1,梁卓1,韩智红1,汪烨1,任学军1,李学斌2
目的 探讨主动脉右冠窦(RCC)起源的室性心律失常(VAs)患者的心电生理特征和射频消融疗效。方法 入选2008年1月~2016年8月经电生理检查及射频消融证实起源于RCC 的27例患者,分别在右室流出道(RVOT)、主动脉根部和左室流出道行激动顺序标测和起搏标测,分析其体表心电图特征,右室流出道标测电生理特点,成功消融靶点处电位特征及射频消融的疗效。结果 Ⅰ导联R波振幅较高(0.52±0.35 mV)提示VAs起源于RCC可能。RCC起源VAs在右室流出道标测最早激动点(EAS)位于中后间隔,74.1%(20/27)的患者RVOT EAS处及周围表现为双电位或复合电位,RVOT激动自中间隔向上、下传导,Carto系统测量右室流出道EAS距离希氏束(26.3±4.4)mm。75.0%(6/9)的患者在RVOT最早点处放电消融一过性有效,最终24例(88.9%)成功消融靶点位于RCC前上缘,3例(11.1%)成功靶点位于右窦瓣下。结论 RCC起源VAs在RVOT和RCC标测时具有特征性电位, RVOT EAS处放电可一过性有效,大部分在RCC前上缘消融成功,少数需在瓣下消融始能成功。
射频消融;主动脉右冠窦;室性心律失常;电生理
特发性室性心律失常(VAs)最常见起源于心室流出道。虽然既往有一些研究来比较右室流出道(RVOT)起源的VAs与主动脉窦起源VAs的电生理特点[1-6],但是关于主动脉右冠窦(RCC)起源VAs电生理特征的报道尚少。本研究观察分析了一组RCC起源VAs,重点探讨其电生理特点和射频消融治疗的疗效及安全性。
1 资料与方法
1.1 研究对象 入选2008年1月~2016年8月间于北京安贞医院心内科行电生理检查加射频消融证实起源于RCC的27例患者(其中男性11例、女性16例),年龄12~67(44±24)岁。27例患者均有VAs相关症状,其中14例表现为持续性或非持续性室速合并室性早搏(PVC),13例单纯表现为PVC。所有患者均无明显的心脏结构和功能异常,窦性心律下体表心电图完全正常。所有患者在接受射频消融治疗前均使用过至少一种抗心律失常药物,且药物治疗难以控制VAs。
1.2 电生理检查,标测和消融 术前签署知情同意书,停用抗心律失常药5个半衰期以上。本研究应用Bard电生理记录系统记录患者窦性心律和VAs时的心电图,术前确保准确放置心电图电极片,心内双极电图滤波30~500 Hz。如术中无或极少有自发VAs,则给予静脉滴加异丙肾上腺素(2~5 μg/min)诱发临床VAs。
如果VAs时心电图V1导联为左束支阻滞图形,则首先穿刺右股静脉,采用冷盐水灌注导管(NaviStar,Biosense Webster,CA,USA)或压力导管在三维系统(CARTO,Biosense Webster,Diamond Bar,CA,USA)下标测RVOT,采用激动顺序标测联合起搏标测以识别VAs起源部位。基于既往研究[6]将RVOT间隔部分为前间隔、中间隔和后间隔。如RVOT标测不能找到最早激动部位或消融失败,则改行主动脉逆行途径标测左室流出道和主动脉窦。起搏标测时起搏周长为500 ms,刺激电流为舒张晚期起搏阈值+1 mA。如行动脉系统标测则给予静脉肝素并维持ACT在250 s左右。
拟于主动脉瓣上放电消融前,先行冠状动脉或主动脉根部造影或经心内超声明确消融导管头端位置,并在造影影像下通过左前斜位和右前斜位测量RCC成功消融靶点与右冠状动脉开口及RCC底部的距离。设定消融温度为43℃,功率为30~35 W,盐水灌注速度为17 ml/min。如果放电10 s内可见室速或室早消失或明显减少,则持续放电60~90 s,否则终止放电并调整导管位置。如果主动脉瓣上消融失败,则继续行主动脉瓣下标测或再次行RVOT内标测。消融终点为VAs消失,并且静滴异丙肾上腺素(2~5μg/min)不能诱发VAs。
1.3 主动脉窦内电图特征比较 使用Bard电生理记录系统定量分析消融导管记录到的主动脉窦内电位特征,计算激动时间与电位振幅。分析主动脉窦内成功靶点的电位特征:计算收缩期前电位(P1)的发生率、P1振幅和P1电位领先QRS波起始的时间;记录窦性心律时紧跟QRS波出现的异常电位(P2)的发生率;将成功消融靶点与非成功消融点的电位特征进行比较。
1.4 统计学方法 使用SPSS 19.0统计软件进行分析,计量参数以均数±标准差表示 。
2 结果
2.1 临床特征及心电图特征 入选的所有患者VAs时QRS形态呈左束支阻滞图形,Ⅱ、Ⅲ、aVF导联R波直立(图1),Ⅰ导联R波振幅较高(0.52 ±0.35)mV。其中5例曾于RVOT行射频消融失败或复发。
2.2 右室流出道标测及消融 27例RCC起源VAs在RVOT标测最早激动点(EAS)位于中后间隔,领先QRS波起始19~30(28±9.8)ms。70%(20/27)的患者RVOT EAS局部电位表现为双电位或复合电位,并且在RVOT EAS周围的一小块区域内也可标测到双电位或复合电位(图2)。RVOT间隔区域的激动标测表明,激动自中间隔向上、下传导。Carto系统测量RVOT间隔EAS距离希氏束22~29.4(26.3±4.4mm)(图3)。
19例患者进行了起搏标测,其中15例在RVOT的EAS起搏心电图与自发VAs图形不一致。共有9例在RVOT EAS进行了放电消融,6例一过性有效,均在放电10 s内VAs消失,但均在2~8(5±3)min内恢复。这6例在该部位反复放电均不能获得完全的成功,遂改行主动脉根部标测及消融。

图1 RCC起源VAs体表12导联心电图
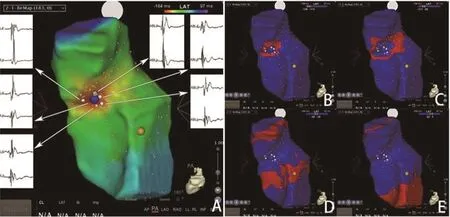
图2 RCC起源VAs标测RVOT(A:RVOT最早点位于中后间隔,局部电位为双电位或复杂电位,最早点附近一下片范围内能够记录到双电位或复杂电位;B,C,D,E:RVOT激动自最早点向上、下激动)
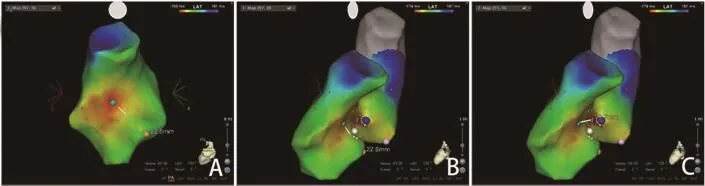
图3 Carto测量RVOT最早点与希氏束(A),RCC靶点(B、C)距离
2.3 主动脉窦内标测及消融 27例RCC起源的VAs患者中24例(88.9%)成功消融靶点位于RCC前上缘,3例(11.1%)成功靶点位于右窦瓣下,平均放电1~9(2.8±3.0)次,RCC内成功消融靶点领先QRS波起始(31±13.1)ms,Carto系统测量RCC成功消融点距离RVOT EAS仅(12.3±2.6)mm(图3)。RCC内成功消融靶点处窦性心律下局部心室电位很大,而心房波很小或缺失(图4)。
与RVOT的EAS相比,RCC内成功消融靶点领先QRS波起始的程度并未明显增加,但二者记录到的局部电位明显不同。放电前24例在RCC的EAS处进行起搏标测,20例没有获得较好的起搏图形。通过综合应用三维电解剖标测、X线透视及心内超声来定位消融靶点在RCC内的位置[9]。在右前斜位时消融导管位于右冠状动脉开口前下部(图5A),而左前斜位透视下消融导管较右冠状动脉开口更偏左,且高于RCC窦底(图5B)。X线透视下,右前斜位消融靶点距右冠状动脉口部为(12.2±3.2)mm,左前斜位距RCC底部(7.2±0.8)mm。3例通过心内超声定位消融导管位于RCC前上部(图5C)。24例RCC成功消融靶点均未记录到His电位,但有13例在RCC后部或底部记录到了His电位。有3例频发PVC的患者在RCC内仅一过性有效但未能消融成功,后于主动脉瓣下与RCC内消融点相对应部位消融成功。

图4 成功靶点及不成功靶点(A:无效靶点;B:有效但不成功靶点;C:成功靶点)
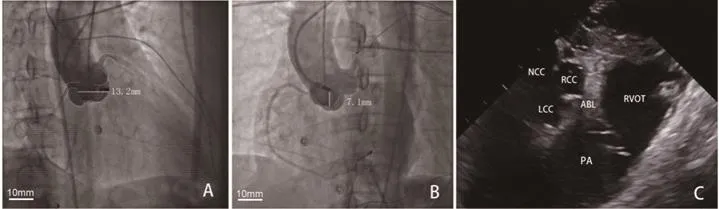
图5 主动脉根部造影(A,B)及心腔内超声(C)提示导管顶端位于RCC前缘(LCC:左冠窦,NCC:无冠窦,PA:肺动脉,ABL:消融导管)
2.4 RCC心内电图分析 24例RCC成功消融靶点处的局部电位可见2种电位,一种为高频的近场电位P1,另一种为远场的心室电位P2(图4)。窦性心律时,仅10例在RCC靶点处内可见明显延迟出现的P2电位,其余大部分病例P2电位融于心室波中。当VAs发生时,可见P2电位反转形成P1电位。所有24例在RCC成功消融点均记录到明显P1电位,但76.6% RCC内非成功消融点也能记录到P1电位。成功消融靶点处的P1电位平均领先QRS波起始(31±13.1)ms,且与领先度相似的非成功消融点相比,成功消融靶点的P1电位振幅更高(图4)。
2.5 并发症与预后 所有患者均无卒中、心包填塞、冠状动脉损伤、急性心肌梗死或心脏瓣膜损伤等。随访(9±3)个月,所有患者停用抗心律失常药物且无室性心律失常发作。
3 讨论
本文通过对RCC起源VAs的心电图及电生理特点研究发现:①RCC起源的VAs在RVOT标测时EAS位于RVOT中后间隔;②RCC起源的VAs在RVOT标测时可在EAS周围的一小块区域内也可标测到双电位或复合电位;③成功消融靶点多位于RCC前缘,且大部分高于窦底部;④P1振幅和P1领先度可能是RCC起源VAs成功消融的预测因子;⑤因在解剖上RCC前上部与RVOT中后间隔临近,因此在RVOT标测到的EAS处进行放电消融,可一过性有效;⑥RCC内消融有效但不能成功时可尝试于主动脉瓣下标测消融。
Yamada等[2]发现RCC与左冠窦(LCC)连接处起源的VAs在V1~V3导联呈qrS型,Bala等[1]研究显示19例起源于RCC-LCC连接处的VAs中,15例V1导联呈QS波形,且降支有切迹。在我们的研究中,大部分VAs起源于RCC前上部,接近或位于RCC-LCC连接处,因为均于RCC消融成功,故我们将其认为RCC起源的VAs,符合上述心电图特征的比例很低,这可能与样本量较小和对心脏空间方位的定义不同有关。Yamada等[4]研究显示起源于RCC和LCC的VAs,EAS位于希氏束区域。而本研究发现RCC起源VAs在RVOT标测到的EAS位于中后间隔,造成两个研究不同的原因可能是Yamada的研究中VAs起源于RCC偏后靠近NCC部位,而本研究中VAs起源于RCC前上部位。
该研究提示RVOT标测结果对RCC起源VAs的预测具有一定的指导意义。该研究所有患者首先行RVOT标测,最早点均位于中后间隔,三维标测系统测量最早激动点与希氏束之间的距离为(26.3±4.4)mm。这可能与解剖相关:RCC紧邻RVOT间隔侧较低的位置。因此RVOT标测最早激动点距离希氏束较近(小于3 cm)对于预测VAs起源于RCC有一定的指导作用。该研究中19例RVOT EAS局部电位为双电位或复合电位,并且EAS附近RVOT中后间隔一小片区域内能够标测到双向或复合电位,同时RVOT的EAS处电位与RCC内成功消融靶点处的局部电位几乎同步领先,Carto系统测量二者距离为(12.3±2.6)mm,而且RVOT的激动标测显示激动是自中间隔向间隔上、下传导,因此我们认为RVOT中后间隔处标测到最早激动点为RCC的远场电位与RVOT近场电位的融合。因此RVOT最早点处能够标测到双电位或复杂电位也对RCC起源有预测作用。9例患者于RVOT的EAS处消融,其中6例一过性有效,这也表明二者位置非常接近,同时也提示在RVOT中后间隔消融一过性有效时应考虑VAs起源于RCC。
27例RCC起源的VAs患者中24例有效消融靶点在RCC前上缘,为避免冠状动脉损伤,RCC内消融前应行冠状动脉造影。在24例成功消融靶点未记录到希氏束电位,但标测过程中有13例在RCC后部或底部记录到了His电位。这与解剖位置有关,RCC后部临近中心纤维体,而希氏束从中间穿过[7]。因此在RCC内消融时,应警惕由于靶点与希氏束可能临近而有发生传导阻滞的风险。有文献报道在主动脉窦起源的VAs中可记录到P1和P2电位[1,2],P1领先QRS波≥50 ms提示消融可能成功[2]。本研究中,仅小部分病例在RCC内可见明显延迟出现的P2电位,其余大部分病例P2电位融于心室波中。所有24例在RCC成功消融点均记录到明显P1电位,但非成功消融点也能记录到P1电位,二者P1电位记录率无明显差别,因此记录到P1、P2不能帮助判断消融点能否成功,但成功消融靶点的P1电位振幅较高。因为主动脉内消融有发生冠状动脉和主动脉瓣损伤等严重并发症的可能,因此为了提高消融的安全性和有效性,在消融前通过P1电位振幅和P1领先QRS波的程度来帮助判断理想靶点,从而尽可能减少主动脉内放电次数。起搏标测通常不能获得完全匹配的图形,原因是由于RCC内成功起搏常常需要高输出能量,而这会导致较大面积的心肌夺获。本研究中,3例在RCC消融一过性有效,后于主动脉瓣下与RCC消融点相对应部位消融成功。虽然这3例在RCC内可记录到高大的P1电位,但瓣下成功消融靶点领先度较RCC内消融点更多。提示一些貌似RCC起源的VAs可能真正的起源点位于主动脉瓣下[8],因此右窦内消融只一过性有效时可尝试于主动脉瓣下标测消融。
综上所述,主动脉RCC起源VAs在RVOT和RCC标测时具有特征性电位, RVOT EAS处放电,可一过性有效。大部分RCC起源VAs可在RCC前上缘消融成功,P1振幅和P1领先度是成功消融靶点的预测因素,少数可在瓣下消融成功。
[1] Bala R,Garcia FC,Hutchinson MD,et al. Electrocardiographic and electrophysiologic features of ventricular arrhythmias originating from the right/left coronary cusp commissure[J]. Heart Rhythm,2010,7(3):312-22.
[2] Hachiya H,Yamauchi Y,Iesaka Y,et al. Discrete prepotential as an indicator of successful ablation in patients with coronary cusp ventricular arrhythmia[J]. Circ Arrhythm Electrophysiol,2013,6(5):898-904.
[3] Yamada T,Lau YR,Litovsky SH,et al. Prevalence and clinical, electrocardiographic, and electrophysiologic characteristics of ventricular arrhythmias originating from the noncoronary sinus of Valsalva[J]. Heart Rhythm,2013,10(11):1605-12.
[4] Yamada T,McElderry HT,Doppalapudi H,et al. Idiopathic ventricular arrhythmias originating from the aortic root: Prevalence, electrocardiographic and electrophysiologic characteristics, and results of radiofrequency catheter ablation[J]. J Am Coll Cardiol,2008,52(2): 139-47.
[5] Yamada T,Yoshida N,Murakami Y,et al. Electrocardiographic characteristics of ventricular arrhythmias originating from the junction of the left and right coronary sinuses of Valsalva in the aorta: The activation pattern as a rationale for the electrocardiographic characteristics[J]. Heart Rhythm,2008,5(2):184-92.
[6] 张俊蒙,王云龙,韩智红,等. Carto系统与传统电生理标测指导消融频发室性期前收缩的对比研究[J]. 中国循证心血管医学杂志, 2014(6):687-9.
[7] Dixit S,Gerstenfeld EP,Callans DJ,et al. Electrocardiographic patterns of superior right ventricular out flow tract tachycardias: distinguishing septal and free-wall sites of origin[J]. J Cardiovasc Electrophysiol. 2003 Jan;14(1):1-7.
[8] Yamada T,Yoshida N,Murakami Y,et al. Electrocardiographic characteristics of ventricular arrhythmias originating from the junction of the left and right coronary sinuses of Valsalva in the aorta: The activation pattern as a rationale for the electrocardiographic characteristics[J]. Heart Rhythm,2008,5(2):184-92.
本文编辑:田国祥
Idiopathic ventricular arrhythmias originating from the right coronary sinus: prevalence,electrocardiographic/electrophysiological characteristics, and catheter ablation
WANG Yun-long*, WANG Yun, LIANG Zhuo, HAN Zhi-hong, WANG Ye, REN Xue-jun, LI Xue-bin.*Department of Cardiac Electrophysiology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China.
REN Xue-jun, E-mail: renxj@163.com
Objectives To investigate the electrophysiological characteristics and radiofrequency ablation of patients with ventricular arrhythmia (VAs) originating from the right coronary cusp (RCC). Methods Twentyseven patients were enrolled from January 2008 to August 2016. activation mapping and pace mapping were conducted at right ventricular outflow tract (RVOT), aortic root and left ventricular outflow tract, to analyze the electrocardiographic characteristics of the surface, the electrophysiological characteristics of the right ventricular outflow tract, the potentials characteristics of the ablation target and the effect of radiofrequency ablation. Results RCC origin predictors were larger R amplitude in ECG lead I (0.52±0.35 mV). The earliest activation site (EAS) of RVOT was located in middle-posterior septal portion and the distance between His bundle and EAS was 26.3 ±4.4 mm. Double or complex potentials was recorded in RVOT middle-posterior septal area surrounding EAS in 70% (20/27) patients. Most of successful ablation (24/27) happened in anterior and upper margin of RCC. Among 3 patients, ablation was successfully below the aortic valve. Conclusions VAs originating from RCC have characteristic potentials in mapping at RVOT and RCC. Discharge at RVOT EAS can be a transient effective. Most RCC-VAs were ablated successfully in anterior and upper aspects of RCC, a few could be successfully ablated only in the subvalvular.
Radiofrequency ablation; Right coronary cusp; Ventricular arrhythmias; Electrophysiology
R540.46
A
1674-4055(2017)06-0655-04
国家自然科学基金(81100126);北京市卫生系统高层次卫生技术人才培养计划资助(2015-3-056)
1100029 北京,首都医科大学附属北京安贞医院心内科;2100044 北京,北京大学人民医院心内科
任学军,E-mail:renxj@163.com
10.3969/j.issn.1674-4055.2017.06.04
