冻融作用对农田土壤可溶性氮组分的影响①
2017-07-21田路路隽英华孙文涛程淑芳
田路路,隽英华,刘 艳,孙文涛,程淑芳
冻融作用对农田土壤可溶性氮组分的影响①
田路路1,隽英华2*,刘 艳2,孙文涛2*,程淑芳3
(1 沈阳农业大学土地与环境学院,沈阳 110866;2 辽宁省农业科学院植物营养与环境资源研究所,沈阳 110161; 3 冠县农业局,山东聊城 252500)
为了解非生长季农田土壤氮素转化过程,采用室内冻融模拟培养试验研究了不同冻融温度和冻融循环次数对东北4种典型农田土壤(棕壤、褐土、草甸土、黑土)可溶性氮组分含量的影响。结果表明:随着冻结温度降低,4种农田土壤可溶性无机氮(DIN,NO– 3-N + NH4+-N)、可溶性有机氮(DON)和可溶性全氮(DTN)含量均显著增加。随着融化温度升高,除NH4+-N含量显著升高外,4种农田土壤NO– 3-N、DON和DTN含量的变化行为受冻结温度和土壤类型的协同影响。随着冻融循环次数增加,棕壤和褐土NO– 3-N、NH4+-N、DON和DTN含量均显著增加;草甸土NO– 3-N、DON和DTN 含量均显著增加,而NH4+-N含量显著降低;黑土NO– 3-N和NH4+-N含量均显著降低,而DON和DTN含量则先升高后降低。不同类型土壤受冻融作用影响的响应能力不同,其大小顺序为褐土>棕壤、草甸土>黑土。可见,冻融作用促进了土壤氮素转化,有利于土壤有效氮的累积,为春季作物生长提供足够的氮素,但同时也增加了土壤氮素流失风险。
冻融作用;农田土壤;氮素转化;可溶性氮组分
氮素在土壤生态系统中的存在形态及其迁移转化与土壤氮素供应和生态环境质量密不可分。土壤中能被水或盐溶液浸提出的氮素称为可溶性氮素(DN, dissolved nitrogen),它是土壤氮素中最活跃的组分[1]。一方面, 它是土壤有效养分,可以直接或经过转化后为作物吸收利用[2-3];另一方面,它的移动性相对较强,可能随水分运移而发生径流或淋溶损失,引起环境污染[4]。这些可溶性氮素又可以分为可溶性无机氮(DIN, dissolved inorganic nitrogen)和可溶性有机氮(DON, dissolved organic nitrogen),目前对农田土壤DIN (硝态氮 + 铵态氮,NO– 3-N + NH4+-N)的迁移、转化及其对生态环境效应等方面已进行了大量研究[5],而对DON变化行为及其效应的研究相对较少。DON是土壤有机氮中最活跃的组分,是土壤中溶解性有机氮的潜在来源[6]。DON的变化行为是土壤微生物分解土壤有机质释放DON和DON被土壤吸附及微生物降解等过程综合作用的结果,与DON在土壤氮素矿化、固持、淋失和作物吸收等方面中的作用有密切的关系[3, 7]。
在中高纬度和高海拔地区,冻融交替是非生长季常见的自然现象[8]。冻融作用可以明显改变土壤的理化性质和生物学性质,如破坏土壤结构、影响团聚体稳定性、释放一部分可供微生物直接利用的营养元素、加强有机质的矿化作用、增强酶的活化效应等[9-11]。已有研究表明,冻融作用提高土壤中可溶性无机氮含量,促进土壤氮矿化[12]。但也有研究表明,频繁的冻融循环会对微生物群落和活性造成伤害并明显降低土壤氮矿化速率,甚至还通过破坏土壤团聚体结构影响土壤可溶性氮组分含量的变化[10]。因此,了解不同冻融条件下土壤可溶性氮组分含量的动态变化,对于正确理解冻融作用对土壤氮素转化过程的影响很有意义。东北地区是气候变化、土壤冻融循环显著和氮素循环研究的重要区域,冬季冻融作用时间的长短和冻融循环次数直接影响农田土壤氮素养分的供应[13]。鉴于此,本试验拟选取东北4种典型农田土壤(棕壤、褐土、草甸土、黑土)为研究对象,采用室内冻融模拟培养方法研究不同冻融温度和冻融循环次数作用下土壤可溶性氮组分含量的变化行为,以明确冻融作用对不同农田土壤非生长季氮素有效性的作用差异,为东北地区农田土壤氮素肥力保持和氮肥利用率提高提供理论依据。
1 材料与方法
1.1 供试土壤
供试土壤中的棕壤、褐土、草甸土,分别采自沈阳农业大学长期定位试验站(41°82′ N、123°57′ E)、辽宁省阜蒙县旧庙乡(42°23′ N、121°37′ E)和辽宁省农业科学院长期定位试验基地(41°49′ N、123°32′ E),采样时间为2012年4月;供试土壤中的黑土则于2013年10月采自吉林省公主岭市国家黑土土壤肥力和肥料效益长期定位监测站(43°30′ N、124°48′ E)。采样时,先除去表层杂物,多点混合法采集0 ~ 15 cm表层土壤,将新鲜样品装入塑料袋后迅速带回实验室,挑取肉眼可见的细根和石块等杂物后分成两份,一份过2 mm筛后4℃保存备用,另一份风干后,测定基础理化性质[14](表1)。
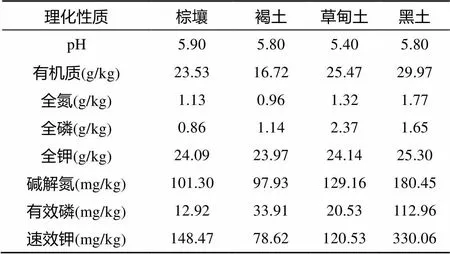
表1 供试土壤基础理化性质
1.2 冻融试验设计
取定量过筛后土壤,调节含水量至150 g/kg,放入10℃ (模拟东北初春土壤冻融发生时的平均气温)的恒温培养箱中恒温培养10 d,使其恢复生物学活性。预培养期间每天透气并补充损失的水分。
1.2.1 冻融温度模拟试验 称取相当于100 g风干土的预培养土壤于100 ml 培养瓶中并平铺于瓶底,用带孔的保鲜膜封口,在某一冻结温度下冻结6 d,然后在某一融化温度下融化1 d。冻结温度设定为-4℃、-15℃,融化温度设定为2℃、5℃。每个处理3次重复,设置未冻融的预培养土壤为对照。培养期间每天补充水分并保持水分含量不变。
1.2.2 冻融循环次数模拟试验 称取相当于100 g风干土的预培养土壤于100 ml 培养瓶中并平铺于瓶底,用带孔的保鲜膜封口,冻融循环次数设定为:1、5、10。其中,在–2℃ 冻结6 d,在2℃融化1 d设定为1个冻融循环。每个处理3次重复,设置未冻融的预培养土壤为对照。培养期间每天补充水分并保持水分含量不变。
1.3 测定方法[14]
可溶性无机氮 (DIN, dissolved inorganic nitrogen)采用2 mol/L KCI溶液浸提,连续流动分析仪(AA3, 德国布朗卢比公司)测定;可溶性全氮 (DTN, dissolved total nitrogen)采用过硫酸钾氧化-紫外分光光度法测定;DON=DTN-DIN。
1.4 数据处理
所有数据采用Excel 2000和SPSS 11.5进行统计分析;试验数值采用Duncan’s法进行多重比较;数值采用平均值的形式表示。
2 结果与分析
2.1 冻融作用对土壤可溶性无机氮含量的影响
农田土壤DIN以NO– 3-N为主,冻融温度和冻融循环次数对农田土壤DIN组分含量均有影响显著 (<0.05)(图1、图2)。不同土壤DIN组分含量不同,其大小顺序为黑土>褐土、草甸土>棕壤。与对照相比,–15℃冻结显著增加了农田褐土、草甸土和黑土NO– 3-N和NH4+-N含量,而–4℃ 冻结则无规律性影响(图1A、图2A)。随着冻结温度降低,4种农田土壤NO– 3-N和NH4+-N含量均显著增加。随着融化温度升高,4种农田土壤NH4+-N含量均显著增加;而NO– 3-N含量的变化受冻结温度的影响(图1A、图2A)。–4℃冻结时,除黑土显著增加外,其他3种农田土壤NO– 3-N含量均无显著变化;–15℃冻结时,褐土和草甸土NO– 3-N含量均显著增加,而棕壤和黑土均无显著变化 (图1A)。可见,冻融温差对农田土壤DIN组分含量影响显著,较大的冻融温差造成了农田土壤DIN组分含量增加 (图1A、图2A)。
与对照相比,冻融1次后4种农田土壤DIN组分含量的增加幅度最大,说明短期冻融对农田土壤氮素转化过程的影响程度较大 (图1B、图2B)。随着冻融循环次数增加,棕壤、褐土和草甸土NO– 3-N含量均显著增加,以冻融10次的含量最高,分别为31.39、41.97和38.50 mg/kg,较对照处理分别增加了29.84%、36.98% 和30.63%;而黑土则呈降低的趋势,以冻融1次的含量最大(76.45 mg/kg),较对照处理增加了17.75% (图1B)。随着冻融循环次数增加,棕壤和褐土NH4+-N含量均显著增加,以冻融10次的含量最高,较对照处理分别增加了40.68% 和104.00%;而黑土和草甸土则显著降低,以冻融1次的含量最高,较对照处理分别增加8.69% 和26.59% (图2B)。不同类型土壤对冻融作用的响应能力不同,其大小顺序为褐土>棕壤、草甸土>黑土 (图1B、图2B)。
2.2 冻融作用对土壤可溶性有机氮含量的影响
农田土壤DON含量受冻融作用影响显著(<0.05),其作用程度因土壤类型而异(图3)。与对照相比,除棕壤–4 ~ 2℃ 冻融和黑土冻融1次降低外,4种农田土壤DON含量均显著增加(图3)。随着冻结温度降低,棕壤、褐土和草甸土DON含量均显著增加,而黑土则无规律性变化。随着融化温度升高,农田土壤DON含量的变化行为受冻结温度和土壤类型的双重影响。–4℃冻结时,棕壤DON含量显著增加,黑土显著降低,而褐土和草甸土则无显著变化;–15℃冻结时,除黑土显著增加外,其他3种农田土壤DON含量均降低,但降低没有达到显著性水平 (图3A)。随着冻融循环次数增加,褐土和草甸土DON含量均显著增加,以冻融10次的含量最高,分别为6.92和6.61 mg/kg,较对照处理分别增加了250.47% 和349.33%;而棕壤和黑土呈现先增加后减小的变化趋势,以冻融5次的含量最高 (图3B)。可见,冻融温差对农田土壤DON含量影响显著,较大的冻融温差造成了农田土壤DON含量增加 (图3A)。
2.3 冻融作用对土壤可溶性全氮含量的影响
冻融作用对农田土壤DTN含量影响显著(<0.05) (图4)。不同土壤类型DTN含量不同,其大小顺序为黑土>草甸土、褐土>棕壤 (图4)。随着冻结温度降低,4种农田土壤DTN含量均显著增加。随着融化温度升高,农田土壤DTN含量的变化行为受冻结温度的协同影响。–4℃冻结时,除棕壤显著增加外,其他3种农田土壤DTN含量均无显著变化;–15℃冻结时,除棕壤无显著变化外,其他3种农田土壤DTN含量均显著增加(图4A)。随着冻融循环次数增加,棕壤、褐土和草甸土DTN含量均显著增加,但增加幅度越来越小,以冻融10次的含量最高,分别为39.85、54.28和49.83 mg/kg;而黑土则呈现先增加后减少的变化趋势,以冻融5次的含量最高(99.25 mg/kg) (图4B)。说明短期冻融更有利于促进农田土壤DTN的释放。结合DIN和DON含量的变化行为,发现冻融作用对农田土壤DON的影响程度较大。
3 讨论
冻融作用通过改变土壤水分状况和分布,直接影响土壤理化性质与微生物活动,导致土壤养分含量的变化[15-16]。本研究中,冻融作用造成农田土壤可溶性氮组分含量的显著增加 (图1 ~ 4),这是由于冻融循环过程中土壤结构、孔隙等物理性状的变化,破坏了土壤团聚体和微生物群落结构,有利于土壤包裹吸附着的小分子释放出来,为残留微生物提供了足够的养分,造成土壤氮矿化和可溶性氮组分释放量的增加[17-18]。冻融温差和冻融循环次数是影响土壤氮素转化的主要驱动因子。范志平等[12]对河岸缓冲带土壤的研究认为,冻融交替增加土壤无机氮含量,其中冻融温差和冻融频数均对土壤无机氮含量影响极显著,较大的冻融温差更容易致使土壤微生物细胞裂解,进而使土壤无机氮含量升高,这也进一步佐证了本文的研究结果 (图1A、图2A)。Zhou等[19]对长白山土壤冻融模拟试验研究表明,土壤DIN含量与冻融循环次数呈正相关。本研究中,农田棕壤和褐土DIN组分含量均随着冻融循环次数增多而增大(图1B、图2B),这与隽英华等[20]和Judd等[15]的研究结果相一致;而黑土则呈降低的变化趋势,这与李源等[21]的研究结果正好相反。这是由于,一方面,黑土肥力较高,含有较高的速效氮含量(表1);另一方面,室内培养不考虑植被吸收和养分淋溶,在连续多次的长期冻融循环中,土壤氮矿化过程产物的累积抑制了氮矿化作用[22]。不同类型土壤DIN组分含量对冻融作用的响应程度不同,以褐土最大,黑土最小。说明土壤肥力越高,土壤氮素转化过程对冻融作用的响应程度越小 (图1、图2)。
Schimel和Clein[23]研究表明,冻融过程如同干湿交替或氯仿熏蒸等一样对微生物有灭杀作用,造成微生物死亡。死亡的微生物在分解过程中释放出一些小分子糖和氨基酸等,增加了土壤DON含量[24]。本研究中,随着冻结温度降低,4种农田土壤DON和DTN含量均显著增加(图3A、图4A),这与周旺明等[25]的研究具有相似之处,认为冻结温度是影响土壤DON含量的重要因素,冻融速率越大,越有利于土壤释放DON。冻结温度越低,土壤稳定性团聚体越少,释放出的可溶性有机物质就越多[26]。但也有不同观点,徐俊俊[27]对青藏高原高寒草甸土的研究结果则认为,冻融温度对DON含量影响不显著 (>0.05)。本研究中,随着冻融循环次数增多,褐土和草甸土DON和DTN含量均显著增加,但增加幅度越来越小,以冻融10次的含量最大(图3B、图4B),这与Grogan等[28]的研究结果相一致;而黑土和棕壤DON含量则呈现先升高后降低的变化趋势(图3B)。这是由于,一方面,冻融初期造成微生物大量死亡,释放大量可溶性养分,随着冻融循环次数增加,微生物适应环境导致死亡绝对量减少,减少了来自死亡微生物的DON含量;另一方面,随着冻融循环次数增加,从土壤团聚体中释放出的DON含量也逐渐降低。而由于矿化作用,土壤中的DON却不断地被微生物利用分解,导致土壤DON含量在多次冻融后呈下降趋势[29]。本研究表明,不同土壤类型可溶性氮组分含量不同,其大小顺序为黑土>棕壤、草甸土>褐土(图1 ~ 4),这与土壤对冻融作用响应能力的变化趋势正好相反,说明高肥力土壤受冻融作用影响的缓冲性较大。这是由于高肥力土壤中的腐殖质能够增强有机质的亲水性,土壤腐殖质含量越高(表1),冰冻过程中的膨胀作用越强,释放的有机物质越多[30]。
冻融作用通过影响土壤物理性状和微生物活性增加了土壤DIN组分含量[15, 31],造成春季土壤根系吸收与微生物矿化释放养分过程在时间和空间上的不同步[32],增加了土壤氮素随冰雪融水进入地表水的流失风险。Groffman等[33]关于森林流域研究表明,氮素流失的主要形态是NO– 3-N,冻融造成NO– 3-N的流失增多。Piatek等[34]利用氮氧同位素方法研究认为,土壤流失的NO– 3-N主要来源于微生物的硝化作用。可见,受季节性温度变化的影响,冻融作用对农田土壤DIN有显著影响,在无机氮中,NO– 3-N是较易淋失的氮素形态。由于东北地区农田土壤融化期作物对氮素的吸收量较小,土壤氮素流失的风险也相应增大,可能导致农田生态系统养分的亏缺和氮素利用效率的下降,这些现象的机制还需要进一步研究。
4 结论
冻融作用对4种典型农田土壤氮素转化过程均有显著影响。随着冻融温度和冻融循环次数的变化,农田土壤DIN (NO– 3-N、NH4+-N)、DON和DTN含量均产生显著变化;其中,适宜的冻融温差和冻融循环次数是影响土壤氮素转化过程的主要因素。不同类型土壤对冻融作用的响应能力不同,总体呈现出褐土>棕壤、草甸土>黑土。说明高肥力土壤受冻融作用影响的缓冲性较强。可见,在季节性冻融期间,农田土壤表现出的固氮作用是生态系统保持氮的一种机制,为农田生态系统提供大量可利用养分的同时,增加了土壤氮素的淋溶流失风险。
[1] Murphy D V, Macdonald A J, Stockdale E A, et al. Soluble organic nitrogen in agricultural soil[J]. Biology and Fertility of Soils, 2000, 30(5/6): 374–387
[2] 周建斌, 陈竹君, 郑险峰. 土壤可溶性有机氮及其在氮素供应及转化中的应用[J]. 土壤通报, 2005, 36(2): 244–288
[3] 杨绒, 周建斌, 赵满兴. 土壤中可溶性有机氮含量及其影响因素研究[J]. 土壤通报, 2007, 38(1): 15–18
[4] 韦剑锋, 韦冬萍, 陈超君, 等. 不同施氮方式对甘蔗氮肥效率及氮素去向的影响[J]. 核农学报, 2013, 27(2): 213–218
[5] 张维理. 我国北方农用氮肥造成地下水硝酸盐污染的调查[J]. 植物营养与肥料学报, 1995, 1(2): 80–87
[6] Zhong Z K, Makeschin F. Soluble organic nitrogen in temperate forest soils[J]. Soil Biology and Biochemistry, 2003(35): 333–338
[7] 赵满兴, 周建斌, 陈竹君, 等. 不同类型农田土壤对可溶性有机氮、碳的吸附特性[J]. 应用生态学报, 2008, 19(1):76–80
[8] Henry H. Soil freeze-thaw cycle experiments: Trends, methodological weaknesses and suggested improvements[J]. Soil Biology and Biochemistry, 2007(39): 977–986
[9] 朴春和, 刘广深, 洪业汤. 干湿交替和冻融作用对土壤肥力和生态环境的影响[J]. 生态学杂志, 1995, 14(6): 29–34
[10] Herrman A, Witter E. Source of C and N contributing to the flush in mineralization upon freeze thaw cycles in soil[J]. Soil Biology and Biochemistry, 2002(34): 1 495– 1505
[11] 王风, 韩晓增, 李良皓, 等. 冻融过程对黑土水稳性团聚体含量影响[J]. 冰川冻土, 2009, 31(5):915–919
[12] 范志平, 李胜男, 李法云, 等. 冻融交替对河岸缓冲带土壤无机氮和土壤微生物量氮的影响[J]. 气象与环境学报, 2013, 29(4):106–111
[13] 魏燕华, 赵鑫, 翟云龙, 等. 耕作方式对华北农田土壤固碳效应的影响[J]. 农业工程学报, 2013, 29(17): 87–95
[14] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000
[15] Judd K E, Likens G E, Buso D C, et al. Minimal response in watershed nitrate export to severe soil frost raises questions about nutrient dynamics in the Hubbard Brook experimental forest [J]. Biogeochemistry, 2011(106): 443– 459
[16] 乔思宇, 周丽丽, 范昊明, 等. 冻融条件下黑土无机磷分级及有效性研究[J]. 土壤, 2016, 48(2): 259–264
[17] 郑秀清, 樊贵盛, 邢述彦. 水分在季节性非饱和冻融土壤中的运动[M]. 北京: 地质出版社, 2002: 1–303
[18] 李忠佩, 张桃林, 陈碧云. 可溶性有机碳的含量动态及其与土壤有机碳矿化的关系[J]. 土壤学报, 2004, 41(4): 544–552
[19] Zhou W M, Chen H, Zhou L, et al. Effect of freezing- thawing on nitrogen mineralization in vegetation soils of four landscape zones of Changbai Mountain[J]. Annals of Forest Science, 2011(68): 943–951
[20] 隽英华, 刘艳, 田路路, 等. 冻融交替对农田棕壤氮素转化过程的调控效应[J]. 土壤, 2015, 47(4): 647–652
[21] 李源, 祝惠, 袁星. 冻融交替对黑土氮素转化及酶活性的影响[J]. 土壤学报, 2014, 51(5): 1 103–1 109
[22] Amador J A , Gorres J H, Savin M C. Role of soil water content in the carbon and nitrogen dynamics ofL. burrow soil[J]. Applied Soil Ecology, 2005, (28):15–22
[23] Schimel J P, Clein J S. Microbial response to freezing and thawing cycles in tundra and taiga soils[J]. Soil Biology and Biochemistry, 1996, 28(8): 1 061–1 066
[24] Wang L, Bettany R. Influence of freeze-thaw and f1ooding on the loss of soluble organic carbon and carbon dioxide from soil [J]. Journal of Environmental Quality, 1993, 22(4): 709–714
[25] 周旺明, 王金达, 刘景双, 等. 冻融对湿地土壤可溶性碳、氮和氮矿化的影响[J]. 生态与农村环境学报, 2008, 24 (3): 1–6
[26] Lehrsch G A, Sojka R E, Carter D L, et al. Freezing effects on aggregate stability affected by texture, mineralogy, and organic matter[J]. Soil Science Society of America Proceedings, 1991(55): 1 401–1 406
[27] 徐俊俊. 冻融交替对高寒草甸土壤氮素的影响[D]. 成都: 四川农业大学, 2010
[28] Grogan P, Michelsen A, Ambus P, et al. Freeze-thaw regime effects on carbon and nitrogen dynamics in subarctic health tundra mesocosms[J]. Soil Biology and Biochemistry, 2004, 36(4): 641–654
[29] Campbell C A, Biederbeck V O. Influence of fluctuating temperatures and constant soil moistures on nitrogen changes in amended and unamended loam[J]. Canadian Journal of Soil Science, 1972(52): 323–336
[30] Puget P, Chenu C, Balesdent J. Total and young organic matter distributions in agregates of silty cuhivated soils[J]. European Journal of Soil Science, 1995, 46(3): 449–459
[31] 王恩姮, 卢倩倩, 陈祥伟. 模拟冻融循环对黑土剖面大孔隙特征的影响[J]. 土壤学报, 2014, 51(3): 490–496
[32] Yano Y, Shaver G R, Giblin A E. Nitrogen dynamics in a small arctic watershed: Retention and downhill movement of15N[J]. Ecological Monographs, 2010(80): 331–351
[33] Groffman P M, Driscoll C T, Fahey T J, et al. Effects of mild winter freezing on soil nitrogen and carbon dynamics in a northern hardwood forest[J]. Biogeochemistry, 2001(56): 191–213
[34] Piatek K B,Mitchell M J,Silva S R,et al. Sources of nitrate in snowmelt discharge: evidence from water chemistry and stable isotopes of nitrate[J]. Water, Air and Soil Pollution, 2005, 165(1/2/3/4): 13–35
Effects of Freezing-Thawing on Dissolved Nitrogen Components of Farmland Soils
TIAN Lulu1, JUAN Yinghua2*, LIU Yan2, SUN Wentao2, CHENG Shufang3
(1 College of Land and Environment, Shenyang Agricultural University, Shenyang 110866, China; 2 Institute of Plant Nutrition and Environmental Resources, Liaoning Academy of Agricultural Sciences, Shenyang 110161, China; 3 Guanxian Agricultural Bureau, Liaocheng, Shandong 252500, China)
In order to deeply understand nitrogen (N) transformation process in farmland soil during non-growing season, with a laboratory simulation experiment, the effects of different freezing and thawing temperatures and freezing-thawing cycling frequencies on the contents of soil dissolved N components were investigated in four typical farmland soils (brown soil, cinnamon soil, meadow soil and black soil). The results showed that with freezing temperature decreasing, the contents of nitrate N (NO– 3-N), ammonium N (NH4+-N), dissolved organic N (DON) and dissolved total N (DTN) all increased significantly in four farmland soils. With thawing temperature increasing, the dynamics of soil NO– 3-N, DON and DTN in four farmland soils were synergistically affected by freezing temperature and soil type, except for NH4+-N content increasing significantly. With freezing-thawing cycling increasing, the contents of NO– 3-N, NH4+-N, DON and DTN all increased significantly in brown soil and cinnamon soil; the contents of NO– 3-N, DON and DTN all increased significantly, andNH4+-N content decreased significantly in meadow soil; the contents of NO– 3-N and NH4+-N both increased significantly, and DON and DTN contents both first increased then decreased in black soil. As affected by freezing-thawing, the response capacity of tested soils differed from soil type, with following as cinnamon soil>brown soil, meadow soil>black soil. Therefore, it is preliminarily concluded that freezing-thawing cycling could promote soil N transformation, and was beneficial to the accumulation of soil available N, which could provide abundant nutrients for crop growth in spring but might also increase the risk of soil N loss at the same time.
Freezing-thawing cycles; Farmland soil; Nitrogen transformation; Dissolved nitrogen components
10.13758/j.cnki.tr.2017.03.013
S153.6
A
国家自然科学基金项目(41301253)、辽宁省农业领域青年科技创新人才培养计划项目(2014018)、公益性行业(农业)科研专项(201503118-08)和国家科技支撑计划项目(2013BAD05B07)资助。
(juanyong_001@sohu.com)
田路路(1990—),女,河南鲁山人,硕士研究生,主要从事冻融对土壤氮素转化的影响研究。E-mail: 760848132@qq.com
