JMJD1A通过调节c-Myc的表达影响胃癌细胞的增殖及侵袭
2017-07-20王朝阳李炳辉郑忠立孟继明任学群
王朝阳,李炳辉,郑忠立,孟继明,任学群,3
1. 河南大学淮河医院 普外科,河南 开封 475000; 2. 河南大学 循证医学中心,河南 开封 475000; 3. 河南大学淮河医院 转化医学中心,河南 开封 475000
JMJD1A通过调节c-Myc的表达影响胃癌细胞的增殖及侵袭
王朝阳1,2,李炳辉1,郑忠立1,孟继明1,任学群1,2,3
1. 河南大学淮河医院 普外科,河南 开封 475000; 2. 河南大学 循证医学中心,河南 开封 475000; 3. 河南大学淮河医院 转化医学中心,河南 开封 475000
〔目的〕探讨JMJD1A调节c-Myc的表达变化对胃癌细胞增殖及侵袭的影响。〔方法〕使用QRT-PCR和Western blot实验检测JMJD1A、c-Myc基因表达,CCK8用于检测转染后细胞的增殖能力,Transwell实验及划痕实验检测转染后细胞的侵袭及迁移能力。〔结果〕JMJD1A高表达并且可调控c-Myc的表达,对c-Myc的表达呈正调控。在JMJD1A的表达受到干扰后,胃癌细胞的增殖能力明显下降,侵袭和迁移能力明显降低。〔结论〕JMJD1A能够通过调控c-Myc表达促进胃癌细胞的增殖、侵袭和迁移能力。
JMJD1A; c-Myc; 胃癌;侵袭;细胞增殖
胃癌是世界上最常见的消化系统恶性肿瘤之一。我国胃癌发病率很高,其死亡率占世界所有胃癌死亡率的一半,高于发达国家[1-2]。其发生可能与饮食习惯、幽门螺旋杆菌感染、遗传等因素有关,且发病率随年龄增长而增高[3]。组蛋白去甲基化酶JMJD1A(Jumonji domain containing 1A)通过羟基化作用使组蛋白赖氨酸去甲基化在细胞生长、组织发育和器官行程中起作用[4-5]。有研究表明,JMJD1A表达的变化与肿瘤的发生和发展有密切关系,但在胃癌中的作用及调节机制尚不清楚。本研究以胃癌细胞系为材料,检测JMJD1A在胃癌细胞的表达和调节。
1 材料与方法
1.1 细胞株及主要试剂
胃癌细胞株HGC-27和MKN-45均购于中科院上海细胞生物所;TRIzol试剂、反转录试剂和SYBR Green I试剂均购于上海闪晶分子生物科技有限公司;Western-blot抗体购于美国Santa Cruz公司;CCK-8试剂和Transwell购于Sigma公司;LV3-si-JMJD1A和LV3-NC购于GenePharma公司。
1.2 细胞株培养
人胃癌细胞系HGC-27和MKN-45用体积分数为10%的胎牛血清RPMI 1640培养基进行培养,并加入青霉素(100 U/mL)和链霉素(100 mg/L),置于37 ℃体积分数为5%的CO2培养箱内培养。待生长到对数期时备用。
1.3 JMJD1A干扰载体的构建及转染
首先构建JMJD1A干扰病毒载体LV3-si-JMJD1A及空白对照LV3-NC。将复苏的HGC-27和MKN-45细胞接种于6孔板中(密度为2×105个/孔),每孔3 mL。待细胞贴壁后更换新的不含双抗而含体积分数为5%的FBS培养基2 mL,然后进行转染。HGC-27、MKN-45细胞MOI值为1,结合病毒滴度加入病毒液,轻轻混匀,放入37 ℃培养箱培养;过夜后,更换新鲜的完全培养基,进行培养。转染48 h后,拍照观察。
1.4 QRT-PCR和Western blot实验
按照TRIzol说明书提取总RNA,反转录为cDNA,然后应用FTC 2000进行荧光定量PCR分析。采用2-ΔΔCt方法分析mRNA的表达,其中β-actin作为内参。将细胞裂解提取总蛋白,然后进行SDS-PAGE凝胶电泳,之后转移到PVDF膜上,用体积分数为5%的脱脂牛奶室温封闭2 h,再用体积分数为1%的脱脂牛奶稀释孵育一抗4 ℃过夜(1∶500),稀释孵育二抗37 ℃ 1 h(1∶1 000),暗室显影。
1.5 细胞增殖能力检测
取正常培养的HGC-27和MKN-45细胞及转染72 h后的HGC-27和MKN-45细胞,观察细胞状态。细胞铺板,对数生长期的细胞用胰蛋白酶消化成单个细胞,接种于96孔板中,铺5板,培养箱中培养。每种细胞分为3组:未转染的空白对照组、转染空载体的NC组及转染JMJD1A慢病毒组。分别在培养1、2、3、4、5 d后,每孔加入10 μL CCK8溶液(5 g/L),培养箱中继续培养2 h后,用酶标仪在450 nm测出各孔吸光值,记录不同时间点的实验数据。
1.6 细胞Transwell实验
用胰蛋白酶消化细胞,细胞计数5×104,接种于6孔Transwell小室,小室中铺500 μL细胞,板孔中加入3 mL完全培养基。每种细胞分3组:未转染的空白对照组、转染空载体的NC组及转染JMJD1A慢病毒组。在CO2培养箱中培养48 h后,小室用1×PBS洗2次。用刀片把小室穿透膜取下来放在载玻片上(把有透过细胞的那面朝上放,便于染色),然后把贴有小室穿透膜的载玻片用体积分数为4%的多聚甲醛固定20 min,1×PBS洗3次(5 min/次)。用质量分数为0.1%的Trition X-100透化细胞15 min,1×PBS洗3次,加100 μL苏木素染色20 min。自来水洗2 min,再用新的自来水浸泡10 min反蓝,用中性树胶封片,镜检。
1.7 细胞划痕实验
正常培养的HGC-27和MKN-45细胞及转染72 h后的HGC-27和MKN-45细胞,长满培养板底部。用200 μL tip头划痕,用PBS洗至培养基内无漂浮的细胞。镜下观察拍照划痕的部位,并做好标记。并在0、36、48 h时观察拍照。
1.8 统计分析
应用SPSS 19.0统计学软件,数值用mean±SD表示,组间比较采用t检验或非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 载体构建及病毒包装
病毒LV3-si-JMJD1A的滴度约为4×108TU/mL,LV3-NC的滴度约为3×108TU/mL。病毒滴度较高,可以用于后续的浸染胃癌细胞。
2.2 转染干扰JMJD1A载体后基因mRNA及蛋白的表达
在HGC-27和MKN-45细胞中,JMJD1A均高表达,并且c-Myc的表达与JMJD1A的表达呈正相关。在胃癌细胞株中,干扰JMJD1A的表达后,c-Myc的表达也明显下降(P<0.05)。见图1。
Westernblot结果显示,在两组细胞系中,c-Myc的蛋白表达与JMJD1A的蛋白表达量呈正相关,与图1的结果相似。见图2。
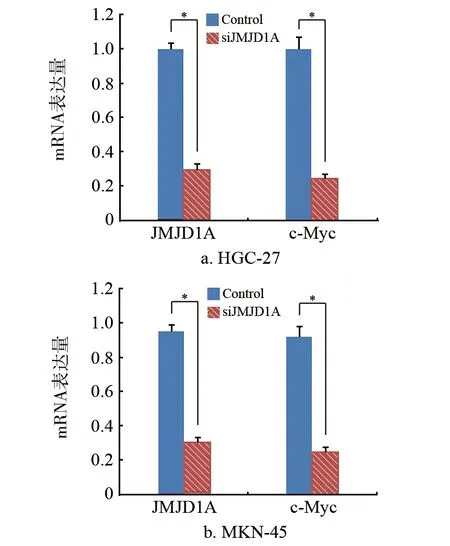
图1 转染干扰JMJD1A载体后基因mRNA的表达
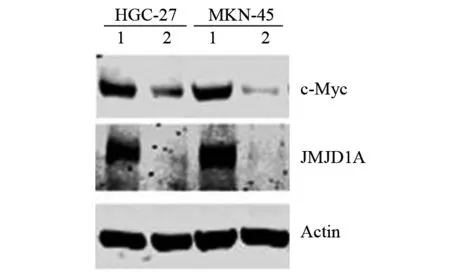
图2 转染干扰JMJD1A载体后蛋白的表达
2.3 细胞增殖能力检测结果
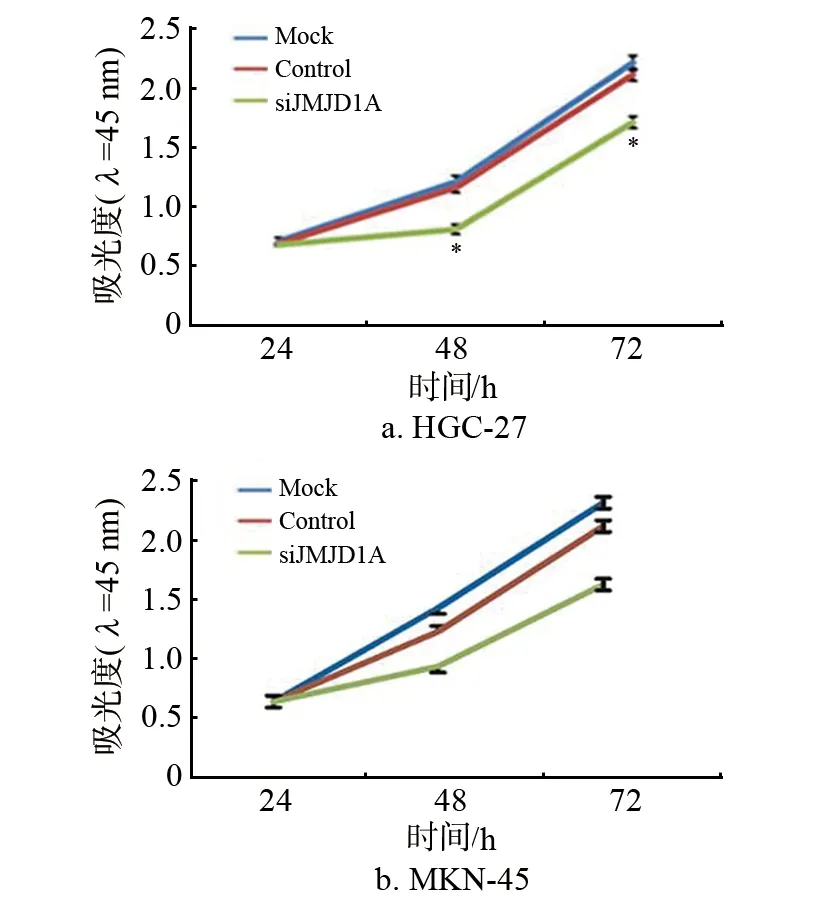
图3 3组细胞的增殖能力比较
图3显示了3组细胞的增殖能力。从图中可以得出,在HGC-27和MKN-45细胞中,转染干扰载体组与阴性对照及空白对照组相比,细胞的增殖能力均明显下降(P<0.05)。即干扰JMJD1A的表达后,胃癌细胞增值能力降低。
2.4 细胞Transwell实验结果
图4、图5表明,无论是在HGC-27细胞中,还是在MKN-45细胞中,干扰JMJD1A的表达后,胃癌细胞的侵袭能力都明显下降(P<0.05)。

图4 3组细胞电镜下的染色图片

图5 3组细胞侵袭能力的比较
2.5 细胞划痕实验结果
细胞划痕实验结果表明,干扰JMJD1A的表达后,HGC-27和MKN-45细胞的迁徙能力均明显下降,见图6、图7。P<0.05。

图6 电镜下胃癌细胞的迁徙能力

图7 3组细胞中划痕愈合实验结果
3 讨论
胃癌是一种多因素影响,发病机制复杂的恶性肿瘤,常规的治疗手段主要是手术、化疗和放疗,但经常出现复发、腹腔转移。肿瘤的浸润转移是影响患者生存质量的主要原因,因此,早期诊断是提高胃癌生存期的重要手段。癌基因的激活与抑癌基因的失活导致癌症的发生,JMJD1A的异常表达在癌症的发生、发展、侵袭与迁移中起着重要作用并有可能作为治疗的重要分子靶点。JMJD1A在多种肿瘤中高表达,比如肝癌、前列腺癌、结直肠癌等。Yamada等[6]发现,JMJD1A在肝癌组织中高表达,在缺氧条件下抑制JMJD1A表达可降低细胞生长,降低侵袭能力并阻止上皮间质转变(EMT)。Fan等[7]的研究显示,JMJD1A在转录和翻译上通过调节c-Myc基因的表达对前列腺癌细胞的生存和增殖起关键作用。Zhan等[8]发现,JMJD1A能促进非小细胞肺癌的发生,JMJD1A/EZH2/Let-7c可构成一个反馈回路,有可能成为非小细胞肺癌的治疗手段。
本次实验为探讨JMJD1A在肿瘤发生的作用,通过RNA干扰技术对胃癌细胞系HGC-27和MKN-45中JMJD1A和c-Myc的表达进行检测,并且研究了通过JMJD1A调控c-Myc,对胃癌细胞增殖和侵袭能力的影响。结果显示,在胃癌细胞中,JMJD1A高表达并且可调控c-Myc的表达,对c-Myc的表达呈正调控。当干扰JMJD1A的表达后,c-Myc的表达明显下降。进一步研究显示,在JMJD1A的表达受到干扰后,胃癌细胞的增殖能力明显下降,侵袭能力明显降低。由结果中可以得出,在胃癌细胞中JMJD1A的表达可调控c-Myc的表达,并呈正相关。另外,JMJD1A在胃癌细胞中可促进胃癌细胞的增殖和侵袭。
总之,JMJD1A通过调控c-Myc的表达对胃癌细胞的生长及侵袭的调节起重要作用。
[1]TrongVE,WuAW,SelbyLV,etal.DifferencesingastriccancersurvivalbetweentheU.S.andChina[J].JSurgOncol, 2015, 112(1):31-37.
[2]ChenW,ZhengR,BaadePD,etal.CancerstatisticsinChina, 2015 [J].CACancerJClin, 2016, 66(2):115-132.
[3]WuMS,ChenCJ,LinJT.Host-environmentinteractions:theirimpactonprogressionfromgastricinflammationtocarcinogenesisandondevelopmentofnewapproachestopreventandtreatgastriccancer[J].CancerEpidemiolBiomarkersPrev, 2005, 14(8):1878-1882.
[4]TsukadaY,FangJ,Erdjument-BromageH,etal.HistonedemethylationbyafamilyofJmjCdomain-containingproteins[J].Nature, 2006, 439(7078):811-816.
[5]TeeAE,LingD,NelsonC,etal.ThehistonedemethylaseJMJD1Ainducescellmigrationandinvasionbyup-regulatingtheexpressionofthelongnoncodingRNAMALAT1 [J].Oncotarget, 2014, 5(7):1793-1804.
[6]YamadaD,KobayashiS,YamamotoH,etal.Roleofthehypoxia-relatedgene,JMJD1A,inhepatocellularcarcinoma:clinicalimpactonrecurrenceafterhepaticresection[J].AnnSurgOncol, 2012, 19(Suppl3):S355-364.
[7]FanL,PengG,SahgalN,etal.Regulationofc-MycexpressionbythehistonedemethylaseJMJD1Aisessentialforprostatecancercellgrowthandsurvival[J].Oncogene, 2016, 35(19):2441-2452.
[8]ZhanM,WenF,LiuL,etal.JMJD1ApromotestumorigenesisandformsafeedbackloopwithEZH2/let-7cinNSCLCcells[J].TumourBiol, 2016, 37(8):11237-11247.
[责任编辑 时 红]
Regulation of c-Myc Expression by the Histone Demethylase JMJD1A is Essntial for Gastric Cancer Cell Growth and Invasion
WANG Chaoyang1,2, LI Binghui1, ZHENG Zhongli1, MENG Jiming1, REN Xuequn1,2,3■
1. Department of Surgery, Huaihe Hospital of Henan University, Kaifeng 475000, China; 2. Center for Evidence-Based Medicine, Henan University, Kaifeng 475000, China; 3. Center for Translational Medicine, Huaihe Hospital of Henan University, Kaifeng 475000, China
〔Objective〕In this study, we aimed to explore the effects of JMJD1A on the proliferation and invasion of gastric cancer by regulating c Myc expression. 〔Methods〕 ORT PCR and Western blot were used to detect the expression of JMJD1A and c-Myc. The cell proliferation ability was detected with CCK8 methods. And Transwell analysis and Wound Healing were used to explore the abilities of invasion and migration, respectively. 〔Results〕JMJD1A was upregulated in gastric cancer cells and could regulated the expression of c Myc. The expression of c-Myc was positive correlation with JMJD1A. After interfered the expression of JMJD1A, the cell proliferation ability, invasion ability and migration ability were all decrease in the gastric cancer cells. 〔Conclusion〕Our findings identified a critical role for JMJD1A in regulating proliferation and invasion of gastric cancer cells by controlling c Myc expression.
JMJD1A; c-Myc; gastric cancer; invasion; cell growth
1672-7606(2017)02-0119-04
2017-02-21
开封市科技发展计划项目(1407008)
王朝阳(1987-),男,河南临颍人,医师,研究方向:消化系统肿瘤及循证外科学研究。
■通信作者:任学群(1964-),男,河南正阳人,主任医师,教授,博士生导师,研究方向:消化系统肿瘤研究及医学教育管理。E-mail:renxuequn001@163.com。
R735.2
A
