微创食管癌切除术与开放食管癌切除术的近期疗效比较
2017-07-19苏立伟张冬梅岳泓旭牛中喜
苏立伟,张冬梅,李 玮,肖 博,岳泓旭,贺 书,牛中喜
微创食管癌切除术与开放食管癌切除术的近期疗效比较
苏立伟,张冬梅,李 玮,肖 博,岳泓旭,贺 书,牛中喜
目的 比较微创食管癌切除(minimally invasive esophagectomy,MIE)和常规开放食管癌手术治疗食管癌的近期疗效。方法 选择2015-04至2016-10北京武警总医院胸外科收治的食管癌60例,随机分为两组,MIE组30例,常规开胸组30例。比较两组患者手术时间、术中出血量、淋巴结清扫数目、第一次下床时间、肛门排气时间、胸腔引流时间、胸腔引流量、住院时间、术后第5天血常规检查、C反应蛋白及疼痛评估等。结果 两组患者基线特征差异无统计学意义,MIE组患者淋巴结清扫数量与开放组无统计学差异[(18.8±8.6)vs(16.2±8.4),P=0.24]。MIE组患者术中出血量(200±50)ml少于开放组(350±150)ml(P<0.001);MIE组患者术后胸腔引流量少于开放组[(550±200)mlvs(800±350)ml,P<0.001],拔管时间早于开放组[(4.7±1.5)dvs(5.9±1.8)d,P<0.001]。两组患者术后排气时间[(2.1±1.3)dvs(2.3±1.5)d,P=0.27]和下床活动时间[(1.2±0.8)dvs(1.3±0.6)d,P=0.52]无统计学差异。MIE组患者术后住院时间少于开放组[(5.2±1.6)dvs(9.4±1.8)d,P<0.001]。MIE组患者术后24 h、48 h以及72 hVAS评分分别为(2.9±1.1)分、(2.1±1.0)分、(1.5±0.8)分,均低于常规开放组(P<0.001)。结论 MIE显著减少术中出血量,减轻疼痛,缩短术后住院时间。微创可作为食管癌手术治疗的新选择。
食管癌;微创食管癌切除;术后
食管癌是常见的上消化道恶性肿瘤,每年新发病例超过45万人,死亡病例约40万人[1]。尽管近年来食管癌药物治疗及放射治疗的技术和疗效有了显著提高,但手术切除依然是食管癌的首选治疗方案。随着手术技术及手术器械的不断发展和改善,国内外的多个医疗中心相继开展了微创食管外科技术,旨在降低食管癌患者术后并发症和死亡率[2-5]。然而,目前针对食管癌患者采用微创手术还是采取常规开放手术尚无定论,本研究旨在通过比较微创食管癌切除(minimally invasive esophagectomy,MIE)和常规开放手术的近期疗效和安全性,以期为食管癌的外科治疗方案选择提供参考。
1 对象与方法
1.1 对象 选取2015-04至2016-10我院胸外科收治的食管癌患者,纳入标准:(1)年龄≥18岁且<80岁;(2)术前经消化道造影及胃镜活检确诊为食管癌;(3)术前胸部增强CT或食管内超声提示肿瘤无明显外侵;(4)术前评估无肝、肺、脑等远处转移;(5)患者心肺功能可耐受手术;(6)术前无急性炎性反应;(7)术前3个月内未服用激素、免疫抑制药等药物。排除标准:(1)合并其他器官恶性肿瘤;(2)非食管原发肿瘤;(3)急诊行食管手术患者;(4)拒绝签署知情同意书者。入选患者通过随机数字表法随机分为微创食管手术组和常规开胸食管手术组,正式入组前将选择的手术方式充分告知患者及其家属,并签署相应的知情同意书。
1.2 手术方法 所有患者均行右胸、上腹及左颈三切口食管癌切除术。
1.2.1 MIE组 采用单腔气管双肺通气,患者均取侧俯卧位,于腋后线第7肋间放置10 mm Trocar作为观察孔,自观察孔注入CO2气体建立人工气胸,使肺叶完全塌陷。然后分别于肩胛下角线第8或9肋间放置10 mm Trocar作为主操作孔,于腋后线第5肋间和第3肋间放置5 mm Trocar作为辅助操作孔。以电凝钩打开纵隔胸膜,游离食管至奇静脉弓水平,奇静脉弓两侧用Hemolock夹闭后用超声刀离断,继续向头侧游离胸段食管。分离暴露右喉返神经,并清扫右喉返神经旁淋巴结,游离食管上至胸廓入口水平,下至膈肌裂孔水平,术中应明确辨认胸导管,并注意保护避免损伤。依次清扫食管旁淋巴结、隆突下和双侧主支气管旁淋巴结,注意避免损伤支气管。最后,放置纵隔引流管及胸腔引流管各1根,关闭胸腔切口完成胸部操作。腹部及颈部操作:患者转平卧位,建立人工气腹后腔镜下游离胃,清扫胃大小弯侧及胃左、肝总和腹腔动脉旁淋巴结后,应用直线切割缝合器裁切胃组织制作管状胃,并在切割线全层加缝加固,通过后纵隔食管床或者胸骨后途径,将管状胃拉提至颈部,采用分层手工包埋吻合方法行食管胃端侧吻合术,放置胃管及营养管。分别安置颈部及腹部引流管,并关闭切口完成手术。
1.2.2 常规开放手术治疗组 (开放组)采用双腔气管插管双肺通气,患者取左侧卧位,经右胸第5肋间做长约25 cm长切口进入胸腔,完成胸部操作后改为平卧位,经腹正中做约15 cm切口进入腹腔,完成腹部操作,然后再于左侧胸锁乳突肌内侧缘做5 cm切口,离断颈段食管,从腹腔切口拉出食管及胃,制作管状胃,通过后纵隔食管床或者胸骨后途径,将管状胃拉提至颈部,采用分层手工包埋吻合方法行食管胃端侧吻合术。具体手术操作以及淋巴结清扫同MIE组。
1.3 术后管理 患者如果在手术结束后复苏,则均在手术室拔除气管插管然后送回病房监护治疗;如果因患者病情较危重或麻醉复苏慢,则在ICU进行术后辅助呼吸,待拔除气管插管生命体征平稳后再转回普通病房监护治疗。MIE组患者术后第1天即开始进食,不限制食物种类,固体食物必须咀嚼50次以上,静脉输液量为全胃肠外营养量的1/2,嘱患者带引流管等下床活动,并行血常规、生化及胸部正侧位片检查。至术后第4天恢复正常进食,停止静脉输液量,改为口服抗生素。术后第5天复查血常规、生化及胸部CT。检查结果基本正常后准予患者出院。开放组患者术后第1天禁饮禁食,予以全胃肠外静脉营养量。嘱患者下床活动,排痰,行血常规、生化以及胸部正侧位片检查。术后第5天复查血常规、生化和胸部CT,术后第7天嘱患者少量饮水,进流食。术后第9天恢复正常饮食,若检查结果正常且无特殊不适准予患者出院。
1.4 观察指标 比较两组手术时间(开始切口至关闭切口)、术中出血量、淋巴结清扫数目、第一次下床时间、肛门排气时间、手术相关并发症(包括吻合口瘘、脓胸、乳糜胸、食管气管瘘、喉返神经损伤、切口感染等)、肺部并发症发生情况(包括肺不张、肺部感染、急性呼吸窘迫综合征、呼吸衰竭、肺栓塞等)、其他并发症(如心律失常、心力衰竭、肾功能不全、肝功能不全等)、胸腔引流时间、胸腔引流量、住院时间、术后第5天血常规检查、C反应蛋白等,并采用视觉模拟评分(visual analogue scales,VAS)于术后24 h、48 h及72 h进行疼痛评估。
1.5 统计学处理 用SPSS 20.0统计软件进行统计学处理。分类变量采用χ2或Fisher’s检验,结果以率或者百分比表示;符合正态分布连续变量的比较应用t检验,不符合正态分布的比较应用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较 共纳入60例初治食管癌患者,其中微创组30例,开胸组30例,平均(56.5±7.4)岁。两组患者在性别、年龄、体重指数(body mass index,BMI)、术前合并症(高血压、冠心病、糖尿病、慢性阻塞性肺疾病等)、肿瘤部位、病理类型、肿瘤分期等方面比较,差异无统计学意义(P>0.05),具有可比性(表1)。
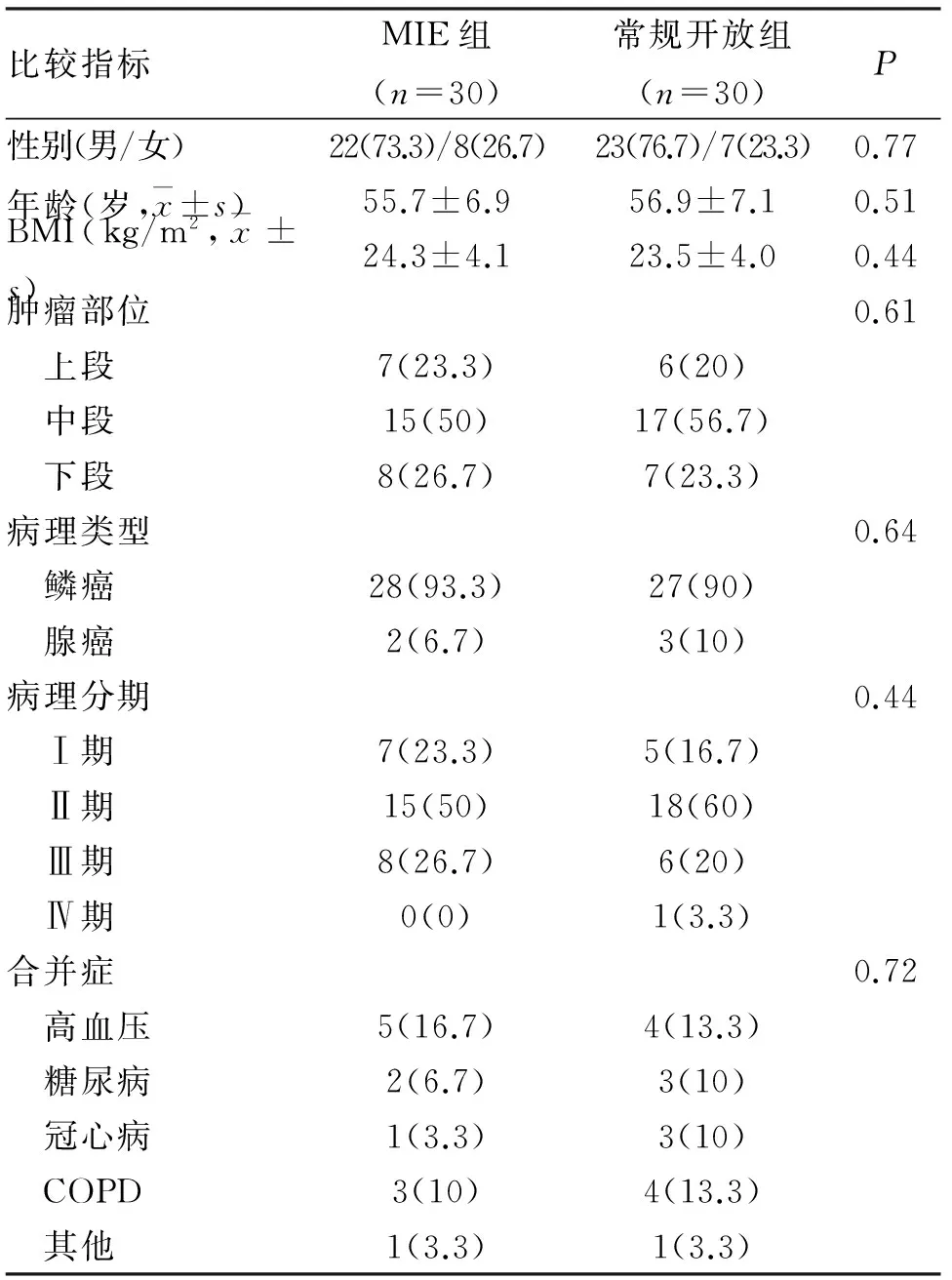
表1 两组患者一般资料比较 (n;%)
2.2 术中情况比较 MIE组共有2例术中需要中转开放手术,其中1例。MIE组手术时间(240±60)min较开放组(180±30)min长(P<0.001)。微创组患者淋巴结清扫数量与开放组无明显差异(18.8±8.6vs16.2±8.4,P=0.24)。微创组患者术中出血量明显(200±50)ml少于开放组(350±150)ml(P<0.001,表2)。
2.3 术后情况比较 所有患者切缘均阴性。MIE组患者术后胸腔引流量少于开放组,且拔管时间早于开放组。两组患者术后排气时间和下床活动时间无明显差异。但微创组患者术后住院时间少于开放组。微创组患者术后24 h、48 h以及72 hVAS评分均显著低于常规开放组(P<0.001,表3)。
2.4 术后并发症比较 两组患者术后均未出现心力衰竭、肾衰竭、急性呼吸窘迫综合征、肺栓塞、吻合口瘘等严重并发症,无手术死亡病例。两组患者术后总并发症发生率分别为13.3%和43.3%,差异具有统计学意义(P=0.01)。微创组人术后出现2例切口感染,1例出现声音嘶哑,1例出现肺部感染,2例出现心律失常;开放组3例术后出现乳糜胸,5例出现切口感染,8例出现声音嘶哑,10例出现肺部感染,2例出现肺不张,6例出现心律失常(表4)。
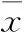
表2 两组患者术中及术后情况比较 (n=30;±s)
注:①表示术后第5天检测
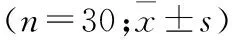

比较指标MIE组常规开放组P术后24hVAS评分2.9±1.15.4±1.3<0.001术后48hVAS评分2.1±1.04.5±1.1<0.001术后72hVAS评分1.5±0.83.6±0.9<0.001
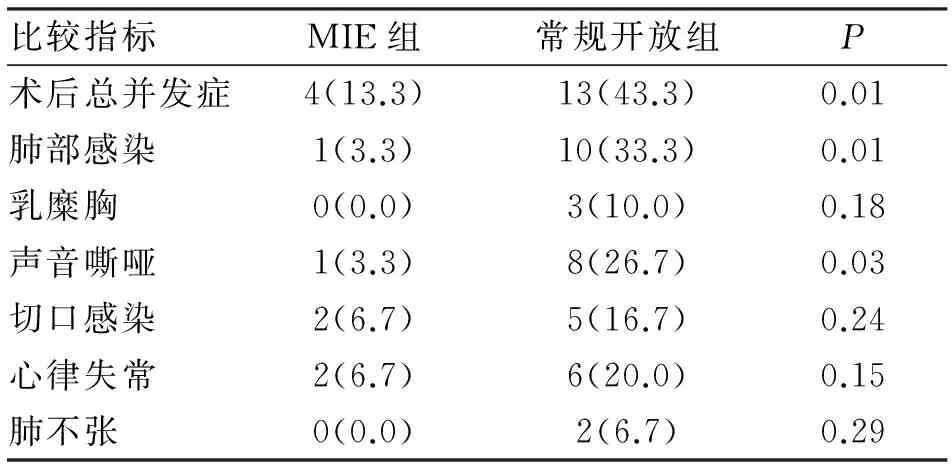
表4 两组患者术后并发症的比较 [n=30;(n;%)]
3 讨 论
1992年,Cushieri等[6]率先将电视胸腔镜和电视腹腔镜引入食管癌手术中,以增加纵隔淋巴结清扫术的可视性,这是世界上最早的腔镜技术在食管癌应用中的报道。随后,DePaula等[7]又首次报道了全腔镜结合经膈肌的食管癌切除手术。2003年,Luketich等[8]第一次报道了222例腔镜下经腹、经右胸和颈部吻合的食管癌手术。这些报道推动了全世界的胸外科医师开始关注微创食管癌手术这一全新的领域。经过20多年的发展和进步,MIE已被大多数医疗中心所采用。
本研究纳入60例于我院行手术治疗的食管癌患者,其中包括8例下段食管癌患者,是因为上腹右胸术式要比左胸单一切口清扫左右喉返神经旁淋巴结更彻底。微创手术行胸腔内手工吻合技术难度较大,可靠性欠佳,故本组患者全部采用颈部吻合。结果显示,MIE可显著减少术中出血量及术后胸腔引流量,减轻术后疼痛,缩短胸腔引流管拔管时间及住院时间,同时可减少肺部并发症的发生,但MIE患者手术时间显著长于常规开放组。在Biere等[2]的一项前瞻性多中心随机对照试验中,MIE组(59例)和常规开放组(56例)患者住院期间肺部感染的发生率分别为12%和34%(P=0.005),与本研究结果基本吻合。
微创食管癌手术的提出,是基于对常规开放手术较高并发症发生率和病死率的考虑,认为MIE可降低食管癌患者术后的并发症发生率和病死率[9,10]。MIE在术中出血、住院时间、术后并发症等方面具有一定优势,这可能与微创手术能较好地保证胸廓的完整性、手术切口小、术后切口疼痛轻有较为密切的关系。常规开放手术心肺并发症发生率往往较高,除开放手术创伤大以外,还由于在暴露后纵隔区域时,对肺组织牵拉挤压容易造成肺损伤;同时,压迫下腔静脉造成回心血量减少从而引起血流动力学不稳定[11]。
食管癌区域淋巴结清扫的范围和程度直接影响着患者的肿瘤分期和预后,因此,区域淋巴结清扫的范围和程度是评价食管癌手术质量的重要指标[12]。NCCN指南要求食管癌手术术中清扫的淋巴结应在15枚以上,本研究中所有患者淋巴结清扫数量均达到了该要求。既往认为,在微创的手术操作条件下清扫淋巴结是比较困难的,其原因是2D的视野、眼手协调性及长器械操作,降低了手术操作的灵活性和准确性。随着腔镜微创技术的发展,越来越多的研究证实MIE对于食管区域淋巴结的清扫范围和彻底程度均不亚于常规开放手术,这不仅体现在淋巴结的清扫数量上,且腔镜下更有利于两侧喉返神经旁淋巴结的清扫[13]。本研究结果显示,MIE组患者淋巴结清扫数目与常规开放组相当。我们认为,腔镜下操作可使外科医师获得更好的视野,与常规开放手术相比,胸腔镜能够将局部视野放大,可以更加清晰地暴露食管及周围组织结构,有助于术者完成精准操作,减少术中出血,避免损伤喉返神经等正常结构,从而使患者术后声音嘶哑发生率也显著降低。
一般认为,手术后4~6 h肠道即可恢复纤毛运动和吸收功能,肠内营养往往比肠外营养更符合生理需求,术后早期应用肠内营养能维持胃肠黏膜的完整性,减少细菌移位,降低感染发生率[14]。本研究中MIE组患者术后第1天即开始进食流质食品或软质固体食物,咀嚼50次后,基本所有固体食物均变为流质食糜,不会对吻合口有机械创伤。肠外营养使用时间短,保证了术后肠内营养的早期实行;而常规开放组患者术后第7天才开始进食,肠外营养时间长,不利于胃肠道功能的恢复和营养的吸收。
综上所述,MIE能显著减少术中出血量,降低术后并发症发生率,缩短术后住院时间。但本研究为单中心研究,且样本量较小,目前尚缺乏长期生存数据,因此本研究的结果有待多中心随机对照试验的结果加以验证。
[1] Torre L A, Bray F, Siegel R L,etal. Global cancer statistics, 2012 [J]. CA: Cancer J Clin, 2015, 65(2): 87-108.
[2] Biere SSAY, van Berge Henegouwen M I, Maas K W,etal. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial [J]. Lancet, 2012, 379(9829): 1887-1892.
[3] Maas K W, Cuesta M A, van Berge Henegouwen M I,etal. Quality of life and late complications after minimally invasive compared to open esophagectomy: results of a randomized trial [J]. World J Surg, 2015, 39(8): 1986-1993.
[4] Sihag S, Kosinski A S, Gaissert H A,etal. Minimally invasive versus open esophagectomy for esophageal cancer: a comparison of early surgical outcomes from the society of thoracic surgeons national database [J]. Ann Thora Surg, 2016, 101(4): 1281-1289.
[5] Tan J T, Zhong J H, Yang Y,etal. Comparison of postoperative immune function in patients with thoracic esophageal cancer after video-assisted thoracoscopic surgery or conventional open esophagectomy [J]. Inter J Surg, 2016, 30: 155-160.
[6] Cuschieri A, Shimi S, Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach [J]. J Royal College Surg Edinburgh, 1992, 37(1): 7-11.
[7] DePaula A L, Hashiba K, Ferreira E A B,etal. Laparoscopic transhiatal esophagectomy with esophagogastroplasty [J]. Surg Laparo Endo Per Tech, 1995, 5(1): 1-5.
[8] Luketich J D, Alvelo-Rivera M, Buenaventura P O,etal. Minimally invasive esophagectomy: outcomes in 222 patients [J]. Ann Surg, 2003, 238(4): 486-495.
[9] Guo W, Ma X, Yang S,etal. Combined thoracoscopic-laparoscopic esophagectomy versus open esophagectomy: a meta-analysis of outcomes [J]. Surg Endo, 2016,30(9): 3873-3881.
[10] Yerokun B A, Sun Z, Yang C F J,etal. Minimally invasive versus open esophagectomy for esophageal cancer: a population-based analysis [J]. Ann Thorac Surg, 2016,102(2):416-423.
[11] Singh R K, Pham T H, Diggs B S,etal. Minimally invasive esophagectomy provides equivalent oncologic outcomes to open esophagectomy for locally advanced (stage Ⅱ or Ⅲ) esophageal carcinoma [J]. Arch Surg, 2011, 146(6): 711-714.
[12] Akutsu Y, Matsubara H. The significance of lymph node status as a prognostic factor for esophageal cancer [J]. Surg Today, 2011,41(9):1190-1195.
[13] Ye B, Zhong C X, Yang Y,etal. Lymph node dissection in esophageal carcinoma: minimally invasive esophagectomy vs open surgery [J]. World J Gastroenterol, 2016, 22(19): 4750.
[14] Bozzetti F, Gavazzi C, Miceli R,etal. Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients: a randomized, clinical trial [J]. J Parent Enter Nutr, 2000, 24(1):7-14.
(2017-01-18收稿 2017-03-15修回)
(责任编辑 梁秋野)
Comparison of short-term efficacy of minimally invasive esophagectomy and esophagectomy in the treatment of esophageal cancer
SU Liwei, ZHANG Dongmei, LI Wei, XIAO Bo, YUE Hongxu, HE Shu, and NIU Zhongxi.
Department of Thoracic Surgery, the General Hospital of Chinese People’s Armed Police Force, Beijing 100039 , China
Objective To compare the short-term efficacy of minimally invasive esophagectomy (MIE) and esophageal carcinoma in the treatment of esophageal cancer.Methods A total of 60 patients with esophageal carcinoma admitted to our hospital between April 2015 and October 2016 were randomly divided into MIE group (30 cases) and esophagectomy group (30 cases). The time of operation, amount of blood loss, number of lymph nodes dissected, time the patient got out of bed for the first time, time of anus exhaust, drainage time of thoracic cavity, drainage volume of thoracic cavity, length of hospital stay, blood routine examinations on day 5, C reaction protein and pain assessment were compared between the two groups after treatment.Results There were no significant differences in baseline characteristics or in the number of lymph nodes dissected [(18.8±8.6)vs(16.2±8.4),P=0.24] between the two groups (P>0.05). MIE patients had a smaller bleeding volume (200±50) ml than those in the esophagectomy group (350 ± 150) ml (P<0.001), as was the case with pleural cavity drainage [(550±200) mlvs(800±350) ml,P<0.001]. Extubation was performed earlier than in the open group [(4.7±1.5) dvs(5.9±1.8) d,P<0.001].There was no significant difference between the two groups in terms of postoperative venting time [(2.1±1.3) dvs(2.3±1.5) d,P=0.27] and ambulation time [(1.2±0.8) dvs(1.3±0.6) d,P=0.52]. In the MIE group, the hospital stay was shorter than that in the open group [(5.2±1.6) dvs(9.4±1.8) d,P<0.001]. The VAS scores of the MIE group were (2.9±1.1), (2.1±1.0) and (1.5±0.8) respectively at 24 h, 48 h and 72 h after operation, which were significantly lower than those of the conventional open group (P<0.001).Conclusions MIE can significantly reduce the amount of bleeding in patients, alleviate pain, and shorten hospital stay after surgery. It can be used as a new surgical therapy for esophageal cancer.
esophageal cancer;MIE;post-operation
武警总医院临床类创新预研课题基金(WZ2015014)
苏立伟,硕士,副主任医师。
100039 北京,武警总医院胸外科
牛中喜,E-mail: nzxnzx182@163.com
R655.4
