小白菜抗盐胁迫的根系响应机制
2017-07-19徐芬芬叶利民夏晓蕾
徐芬芬,叶利民,夏晓蕾
(上饶师范学院生命科学学院, 江西 上饶 334001)
小白菜抗盐胁迫的根系响应机制
徐芬芬,叶利民,夏晓蕾
(上饶师范学院生命科学学院, 江西 上饶 334001)
以前期筛选得到的抗盐品种‘四倍体矮脚黄’和盐敏感品种‘改良605’为材料,采用水培方法,研究了两品种在根系形态、根系细胞质膜伤害、根系渗透调节物质含量和根系活性氧及其清除系统对盐胁迫的响应。试验结果表明,‘四倍体矮脚黄’盐处理组的根系长度、根系分支数、根毛直径等分别较CK降低了0.71 cm、0.6 个·株-1、0.28 mm和2.5 μm,根毛密度较CK增加了3 根·mm-1,除根毛长度较CK显著降低外(P<0.05),其它指标均与CK差异不显著。而‘改良605’在盐处理组未见根毛分化,根系也不分支,其根长、根系分支数、根毛长度、根毛直径和根毛密度等较CK的降低值分别为:5.87 cm、5.0 个·株-1、0.63 mm、17.3 μm和24 根·mm-1,远远高于‘四倍体矮脚黄’。盐处理组各指标均极显著低于CK(P<0.01)。生理指标测定结果表明,盐胁迫促使两个品种根系可溶性糖、可溶性蛋白质含量增加,相对电导率提高,保护酶活性降低,Na+/K+比值增大,活性氧积累,但抗盐品种‘四倍体矮脚黄’的变化程度小于盐敏感品种‘改良605’。
小白菜;盐胁迫;根系生长;生理响应
小白菜(BrassicacampestrisL. ssp.ChinensisMakinoVar.communis)原产中国,俗称青菜,是人们喜爱的大众化蔬菜。设施蔬菜栽培已成为我国蔬菜生产重要的生产方式,但随着近几年设施蔬菜栽培的迅猛发展,栽培技术和管理措施的落后以及农民过分追求近期经济效益,造成了土壤出现一系列的问题,其中土壤次生盐渍化是主要的问题之一。盐胁迫对不同作物的伤害机制是不同的,因此不同作物对盐胁迫表现出来的抗性机制也不同[1]。有的作物在盐胁迫下表现出较强的渗透调节能力,体内大量积累渗透调节物质,而有的作物通过增强自身的抗氧化能力来缓解盐胁迫伤害。根系最早感受盐胁迫逆境,是最直接的受害部位。因此根系是植物应对盐胁迫的首要部位[2]。根系在逆境下能够通过改变其形态与分布来适应不利环境[3-4],所以,根的生长发育状况对植物的耐盐能力至关重要,而目前缺乏不结球白菜耐盐胁迫机制的系统研究。
目前关于根系对盐胁迫响应的研究较集中于根系生理特性方面的研究,如崔云玲等[5]研究表明,油葵抗性品种通过减少对Na+吸收,维持K+的稳定,来保持较高的Na+/K+比从而增强其抗盐性;侯晨[6]研究表明,旱稻根系可通过增强保护酶活性,降低MDA含量,以及恢复Na+/K+比来使细胞获得耐盐性。关于盐胁迫对根毛形态影响的研究较少,卢学琴等[7]研究表明,0.6%~0.8% NaCl胁迫处理下,剑麻幼苗根毛的生长受到较明显抑制,根毛基部萎缩及根毛脱落加重。根毛是植物吸收水分的主要部位,盐胁迫下根毛发育不良是影响幼苗生长的主要因素。所以研究盐胁迫对根毛形态的影响非常重要,而目前关于盐胁迫对小白菜根系生长影响的报道仅见于徐芬芬等[8]的研究,其结果发现,盐胁迫小白菜细根较少,表现为根毛区宽度极小,有的品种甚至没有根毛分化。而目前对盐胁迫下根毛形态和根尖生理的系统研究较为缺乏,本研究通过模拟盐逆境,对比耐盐和盐敏感品种根系和根毛的形态以及根尖生理特性,探讨不结球白菜抗盐的根系生理响应机制,丰富根系响应盐胁迫的系统理论。
1 材料与方法
1.1 供试材料1.2 材料培养与处理设置

1.3 测定指标与方法
1.3.1 根系和根毛的形态参数测定 选择生长良好、颜色鲜白的根作为根毛形态测定的试验材料。用直尺测量主根长,用剪刀剪下根端约2 cm长的细根,放入事先滴入少许蒸馏水的培养皿中,把培养皿里的细根置于NIKON 7500型显微镜(尼康体视显微镜)下观察并测量和照相,用显微测微尺和Motic Images Plus 2.0软件测量距根端0~7 mm处的细根直径、根毛密度和长度。每株苗测定5次,然后计算平均数。
1.3.2 根系渗透调节物质含量和细胞质膜透性的测定 脯氨酸含量采用酸性茚三酮比色法[9],可溶性糖含量的测定采用蒽酮比色法[9];K+、Na+含量参考王宝山与赵可夫用原子吸收分光光度计测定[10]。细胞质膜透性参照李敏等[11]采用的相对电导率的测定方法。
1.4 数据分析
试验数据用Excel软件分析,采用新复极差法进行显著性测验。
2 结果与分析
2.1 根系和根毛形态参数
由表1分析可知,盐处理下两品种小白菜根长、根系分支数、根毛长度和根毛直径等均较CK降低,其中,耐盐品种‘四倍体矮脚黄’在盐胁迫下根系长度、根系分支数、根毛长度、根毛直径和根毛密度分别为11.64 cm、4.7 个·株-1、0.50 mm、17.5 μm和28 根·mm-1,CK上述各指标值分别为12.35 cm、5.3 个·株-1、0.78 mm、20.0 μm和25 根·mm-1,可见,盐处理组的根系长度、根系分支数、根毛长度、根毛直径分别较CK降低0.71 cm、0.6 个·株-1、0.28 mm和2.5 μm,而根毛密度反而较CK增加了3 根·mm-1。经统计分析可知,盐胁迫处理组除根毛长度较CK显著降低外(P<0.05),其它指标均与CK差异不显著。而盐敏感品种‘改良605’在正常情况下(CK)根毛发育良好,但在盐胁迫下未见根毛分化,根系也不分支,其根长、根系分支数、根毛长度、根毛直径和根毛密度等较CK的降低值分别为:5.87 cm、5.0 个·株-1、0.63 mm、17.3 μm和24 根·mm-1,统计分析结果表明,盐处理组的各指标均极显著低于CK(P<0.01)。‘改良605’各根系生长指标降低值均远远高于‘四倍体矮脚黄’,说明‘改良605’根系生长和根毛发育受盐胁迫影响更为显著。
从图1可以看出两品种盐胁迫下根长变短,分支数减少,根茎变粗,但‘改良605’与CK差异较大。图2为两品种根毛生长情况,盐胁迫下‘改良605’无根毛分化,而‘四倍体矮脚黄’根毛长度明显较CK短,根毛数目与CK相差不大。说明盐胁迫抑制了盐敏感品种根毛的分化是盐敏感品种受盐胁迫伤害的主要原因。
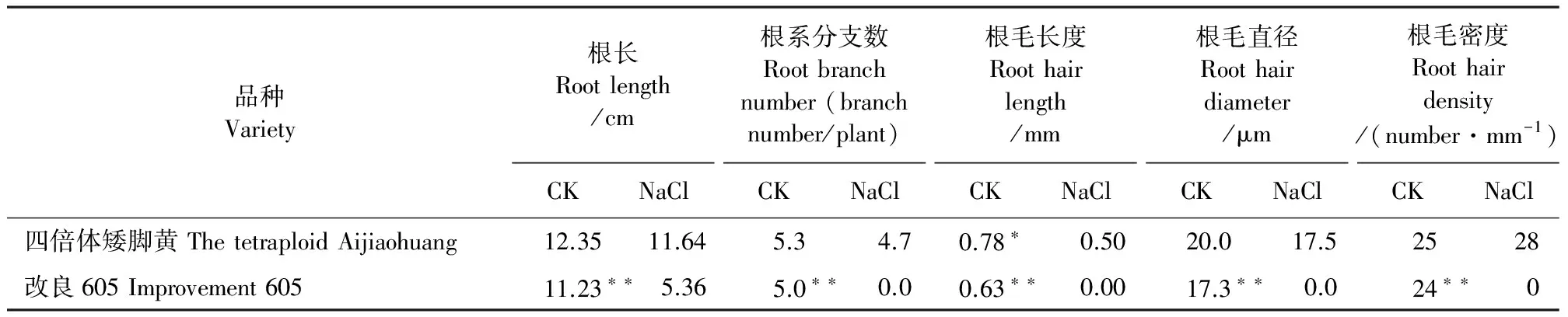
表1 盐胁迫下抗盐性不同的两品种小白菜根系和根毛形态
注:上述差异显著性为t检验结果,“*”和“**”分别表示同一品种NaCl处理与CK差异达0.05和0.01水平,下表同。
Note: The significant difference above wasttest result, * and * * indicate that the significanty difference of NaCl treatment and CK at 0.05 and 0.01 level respectively, the same as below.

图1 两个品种CK与盐处理下根系生长情况

图2 两个品种在正常与盐处理条件下根毛的显微照片(放大40倍)
2.2 根系渗透调节物质含量和细胞质膜透性
由表2分析可知,两个品种NaCl处理的根系脯氨酸含量和可溶性糖含量均较CK显著提高,其中,‘四倍体矮脚黄’盐处理组脯氨酸和可溶性糖两种渗透调节物质含量均极显著高于CK(P<0.01),‘改良605’盐处理组的脯氨酸含量和可溶性糖含量也显著超过CK(P<0.05)。表明盐胁迫下抗盐性不同的小白菜品种均能通过根系合成较多的渗透调节物质来降低自身的渗透势,以增强吸水能力。耐盐品种‘四倍体矮脚黄’的渗透调节能力较盐敏感品种‘改良605’更强。
两品种盐处理组的根系相对电导率均较CK提高,其中,盐敏感品种‘改良605’盐处理的根系相对电导率(为16.12%)显著高于CK(为11.52)(P<0.05),而耐盐品种‘四倍体矮脚黄’的盐处理根系相对电导率(为13.26%)与CK(12.43%)差异不显著。表明盐胁迫下小白菜根系细胞质膜透性增大了,细胞膜受到了一定程度的损伤,盐敏感品种受到的伤害显著,而耐盐品种受伤害不显著。
盐胁迫下,植物体内会积累大量的Na+、Cl-等离子,对植物的生长造成伤害。细胞中Na+/K+比是植物耐盐性的重要指标。盐敏感品种‘改良605’盐处理根系Na+/K+比值(15.63)显著高于CK(6.62)(P<0.01),而‘四倍体矮脚黄’盐处理Na+/K+比值(9.36)和对照Na+/K+比值(6.43)间无显著差异。说明耐盐品种‘四倍体矮脚黄’表现出对Na+的吸收减少,对K+有更好的吸收能力,较盐敏感品种更强。
2.3 根系活性氧积累和保护酶活性
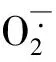

表2 抗盐性不同的两品种小白菜渗透调节物质含量和细胞质膜透性
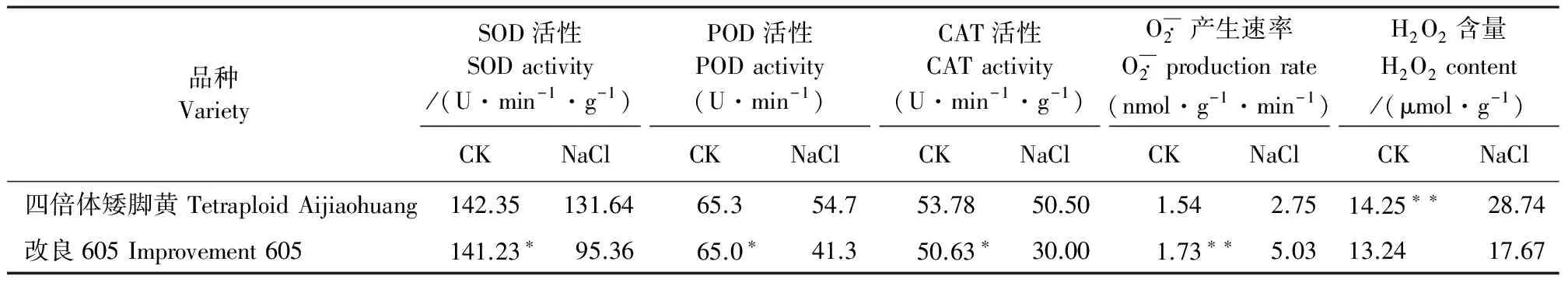
表3 抗盐性不同的两品种小白菜根系活性氧代谢和保护酶活性
3 讨 论
植物根系是营养的直接吸收利用者,当植物遭遇胁迫时,植物根系首先感应并迅速发出信号,使整个植株对胁迫作出反应,同时根系形态结构、化学成分数量和生物质量也发生相应变化。植物根系对胁迫的生理抗性主要包括:根系渗透调节作用、保护酶系统、胁迫蛋白产生、膜结构与功能的变化以及根系合成生物活性物质等。本试验研究结果发现,盐处理下两品种小白菜根长、根系分支数、根毛长度和根毛直径等均较CK降低,盐敏感品种‘改良605’各指标降低值远远高于耐盐品种‘四倍体矮脚黄’,说明盐敏感‘改良605’根系生长和根毛发育受盐胁迫影响更为显著。盐胁迫导致小白菜根尖活性氧积累、保护酶活性增强、渗透调节物质含量提高、细胞质膜透性增大。与盐敏感品种‘改良605’相比,耐盐性品种‘四倍体矮脚黄’根部表现出K+积累、Na+/K+比值低、脯氨酸和可溶性糖含量高、保护酶活性强等。说明耐盐性品种通过积累更多的渗透调节物质、增强保护酶活性、选择性吸收K+来等提高耐盐能力。
盐胁迫下,盐敏感品种‘改良605’将更多的Na+积累于根中,K+吸收量减少,过多的Na+在细胞内聚集会对植物产生毒害作用;而抗盐品种‘四倍体矮脚黄’在盐胁迫条件下对K+的选择性吸收能力强,维持根中Na+/K+比相对恒定,以适应低水势的环境,这与崔云玲等[5]对油葵的研究结果相似。
[1] 许祥明,叶和春,李国凤.植物抗盐机理的研究进展[J].应用与环境生物学报,2000,6(4):379-387
[2] Cramer G R, Luchli A, Epstein E. Effects of NaCl and CaCl2on ion activities in complex nutrient solutions and root growth of cotton[J]. Plant Physiology,1986,81(3):792-797.
[3] Jia Y B, Yang X E, Feng Y, et al. Differential response of root morphology to potassiμm deficient stress among rice genotypes varying in potassiμm efficiency[J]. Journal of Zhejiang University Science B, 2008,9(5):427-434.
[4] Srinivasarao C H, Benzioni A, Eshel A, et al. Effects of salinity on root morphorlogy and nutrient acquisition by Faba beans (ViciafabaL.)[J]. Journal of the Indian Society of Soil Science,2004,52(2):184-191.
[5] 崔云玲,王生录,陈炳东,等.不同品种油葵对盐胁迫响应研究[J].土壤学报,2011,48(5):1051-1058.
[6] 侯 晨.旱稻根对盐胁迫的生理生化响应及信号转导[D].兰州:兰州大学,2008.
[7] 卢学琴,胡尚连,曹 颖,等.NaCl胁迫对剑麻幼苗根毛生长及其生理代谢的影响[J].干旱地区农业研究,2012,30(5):104-108.
[8] 徐芬芬,叶利民,夏晓蕾,等.人工海水胁迫对不同品种小白菜萌发和根系生长的影响[J].上饶师范学院学报,2015,35(6):81-85.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版,2003.
[10] 王宝山,赵可夫.小麦叶片中Na+、K+提取方法的比较[J].植物生理学通讯,1995,31(1):50-52.
[11] 李 敏,王维华,王 然,等.高温胁迫对菠菜叶片保护酶活性和脂膜透性的影响[J].园艺学报,2004,31(1):99-100.
[12] 王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[M].植物生理学通讯,1990,(6):55-57.
[13] 刘 俊,吕 波,徐朗莱.植物叶片中过氧化氢含量测定方法的改进[J].生物化学与生物物理进展,2000,27(5):548-551.
[14] 刘 萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007.
[15] 杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17:121-125.
[16] Foreman J, Demidchik V, Bothmell J H F, et al. Reative oxygen species produced by NADPH oxdase regulated plant growth[J]. Nature, 422:442-446.
Physiologyresponseofrootsofpakchoivarietiestosaltstress
XU Fen-fen, YE Li-min, XIA Xiao-lei
(LifeScienceCollege,ShangraoNormalUniversity,Shangrao,Jiangxi334001,China)
With pakchoi varieties, i.e. a salt-resistance variety ‘tetraploid Aijiaohuang’ and a salt-sensitive variety ‘Improvement 605’, as the experimental materials, this study were carried out to investigate and report the response of root morphology, root cell membrane damage, root osmotic adjustment substance content and its scavenging system of reactive oxygen under the different salt tolerance hydroponic solution. The results showed that the root length, number of branches roots and root hair diameter of the ‘tetraploid Aijiaohuang’ under salt stress was decreased by 0.71 cm, 0.6 number·plant-1, 0.28 mm and 2.5 μm, respectively. But the root hair density was increased by 3 number·mm-1compared with that of CK. The root hair length decreased significantly while other indexes did not changed markedly. In addition, ‘Improvment 605’ had no new hairs and branch roots under the salt stress. Physiological analysis showed increase in proline content, soluble sugar content, the relative conductivity Na+/K+ratio, and reactive oxygen accumulation, whereas revealed decrease in protecting enzyme activity for both varieties. And the variation of physiological indexes were lower for the salt-sensitive variety ‘Improvement 605’ than the tolerant variety ‘tetraploid Aijiaohuang’.
pakchoi; salt-resistance; root growth; physiology response
1000-7601(2017)03-0178-04doi:10.7606/j.issn.1000-7601.2017.03.28
2016-04-12
:2017-03-10
:2015年江西省教育厅科技项目(GJJ151055);2015年上饶师范学院科技创新项目(201503);2015年大学生科技项目
徐芬芬(1978—),女,副教授,硕士,主要从事植物逆境生理研究。 E-mail:xffylm7875@163.com。
Q945.78
: A
