高效液相色谱法测定库尔勒香梨幼果中的4种内源激素
2017-07-19张占畅孙志红郑小能刘怀锋
张占畅,孙志红,郑小能,刘怀锋,
(1.石河子大学农学院园艺系,新疆石河子832000;2.兵团第二师农业科学研究所,新疆库尔勒841503; 3.特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆石河子832000)
高效液相色谱法测定库尔勒香梨幼果中的4种内源激素
张占畅1,孙志红2,郑小能3,刘怀锋1,3
(1.石河子大学农学院园艺系,新疆石河子832000;2.兵团第二师农业科学研究所,新疆库尔勒841503; 3.特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆石河子832000)
【目的】建立高效液相色谱法(HPLC),用于同时分离和测定库尔勒香梨幼果中的玉米素(ZT)、赤霉素(GA3)、生长素(IAA)和脱落酸(ABA)4种植物内源激素。【方法】经过条件筛选和优化,选用80%甲醇作为样品提取试剂。经过石油醚脱色,PVPP吸附杂质和乙酸乙酯萃取,再经Sep-Pak C18小柱纯化。采用SGE ProteCol-P C18(250 mm×4.6 mm,5 μm)色谱柱,柱温40℃,流速为1 mL/ min,进样量10 μL。流动相A为甲醇,流动相B为水(pH=3.5),流动相比例为:45%(A)与55% (B)。检测器波长为254 nm。【结果】建立了玉米素、赤霉素、生长素、脱落酸的高效液相色谱分析方法。运用该方法测得加标回收率达80.4%~91.2%,相对偏差在1.54%~8.1%,分离效果理想,实验效果稳定可靠。【结论】该方法前处理方法简便,分析速度快,具有较高的重现性和精确性。适用于香梨幼果中内源激素玉米素、赤霉素、生长素和脱落酸的测定分析。
库尔勒香梨;高效液相色谱法;幼果;内源激素
0 引言
【研究意义】植物激素是植物正常代谢的产物,是在植物体内合成的,并能从产生部位转移到作用部位,在低浓度下就能调节植物生长发育的有机物质[1]。植物内源激素包括赤霉素、生长素、脱落酸、细胞分裂素、乙烯及油菜素内脂等六大类,对植物的生长、发育、成熟及衰老等生理过程有着显著的支配作用,并使植物各器官间互通信息,互相协调,从而使整株植物的生长发育进程一致[2,3]。因此,分析香梨花期幼果内源激素含量的变化,对于研究香梨脱萼及提高品质等具有重要的生产实践价值[4]。【前人研究进展】目前,植物内源激素含量的测定方法主要有高效液相色谱法(HPLC)、酶联免疫法(ELISA)及放射免疫法(RIA),由于后两种对于激素的提纯精度较低以及可重复性较差等问题[5-7]。而高效液相色谱法具有灵敏度高,分辨率高等优点,而且具备同时检测多种植物激素的特点,因此采用高效液相色谱法作为检测方法[8,9]。由于内源激素在幼果中含量较低,种类较多,分离时易被破坏,而且检测条件各异[10,11]。因此筛选合适的提取方法和优化HPLC的检测方法是试验的关键[12]。【本研究切入点】目前,关于香梨幼果的激素提取,检测方法较少,而使用HPLC法检测库尔勒香梨内源激素含量更是鲜有报道。研究从提取方法,色谱条件等方面进行优化,而对香梨幼果中ZT、GA3、IAA、ABA 4种内源激素含量同时进行分离与测定。【拟解决的关键问题】建立一种分析香梨幼果内源激素的可靠方法,而为研究库尔勒香梨生长与调节库尔勒香梨品质等提供技术参考。
1 材料与方法
1.1 材料
液相色谱为岛津LC-2010AHT型高效液相色谱仪(日本岛津),包括四元梯度泵、紫外检测器、HPLC 2D工作站。流动相用KQ-100VDE型超声波清洗仪脱气。研磨后的样品用HITACHI CR22GⅢ冷冻离心机离心。离心后取上清液,用RE-2000A旋转蒸发器浓缩。
玉米素、赤霉素、生长素、脱落酸标准品购自Sigma公司,甲醇、乙酸为色谱级,乙酸乙酯,盐酸、磷酸氢二钠、交联聚乙烯吡咯烷酮(PVPP)为分析纯,实验用水为超纯水。所有试剂使用前均通过0.45 μm微孔滤膜过滤。
试验所选材料为新疆库尔勒地区第二师29团园三连的香梨,于2016年4月26日采取香梨幼果,用锡箔纸包好,置于液氮中速冻带回实验室,放入-76℃低温冰箱保存待测。
1.2 方法
1.2.1 样品测定
样品前处理按照参考文献方法并加以改进和优化[13,14]。准确称取2 g冷藏的香梨幼果,加入10 mL预冷的80%甲醇研磨成匀浆,置于4℃冰箱静置后离心取上清液,重复三次合并全部上清液,将全部上清液旋蒸至原体积的三分之一,加入石油醚脱色,再加入0.1 g PVPP震荡后过滤。将滤液用乙酸乙酯萃取并在35℃下减压蒸干,残留物加2 mL乙酸溶解后过Sep-Pak C18小柱纯化,用甲醇洗脱后减压蒸干,用80%甲醇溶解并定容至2 mL,溶液过0.45 μm微孔滤膜过滤后进行HPLC分析。
1.2.2 标准品的配置
分别称取0.01 g ZT、0.02 g IAA、0.3 g GA3和0.02 g ABA标准品,用纯甲醇溶解并定容至100 mL棕色容量瓶,即为4种激素混合标准溶液。以混合标准溶液为母液,逐级稀释,配制成含有ZT、GA3、IAA和ABA的系列标准溶液,采用优化的色谱条件,依次进样检测,以激素质量浓度(mg/mL)为横坐标,以峰面积( mAU)为纵坐标,建立4种激素的回归方程。
1.2.3 色谱条件
SGE ProteCol-P C18(250 mm×4.6 mm,5 μm)色谱柱;柱温为40℃;进样量10 μL;;流速1.0 mL/min;流动相为甲醇:乙酸的水溶液(pH=3.5)=4.5∶5.5(V/V)。测定波长为254 nm;以外标法进行定量分析。
1.2.4 稳定性试验
用1.2.3所述的色谱条件,对同一浓度的4种激素混合标准溶液通过液相保留峰面积以及记录保留时间,分别在一日内测定不同时间的日内重现性,取不同5个时间点,每次对标准溶液重复测定3次。日间重现性分析进行3 d的连续测定,每次对标准溶液重复测定3次。
1.2.5 回收率试验
准确称取已知4种激素含量的香梨幼果样品2 g共3份,加入ZT、GA3、IAA和ABA标准品,按1.3方法制备样品溶液进行测定,计算回收率。
2 结果与分析
2.1 样品前处理条件的优化
植物内源激素在不同提取液的提取效率不一样,香梨幼果中激素含量较低,且又与酮类,酚类共存,在进行HPLC分析时,其他物质不可避免地对分析进行干扰。因此,在前处理阶段激素提取的关键就是减少杂质的量。在选择提取试剂时,分别以纯甲醇,80%甲醇、纯水、乙酸溶液(pH=3.5)作为提取溶剂。检测结果表明,甲醇作为提取溶剂,不仅在后续脱色,萃取等步骤中较其他溶剂效果明显,同时,甲醇作为提取试剂,提取效率高,杂峰较少。提取时间分别设置12、14、16、18和20 h。研究表明,激素提取效率随着浸提时间的增加而增加,但是提取时间超过16 h后提升效果并不明显,因此,浸提时间设置为16 h。但是,经石油醚脱色和乙酸乙酯萃取后,依然有大量杂质的干扰,选择采用PVPP、Sep-PakC18小柱对样品进行进一步的纯化处理,4种激素提取效果良好。
2.2 色谱条件的筛选
2.2.1 检测波长的选择
取4种激素标准溶液,采用紫外可见光光度计在190~400 nm进行光谱扫描,检测4种植物激素的最佳吸收波长以确定检测波长。研究表明,4种激素的最大吸收波长分别为ABA为237 nm,IAA为235 nm,GA3为215和253 nm,ZT为257 nm;综合分析,由于4种激素在254 nm波长条件下均有良好吸收,因此设置紫外检测器检测波长为254 nm。
2.2.2 流动相的比例的选择
以甲醇和乙酸的水溶液(pH=3.5)作为流动相,选择不同流动相比例对混合激素标准溶液进行分离。分别设置甲醇比例由20%逐渐提升到80%。研究表明,甲醇含量越高,4种激素洗脱越快。当甲醇含量在20%时,4种激素在28~29 min全部洗脱出来,但出峰时间过晚,检测时间长,且赤霉素峰形出现平头峰,表明分离效果较差(图1 A);而当甲醇含量达到80%时,4种激素在4~5 min洗脱出来,4种激素保留时间过短,导致样品峰重叠,其中GA3与IAA峰完全重叠,并未分离出来,且其他3种激素分离度极低(图1 B);当甲醇含量在45%时,4种激素在13~15 min全部分离出来,激素分离度高,峰形尖锐,峰形的对称性好,分析时间也被缩短,符合试验要求(图1 C)。经过对比激素分离度,峰形对称性及分离时间后,表明流动相条件为甲醇:乙酸的水溶液(pH=3.5)=4.5∶5.5(V/V)时,为最优流动相条件。图1
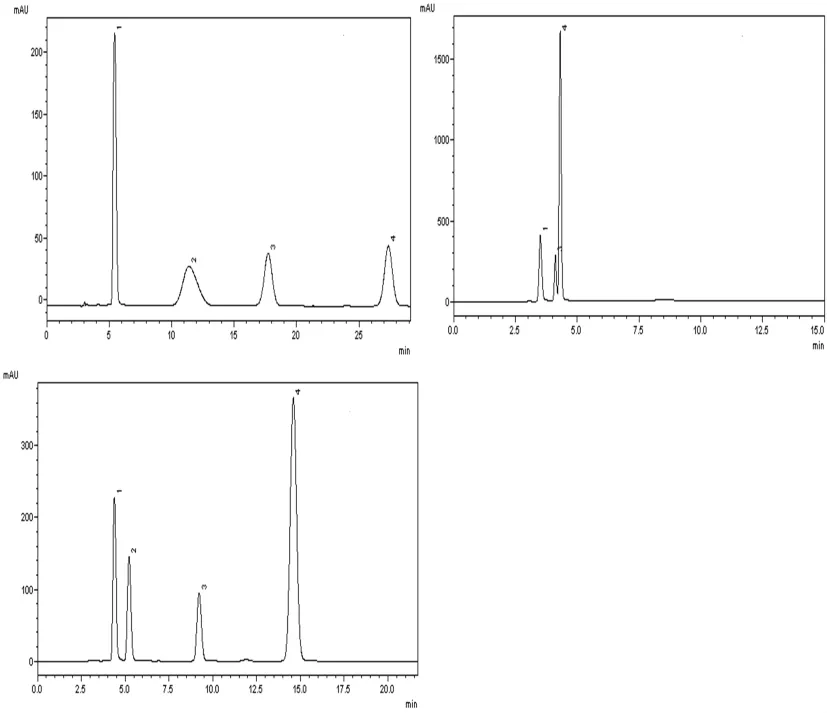
图1 不同流动相比例中的内源激素的色谱图:1-玉米素、2-赤霉素、3-生长素、4-脱落酸Fig.1 Chromatogram of endogenous hormones in different mobile pHase:1-zeatin(ZT)、2-gibberellic acid(GA3)、3-indole-3-acetic acid(IAA)、4-abscisic acid(ABA)
2.2.3 柱温、进样量和流速的选择
柱温的选择对激素分析效果无明显影响,但显著影响分析时间,当柱温为30℃时,4种激素完全分离30~31 min,当柱温为40℃时,4种激素完全分离需要18~19 min。因此,为提高实验进程,选择柱温为40℃。流速也对分析时间有直接的影响,当流速从0.5上升到2 mL/ min时,激素分析时间逐渐缩短,但是过大流速会增大泵压,导致激素分离度下降、4种激素峰距过近等问题。经过筛选,最终确定流速为1.0 mL/min。当分别设置进样量为10、15、20 μL时,随着进样量增大,前沿峰出现的频率越高,且样品过载对色谱柱危害较大。因此确定进样量为10 μL。
2.34 种激素的标准曲线
2.3.1 内源激素的定性分析
采用优化后的色谱条件,对混合激素标准液溶液进行HPLC分析,研究表明,ZT、GA3、IAA和ABA的保留时间分别为(4.525±0.408) min、(5.433±0.50)min、(9.761±0.929)和(15.063±1.346)min。图2
2.3.2 内源激素的定量分析
在优化后的色谱条件下,4种激素检测灵敏度较高,且分离度,峰形较好。按1.4方法得出各激素的回归方程。4种激素回归方程的线性相关系数在0.994 6~0.999 7,表明标准品质量浓度与峰面积相关性良好。同时,按照信噪比(S/N)为3∶1时,得到各激素的检出限,表明测定结果有较好的精确度和灵敏度。图1
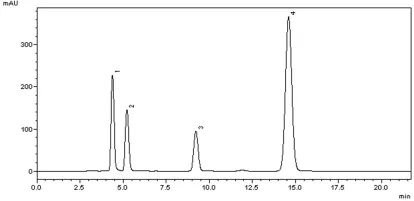
图2 在254 nm检测条件下的混合激素标准品的色谱图:1-玉米素、2-赤霉素、3-生长素、4-脱落酸Fig.2 Chromatogram of the mixture of hormones standards under 254 nm:1-zeatin(ZT)、2-gibberellic acid(GA3)、3-indole-3-acetic acid(IAA)、4-abscisic acid(ABA)
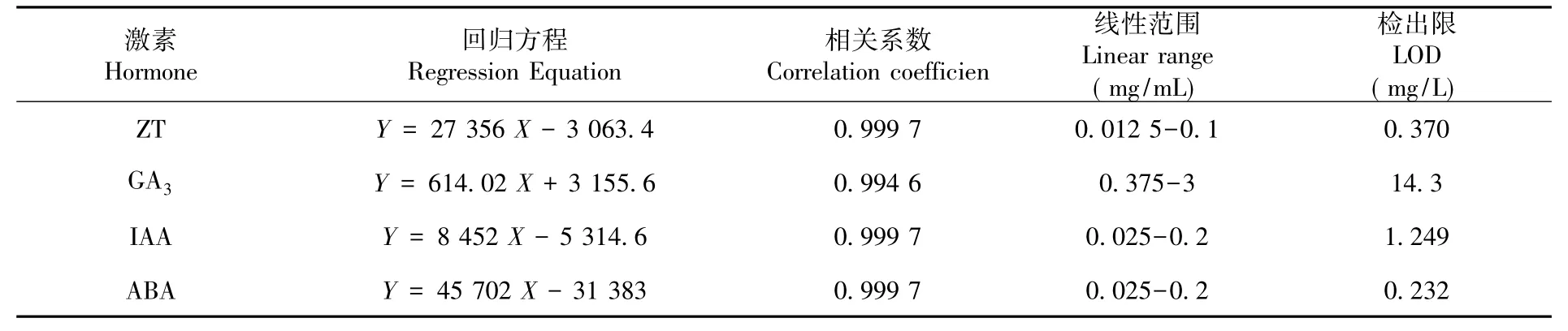
表1 激素在色谱条件下的的标准曲线和检出限Table1 Calibration curves of the standards and LOD of hormones under choosed HPLC conditions
2.4 稳定性试验
按1.2.4试验方法进行稳定性试验,研究表明,4种激素日内重现性相对偏差在0.5%~6.92%;4种激素日间重现性相对标准偏差在0.87%~2.53%。通过稳定性试验,表明使用该方法结果较稳定,仪器精密度及试验重现性良好。表2
2.5 实际样品分析
取冷冻的试验材料2 g,按照1.2方法制备样品并按上述色谱条件进行分析测定。香梨幼果中4种激素均得到较好的分离结果表明香梨幼果中含玉米素(ZT)16.71 μg/g、赤霉素(GA3)1.28 mg/g、生长素(IAA)32.01 μg/g、脱落酸(ABA)1.67 μg/g。图3
2.6 回收率的测定
通过香梨幼果样品测定结果及加标回收率试验结果表明,ZT、GA3、IAA、ABA的平均回收率分别为80.4%、83.2%、91.2%和90.4%,相对偏差均小于8.1%。样品前处理方法可以满足香梨幼果4种内源激素的测定分析。表3
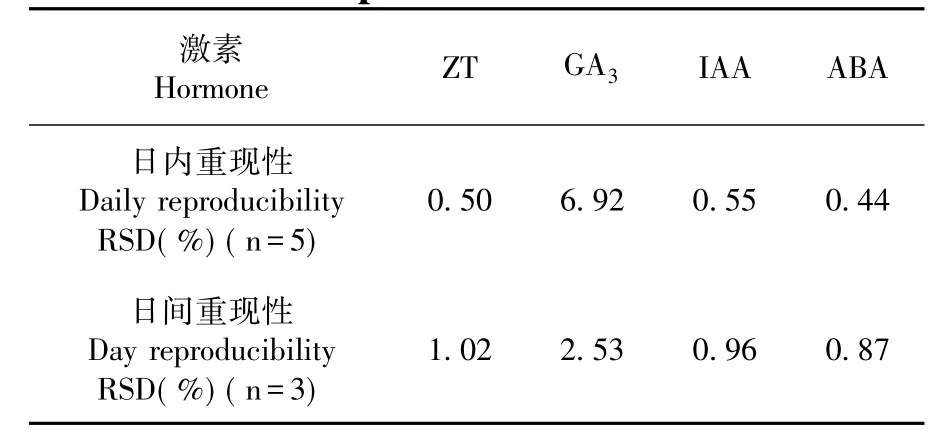
表24 种植物激素的稳定性试验Table2 Stability test of four kinds of plant hormones

图3 在254 nm检测条件下的香梨幼果的色谱图:1-玉米素、2-赤霉素、3-生长素、4-脱落酸Fig.3 Chromatogram of the pear young fruit under 254 nm:1-zeatin(ZT)、2-gibberellic acid(GA3)、3-indole-3-acetic acid(IAA)、4-abscisic acid(ABA)
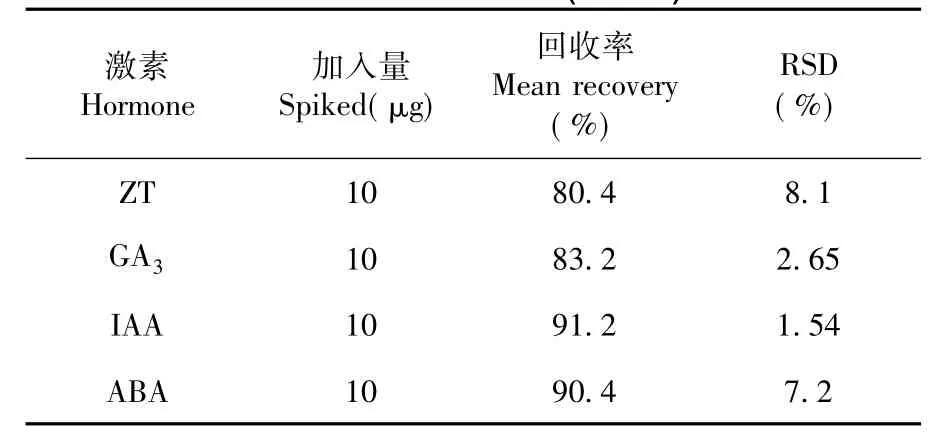
表3 各激素的加标回收率(n=3)Table3 Result of standard addtion recovery test of hormones(n=3)
3 讨论
试验用190~400 nm紫外光对4种激素进行了扫描,结果表明,4种激素均在254 nm左右有较好的吸收,选择254 nm作为检测波长。在选择提取溶剂方面,在实验中发现以纯水及乙酸溶液作为提取溶剂时,在石油醚脱色时,脱色效果差,极易出现枣泥状絮状物。在后续的检测中出现提取效果较差,提取的激素含量不稳定等不利因素。因此,最终选择甲醇作为提取试剂。该选择与张玉琼、刘妮等[8,14]研究结果一致。
在选择纯化方式方面,为避免未经纯化的提取液堵塞色谱柱,根据前人经验,采用PVPP吸附法[6],以尽可能的去除杂质,达到提纯激素的目的[15]。PVPP是乙烯基吡咯烷酮的交联聚合物,具备吸附多酚类和色素类的良好性能[6,16]。Sep技术广泛用于样品的分离和纯化,可以有效的去除干扰有机化合物。其他研究者发现C18小柱纯化植物内源激素效果较好,提高了激素回收率[11,17]。在试验中,通过在前处理过程中提取液中加入0.1 g PVPP震荡后过滤,并在提取液压缩后过C18预处理柱纯化,有效的减少了提取液里面的杂质,初步达到了提纯激素的目的,提高了分析效果。
在内源激素的定性分析方面,4种激素峰形尖锐,分离度较高,同时在连续3 d的稳定性试验检测中,分离效果较稳定,效果良好。在内源激素定量分析方面,各激素相关系数均接近1,所得回归方程理想。
利用高效液相色谱法对香梨幼果中4种内源激素同时测定,结果符合定量分析要求,误差小,取得了较好的效果。而赤霉素由于其检出限较高,在此次分析中出峰难度较大。因此,试验中赤霉素测定的精确度和回收率与其它激素相比仍有一定差距。关于如何利用高效液相色谱法进一步精确测定赤霉素的试验条件仍需进一步的研究。
利用试验确定的高效液相色谱方法,对20个多个不同香梨幼果样品进行了4种内源激素含量的测定,取得了较好的效果,同时也说明了该方法的可行性。
4 结论
通过优化香梨中4种内源激素的提取条件以及色谱条件,建立了一种以SGE ProteCol-P C18(250 mm×4.6 mm,5 μm)作色谱柱,甲醇和乙酸的水溶液(pH=3.5)作流动相,设定流动相流速为1.0 mL/min,柱温为40℃,样品进样量为10 μL,采用高效液相色谱法在波长254 nm下同时测定了库尔勒香梨幼果样品中的玉米素、生长素、细胞分裂素和脱落酸,分析时间不超过17 min,且4种激素出峰稳定,峰型优质,加标回收率均在80%以上。该方法具有样品前处理简单、分离效果较好、精确度高、回收率理想、分析速度快等优点。该方法达到了激素的定量测定要求,适用于香梨以及其他果品多种内源激素含量的同时分析测定。
References)
[1]熊国胜,李家洋,王永红.植物激素调控研究进展[J].科学通报,2009,(18):2 718-2 733.
XIONG Guo-sheng,LI Jia-yang,WANG Yong-hong.(2009).Research progress of plant hormone regulation[J].Chinese Sciences Bulletin,(18):2,718-2,733.(in Chinese)
[2]谈锋.植物激素的高效液相色谱[J].植物生理学通讯,1986,(5):15-23.
TAN Feng.(1986).High performance liquid chromatographic of plant hormones[J].Plant Physiology Communications,(5):15-23.(in Chinese)
[3]柯学莎,李伟.激素对水生植物生理生态的影响及其应用[J].生态学报,2006,(5):1 542-1 549.
KE Xue-sha,LI Wei.(2006).Hormones and aquatic plants: physiology,ecology and utilization[J].Acta Ecologica Sinica,(5):1,542-1,549.(in Chinese)
[4]陈清西.植物激素与果实生长(综述)[J].福建果树,1987,(2):24-27.
CHEN Qing-xi.(1987).Plant hormones and fruit growth[J].Fujian Fruits,(2):24-27.(in Chinese)
[5]李素梅,张自立,姚彦如.植物激素检测技术的研究进展[J].安徽农业大学学报,2003,(2):227-230.
LI Su-mei,ZHANG Zi-li,YAO Yan-ru.(2003).Research progress of plant hormone detection technology[J].Journal of Anhui Agricultural University,(2):227-230.(in Chinese)
[6]黄靖,刘艳芝,刘国伟,等.高效液相色谱法测定植物内源激素研究进展[J].山东农业科学,2011,(8):101-103.
HUANG Jing,LIU Yan-zhi,LIU Guo-wei,et al.(2011).Advances in the determination of endogenous hormones in plants by high performance liquid chromatography[J].Shandong Agricultural Sciences,(8):101-103.(in Chinese)
[7]符继红,孙晓红,王吉德,等.植物激素定量分析方法研究进展[J].科学通报,2010,(33):3 163-3 176.
FU Ji-hong,SUN Xiao-hong,WANG Ji-de,et al.(2010).Advances in quantitative analysis methods of plant hormones[J].Chinese Science Bulletin,(33):3,163-3,176.(in Chinese)
[8]张玉琼,仲延龙,高翠云,等.高效液相色谱法分离和测定小麦中的5种内源激素[J].色谱,2013,31(8):800-803.
ZHANG Yu-qiong,ZHONG Yan-long,GAO Cui-yun,et al.(2013).Determination of five endogenous hormones in wheat by high performance liquid chromatographic(HPLC)[J].Chinese Journal of Chromatography,31(8):800-803.(in Chinese)
[9]孙会敏,田颂九.高效液相色谱法简介及其在药品检验中的应用[J].齐鲁药事,2011,(1):38-42.
SUN Hui-min,TIAN Song-jiu.(2011).Introduction of high performance liquid chromatography and its application in drug testing[J].Qilu Pharmaceutical Affairs,(1):38-42.(in Chinese)
[10]陈小鹏,王秀峰,孙小镭,等.高效液相色谱测定黄瓜瓜条中赤霉素和脱落酸含量[J].山东农业科学,2005,(1):65-67.
CHEN Xiao-peng,WANG Xiu-feng,SUN Xiao-lei,et al.(2005).Determination of gibberellin abbeymycin and abscisic acid in cucumber by high-performance liquid chromatography[J].Shandong Agricultural Sciences,(1):65-67.(in Chinese)
[11]吴耕西,毕桂红.高效液相色谱法测定苹果叶片中的吲哚乙酸和脱落酸[J].山东农业大学学报,1994,25(1):51-55.
WU Geng-xi,BI Gui-hong.(1994).Determination of Indole-3-acetic acid and abscisic acid in apple leaves by high-performance liquid chromatography[J].Journal of Shandong Agricultural U-niversity,25(1):51-55.(in Chinese)
[12]张政,张强,王转花,等.荞麦幼苗内源激素的高效液相色谱测定法[J].色谱,1994,(2):140-141.
ZHANG Zheng,ZHANG Qiang,WANG Zhuan-hua,et al.(1994).Determination of endogenous hormones in buckwheat seedling by high performance liquid chromatography[J].Chinese Journal of Chromatography,(2):140-141.(in Chinese)
[13]丁静,沈镇德,方亦雄,等.植物内源激素的提取分离和生物鉴定[J].植物生理学通讯,1979,(2):27-39.
DING Jing,SHEN Zhen-de,FANG Yi-xiong,et al.(1979).Extraction and isolation of plant endogenous hormones and biological identification[J].Plant Physiology Communications,(2): 27-39.(in Chinese)
[14]刘妮,陶书田,李雷廷,等.'砀山酥梨'幼果萼片脱落期内源激素含量变化[J].南京农业大学学报,2013,(6):147-150.LIU Ni,TAO Shu-tian,LI Lei-ting,et al.(2013).Changes in endogenous hormones levels of young fruit of'Dangshansuli'pear during calyx abscission processes[J].Journal of Nanjing Agricultural University,36(6):147-150.(in Chinese)
[15]郭敏敏,王清连,胡根海.利用高效液相色谱法分离和测定棉花组织培养过程中4种内源激素[J].生物技术通讯,2009,(2):213-216.
GUO Min-min,WANG Qing-lian,HU Gen-Hai.(2009).Separation and Determination of Four Plant Hormones During Somatic Embryogenesis of Gossypium hirsutum L with HPLC[J].Biotechnology Newsletter,(2):213-216.(in Chinese)
[16]曾庆钱,陈厚彬,鲁才浩,等.HPLC测定荔枝不同器官中内源激素流程的优化[J].果树学报,2006,23(1):145-148.
ZENG Qing-qian,CHEN Hou-bin,LU Cai-hao,et al.(2006).An optimized HPLC procedure for analyzing endogenous hormones in different organs of litchi[J].Journal of Fruit Science,23(1):145-148.(in Chinese)
[17]陈建华,曹阳,李昌珠,等.板栗内源激素的高效液相色谱测定方法[J].中南林业科技大学学报,2004,24(5):39-41.
CHEN Jian-hua,CAO Yang,LI Chang-zhu,et al.(2004).High-efficient Liquid Chromatographic Determination of the Internal Hormones in Castanea mollissima Blume[J].Journal of Central South University of Forestry and Technology,24(5):39-41.(in Chinese)
Determination of Four Endogenous Hormones in the Young Fruit of Korla Fragrant Pear by High Performance Liquid Chromatography(HPLC)
ZHANG Zhan-chang1,SUN Zhi-hong2,ZHENG Xiao-neng3,LIU Huai-feng LI1,3
(1.Horticultural Department,College of Agronomy,Shihezi University,Shihezi Xinjiang 832000,China; 2.Research Institute of AgriculturalSciences,Division Two,Xinjiang Production and Construction Corps,Korla Xinjiang 841503,China;3.Key Laboratory of Featured Fruits and Vegetables Cultivation Physiology and Germplasm Resources Utilization of Xinjiang Production and Construction Corps,Shihezi Xinjiang 832000,China)
【Objective】A high performance liquid chromatography(HPLC)method was developed to determine the concentration of four endogenous hormones[indole-3-acetic acid(IAA),abscisic acid (ABA),gibberellic acid(GA3),zeatin(ZT)]in young fruit of Korla fragrant pear.【Method】After screening and optimization of conditions,80%methanol was chosen as extraction solvent.Polyvinylpolypyrrolidone(PVPP)was used to absorb impurities.The samples were extracted with petroleum ether and ethyl acetate.The extracts were purified with a reverse pHase Sep-Pak C18 column(250 mm×4.6 mm,5 μm particle size).The column temperature was 40℃.The flow rate was 1 mL/min.The injection volume was 10 μL.The mobile phase was 45%methanol(A)and 55%acetic acid(B,pH=3.5).The detection wavelength was 254 nm.【Result】ZT,GA3,IAA,abscisic acid analysis method of high performance liquid chromatography was established.The HPLC recovery of known concentrations of IAA,ABA,GA3,and ZT ranged between 80.4%and 91.2%.The relative standard deviations(RSDs)ranged between 1.54%and 8.1%.The experimental results were stable and reliable.【Conclusion】The HPLC method developed in this study is simple,rapid,reproducible,and accurate.Therefore,it is suitable for rapid and accurate quantification of ZT,GA3,IAA and ABA in pear fruit.
fragrant pear;HPLC;young fruit;endogenous hormone
LIU Huai-feng(1972-),Male,Henan Province,Professor,Doctor of agriculture,The research direction is the pHysiology of fruit tree cultivation,(E-mail)lhf_agr@shzu.edu.cn
S601.2
A
1001-4330(2017)05-0886-07
10.6048/j.issn.1001-4330.2017.05.012
2017-03-03
兵团科技计划南疆专项“库尔勒香梨优质高效生产关键技术研究与示范”(2013BA038)
张占畅(1993-),男,安徽人,硕士研究生,研究方向为果树栽培生理,(E-mail)1170258813@qq.com
刘怀锋(1972-),男,河南人,教授,博士,研究方向为果树栽培生理,(E-mail)lhf_agr@shzu.edu.cn
Supported by:Xinjiang Production and Construction Corps Science and Technology Plan(special research program in southern Xinjiang)"Key technology research and demonstration of quality and efficient production of Korlar fragrant pear"(2013BA038)
