隶属函数法评价不同加工番茄品种耐盐性
2017-07-19许立志庞胜群张国儒
许立志,庞胜群,刁 明,张国儒,李 琦,牛 宁
(石河子大学农学院园艺系/特色果蔬栽培生理与种资资源利用兵团重点实验室,新疆石河子832003)
隶属函数法评价不同加工番茄品种耐盐性
许立志,庞胜群,刁 明,张国儒,李 琦,牛 宁
(石河子大学农学院园艺系/特色果蔬栽培生理与种资资源利用兵团重点实验室,新疆石河子832003)
【目的】评价不同加工番茄品种的耐盐性,为生产上合理选用耐盐性较好的品种提供参考依据。【方法】以7个加工番茄品种,用100 mM NaCl盐溶液进行胁迫处理。测定盐胁迫后叶片的脯氨酸、丙二醛、可溶性糖、可溶性蛋白、SOD、POD、CAT酶活性等生理指标。【结果】各生理指标测定得出品种耐盐性各不相同,其中脯氨酸含量,可溶性糖含量以及抗氧化酶促系统中SOD酶活性,POD酶活性,CAT酶活性,可溶性蛋白含量与植物耐盐性呈正相关关系,丙二醛含量的积累与植物耐盐性呈负相关关系。最后使用隶属函数法评价7个品种的耐盐性。【结论】7个加工番茄耐盐性能力由强到弱依次为:农番3号、IVF6172、石红9号、屯河17号、IVF3155、PT501Q、JW001。
加工番茄;耐盐性;生理指标;隶属函数
0 引言
【研究意义】番茄(Solanum lycopersicum)是茄科番茄属一年生草本植物,属中度盐敏感的鲜食和加工型蔬菜作物,在高盐土壤上生育状况差。国内外对番茄的耐盐性进行了广泛的研究[1]。新疆地处N34~49°,凭借着优越的地理优势和产业政策,经过近30 a的发展已成为我国最主要的番茄生产和加工省区,加工番茄产业也成为新疆农业产业结构调整和经济发展的重要组成部分[2]。但新疆地处内陆干旱区,水资源缺乏,土壤水分蒸发较大,导致土壤盐渍化严重。盐渍环境下,加工番茄的生长抑制增强、发病率提高、生育状况明显变差,产量与质量严重下降[3]。【前人研究进展】魏国强等[4]研究表明盐胁迫导致丙二醛含量显著增加和积累,膜系统受到破坏,渗透能力增强,这与实验研究结果相类似。有研究认为可溶性糖、可溶性蛋白也是很多非盐生植物的主要渗透调节剂[5-6]。杨婷等[7]研究认为所有的逆境均能导致活性氧的产生从而引发氧化破坏,与此同时植物也拥有一些有效系统去清除活性氧,保护植物免受氧化破坏,其中保护酶系统是一个关键的防御机制。这些保护酶主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等。【本研究切入点】研究选取生产上小面积推广示范的7个加工番茄品种采用水培方法,从渗透调节系统以及抗氧化酶促系统的各项生理指标进行耐盐性评价。【拟解决的关键问题】植物对盐胁迫的反应与适应是一个复杂多变的生理过程,不同植物的反应机制也是不同的[8],从两个系统7个生理指标来评价加工番茄耐盐性,为加工番茄原料种植基地选用优良的品种提供参考。
1 材料与方法
1.1 材料
试验于2016年在石河子大学农学院试验站进行。
供试的7个加工番茄品种:IVF3155、IVF6172由中国农业科学院蔬菜花卉研究所育成;屯河17号由中粮屯河种业有限公司育成;农番3号、JW001由石河子大学农学院园艺系育成;石红9号由石河子蔬菜研究所育成;PT501Q由厦门市华泰五谷种苗有限公司育成。
1.2 方法
1.2.1 盐胁迫处理
2016年4月采用草炭∶蛭石为2∶1的基质进行穴盘育苗,2016年5月待幼苗长至两叶一心时,移栽于水培槽中进行水培,水培槽长度为300 cm,直径为120 cm,每个水培槽定量水的体积为60 L,水培株距为25 cm,每个水培槽定植21株,一个水培槽为一个试验小区,每品种均重复3次。采用Hoagland营养液栽培,待幼苗长至四叶一心以60 L水的体积加盐,水培槽前端有放水装置,为避免重新加水导致营养液浓度发生变化,将水培槽中含有营养液的水放出至事先准备好的水桶中,将计算好的60 L中应加入NaCl的质量先溶于水桶中,再将盐溶液加至水培槽中,使溶液盐浓度达到100 mmol/L,对幼苗进行盐胁迫处理[9-10]。由于加工番茄属于中度盐敏感性植物,北疆土壤以氯化物-硫酸盐、硫酸盐为主,南疆土壤以硫酸盐-氯化物、氯化物盐为主,由北疆到南疆,北疆由东到西,南疆由西到东,积盐程度和强度增加,土壤含盐量增高[11]。试验中,经过试验预处理得出此7类加工番茄半致死盐浓度为180 mM左右,较低盐浓度不能说明植物耐盐性,因此选用100 mM的盐浓度进行加工番茄盐胁迫。记加盐处理的当天为第1 d,处理后的第6 d进行采样,每个品种采取生长较正常的幼嫩叶片,经液氮处理,保存于-70℃冰箱内,作为研究材料待测,每个品种均为3次重复。
1.2.2 生理指标测定
每包样品为0.3 g,使用酸性茚三酮法测定游离脯氨酸含量,硫酸蒽酮法测定可溶性糖,硫代巴比妥酸法测定丙二醛,磷酸缓冲液冰浴下研磨成匀浆后,进行高速低温离心,取上清液使用考马斯亮蓝法测定可溶性蛋白。氮蓝四唑法测定SOD酶活性。愈创木酚法测定POD酶活性,以1 min内ΔA470变化0.01为1个酶活性单位(μ)。分光光度法测定CAT酶活性,以1 min内ΔA240变化0.01为1个酶活性单位(u)[12]。
1.3 数据处理
数据使用Excel进行整理,用SPSS19.0软件进行不同品种不同指标差异的显著性分析。使用模糊数学隶属函数法进行综合评价。
2 结果与分析
2.1 盐胁迫对不同加工番茄渗透调节系统影响
植物在盐胁迫下,自身会通过积累一些有机物质来降低渗透势,提高细胞液渗透压。脯氨酸为植物体内主要的渗透调节物质;丙二醛破坏膜脂系统,从而改变渗透调节机制,与植物耐盐性呈负相关;可溶性糖、可溶性蛋白质均也参与细胞内渗透调节,植物在逆境胁迫下,体内通过积累可溶性糖与可溶性蛋白来适应高盐环境[13]。
2.1.1 盐胁迫下不同加工番茄品种脯氨酸含量的变化
脯氨酸是一种游离态的氨基酸,是植物体内重要的代谢物质,所以脯氨酸含量的变化在很大程度上反应了植物体内氨基酸代谢的变化。研究表明,非盐胁迫条件下,PT501Q的脯氨酸含量在所有参试品种中最高,为75.75 μg/g,除与屯河17号差异不显著外,与其他品种均有显著差异。IVF3155脯氨酸含量最低为8.74 μg/g,与农番3号和石红9号差异不显著,与其他参试品种均有显著差异。而IVF6172的脯氨酸含量与农番3号、石红9号和JW001品种差异不显著。表1
而盐胁迫下不同加工番茄品种的脯氨酸含量均呈上升趋势。IVF3155、IVF6172、屯河17号、农番3号的脯氨酸含量显著高于石红9号、PT501Q、JW001。石红9号显著高于PT501Q、JW001。从变化趋势上看,非盐胁迫下脯氨酸含量高的品种在盐胁迫后脯氨酸增加量少,脯氨酸含量低的品种脯氨酸增加量大。如品种IVF3155,盐胁迫处理后,在所有参试品种中脯氨酸含量由非胁迫下的最低增加到最高值,达到568.49 ug/g,增加了65.04倍;非盐胁迫下脯氨酸含量最高的PT501Q,在盐胁迫后脯氨酸含量仅高于JW001,为271.18 μg/g,与对照相比只增加了3.57倍,在所有参试品种中,增幅最小。增加幅度较大的还有石红9号和石红3号,分别比对照增加了30.49和17.18倍,说明这些品种在正常条件下,只需要较少量的脯氨酸即可以维持细胞的渗透平衡,当受到盐胁迫后,能迅速积累脯氨酸来降低渗透势,提高细胞液渗透压,以抵御逆境胁迫。表1

表1 盐胁迫下加工番茄幼苗脯氨酸含量变化Table1 Effect of NaCl stress on content of processing tomato plant proline(ug/g)
2.1.2 盐胁迫下不同加工番茄品种丙二醛含量的变化
丙二醛含量的增加,使得植物体内自由基含量增加,导致膜脂过氧化,渗透系统受破坏。研究表明,PT501Q品种丙二醛含量在所有参试品种中最高为4.94 nmol/g,与IVF6172、屯河17号品种间存在显著差异,但与其他几个参试品种差异不显著。屯河17号最低为1.10 nmol/g,除与PT501Q品种间差异显著外,与其他几个参试品种差异不显著。说明参试品种在正常条件下,丙二醛含量基本处于同一水平。
而盐胁迫显著增加了不同加工番茄品种的丙二醛含量。品种PT501Q显著高于其他品种,其中农番3号丙二醛含量又显著高于JW001、石红9号两个品种。从增加幅度上看,非盐胁迫下丙二醛含量低的品种在盐胁迫后丙二醛增加量大,丙二醛含量高的品种丙二醛增加量小。如品种屯河17号在受盐胁迫后丙二醛增加量最大,增加了6.39倍。其次是IVF6172品种,增加量是对照的5.36倍,说明这2个品种在盐胁迫下丙二醛易积累,使得植物体内自由基含量增加,导致膜的不稳定;非盐胁迫下丙二醛含量较高的品种JW001,在盐胁迫后,丙二醛含量为参试品种中最低,仅为5.81 mmol/L,相比于对照只增加了1.82倍。增加幅度较小的还有PT501Q和农番3号,分别比对照增加了1.98和2.11倍。说明这2个品种在盐胁迫下丙二醛积累较慢,丙二醛含量增加量较小,有利于保持膜的稳定性,抵御逆境胁迫的能力就越强。表2

表2 盐胁迫下加工番茄幼苗丙二醛变化Table2 Effect of NaCl stress on content of processing tomato plant MDA(nmol/g)
2.1.3 盐胁迫下不同加工番茄品种可溶性糖含量的变化
可溶性糖是合成有机物的碳架和能量,对细胞膜和原生质胶体也有稳定作用,还可在细胞内无机离子含量高时起保护酶类的作用,研究表明,可溶性糖含量与耐盐性呈正相关。
研究表明,非盐胁迫条件下,品种JW001可溶性糖含量最高,为0.40%。除与石红9号差异不显著外,与其他参试品种均差异显著。农番3号品种可溶性糖含量最低,为0.19%,与JW001、石红9号存在显著差异,与其他品种差异不显著。
而盐胁迫显著增加了不同加工番茄品种的可溶性糖含量。品种JW001可溶性糖含量显著高于IVF3155、屯河17号和农番3号,但与IVF6172、石红9号和PT501Q差异不显著。从变化趋势上看,正常条件下可溶性糖含量低的品种,在受到盐胁迫后,可溶性糖含量增加量大,如IVF6172盐胁迫处理后,可溶性糖含量增加量最大,增加了1.74倍;而正常条件下可溶性糖含量较高的品种石红9号,在盐胁迫后仅增加了1.14倍,增幅最小。说明这些品种在受到逆境胁迫时,增加可溶性糖的含量来稳定细胞膜和原生质胶体,保持渗透压,抵御逆境胁迫。表3
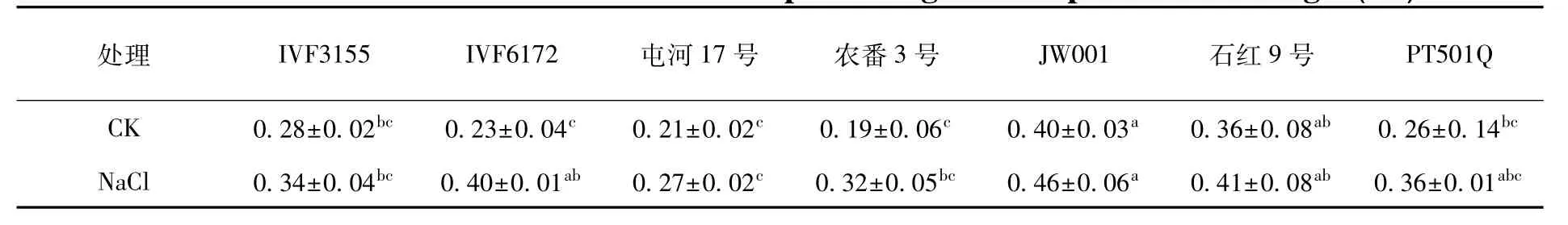
表3 盐胁迫下加工番茄幼苗可溶性糖变化Table3 Effect of NaCl stress on content of processing tomato plant soluble sugar(%)
2.1.4 盐胁迫下不同加工番茄品种可溶性蛋白含量的变化
细胞膜是植物抵御逆境胁迫的第一道防线,而蛋白质又是细胞膜重要组成成分之一,可溶性蛋白对于细胞膜具有运输物质和稳定渗透压的作用。有研究表明,可溶性蛋白的含量与植物耐盐性呈正相关关系。研究表明,IVF3155可溶性蛋白含量最高,为1.92 mg/g,IVF6172可溶性蛋白含量最低,为1.20 mg/g,IVF3155与IVF6172品种间存在显著差异,与其他品种差异不显著。说明在正常条件下不同品种间可溶性蛋白含量差异不大。
而盐处理显著升高了不同品种的加工番茄可溶性蛋白含量。屯河17号、JW001和石红9号品种的可溶性蛋白含量显著高于IVF6172、农番3号和PT501Q。
其中,JW001品种可溶性蛋白增加量最大,增加了2.19倍。而农番3号品种可溶性蛋白增加量最小,只增加了1.12倍。说明植物在受到逆境胁迫时,植物体内会积累大量的无机和有机物质来进行渗透调节,维持细胞膜的稳定,以及为合成酶类提供能量来抵御逆境胁迫。表4
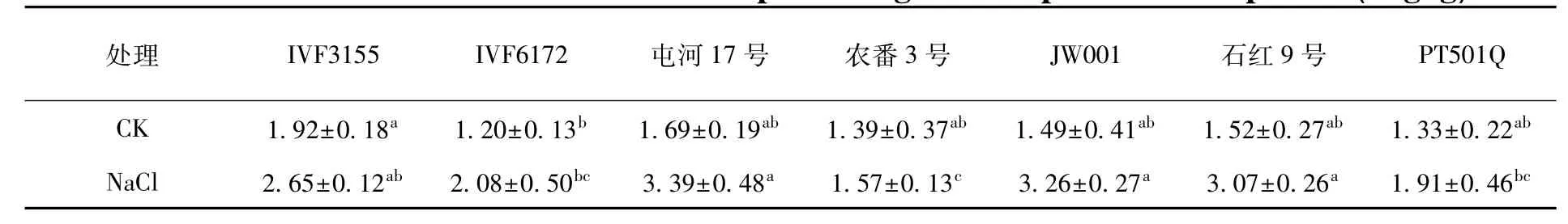
表4 盐胁迫下加工番茄幼苗可溶性蛋白变化Table4 Effect of NaCl stress on content of processing tomato plant soluble protein(mg/g)
2.2 盐胁迫对不同加工番茄抗氧化酶促系统的影响
植物在处于正常生长条件下时,体内活性氧的形成和清除处于一种动态平衡状态,但当植物遭受到逆境胁迫(如盐胁迫)时,这种动态平衡将被破坏,活性氧水平超出机体防御机制范围,产生自由基积累,发生氧化胁迫,造成氧化损伤,引起膜脂过氧化,蛋白质氧化,酶失活及核酸损伤,并激发细胞程序性死亡。活性氧清除系统主要包含酶促及非酶促两大防御体系。酶促系统主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等。
2.2.1 盐胁迫下不同加工番茄品种超氧化物歧化酶(SOD)活性的变化
植物受外界环境胁迫时,SOD能发生歧化反应特异清除超氧阴离子(·),生成过氧化氢和氧气。进而解除对植物细胞的毒害作用。研究表明,在正常生长情况下,IVF6172品种SOD酶活性最高,为242.43 μ/g,与IVF3155、屯河17号、JW001和PT501Q品种间差异不显著,而与农番3号和石红9号存在显著差异,且石红9号SOD酶活性最低,为211.00 μ/g经盐胁迫处理后,显著增加不同加工番茄品种的SOD酶活性。IVF3155、IVF6172、JW001、 PT501Q品种的酶活性显著高于屯河17号、农番3号、石红9号。从变化趋势上看,正常条件下SOD酶活性较高的品种在受到盐胁迫后SOD酶活性增加量有最大,也有增长量最小的。如正常条件下酶活性较高的PT501Q在受到盐胁迫后,SOD酶活性增长量也是最大的,增加了30.47%,而正常条件下酶活性也较高的屯河17号在受到盐胁迫后,SOD酶活性反而增加量最小,只增加了11.79%。说明正常条件下,相同类型加工番茄品种在盐胁迫情况下,SOD酶活性所做出的响应也可能不相同。表5

表5 盐胁迫下加工番茄幼苗超氧化物歧化酶活性变化Table5 Effect of NaCl stress on content of processing tomato plant SOD(μ/g)
2.2.2 盐胁迫下不同加工番茄品种过氧化物酶(POD)活性的变化
植物在受到逆境胁迫时,植物体内积累POD酶清除歧化作用中产生的H2O2,可以催化H2O2氧化生成H2O,由此可以降低胞内不饱和脂肪酸的氧化过程,保持细胞膜的稳定性及完整性,很大程度上提升了植物的耐盐性,因此POD酶活性与植物耐盐性呈正相关关系。
研究表明,在正常生长情况下,品种IVF6172中POD酶活性最高,为424.67 μ/g,显著高于其他品种且存在显著差异,其中IVF3155、屯河17号和JW001品种有显著高于农番3号、石红9号和PT501Q。农番3号品种中POD酶活性最低,为181.50 μ/g,与石红9号和PT501Q品种间差异不显著,但与IVF3155、IVF6172、屯河17号和JW001品种间存在显著差异。
而受到胁迫后显著增加了POD酶活性。IVF3155、IVF6172、屯河17号和农番3号品种的POD酶活性显著高于JW001、石红9号和PT501Q。从变化趋势上看,正常条件下POD酶活性低的品种受胁迫后POD酶活性增加量大,反而POD酶活性较高的品种受盐胁迫后增加量小。如农番3号,盐胁迫处理后,POD酶活性增加量最大,增加了321.49%;而JW001在正常条件下POD酶活性较高,盐胁迫处理后,POD酶活性增加量最小,只增加了10.34%。说明正常条件下POD酶活性较高类型的加工番茄品种对盐胁迫表现不敏感,而POD酶活性较低类型的加工番茄品种对盐胁迫表现较敏感。表6

表6 盐胁迫下加工番茄幼苗过氧化物酶活性变化Table6 Effect of NaCl stress on content of processing tomato plant POD(μ/g)
2.2.3 盐胁迫下不同加工番茄品种过氧化氢酶(CAT)活性的变化
植物受到逆境胁迫时,CAT酶的积累虽然不能直接参与H2O2的分解,但它能通过酶分子中的血红素铁和H2O2反应生成铁过氧化物活性体,然后再将H2O2氧化生成H2O和O2,从而抵御逆境胁迫。
研究表明,在非盐胁迫条件下,JW001品种中CAT酶活性最高,为165.83 μ/g,除与IVF3155品种间差异不显著外,与其他品种存在显著差异。而屯河17号中CAT酶活性最低,为51.33 μ/g,与农番3号和PT501Q品种间差异不显著,但与其他品种存在显著差异。
受到盐胁迫后,显著增加不同加工番茄品种的CAT酶活性。农番3号的CAT酶活性显著高于其他品种,从变化趋势上看,正常条件下CAT酶活性较高的品种在受到盐胁迫后,增加量最小。反之,正常条件下酶活性最低的品种增加量最大。如农番3号在盐胁迫处理后,CAT酶活性由次低增加到最高,增加了466.23%,而酶活性最高的JW001只增加了6.74%。说明正常条件下,CAT酶活性较高类型的加工番茄品种对盐胁迫表现出不敏感,反而CAT酶活性较低类型的加工番茄品种对盐胁迫表现出较敏感。表7

表7 盐胁迫下加工番茄幼苗过氧化氢酶活性变化Table7 Effect of NaCl stress on content of processing tomato plant CAT(μ/g)
2.3 不同加工番茄品种耐盐性的综合评价
隶属函数值计算方法:若测定指标与抗逆性呈正相关,则Xμ=(Xi-Xmin)/(Xmax-Xmin);若测定指标与抗逆性呈负相关,则采用反隶属函数值,计算公式为Xμ=1-[(Xi-Xmin)/(Xmax-Xmin)]。式中Xμ表示所测指标的隶属函数值,Xi表示某供试品种盐胁迫处理后某一指标的增加量,Xmax、Xmin分别表示所有供试品种测定指标增加量的最大值与最小值。研究中,各品种的隶属函数值累计越大,则耐盐性越强。
植物耐盐性的强弱受到多方面因素的影响,同种植物不同品种的耐盐性也各不相同,不能从单个指标评价植物的耐盐性,应对多个指标进行综合评价,尤其番茄的耐盐机制是一个极其复杂的生理生化响应过程,影响番茄耐盐特性的因素有很多,仅从单一的抗性指标来评价番茄苗期的耐盐性具有片面性,因此在评价番茄耐盐性时需要对多个指标进行综合考量[14]。通过隶属函数法综合分析可知,不同品种的不同生理指标对耐盐性的影响也是不同的,综合评价值越大,表明该材料的耐盐性越强。农番3号品种的综合评价值最大(4.06),接下来依次为:IVF6172(3.99),石红9号(3.63),屯河17号(3.33),IVF3155 (3.29),PT501Q(3.06),JW001(2.99)。因此,这7个加工番茄品种耐盐性强弱依次为:农番3号、IVF6172、石红9号、屯河17号、IVF3155、PT501Q、JW001。表8

表8 加工番茄耐盐性的综合评价Table8 Comprehensive appraisal of different NaCl concentration of processing tomato varieties
3 讨论
植物的抗逆性是一个多因素影响的复杂数量性状,且不同品种的抗逆机制也不同,从而使得在逆境条件下的不同品种的某种指标反应也不尽相同[15]。在实际生产中,加工番茄主要是以移栽的方式进行培育,从育苗苗床移栽到露地中,幼苗的成活率是主要问题。尤其在新疆,土地盐渍化情况日益严重,加工番茄幼苗的耐盐性是反应不同品种耐盐性强弱的重要时期。在试验中,筛选7个供试品种盐胁迫浓度,选择盐度适中的100 mM NaCl进行胁迫。
植物受到逆境胁迫时,第一道防线为渗透调节系统。首先,盐胁迫会导致植物体内自由基的产生与清除之间的平衡被打破,自由基含量增加,他们可直接攻击膜系统中不饱和脂肪酸,导致膜脂过氧化,并产生MDA,MDA又可与细胞膜上的蛋白质,酶交连而使之变性失活,膜脂过氧化的直接后果是细胞膜系统中不饱和脂肪酸含量的下降,膜结构破坏引起膜透性的增大以及一系列生理生化功能的改变[4]。试验中,盐胁迫导致丙二醛含量显著增加和积累,膜系统受到破坏,渗透能力增强。其中,屯河17号品种MDA含量最大,为7.03 nmol/g,相比于对照增加了6.39倍。植物幼苗受到环境胁迫导致丙二醛积累,含量增加,这与王龙强的研究结果相类似。其次,可溶性糖、可溶性蛋白也是很多非盐生植物的主要渗透调节剂[5-6]。同时,可溶性糖、可溶性蛋白也是合成有机物的碳架和能量来源[16],对细胞膜和原生质胶体也有稳定作用,还可在细胞内无机离子含量高时起保护酶类的作用。可溶性糖积累造成反馈抑制,即盐胁迫下植物生长受到抑制,糖利用减少,植物叶片内可溶性糖浓度增加,从而反馈性地抑制光合作用[17]。其中,IVF6172品种受盐胁迫影响可溶性糖含量增加量最大,为0.40%,增加了1.74倍。而受胁迫后可溶性蛋白含量增加量最大的为JW001品种,为3.26 mg/g,增加了2.19倍。因此,试验研究表明加工番茄植株幼苗受盐胁迫后,使可溶性糖、可溶性蛋白含量显著增加,这与王宝山研究结果相类似。最后,渗透调解机制中最关键的调节物质为脯氨酸,脯氨酸是植物体内主要的有机调节物质之一,在盐胁迫条件下,不但可以视为羟基的清除剂和大分子的保护剂,还可以当作由胁迫恢复到正常过程中的有效氮源、碳源和还原剂[18]。试验研究结果得出,IVF3155品种受盐胁迫后脯氨酸含量最大,为568.49 μg/g,相比于对照增加了65.04倍,有研究认为,脯氨酸的积累与植物的耐盐性呈正相关,是植物抵御盐害而采取的一种生理保护性应激措施。这与试验中脯氨酸含量的变化相一致。
盐胁迫的第二道防线为抗氧化酶促系统,SOD是一种植物体内普遍存在的,且对植物体极为重要的金属抗氧化酶,它可以特异清除O2
-·,生成过氧化氢和氧气。SOD主要包括Cu/Zn SOD、Mn-SOD和Fe-SOD,研究发现,烟草幼叶中Cu/Zn-SOD含量较多,而老叶中以Mn-SOD和Fe-SOD为主[19],说明叶片中SOD同工酶的存在形式受植株的发育阶段调控。POD是植物体内适应性较高的酶,是植物体内担负清除H2O2的主要酶之一,可以催化H2O2氧化生成H2O,由此可以降低胞内不饱和脂肪酸的氧化过程,保持细胞膜的稳定性及完整性,很大程度上提升了植物的耐盐性。有研究者认为,POD的功能具有双重性,既可以在逆境初期起保护效应,清除叶片中产生的H2O2,但在逆境后期具有伤害效应,可以生成活性氧,降解叶绿素,引起膜脂过氧化[20]。CAT主要存在于植物细胞的过氧化物体中,CAT不能直接参与H2O2的分解,它是通过酶分子中的血红素铁和H2O2反应生成铁过氧化物活性体,然后再将H2O2氧化生成H2O和O2[21]。研究表明,盐芥在50、100 mmol/L NaCl胁迫下,SOD活性显著增大,O2-·的含量下降,同时POD、CAT活性增强,说明SOD、POD、CAT三者协调统一,共同完成了植物体内活性氧的清除[22]。试验中加工番茄幼苗SOD酶活性、POD酶活性、CAT酶活性在受到盐胁迫后,改变了清除活性氧的机制,使酶活性呈上升趋势,其中PT501Q品种受盐胁迫后SOD酶活性增加量最大,为302.80 μ/g,相比于对照增加了30.47%。而农番3号受盐胁迫处理后POD、CAT酶活性增加量最大,分别为765.00 μ/g、323.17 μ/g,相比于对照分别增加了321.49%和466.23%,这与杨婷研究番茄盐胁迫下生理生化结果相一致[7]。最后,对7个供试品种的7项生理指标进行隶属函数综合分析,得出耐盐性强弱排序。
4 结论
7个加工番茄品种在盐胁迫下,不同生理指标所反应的耐盐性也不相同。在受到盐胁迫情况下,渗透调节系统中脯氨酸含量,可溶性糖含量以及抗氧化酶促系统中SOD酶活性,POD酶活性,CAT酶活性,可溶性蛋白含量与植物耐盐性呈正相关关系,且相对于对照呈显著增加趋势。而渗透调节系统中丙二醛的积累会导致自由基增加,膜脂过氧化,与植物耐盐性呈负相关关系,丙二醛积累量越大,品种耐盐性越差。根据隶属函数综合评价,7个加工番茄品种耐盐性由强到弱依次为:农番3号、IVF6172、石红9号、屯河17号、IVF3155、PT501Q、JW001。
References)
[1]徐鹤林,李景富.中国番茄[M].北京:中国农业出版社,2007:2-3.
XU He-ling,LI Jing-fu.(2007).China Tomato[M].Beijing: China Agriculture Press:2-3.(in Chinese)
[2]张源颖.新疆加工番茄产业发展面临的问题及对策[J].新疆农垦经济,2011,(11):46-49.
ZHANG Yuan-ying.(2011).The Problems and Countermeasures of Processing Tomato Industry in Xinjiang[J].Xinjiang State Farms Economy,(11):46-49.(in Chinese)
[3]齐士发,石书兵,俞钧山.新疆加工番茄产业现状及障碍因子对策[J].新疆农业科技,2007,(1):41.
QI Shi-fa,SHI Shu-bing,YU Jun-shan.(2007).Status and Obstacle Factors of Processing Tomato Industry in Xinjiang[J].Xinjiang Agricultural Science and Technology,(1):41.(in Chinese)
[4]魏国强,朱祝军.NaCl胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响[J].中国农业科学,2004,37 (11):1 754-1 759.
WEI Guo-qiang,ZHU Zhu-jun.(2004).The Effects of NaCl Stress on Plant Growth,Chlorophyll Fluorescence Characteristics and Active Oxygen Metabolism in Seedlings of Two Cucumber Cultivars[J].Scientia Agricultura Sinica,37(11):1,754-1,759.(in Chinese)
[5]翟凤林.植物的耐盐性及其改良[M].北京:农业出版社,1989: 35-37.
ZHAI Feng-lin.(1989).Salt Tolerance of Plant and Its Improvement[M].Beijing:China Agriculture Press:35-37.(in Chinese)
[6]赵可夫.植物抗性生理[M].北京:中国科学技术出版社,1989: 86-88.
ZHAO Ke-fu.(1989).Plant resistance physiology[M].Beijing: Science and Technology of China press:86-88.(in Chinese)
[7]杨婷.番茄盐胁迫下的生理生化特性及耐盐相关基因的分离[D].武汉:华中农业大学硕士毕业论文,2006.
YANG Ting.(2006).Physiological and Biochemical Characteristics of Tomato under Salt Stress and Isolation of Salt-Resistant Genes[D].Master Dissertation.Huazhong Agricultural University,Wuhan.(in Chinese)
[8]陈玉姬,王伟,李烨,等.加工番茄幼苗品种间的耐盐性比较研究[J].新疆农业大学学报,2012,35(6):457-462.
CHEN Yu-ji,WANG Wei,LI Ye,et al.(2012).Research on Comparison of Resistance to Salt of Different Processing Tomato Varieties Seedling[J].Journal of Xinjiang Agricultural Universi-ty,35(6):457-462.(in Chinese)
[9]张纪涛,徐猛,韩坤,等.盐胁迫对番茄幼苗的营养及生理效应[J].西北农业学报,2011,20(2):128-133.
ZHANG Ji-tao,XU Meng,HAN Kun,et al.(2011).Effect of Sale Stress on Plant Nutrition and Physiology of Tomato Seedings[J].Acta Agriculturae Boreali-Occidentalis Sinica,20(2):128-133.(in Chinese)
[10]王松,莘冰茹,周艳,等.外源NO对NaCl胁迫下番茄幼苗生长及光合特性的影响[J].石河子大学学报(自然科学版),2016,34(3):321-327.
WANG Song,XIN Bing-ru,ZHOU Yan,et al.(2016).Effect of exogenous nitric oxide on growth and photosynthetic characteristics in tomato seedlings under NaCI stress[J].Journal of Shihezi University(Natural Science),34(3):321-327.(in Chinese)
[11]刘蕾.新疆土壤盐分的组成和分布特征[J].干旱环境检测,2009,23(4):227-229.
LIU Lei.(2009).Constitute and Distributing Character of Salinity in Soil in Xinjiang[J].Arid Environmental Monitoring,23(4): 227-229.(in Chinese)
[12]贾庆虎,孟凡珍,宁峰,等.低温弱光对不同形态黄瓜幼苗生理生化特性的影响[J].长江蔬菜,2009,(18):47-50.
JIA Qing-hu,MENG Fan-zhen,NING Feng,et al.(2009).Effects of Low Temperature and Poor Light on Physiological and Biochemical Characteristic in Cucumber Seedlings of Different E-cotypes[J].Journal of Changjiang Vegetables,(18):47-50.(in Chinese)
[13]杨升,张华新,张丽.植物耐盐生理生化指标及耐盐植物筛选综述[J].西北林学院学报,2010,25(3):59-65.
YANG Sheng,ZHANG Hua-xin,ZHANG Li.(2010).Physiological and Biochemical Indices of Salt Tolerance and Scanning of Salt-tolerance Plants:A Review[J].Journal of Northwest Forestry University,25(3):59-65.(in Chinese)
[14]彭玉梅,石国亮,崔辉梅.加工番茄幼苗期耐盐生理指标筛选及耐盐性综合评价[J].干旱地区农业研究,2014,32(5):61-66.
PENG Yu-mei,SHI Guo-liang,CUI Hui-mei.(2014).Salt tolerance evaluation of processing tomato lines based on physiological traits at seedling stages[J].Agricultural Research in the Arid Areas,32(5):61-66.(in Chinese)
[15]周广生,梅方竹,周竹青,等.不同小麦品种(系)耐湿性的综合评价[J].生物数学学报,2003,18(1):98-104.
ZHOU Guang-sheng,MEI Fang-zhu,ZHOU Zhu-qing,et al.(2003).Comprehensive Evaluation on Waterlogging Resistance of Different Wheat Varieties[J].Journal of Biomathematics,18 (1):98-104.(in Chinese)
[16]霍仕平,晏庆九.玉米抗旱鉴定的形态和生理生化指标研究进展[J].干旱地区农业研究,1995,(9):67-73.
HUO Shi-ping,YAN Qing-jiu.(1995).Progress in Morphological and Physiological and Biochemical Indexes of Drought Resistance Identification of Maize[J].Agricultural Research in the arid areas,(9):67-73.(in Chinese)
[17]Ott,T.,Clarke,J.,Birks,K.,&Johnson,G.(1999).Regulation of the photosynthetic electron transport chain.Planta,209 (2):250-258.
[18]景欣,张旸,李玉花.植物耐盐研究进展[J].生物技术通讯,2010,21(2):290-294.
JING Xin,ZHANG Yang,LI Yu-hua.(2010).Plant Salt-Tolerance and Research Development[J].Letters in Biotechnology,21(2):290-294.(in Chinese)
[19]李合生.现代植物生理学[M].北京:高等教育出版社,2002: 415-419.LI He-sheng.(2002).Modern Plant Physiology[M].Beijing: Higher Education Press:415-419.(in Chinese)
[20]何晓玲.外源硒对NaCl胁迫下加工番茄幼苗光合碳同化的影响[D].石河子:石河子大学硕士论文,2015.
HE Xiao-ling.(2015).Effects of exogenous Se on expression of CO2assimilation in leaves of tomato seedlings under NaCI stress[D].Master Dissertation.Shihezi University,Shihezi.(in Chinese)
[21]全先庆,高文.盐生植物活性氧的酶促清除机制[J].安徽农业科学,2003,31(2):320-322.
QUAN Xian-qing,GAO Wen.(2003).No-enzymatic Mechanism of Scavenging Reactive Oxygen Species of Euhalophytes[J].Journal of Anhui Agricultural Sciences,31(2):320-322.(in Chinese)
[22]刘爱荣,赵可夫.盐胁迫下盐芥渗透调节物质的积累及其渗透调节作用[J].植物生理与分子生物学学报,2005,31(4): 389-395.
LIU Ai-rong,ZHAO Ke-fu.(2005).Osmotica Accumulation and Its Role in Osmotic Adjustment in Thellungiella halonhila Under Salt Stress[J].Journal of Plant Physiology and Molecular Biology,31(4):389-395.(in Chinese)
Comprehensive Evaluation of Salt Tolerance of Different Processing Tomato Cultivars by Membership Function Method
XU Li-zhi,PANG Sheng-qun,DIAO Ming,ZHANG Guo-ru,LI Qi,NIU Ning
(College of Agronomy,Shihezi Univevsity/Key Laboratory of Featured Fruits and Vegetables Cultivation Physiology and Germplasm Resources Utilization of Xinjiang Production and Construction Corps,Shihezi Xinjiang 832003,China)
【Objective】The aim of this study is to evaluate the salt tolerance of different processed tomato varieties in order to provide reference for the rational selection of varieties with good salt tolerance.【Method】Seven tomato cultivars were used as materials to determine such physiological indicators as proline content,malondialdehyde,soluble sugar content,soluble protein content,SOD,POD,CAT activity of them under the stress of NaCl concentration of 100 mmol/L which were widely planted in Xinjiang.【Result】The activities of SOD,POD,CAT and soluble protein in proline,soluble sugar and antioxidant enzyme system were positively correlated with the salt tolerance of plants and the accumulation of malondialdehyde tolerance of plants was negatively related with to salt stress.And finally,the salt tolerance of 7 varieties was evaluated by the method of membership function.【Conclusion】The salt resistance ability of seven processing tomato cultivars from strong to weak is:Nongfan 3>IVF6172>Shihong 9>Tunhe17>IVF3155>PT501Q>JW001.
processing tomato;salt tolerance;physiological indicators;membership function
Pang sheng-qun,Han nationality,An Hui,Associate Professor,Master tutor,Work on Vegetable breeding.(E-mail)pangshqok@shz.edu.cn
S641.2
A
1001-4330(2017)05-0833-10
10.6048/j.issn.1001-4330.2017.05.006
2017-03-17
国家星火计划重点项目“加工番茄高效生产关键技术集成与示范”(2015GA891008);新疆生产建设兵团科技局支疆计划项目(2014 AB 004)
许立志(1992-),男,新疆奎屯人,硕士研究生,研究方向为蔬菜遗传育种,(E-mail)1066810392@qq.com
庞胜群(1970-),女,安徽人,副教授,硕士生导师,研究方向为蔬菜遗传育种,(E-mail)pangshqok@sh2.edu.cn
Supported by:Key Projects of National Spark Porgram"Key Technology Integration and Demonstration of Efficient Production of Processing Tomato"(2015GA891008)and Xinjiang Production and Construction Corps Science and Technology Bureau R&D Program(2014AB004)
