RP-HPLC-DAD法测定茶叶籽油酚类化合物
2017-07-19曾秋梅梁杏秋王晓琴
曾秋梅 梁杏秋 王晓琴 卢 鹤
(华侨大学化工学院;华侨大学油脂及天然产物研究所,厦门 361021)
RP-HPLC-DAD法测定茶叶籽油酚类化合物
曾秋梅 梁杏秋 王晓琴 卢 鹤
(华侨大学化工学院;华侨大学油脂及天然产物研究所,厦门 361021)
建立同时分离、检测茶叶籽油中酚类化合物组分和含量的高效液相色谱法。比较了流动相组成的影响,选择合适的乙酸加入量,建立最优梯度洗脱条件。结果表明,14种酚类物质在该条件下能够得到较好的分离,各物质的线性相关系数均在0.99以上。运用该方法从茶叶籽油中共检测到13种酚类化合物,包括5种酚酸、3种黄酮类和5种儿茶素类,含量分别为46.8、21.72、40.16 μg/g;其酚酸类主要为肉桂酸和咖啡酸,黄酮类主要为山奈酚、槲皮素和芦丁,儿茶素类主要为儿茶素。该方法准确、可靠,适用于茶叶籽油中酚类化合物分析。
茶叶籽油 酚类化合物 高效液相色谱法
茶叶籽油,是从山茶科山茶属茶树(CamelliasinensisO.Ktze)种子中获得的一种新资源食品,其不饱脂肪酸质量分数高达85%以上[1],却具有较高的氧化稳定性[2],茶叶籽油的抗氧化作用机理引起了研究人员的关注。刘雳等[3]通过萃取茶叶籽油中酚类物质,发现随着多酚物质的减少,油脂氧化稳定性相应降低;而在精炼茶叶籽油中按不同溶度添加萃取物,发现极性酚类物质的添加量与油脂氧化稳定性存在量效关系。Wang等[4]萃取28种茶叶籽油甲醇提取物,测定其自由基清除(DPPH)能力为91.0~2 164.5 μmolTE/100 g,抗氧化能力指数(ORAC)为251.0~1 209.5 μmolTE/100 g,证明茶叶籽油极性提取物具有强抗氧化能力。
然而,茶叶籽油分析报道目前主要集中于脂肪酸及甾醇等非极性物质的组成[5],对酚类化合物鉴定分析报道极为有限。Fazel等[6]采用高效液相色谱技术对伊朗茶叶籽油进行分析,其中检测到没食子儿茶素、儿茶素、表没食子儿茶素、表没食子儿茶素没食子酸酯、表儿茶素、没食子儿茶素没食子酸酯、表儿茶素没食子酸酯和儿茶素没食子酸酯8种儿茶素类酚类化合物。可见,茶叶籽油因与茶叶同源,含有独特的脂溶性茶多酚,具有重要的开发价值。茶多酚对人体具有特殊的生理功能,能通过抑制氧化酶系和激活抗氧化酶系来调节生物体内自由基的平衡;同时茶多酚也能主动清除无机和脂质自由基,络合诱导氧化的金属离子,起到抗氧化作用[7-8]。然而,我国茶区茶叶籽油酚类化合物资料极为有限,研究报道主要还集中在总酚含量测定[9],对其组分的研究鲜见报道。
本试验参考不同植物油中酚类物质的研究方法[10-11],采用反相高效液相色谱法-二极管(RP-HPLC-DAD)技术结合14种标准品化合物对茶叶籽油酚类化合物进行定性定量分析,探索我国茶叶籽油酚类化合物组成,为其鉴伪及深度开发提供参考。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
茶叶籽原料采自陕西省茶园。采摘后置于室温通风处自然风干,脱壳、压榨(冷榨法)沉淀得到茶叶籽毛油。
没食子酸、羟基酪醇、4-羟基苯乙酸、咖啡酸、苯甲酸、肉桂酸、芦丁:阿拉丁试剂公司;儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯甲醇(色谱纯),乙腈(色谱纯):美国Sigma公司。正己烷(分析纯)、甲醇(分析纯)、乙酸(色谱纯):国药集团化学试剂有限公司;试验用水为自制超纯水。
1.1.2 仪器与设备
岛津LC-20型高效液相色谱仪、WondaSil反相C18分析型色谱柱(250 mm×4.6 mm,5 μm):日本岛津公司; TGL-16M台式高速冷冻离心机:湖南湘仪离心机仪器有限公司;RE52CS旋转蒸发仪:上海亚荣生化仪器厂;Simplicity型超纯水系统:德国默克密理博公司。
1.2 试验方法
1.2.1 标准溶液配制
称取羟基酪醇对照品10 mg、咖啡酸对照品20 mg、表没食子儿茶素没食子酸酯 6 mg、芦丁3 mg,分别用10 mL色谱纯甲醇溶解并定容;称取没食子酸、4-羟基苯乙酸、肉桂酸、苯甲酸、儿茶素对照品各50 mg,分别用10 mL色谱纯甲醇溶解并定容;称取表没食子儿茶素、表儿茶素、表儿茶素没食子酸酯、槲皮素、山奈酚各5 mg,用10 mL色谱纯甲醇溶解并定容;分别移取1.0 mL上述单酚标准溶液,用甲醇定容至50 mL,得多酚混合标品储备液,各标准品储备液置于-20 ℃下冷藏备用。用0.45 μm微孔滤膜过滤,用于色谱定性和定量分析。
1.2.2 样品前处理
参考橄榄油[12-13]和山茶油[3,14-15]的处理方法,并通过不断摸索和优化最终确定茶叶籽油酚类化合物前处理方法。称取茶叶籽油50 g,加入50 mL甲醇溶液振荡萃取,静置分层后,将甲醇层分离出来,提取重复4次,收集甲醇提取液,分别用50 mL正己烷洗涤3次,以除去脂溶性物质;弃去正己烷萃取层,将收集到的甲醇粗提液于35 ℃下真空旋蒸除去溶剂,再用甲醇溶液(色谱纯)洗涤溶解残液,分别定容至5 mL。预试验结果显示茶叶籽油中4-羟基苯乙酸、表没食子儿茶素、表儿茶素、表儿茶素没食子酸酯4个组分含量较低,故除上述操作之外,在对这4种组分进行定量时,样品最终定容至500 μL。每个样品重复3次。所有样品过0.45 μm滤膜,置于-20 ℃下待测。
1.2.3 色谱条件
色谱柱:WondaSil反相C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-乙酸(5∶5∶0.1)(A),0.2%乙酸水溶液(B),总流速1.0 mL/min,柱温35 ℃,紫外检测波长280 nm,进样体积10 μL。采用多级线性梯度洗脱程序,0.01~5 min,90%(B);5.01~10 min,90%~80%(B);10.01~20 min,80%~75%(B);20.01~35 min,75%~0(B);35.01 min~40 min,0%(B);40.01~45 min,0~90%(B)。每次进样前平衡10 min。
1.2.4 线性关系考察
将配制好的混合对照品溶液,按1.2.3色谱条件进样分析。每个样重复进样3次,以对照品的质量浓度X(mg/L)对峰面积Y进行线性回归分析。
1.2.5 色谱峰定性、定量
在相同色谱条件下,首先将14种单体酚分别进样,确定各单体酚的保留时间和出峰顺序;再对不同浓度的混合标准品溶液进行测试,以峰面积Y为纵坐标,质量浓度X为横坐标,计算得到14个标准曲线回归方程。将茶叶籽油提取物按照同样色谱条件进行测试,得到未知组分色谱图。将已知纯物质和未知物峰的保留时间进行比较,初步定性鉴定出未知物;然后向油多酚提取样品中分别加入这14种单体酚进行测试,将得到的色谱图与原未知组分色谱图进行比较,根据峰高是否增加来验证各个组分,完成茶叶籽油提取物中酚类化合物的定性。根据1.2.4中14种标准品的线性回归方程计算茶叶籽油提取物中鉴定出的酚类化合物含量。
2 结果与讨论
2.1 流动相的选择
用甲醇-水和乙腈-水作流动相进行洗脱,发现酚类化合物的色谱峰出现严重拖尾现象,这是由于多酚物质化学结构上的酚羟基在中性溶液中易发生解离,停留在固定相表面,从而不易实现物质间完全分离[16]。而加入酸把流动相的pH值降低,可以抑制酚羟基的解离,酚类化合物变成疏水缔合物,明显提高分离度和改变峰形;但如果洗脱液的酸值太高,则易损坏色谱柱降低柱效[16-17]。参考赵清洁[18]利用HPLC分析多酚的方法,考察了流动相中有机相的组分和配比(图1),结果发现选用甲醇-乙腈-乙酸(5∶5∶0.1)和0.2%乙酸水溶液作流动相,分离效果较好,因此,本试验采用甲醇-乙腈-乙酸(5∶5∶0.1)和0.2%乙酸水溶液作为流动相进行试验。

注:a. 甲醇+0.2%乙酸水溶液,b. 甲醇-乙腈(5∶5)+0.2%乙酸水溶液,c. 甲醇-乙腈-乙酸(5∶5∶0.1)+0.2%乙酸水溶液。图1 采用不同流动相分离混标的色谱图
2.2 色谱条件的选择
选用不同比例的甲醇-乙腈-乙酸(5∶5∶0.1)进行等度洗脱,发现混合标准品中的各组分无法均匀分离开,这是由于标品之间极性相差较大,故采用梯度洗脱。选择甲醇-乙腈-乙酸(5∶5∶0.1)(A),0.2%乙酸水溶液(B)为流动相,参考相关文献[18-20],进行多次试验比较,探索适合茶叶籽油酚类化合物分析的梯度洗脱方法。结果发现,如表1所示的洗脱条件下14种对照品能得到最佳的分离效果。同时根据文献[18]和多次试验比较,最终确定流速1.0 mL/min,柱温35 ℃,紫外检测波长280 nm,进样体积10 μL条件下,14种酚类化合物间分离效果达到最好,色谱图如图2所示。同时,为了确保每次分析的色谱峰保留时间、峰形及分离效果的准确性,每次分析结束后,用同样的梯度洗脱方法清洗2次色谱柱。

表1 梯度洗脱程序
注:1.没食子酸;2.羟基酪醇;3.表没食子儿茶素;4.4-羟基苯乙酸;5.儿茶素;6.表儿茶素;7.咖啡酸;8.表没食子儿茶素没食子酸酯;9.表儿茶素没食子酸酯;10.苯甲酸;11.肉桂酸;12.芦丁;13.槲皮素;14.山奈酚。下同。图2 14种多酚化合物标准品HPLC色谱图
2.3 线性关系
将14种单体酚按照优化后的色谱条件分别进样,确定各单体酚的保留时间和出峰顺序,对不同浓度的混合标准品溶液进行测试。分别以各个对照品溶液的质量浓度X(mg/L)为横坐标,相应峰面积Y为纵坐标绘制标准曲线,进行线性回归分析,根据信噪比S/N=3,测得各组分最低检测浓度。各个单体酚的线性方程、相关系数(R2)、线性范围和检出限如表2所示。由表2可见,在线性范围内各标准品溶液浓度与峰面积相关性良好。

表2 标准品的线性回归方程
2.4 方法的精密度(重复性)
取同一混合标准品溶液,按照优化后的色谱条件进行分析,平行测定6次,各峰面积的相对标准偏差(RSD)在0.2%~10.8%之间,保留时间的RSD在0.1%~2.1%之间,表明该方法具有较好的精密度(重复性)。
2.5 茶叶籽油中酚类化合物组成分析
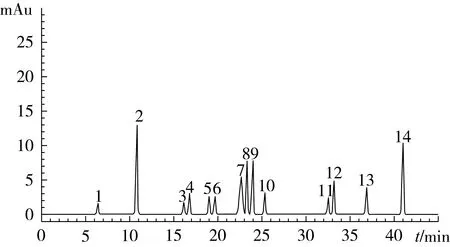
称取茶叶籽油50.0 g样品3份,按照1.2.1方法进行前处理,利用已确定的HPLC条件对油提取物中多酚化合物进行分析,色谱图如图3所示。按照1.2.5定性定量方法,比较各未知峰和已知单体酚的保留时间以及加标试验,最终确定样品中各个组分,将每种物质所得面积根据线性方程计算出相应含量,分析结果见表3。其中由于表没食子儿茶素、4-羟基苯乙酸、表儿茶素、表儿茶素没食子酸酯4种组分在茶叶籽油中含量较低,导致色谱响应水平低,因此在对这4个组分进行定量分析时采取将样品提取液浓缩定容至500 μL,以提高响应水平。所选定的14种单体酚作为对照品主要是根据前人的研究结果进行的[10-11]。从茶叶籽油中鉴定出13个酚类化合物,包括没食子酸、苯甲酸、咖啡酸、4-羟基苯乙酸、反式肉桂酸、表没食子儿茶素(EGC)、儿茶素(C)、表儿茶素(EC)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、芦丁、槲皮素及山奈酚。

图3 茶叶籽油样品中酚类化合物HPLC图

表3 茶叶籽油提取物中酚类化合物组分和含量(n=3)
如表3定量结果显示,在13种酚类化合物中山奈酚的含量最高,其次是儿茶素、咖啡酸,表没食子酸儿茶素(EGC)的含量最低。从HPLC分析中得到,茶叶籽油总酚含量为106.98 μg/g。根据化学结构划分,这13种酚类化合物可分为酚酸类、儿茶素类及黄酮类3大类化合物。茶叶籽油中酚酸类化合物总量为46.8 μg/g,其中肉桂酸的含量最高,4-羟基苯乙酸最低。由于化学结构上,4-羟基苯乙酸比肉桂酸侧链短,并且侧链上比肉桂酸多一个羟基,所以4-羟基苯乙酸的极性更大,因此不易溶于油相。儿茶素类化合物在茶叶籽油中总含量为21.72 μg/g,其中儿茶素含量最高,表没食子儿茶素最低。如图3所示,儿茶素类化合物中表没食子儿茶素最先被洗脱,其结构上比儿茶素多1个羟基,极性更大,更难溶于油相,检测到的含量较低。儿茶素类EGCG在茶叶中含量丰富[21],在茶叶籽油中亦比较高,这是由于两者之间存在同源关系。在茶叶籽油中检测到3种黄酮类化合物,分别是山奈酚、槲皮素及芦丁,总量为40.16 μg/g,其中山奈酚的含量最高,其化学结构上比槲皮素、芦丁所含的羟基少,极性更弱,使其更易溶于油相且更迟洗脱分离。
Fazel等[6]从茶叶籽油中鉴定出其含有没食子酸(GC)、儿茶素(C)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素(EC)、儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG)及儿茶素没食子酸酯(CG)8种儿茶素类化合物,而本试验仅检测到其中6种,其主要原因可能在于茶树品种及物质含量存在不同之处,以及多酚物质提取方法和检测条件的差异。尽管茶树品种和产地来源不同,但研究中茶叶籽油均见儿茶素酯型化合物,如EGCG、ECG、EGC等,这在其他植物油中鲜见有相关报道,可作为茶叶籽油鉴定的标记。
3 结论
本研究通过优化色谱分析条件,建立高效液相色谱法测定茶叶籽油提取物中酚类化合物。以甲醇-乙腈-乙酸为流动相经反相液相色谱柱,在流速1.0 mL/min、柱温35 ℃、紫外检测波长280 nm条件下,对混合标准品进行分析。所有组分均得到有效分离,在0.01~0.50 mg/mL范围内具有良好的线性关系,相关系数在0.99以上,检出限为0.000 3~0.010 0 mg/mL,相对标准偏差为0.2%~10.8%,表明该方法准确度、稳定性和重现性均可靠。
运用该方法测定茶叶籽油样品,共鉴定出13种酚类化合物,分别是没食子酸、咖啡酸、表没食子儿茶素、4-羟基苯乙酸、槲皮素、芦丁、儿茶素、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、反式肉桂酸、山奈酚及苯甲酸,根据结构划分为酚酸类、儿茶素类和黄酮类三大类化合物。同时,定量分析表明,茶叶籽油中总酚含量为106.98 μg/g,主要以酚酸类和黄酮类化合物为主,其中山奈酚含量最高,表没食子儿茶素最低。另外,从所检测到的酚类化合物化学结构上分析,化合物极性越低,苯环上所含羟基越少,苯环侧链越长,更易溶解于油中。通过本研究进一步明确了茶叶籽油中酚类化合物的组成,这些化合物从结构上初步解释茶叶籽油所表现出来的多方面功能,并为茶叶籽油的深度开发奠定基础。
[1]黄兵兵,王晓琴,梁杏秋. 茶树品种及提取工艺对茶叶籽油脂肪酸组成的影响[J]. 中国粮油学报, 2015, 30(1): 65-70 Huang B B, Wang X Q, Liang X Q. Effects of tea cultivars and oil extraction process on fatty acid component in tea seed [J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(1):65-70
[2]梁杏秋,王晓琴,黄兵兵. 茶叶籽油组成分析及其抗氧化机理研究进展[J]. 中国粮油学报, 2013, 28(11): 123-128 Liang X Q, Wang X Q, Huang B B. Research progress of composition analysis and antioxidant mechanism of tea seed oil [J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(11):123-127
[3]刘雳,赵正惠. 茶籽毛油中极性抗氧化物质的研究[J]. 中国粮油学报, 2002, 17(3): 4-9 Liu L, Zhao Z H. Study on polar antioxidative compounds in tea (Camelliasinensis) seed oil [J]. Journal of the Chinese Cereals and Oils Association, 2002, 17(3):4-9
[4]Wang X Q, Liang X Q, Zhao J, et al. Cultivar characterization of tea seed oils by their active components and antioxidant capacity[J]. Journal of the American Oil Chemists’ Society, 2014, 91: 629-639
[5]朱晋萱,朱跃进,刘国艳,等. 13个省茶叶籽油脂肪伴随物分析[J]. 中国油脂, 2013, 38(1): 84-88 Zhu J X, Zhu Y J, Liu G Y, et al. Analysis of lipid accompaniments in tea seed oils from thirteen provinces [J]. China Oils and Fats, 2013, 38(1): 84-88
[6]Fazel M, Sahari M, Barzegar M. Determination of main tea seed oil antioxidant and their effects on common kilka oil [J]. International Food Research Journal, 2008, 15(1): 209-217
[7]胡秀芳,沈生荣,朴宰日,等. 茶多酚抗氧化机理研究现状[J]. 茶业科学, 1999, 19(2): 93-103 Hu X F, Shen S R, Park J, et al. Review on antioxidative mechanism of tea polyphenols [J]. Journal of Tea Science, 1999,19(2): 93-103
[8]Sahari M A, Amooi M. Tea seed oil: Extraction, compositions, applications, functional and antioxidant properties [J]. Academia Journal of Medicinal Plants, 2013, 1(4): 68-79
[9]刘国艳,王兴国,金青哲,等. 不同地区茶叶籽油活性成分的比较分析[J]. 中国油脂, 2014, 39(11): 44-47 Liu G Y, Wang X G, Jin Q Z, et al. Comparison of active constituents in tea seed oils from different areas [J]. China Oils and Fats, 2014, 39(11): 44-47
[10]罗凡,费学谦,方学智,等. 固相萃取/高效液相色谱法测定茶油中的多种天然酚类物质[J]. 分析测试学报, 2011, 30(6): 696-700 Luo F, Fei X Q, Fang X Z, et al. Determination of phenols in camellia oil by high-performance liquid chromatographywith solid-phase extraction [J]. Journal of Instrumental Analysis, 2011, 30(6) : 696-700
[11]王进英,钟海雁. RP-HPLC内标标准曲线法测定茶油中的7种酚类物质[J]. 中国粮油学报, 2014, 29(9): 107-111 Wang J Y, Zhong H Y. Determination of the content of phenols in camellia oil by RP-HPLC with internal standard method [J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(9): 107-111
[12]García-Villalba R, Carrasco-Pancorbo A, Oliveras-Ferraros C, et al. Characterization and quantification of phenolic compounds of extra-virgin olive oils with anticancer properties by a rapid and resolutive LC-ESI-TOF MS method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 416-429
[13]Ouni Y, Taamalli A, Gómez-Caravaca A M, et al. Characterisation and quantification of phenolic compounds of extra-virgin olive oils according to their geographical origin by a rapid and resolutive LC-ESI-TOF MS method[J]. Food Chemistry, 2011, 127(3): 1263-1267
[14]张志英. 山茶油抗氧化防辐射活性成分及其机理的研究[D]. 杭州: 浙江大学, 2006 Zhang Z Y. Study on the bioactivity compounds of ant-radiation and antioxidant mechanism of camellia oil [D]. Hangzhou: Zhejiang University, 2006
[15]廖义秀. 茶油多酚分析及其抗氧化稳定性研究[D]. 长沙: 中南林业科技大学, 2013 Liao Y X. The study of polyphenol and oxidation stability of oil from camellia [D]. Changsha: Central South University of Forestry and Technology, 2013
[16]胡秋芬,李德良,李海涛,等. 微柱高效液相色谱法测定茶多酚的研究[J]. 食品科学, 2004, 25(6): 147-149 Hu Q F, Li D L, Li H T, et al. Study on microcolumn high performance liquid chromatography method for the determination of tea polyphenols [J]. Food Science, 2004, 25(6): 147-149
[17]胡秋芬,杨光宇,黄章杰,等. 微柱高效液相色谱法测定金银花中多酚类物质[J]. 分析化学, 2005, 33(1):69-72 Hu Q F, Yang G Y, Huang Z J, et al. Study on determination of polyphenols in Honeysuckle flower by microcolumn high performance liquid chromatography [J]. Chinese Journal of Analytical Chemistry, 2005, 33(1): 69-72
[18]赵清洁. 山茶属植物果皮多酚的分离制备及抗氧化研究[D]. 长沙: 中南林业科技大学, 2012 Zhao Q J. Study on the separation preparation and antioxidant of Camellia pericarp polyphenol [D]. Changsha: Central South University of Forestry and Technology, 2012
[19]Peng L, Song X, Shi X, et al. An improved HPLC method for simultaneous determination of phenolic compounds, purine alkaloids and theanine inCamelliaspecies[J]. Journal of Food Composition and Analysis, 2008, 21(7): 559-563
[20]Yao L, Jiang Y, Datta N, et al. HPLC analyses of flavanols and phenolic acids in the fresh young shoots of tea (Camelliasinensis) grown in Australia[J]. Food Chemistry, 2004, 84(2): 253-263
[21]He X, Li J, Zhao W, et al. Chemical fingerprint analysis for quality control and identification of Ziyang green tea by HPLC[J]. Food Chemistry, 2015, 171: 405-411.
Determination of Phenolic Compounds inCamelliaSinensisSeed Oil by RP-High-Performance Liquid Chromatography-DAD
Zeng Qiumei Liang Xingqiu Wang Xiaoqin Lu He
(College of Chemical Engineering;Institute of Oil and Natural Product,Huaqiao University, Xiamen 361021)
The high performance liquid chromatographic (HPLC) was established for separation and determination of the components and contents of various phenolic compounds in tea seed oil. Compared the the influence of the mobile phase component, the suitable acetic acid addition was added to establish optimal gradient elute condition. Good separation was performed for 14 phenolic compounds under the optimal conditions with linearly dependent coefficient of various materials above 0.99. 13 phenolic compounds, including 5 phenolic acids, 3 flavonoids and 5 catechinic acid, were detected by the proposed method. The contents were 46.8, 21.72 and 40.16 μg/g, respectively. The maior compositions of phenolic acids were cinnamic acid and caffeic acid, major compositions of flavonoids were quercetin, kaempferol and rutin, while catechinic acid was the major catechin compounds. The method, accurate and reliable, was applicable for analysis of phenolic compound in tea seed oil. It provided a basic data of phenolic compounds of tea seed oil, providing a reference for further study.
Camelliasinensisseed oil, phenolic compounds, high-performance liquid chromatographic (HPLC)
福建省重点科技计划(2012N0016)
2015-09-28
曾秋梅,女,1990年出生,硕士,油脂及天然活性成分开发
王晓琴,女,1977年出生,副教授,油脂及天然活性成分开发
TS225.1
A
1003-0174(2017)04-0141-06
