发酵豆粕替代鱼粉对凡纳滨对虾的作用效果研究
2017-07-19李小勤赵金鑫郑小淼李百安冷向军上海海洋大学水产与生命学院上海006丰益上海生物技术研发中心有限公司上海007上海海洋大学农业部淡水水产种质资源重点实验室上海市水产养殖工程技术研究中心上海高校知识服务平台上海海洋大学水产动物遗传育种中心ZF06上海006
彭 松 张 敏 李小勤 赵金鑫 郑小淼 李百安 魏 静 冷向军,(上海海洋大学水产与生命学院,上海 006)(丰益(上海)生物技术研发中心有限公司,上海 007)(上海海洋大学农业部淡水水产种质资源重点实验室;上海市水产养殖工程技术研究中心;上海高校知识服务平台,上海海洋大学水产动物遗传育种中心(ZF06),上海 006)
发酵豆粕替代鱼粉对凡纳滨对虾的作用效果研究
彭 松1张 敏2李小勤1赵金鑫1郑小淼1李百安1魏 静1冷向军1,3
(上海海洋大学水产与生命学院1,上海 201306)(丰益(上海)生物技术研发中心有限公司2,上海 200137)(上海海洋大学农业部淡水水产种质资源重点实验室;上海市水产养殖工程技术研究中心;上海高校知识服务平台,上海海洋大学水产动物遗传育种中心(ZF1206)3,上海 201306)
本试验旨在研究发酵豆粕替代鱼粉对凡纳滨对虾生长、营养物质利用、肝胰腺消化酶活性和血淋巴非特异性免疫指标的影响。以豆粕(负对照组)、发酵豆粕T468、P839、B356和Y918等蛋白质替代正对照饲料中6%鱼粉(正对照饲料含21%鱼粉),另以发酵豆粕B356等蛋白质替代正对照饲料中9%鱼粉(B356-2),配制成7组等氮饲料,饲喂平均质量4.0 g的凡纳滨对虾42 d。结果表明:发酵可部分降解豆粕中胰蛋白酶抑制因子、抗原蛋白质及大分子蛋白质,提高粗蛋白质和小肽含量;与负对照组相比,发酵豆粕T468、P839、B356、Y918替代6%鱼粉后,提高凡纳滨对虾增重率16.7%、12.0%、9.9%、11.9%,降低饲料系数18.1%、13.7%、12.6%、14.8%(P<0.05),到达和正对照组基本一致的生长性能,同时显著提高了蛋白质效率、蛋白质沉积率、干物质消化率和蛋白质消化率(P<0.05);各发酵豆粕组均较负对照组显著提高了肝胰腺淀粉酶活性和血淋巴SOD活性(P<0.05),P839组的蛋白酶活性和血淋巴PO活性显著高于负对照组(P<0.05)。发酵可改善豆粕的可利用性,在不影响凡纳滨对虾生长和饲料利用的前提下,发酵豆粕可替代饲料中6%鱼粉。
凡纳滨对虾 发酵豆粕 生长 营养物质利用率 消化酶活性 非特异性免疫
鱼粉是水产饲料常用的动物蛋白原料,但资源有限,价格居高不下,开发植物蛋白源以全部或部分代替鱼粉一直是行业界关注和研究的热点。与其他植物蛋白源相比,豆粕的蛋白质含量高、富含赖氨酸,资源丰富,已在水产饲料中得到了较广泛的应用。然而,与鱼粉相比,豆粕的蛋氨酸含量低,含多种抗营养因子,如胰蛋白酶抑制因子,可降低胰蛋白酶活性[1],诱导胰蛋白酶补偿性分泌造成含硫氨基酸的内源性损失[2];豆粕含约30%抗原蛋白质,主要是大豆球蛋白和β-伴大豆球蛋白[3],可引起断奶仔猪生长性能降低及肠道过敏反应[4]。此外,豆粕中大分子蛋白质含量较高,质量分数约为24.44%[5],对于消化系统发育不完全的幼龄水产动物以及消化道较短的虾蟹而言,大分子蛋白质进入消化道后,未充分消化吸收便排出体外,既浪费原料,又增加了N、P排放[6]。
发酵是指在可控条件下利用微生物降解动、植物原料并产生多种生物活性物质的过程,是改善饲料原料可利用性的一种有效方式。研究表明,发酵可消除抗营养因子,把大分子蛋白质降解为易消化吸收的可溶性蛋白质、多肽和寡肽,把纤维类物质分解为糖,部分糖转化为乳酸,产生大量有益微生物,同时产生蛋白酶、非淀粉多糖酶、脂肪酶等活性物质[7-10]。目前,常用的发酵菌种有芽孢杆菌、霉菌、酵母菌和乳酸菌等。
研究表明,在不影响生长性能的前提下,发酵豆粕可替代石斑鱼(Epinepheluscoioides)饲料中10%鱼粉[11]、虹鳟(Oncorhynchusmykiss)幼鱼饲料中30%鱼粉[12]、金鲳(Trachinotusovatus)饲料中8%鱼粉[13]、胭脂鱼(Myxocyprinusasiaticus)幼鱼饲料中23%鱼粉[14]、凡纳滨对虾(Litopenaeusvannamei(Boone))饲料中34%鱼粉[15]。发酵豆粕在不同水产饲料中替代鱼粉比例的不同,与发酵豆粕质量、水产动物种类、基础饲料组成,特别是鱼粉含量等因素有关,而发酵豆粕质量又与发酵菌种、发酵工艺等有关。
目前,鲜见来自于不同发酵菌种的发酵豆粕对凡纳滨对虾作用效果的比较,因此,本试验以凡纳滨对虾为研究对象,比较了3种不同菌种发酵的豆粕等蛋白质替代鱼粉对凡纳滨对虾生长性能、体组成、肝胰腺消化酶活性、营养物质消化率和血淋巴非特异性免疫的影响,为发酵豆粕在对虾饲料中的合理应用提供参考。
1 材料与方法
1.1 发酵豆粕制备及聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
所用豆粕及发酵豆粕均由丰益(上海)生物技术研发中心有限公司提供,豆粕经枯草芽孢杆菌(Bacillussubtilis)、枯草芽孢杆菌+酵母菌(Saccharomyces)和枯草芽孢杆菌+乳酸菌(Lactobacillus)发酵分别获得3种发酵豆粕B356、T468和P839;另外,从市场购得某商品发酵豆粕Y918。参照Marsman等[16]的方法,对豆粕及发酵豆粕进行蛋白质聚丙烯酰胺凝胶电泳(SDS-PAGE)分析;挥发性盐基氮(VBN)的测定参照GB/T 5009.44—1996[17];小肽的测定采用三氯乙酸沉淀法;胰蛋白酶抑制因子(TI)的测定参照NY/T 1103.2—2006[18]。豆粕及发酵豆粕主要营养成分见表1。

表1 豆粕及发酵豆粕营养组成(风干基础)
注:“—”表示数据未测定。
1.2 试验设计及饲料配方
配制含21%鱼粉的正对照饲料,在此基础上,将鱼粉质量分数降为15%,以10%豆粕(负对照)、7%发酵豆粕T468、7.5%发酵豆粕P839、8%发酵豆粕B356和8%发酵豆粕Y918等蛋白替代饲料中6%鱼粉,另外,以12%发酵豆粕B356替代9%鱼粉组(B356-2),共制成7种等氮饲料(表2)。根据凡纳滨对虾对氨基酸的需求量[19],分别向各鱼粉替代组添加微囊蛋氨酸、微囊赖氨酸、微囊苏氨酸(广东海纳川药业股份有限公司,有效质量分数为50%、39%、50%),使其达到与正对照饲料一致的水平;同时,添加0.02%氧化钇作为指示剂,以测定营养物质表观消化率。主要饲料原料粉碎过60目筛,逐级混匀,以绞肉机制成粒径1.2 mm饲料,95 ℃后熟化25 min,45 ℃烘干6 h,4 ℃保存备用。

表2 试验饲料组成和营养水平(风干基础)/%
注:1)配方中饲料原料购于上海农好饲料有限公司。其中鱼粉(秘鲁)、豆粕、花生粕、肉骨粉、鱿鱼膏、啤酒酵母和次粉的粗蛋白质质量分别为67.79%、47.82%、48.89%、51.81%、32.57%、49.95%和17.40%。
2)每千克维生素预混料含有:VA 12 500 000 IU,VD33 000 000 IU,VE 100 000 IU,VK36 870 mg,VB120 000 mg,VB230 000 mg,VB630 000 mg,VB1240 mg,D-生物素800 mg,烟酰胺60 000 mg,D-泛酸钙50 000 mg。
3)每千克矿物质预混料含有:Ca(IO3)210 g,CoCl2·6H2O 10 g,CuSO4·5H2O 8 g,FeSO4·H2O 16.7 g,ZnSO4·H2O 22.9 g,MnSO4·H2O 6.3 g,Na2SeO3·5H2O 2 g,MgSO4·7H2O 66.7 g,KCl 500 g,NaCl 200 g,Ca(H2PO4)2157.5 g。
4)其他包含:豆粕15%、花生粕15%、肉骨粉5%、鱿鱼膏5%、啤酒酵母5%、大豆磷脂1.5%、鱼油2%、磷酸二氢钙2%、60%氯化胆碱0.5%、35%VC 0.1%和肌醇0.04%。
1.3 实验动物与饲养管理
凡纳滨对虾购于上海市浦东新区滨海镇某养殖场,取规格一致、体格健壮的凡纳滨对虾(平均体质量为4.0 g)1 680尾,随机分配于28口网箱(2.0 m×1.0 m×1.2 m),每网箱60尾,试验共7个处理组,每处理4重复。试验前驯养1周,待对虾适应环境且正常摄食后开始试验。养殖期间,每日投喂4次(07:00、12:00、17:00、22:00),投饲率为虾体重4%~7%,以投饲后2.5 h内食完为宜,并根据天气及摄食情况作适当调整,使各网箱投饲量基本一致;昼夜充气,每周换水1/5。试验期间,水温28.2~30.4 ℃,盐度0.5‰~1.0‰,溶氧>5.6 mg/L,pH 7.8~8.5,氨氮≤0.2 mg/L,亚硝酸盐≤0.1 mg/L。饲养试验共持续42 d。饲养试验于上海海洋大学滨海基地室内养殖场进行。
1.4 样品采集及分析
1.4.1 样品采集
养殖试验开始前,取40尾对虾于-20 ℃冰箱保存,其中5尾虾合并为1个样本,用于初始样品体成分分析。
养殖试验结束后,虾体饥饿12 h,逐网箱计数称重。从每网箱取15尾对虾,其中3尾存放于-20 ℃冰箱中,用于全虾体组成分析;12尾于头胸甲后插入围心腔取血淋巴,4尾虾的血淋巴合并为一个样本,4 ℃条件下5 000 r/min离心10 min,取上清液于-20 ℃保存,用于免疫指标分析;将采血后的对虾解剖,取肝胰腺于-20 ℃保存,用于消化酶分析。
其余对虾在称重后放回原网箱暂养,投喂原饲料,待稳定后参照Lin等[20]方法收集粪便。用虹吸管将粪便吸至筛网,收集完整粪便于-20 ℃保存,用于营养物质消化率分析。
1.4.2 饲料、粪便、全虾组成和钇元素分析
饲料和全虾组成测定包括水分、粗蛋白质、粗脂肪、灰分、钇(仅饲料),粪便测定包括粗蛋白质和钇含量。水分采用105 ℃烘干法(GB 6434—1986),粗蛋白质采用KjeltecTM2300凯氏定氮仪(丹麦FOSS公司)测定(GB/T 6432—1994),灰分采用550 ℃灼烧法(GB/T 6432—1992),饲料粗脂肪采用SOX416索氏脂肪测定仪(德国Gerhardt公司)测定;全虾粗脂肪采用氯仿-甲醇法测定;钇元素用等离子体原子发射光谱法(ICP)测定。
1.4.3 血淋巴免疫指标
总超氧化物歧化酶(T-SOD)和碱性磷酸酶(AKP)采用南京建成试剂盒测定。T-SOD单位定义(U/mL):每mL反应液中T-SOD抑制率达50%时所对应的T-SOD量为一个活力单位。AKP单位定义(U/100 mL):100 mL血淋巴在37 ℃与基质作用15 min产生1 mg酚定义为一个金氏单位。
酚氧化酶(PO)测定以L-dopa为底物,参照王雷等[21]方法适当修改后进行。将3 mL 0.1 mol/L pH 6.0的磷酸缓冲液与0.1 mL 0.01 mol/L的L-dopa及0.1 mL待测血淋巴于室温下混匀,每隔2 min读取490 nm波长下吸光值。PO单位定义(U/mL):以A490对反应时间(min)作图,以试验条件下A490每1 min增加0.001定义为一个酶活力单位。
1.4.4 肝胰腺消化酶
蛋白酶测定采用福林酚法[22]。蛋白酶单位定义(U/mg prot):1 mg组织蛋白质在40 ℃、pH 9.8条件下1 min水解酪素产生1 μg酪氨酸定义为一个酶活力单位。脂肪酶和淀粉酶采用南京建成试剂盒测定。脂肪酶单位定义(U/mg prot):37 ℃条件下,1 mg组织蛋白质在反应体系中与底物反应1 min,每消耗1 μmol底物定义为一个酶活力单位。淀粉酶单位定义(U/mg prot):1 mg组织蛋白质在37 ℃与底物作用30 min,水解10 mg淀粉定义为一个酶活力单位。
1.4.5 计算公式
增重率=(末体重-初体重)/初体重×100%;
成活率=末尾数/初尾数×100%;
饲料系数=摄食量/(末体重-初体重);
蛋白质效率=(末体重-初体重)/(投饲量×饲料蛋白质含量);
蛋白质沉积率=(末体重×末全虾蛋白质含量-初体重×初全虾蛋白质含量)/(投饲量×饲料蛋白质含量)×100%;
脂肪沉积率=(末体重×末全虾脂肪含量-初体重×初全虾脂肪含量)/(投饲量×饲料脂肪含量)×100%;
干物质消化率=(粪便钇含量-饲料钇含量)/粪便钇含量×100%;
蛋白质表观消化率=(粪便钇含量×饲料蛋白质含量-饲料钇含量×粪便蛋白质含量)/(粪便钇含量×饲料蛋白质含量)×100%。
1.5 数据统计
试验数据均以平均值±标准差(mean±SD)表示。采用SPSS 17.0对数据进行单因素方差分析(one-way ANOVA),用Duncan法进行多重比较,显著水平为P<0.05。
2 结果
2.1 豆粕发酵前后蛋白质SDS-PAGE分析
由图1可见,豆粕的蛋白质分子质量分布较广,在70、50、35、20 ku附近较为集中,含有大量抗原蛋白,如大豆球蛋白和β-伴大豆球蛋白。经微生物发酵后,在B356和P839发酵豆粕中,分子质量大于25 ku的蛋白质大部分被降解,大豆球蛋白和β-伴大豆球蛋白明显减少,小分子蛋白质明显增加。在发酵豆粕T468中,大豆球蛋白和β-伴大豆球蛋白含量也有一定程度降低,但大分子质量蛋白质含量相对较多,大部分蛋白质的分子质量小于55 ku。

图1 发酵豆粕SDS-PAGE
2.2 生长性能
由表3可见,正对照组具有最高增重率和最低饲料系数,而负对照组的增重率最低,饲料系数最高;与负对照(豆粕组)相比,除B356-2外,各发酵豆粕组的增重率均显著提高(P<0.05),饲料系数显著降低(P<0.05),并达到了与正对照组基本一致的水平;在发酵豆粕B356组,随替代鱼粉比例由6%(B356-1)增加到9%(B356-2),增重率呈下降趋势。各处理组在成活率上无显著差异(P>0.05)。
此外,在养殖期间,正对照组、B356和Y918组对虾通常在投喂后1.5~2 h内摄食完毕,而T468、P839组和负对照组通常在投喂后2~2.5 h内摄食完毕。
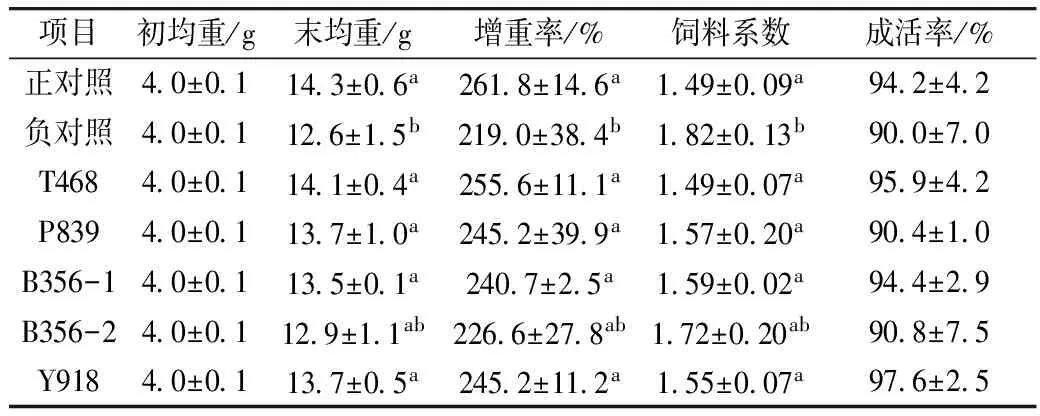
表3 发酵豆粕对凡纳滨对虾生长性能的影响
注:同列数据后具不同字母者表示差异显著(P<0.05),余同。
2.3 营养物质利用率
由表4可见,负对照组蛋白质效率、蛋白质沉积率、干物质及蛋白质消化率最低;与负对照相比,除B356-2外,各发酵豆粕组蛋白质效率、蛋白质沉积率、干物质及蛋白质消化率均显著增高(P<0.05),并达到了与正对照基本一致的水平;在发酵豆粕B356组,当替代鱼粉比例由6%(B356-1)增加到9%(B356-2)时,干物质及蛋白质消化率未受影响(P>0.05),但蛋白质效率和蛋白质沉积率显著下降(P<0.05)。各处理组在脂肪沉积率上无显著差异(P>0.05)。
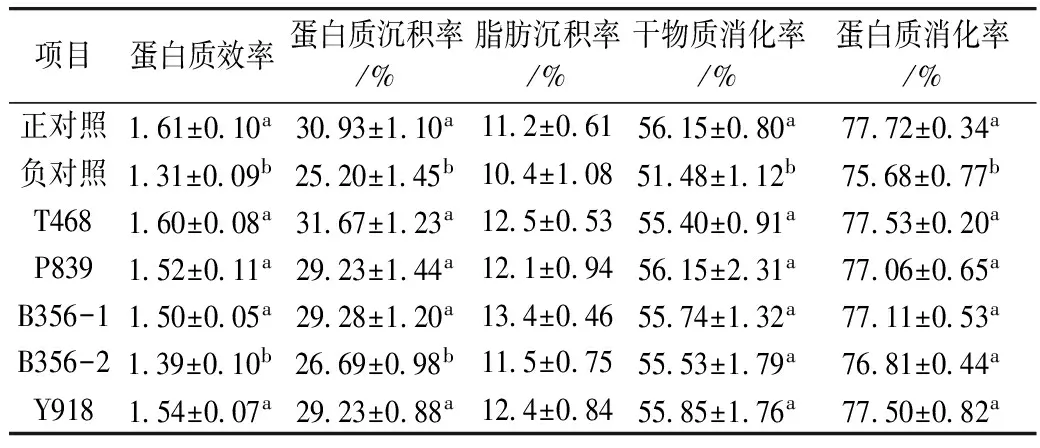
表4 发酵豆粕对饲料营养物质利用的影响
2.4 全虾成分
由表5可见,各处理组在全虾水分、灰分含量上无显著差异(P>0.05);正对照组具有最高粗蛋白含量和最低粗脂肪含量,B356-1、B356-2分别具有最高粗脂肪含量和最低粗蛋白含量。
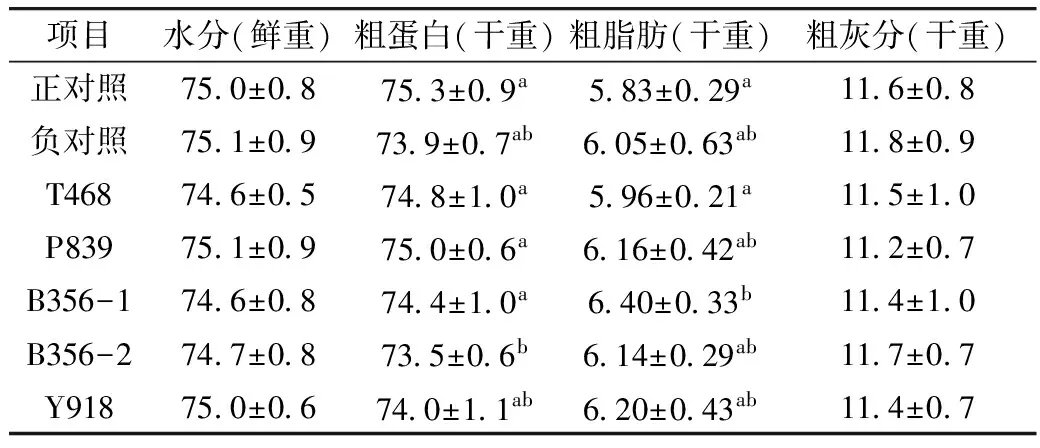
表5 发酵豆粕对凡纳滨对虾全虾组成的影响/%
2.5 肝胰腺消化酶活性
由表6可见,正对照组具有最高的蛋白酶和淀粉酶活性,而负对照组的蛋白酶和淀粉酶活性最低;与负对照相比,各发酵豆粕组的淀粉酶活性均显著升高(P<0.05),但在蛋白酶活性上,仅P839组显著升高(P<0.05),其他组仅在数值上有所增加;各处理组在脂肪酶活性上没有显著差异(P>0.05)。

表6 发酵豆粕对凡纳滨对虾肝胰腺消化酶活性的影响/U/mg prot
2.6 血淋巴非特异性免疫指标
由表7可见,负对照组的T-SOD活性和PO活性均为最低,与负对照组相比,各发酵豆粕组的T-SOD活性均显著升高(P<0.05),PO活性在不同程度上也有增加,其中P839组的T-SOD、PO活性最高;在AKP活性方面,正对照组的AKP活性最低,而P839组具有最高AKP活性。
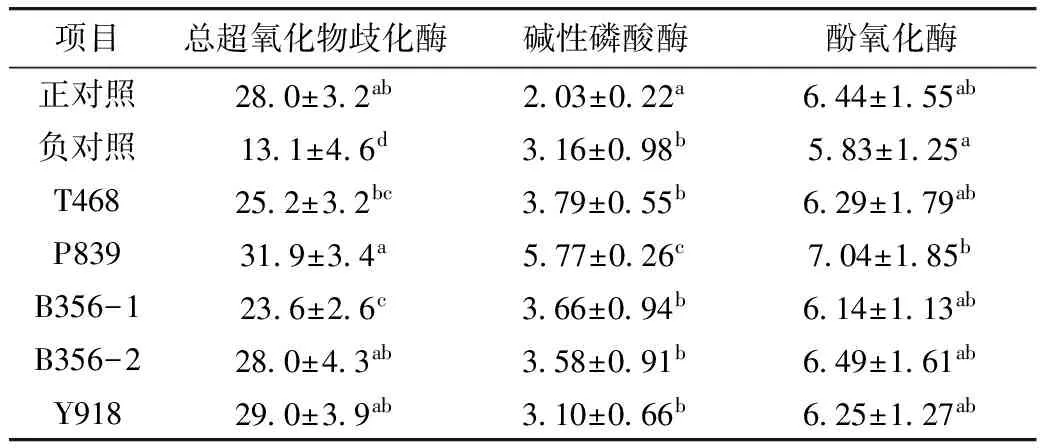
表7 发酵豆粕对凡纳滨对虾血淋巴非特异性免疫的影响/U/100 mL
3 讨论
3.1 发酵豆粕替代鱼粉对凡纳滨对虾生长性能的影响
在相同配方条件下,石斑鱼[12]、凡纳滨对虾[16]及杂交鲈(Moronechrysops×Moronesaxatilis)[23]摄食发酵豆粕组饲料,较摄食豆粕组饲料具有更高增重率和更低饲料系数;Barnes等[12]研究表明,发酵豆粕可替代虹鳟幼鱼饲料中30%鱼粉,Zhou等[24]认为发酵豆粕可替代黑鲷幼鱼饲料中12%鱼粉,然而替代更高比例的鱼粉,会降低虹鳟、黑鲷生长性能及饲料利用效率。本试验中,与负对照相比,发酵豆粕T468、P839、B356、Y918替代6%鱼粉,均显著提高了凡纳滨对虾增重率,降低了饲料系数,并达到与正对照组基本一致的水平;在发酵豆粕B356组,随替代鱼粉比例由6%(B356-1)增加到9%(B356-2),增重率呈下降趋势,饲料系数呈增高趋势,与其他研究结果相一致。
本试验中,各鱼粉替代饲料中均补充了微囊蛋氨酸、赖氨酸和苏氨酸,使其达到了与对照组一致的水平,消除了由于这些必需氨基酸缺乏对虾体生长的影响;此外,各试验组的投饲量也保持在基本一致的水平,排除了采食量不同对生长性能的影响。因此,本试验中发酵豆粕组虾体生长性能的提高主要与微生物发酵对抗营养因子的消除和营养物质消化率的提高有关,也可能与发酵产生的一些未知因子有关。
3.2 发酵对抗养因子的消除和营养物质消化率的提高
Refstie等[7]以乳酸菌发酵豆粕,其胰蛋白酶抑制因子(TI)含量由6.19 μg/g降为0.90 μg/g,蔗糖(含量由59.3 g/kg降为0.9 g/kg;豆粕经米曲霉发酵后,TI含量由2.70 mg/g降为0.42mg/g[8];以假丝酵母发酵豆粕,TI、植物凝集素、脲酶分别由10.05、30.75、3.25 mg/g降为1、0.05、0.02 mg/g[24];以枯草芽孢杆菌、米曲霉发酵豆粕,TI由3.508 mg/g降为0.164、0.655 mg/g[3]。本试验中,发酵豆粕T468、P839和B356中TI含量由6.00 mg/g降为1.26、0.63、0.96 mg/g,SDS-PAGE分析也显示大豆球蛋白和β-伴大豆球蛋白明显减少,说明微生物发酵显著降低了豆粕中的抗营养因子。
消化酶活性是评价养殖动物对营养物质消化能力的重要指标。Feng等[25]以枯草芽孢杆菌发酵豆粕,显著提高了断奶仔猪十二指肠胰蛋白酶活性。本试验中,豆粕经发酵后,TI、大豆球蛋白和β-伴大豆球蛋白含量明显减少,各发酵豆粕组对虾肝胰腺淀粉酶活性显著提高,蛋白酶活性也在不同程度有所提高。这说明,凡纳滨对虾消化酶活性的提高与发酵降解了胰蛋白酶抑制因子和抗原蛋白有关,也可能与发酵产物刺激了消化酶的分泌有关,这有待今后进一步研究。
Teng等[3]发现,豆粕经枯草芽孢杆菌和米曲霉发酵后,其蛋白质体外消化率显著增高。在Kiers等[26]研究中,以芽孢杆菌发酵大豆48 h后,大豆的体外消化率由29%增加到33%~43%。发酵可将大分子蛋白降解为易于消化吸收的可溶性蛋白、多肽和寡肽,纤维类物质分解为糖,部分糖转化为乳酸,从而提高营养物质消化率[7-10]。本试验的SDS-PAGE分析表明,发酵豆粕P839和B356蛋白质分子质量大部分小于25 ku,T468的蛋白质分子量也有降低,三者的小肽质量分数由2.00%(未发酵豆粕)增加到6.64%、6.41%和10.11%;消化试验则表明各发酵豆粕组的干物质和蛋白质表观消化率均较未发酵组显著提高,这说明发酵降解了大分子蛋白质,提高了营养物质消化率,从而提高蛋白质效率、蛋白质沉积率和凡纳滨对虾生长性能。
3.3 发酵豆粕对血淋巴非特异性免疫的影响
Kim等[27]在饲料中添加4%米曲霉发酵豆粕及0.08%米曲霉均显著提高了鹦鹉鱼(Oplegnathusfasciatus)肝脏SOD活性,并认为这种抗氧化性的增高与游离型大豆异黄酮,特别是苷元和丙二酰基葡萄糖苷异黄酮含量的增高有关。在饲料中添加10~20 mg/kg大豆异黄酮可显著提高大菱鲆(Scophthalmusmaximus)血清SOD活性[28]。大豆异黄酮活性的高低与母核上糖基侧链有关,去掉糖基侧链的游离型大豆异黄酮的活性可显著增高。发酵过程中微生物产生的β-葡萄糖苷酶可使异黄酮葡萄糖苷水解成游离型大豆异黄酮,提高其生物活性。本试验中,各发酵豆粕组的血淋巴T-SOD活性均较未发酵组显著提高,PO活性也在不同程度上有所增高,这可能与发酵增高了游离型大豆异黄酮含量有关。此外,发酵豆粕中还含有大量有益微生物,这些微生物进入肠道后与病原菌竞争宿主,并通过其代谢物调节微生态平衡,从而提高机体抗病能力[29-30]。在今后有关发酵豆粕的研究中,有必要对这些指标进行测定,以进一步阐明发酵豆粕的作用机理。
4 结论
发酵可部分降解豆粕中胰蛋白酶抑制因子、抗原蛋白质及大分子蛋白质,提高粗蛋白质及小肽含量。本试验条件下,发酵豆粕T468、P839、B356可替代饲料中6%的鱼粉而不影响凡纳滨对虾生长和饲料利用,并可提高凡纳滨对虾非特异性免疫功能。
[1]Francis G,Makkar H P S,Becker K.Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish[J].Aquaculture,2001,199(3):197-227[2]Schneeman B O,Gallaher D.Pancreatic response to dietary trypsin inhibitor:variation among species[M]. Friedman M.Nutritional and Toxicological Significance of Enzyme Inhibitors in Food.Springer US,1986:185-187
[3]Teng D,Gao M Y,Yang Y L,et al.Bio-modification of soybean meal withBacillussubtilisorAspergillusoryzae[J].Biocatalysis and Agriculture Biotechnology,2012,1(1):32-38
[4]Sun P,Li D F,Dong B,et al.Effects of soybean glycinin on performance and immune function in early weaned pigs[J].Archives of Animal Nutrition,2008,62(4):313-321
[5]马文强,冯杰,刘欢.微生物发酵豆粕营养特性研究[J].中国粮油学报,2008,23(1):121-124 Ma W Q,Feng J,Liu H. Nutritional characteristics of microbe fermented soybean meal[J].Journal of the Chinese Cereals and Oils Association,2008,23(1):121-124
[6]Bergheim A,Aabel J P,Seymour E A.Past and present approaches to aquaculture waste management in Norwegian net pen culture operations[C]//Nutritional Strategies and Aquaculture Waste:First International Symposium on Nutritional Strategies in Management of Aquaculture Waste.Guelph,1991:117-136
[7]Refstie S,Sahlström S,Bråthen E,et al.Lacticacidfermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon(Salmosalar)[J].Aquaculture,2005,246(1):331-345
[8]Hong K J,Lee C H,Kim S W.AspergillusoryzaeGB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J].Journal of Medicinal Food,2004,7(4):430-435
[9]Abdullah S S S,Randeran Z,Noor M A M.Production of amylase enzyme through solid state fermentation byAspergillusniger[J].Journal of Chemistry and Chemical Engineering,2010,4(11):23-26
[10]李建.发酵豆粕研究进展[J].粮食与饲料工业,2009(6):31-35 Li J.The research progress of fermented soybean meal[J].Cereal & Feed industry,2009(6):31-35
[11]Luo Z,Liu Y J,Mai K S,et al.Partial replacement of fish meal by soybean protein in diets for grouperEpinepheluscoioidesjuveniles[J].Journal of Fisheries of China,2004,28(2):175-181
[12]Barnes M E,Brown M L,Rosentrater K A,et al.An initial investigation replacing fish meal with a commercial fermented soybean meal product in the diets of juvenile rainbow trout[J].Open Journal of Animal Sciences,2012,2(4):234-243
[13]Lin H Z,Chen X,Chen S S,et al.Replacement of fish meal with fermented soybean meal in practical diets for pompanoTrachinotusovatus[J].Aquaculture Research,2012,44(1):151-156
[14]Yuan Y C,Lin Y C,Yang H J,et al.Evaluation of fermented soybean meal in the practical diets for juvenile Chinese sucker,Myxocyprinusasiaticus[J].Aquaculture Nutrition,2013,19(1):74-83
[15]Shiu Y L,Wong S L,Guei W C,et al.Increase in the plant protein ratio in the diet of white shrimp,Litopenaeusvannamei(Boon),usingBacillussubtilisE20-fermented soybean meal as a replacement[J].Aquaculture Research,2015,46(2):382-394
[16]Marsman G J P,Gruppen H,Mul A J,et al.Invitroaccessibility of untreated,toasted,and extruded soybean meals for protease and carbohydrates[J].Journal of Agriculture Food Chemistry,1997,45(10):4088-4095
[17]GB/T 5009.44—1996.中华人民共和国国家标准 肉与肉制品卫生标准的分析方法[S] GB/T 5009.44—1996.Method for analysis of hygienic standard of meat and meat products[S][18]NY/T 1103.2—2006.转基因植物及其产品食用安全检测 抗营养素 2部分:胰蛋白酶抑制剂的测定[S] NY/T 1103.2—2006.Transgenic plants and its products’ edible safety testing,Antinutrients,2:The determination of trypsin inhibitor[S]
[19]Akiyama D M,Dominy W G,Lawrence A L.Penaeidshrimp nutrition[M]. Lester L J,Pante M J R,Fast A W,et al.Marine shrimp culture:principles and practices.Elservier Science Publishers,1992,555-568
[20]Lin H Z,Guo Z X,Yang Y Y,et al.Effect of dietary probiotics on apparent digestibility coefficients of nutrients of white shrimpLitopenaeusvannameiBoone[J].Aquaculture Research,2004,35(15):1441-1447
[21]王雷,李光友,毛远兴.中国对虾血淋巴中的抗菌、溶菌活力与酚氧化酶活力的测定及其特性研究[J].海洋与湖沼,1995,26(2):179-185 Wang L,Li G Y,Mao Y X.Studies on the activities and characteristics of the antibacterial,bacteriolysis and phenoloxidase in the haemolymph of penaeus chinensis[J].Oceanologia et limnologiasinica,1995,26(2):179-185
[22]张龙翔,张庭芳,李令媛,等.生化试验方法和技术[M].北京:人民教育出版社,1981 Zhang L X,Zhang T F,Li L Y,et al.Biochemical experiment method and technology[M].Beijing:People’s Education Press,1981
[23]Rombenso A,Crouse C,Trushenski J.Comparison of traditional and fermented soybean meals as alternatives to fish meal in hybrid striped bass feeds[J].North American Journal of Aquaculture,2013,75(2):197-204
[24]Zhou F,Song W X,Shao Q J,et al.Partial replacement of fish meal by fermented soybean meal in diets for black sea breamAcanthopagrusschlegeliijuveniles[J].Journal of the World Aquaculture Society,2011,42(2):184-197
[25]Feng J,Liu X,Xu Z R,et al.Effect of fermented soybean meal on intestinal morphology and digestive enzyme activities in weaned piglets[J].Digestive Diseases and Sciences,2007,52(8):1845-1850
[26]Kiers J L,Van Laeken A E A,Rombouts F M,et al.Invitrodigestibility ofBacillusfermented soya bean[J].International Journal of Food Microbiology,2000,60(2):163-169
[27]Kim S S,Galaz G B,Pham M A,et al.Effects of dietary supplementation of a meju,fermented soybean meal,andAspergillusoryzaefor juvenile Parrot fish(Oplegnathusfasciatus)[J].Asian-Australasian Journal of Animal Sciences,2009,22(6):849-856
[28]胡海滨,刘金桃,李彦先,等.饲料中大豆黄酮对大菱鲆生长、消化酶活力、抗氧化力及肠道结构的影响[J].水产学报,2014,38(9):1503-1513 Hu H B,Liu J T,Li Y X,et al.Effects of dietary daidzein on growth performance,activities of digestive enzymes anti-oxidative ability and intestinal morphology in juvenile turbot(ScophthalmusmaximusL.)[J].Journal of Fisheries of China,2014,38(9):1503-1513
[29]王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29(6):72-75 Wang Y M,Wang Y G.Advance in the mechanisms and application of microecologics in aquaculture[J].Progress in Veterinary Medicine,2008,29(6):72-75
[30]张新明.对虾养殖用微生态制剂菌株的筛选与应用效果的研究[D].青岛:中国海洋大学,2004 Zhang X M.Selection and using effect of probiotics for shrimp culturing[D].Qingdao:Ocean University of China,2004.
Effect of Replacing Fish Meal with Fermented Soybean Meal on White Shrimp,Litopenaeusvannamei(Boone)
Peng Song1Zhang Min2Li Xiaoqin1Zhao Jinxin1Zheng Xiaomiao1Li Baian1Wei Jing1Leng Xiangjun1,3
(College of Fisheries and Life Science,Shanghai Ocean University1,Shanghai 201306)(Wilmar Biotechnology Research & Development Center(Shanghai)Co.,Ltd.2,Shanghai 200137)(Key Laboratory of Freshwater Fishery Germplasm Resources,Ministry of Aquaculture;Shanghai Engineering Technology Research Center of Aquaculture;Shanghai University Knowledge Service Platform,Aquatic Animal Genetic Breeding Center(ZF1206),Shanghai Ocean University3,Shanghai 201306)
The present study was aimed at studying the influence of replacing fish meal with fermented soybean meal(FSM)on the index about growth,nutrients utilization,activities of digestive enzymes in hepatopancreas and hemolymph non-specific immunity ofLitopenaeusvannamei.Seven groups nitrogenous fodders were prepared by replacing 6% fish meal in positive control fodder group(containing 21% fish meal)with soybean meal(SM)(negative control group),fermented SM T468,P839,B356,and Y918 proteins respectively,and by replacing 9% fish meal(B356-2)
in positive control group with fermented SM B356.The seven groups nitrogenous fodders were fedLitopenaeusvannameiwhich with average weight of 4.0 g for 42 days.The results showed: The fermentation could partially degrade the levels of trypsin inhibitor,antigen protein and macromolecular protein in soybean meal,and increase the concentrations of crude protein and small peptide. Compared with the negative control group,after the 6% fish meal was replaced by the fermented soybean meal T468,P839,B356 and Y918,the weight gain rate ofLitopenaeusvannameiwere increased by 16.7%,12.0%,9.9%,11.9%,and the feed coefficient were significantly decreased by 18.1%、13.7%、12.6%、14.8%(P<0.05),which reached the similar levels of growth performance as the positive control group.Meanwhile,protein efficiency,protein retention,digestibilities of dry matter and protein of these groups were significantly higher than those of negative control group(P<0.05). Activities of hepatopancreas amylase and hemolymph SOD of each fermented soybean meal group was significantly higher than those negative control group(P<0.05),and activities of proteinase and hemolymph PO of P839 group were significantly higher than the negative control group(P<0.05).The above results indicated that the fermentation can improve the availability of soybean meal,and 6% fish meal can be replaced by fermented soybean meal provided that the growth and fodder utilization of Litopenaeus vannamei was not be affected.
Litopenaeusvannamei,fermented soybean meal,growth,nutrients utilization,activities of digestive enzymes,non-specific immunity
2015-09-09
彭松,男,1990年出生,硕士,动物营养与饲料科学
冷向军,男,1972年出生,教授,动物营养与饲料科学
S963.7
A
1003-0174(2017)04-0103-08
