eNOS解偶联对大脑中动脉栓塞后大鼠神经血管单元的作用及机制
2017-07-19李丹丹赵弘轶黄勇华张微微迟丽屹
曾 静, 李丹丹, 赵弘轶, 黄勇华, 张微微, 迟丽屹
eNOS解偶联对大脑中动脉栓塞后大鼠神经血管单元的作用及机制
曾 静1, 李丹丹2, 赵弘轶2, 黄勇华2, 张微微2, 迟丽屹3
目的 探讨大鼠大脑中动脉栓塞模型中,内皮型一氧化氮合酶(eNOS)解偶联对神经血管单元的作用及机制。方法 将80只雄性SD大鼠随机分为假手术组(n=40)和大脑中动脉栓塞(MCAO)组(n=40)。参照Longa法制作MCAO模型。栓塞后6 h,通过蛋白印记法检测缺血区eNOS不同偶联状态的表达情况及3-硝基酪氨酸(3-NT)的水平;通过尼氏染色比较缺血区神经元的形态及存活情况;通过免疫组织化学染色比较缺血区星形胶质细胞、微血管内皮细胞以及血脑屏障紧密连接对应的标记物GFAP、VWF、Occludin的表达水平;通过MRI的T2加权序列和动脉自旋标记(ASL)反应栓塞后脑组织病灶范围及血流情况。结果 MCAO后栓塞部位在T2序列上呈高信号,在ASL序列上血流信号减低。eNOS二聚体/单体的比例明显低于假手术组(P<0.05);3-NT的含量明显高于假手术组(P<0.05)。尼氏染色显示MCAO后神经元大量空泡形成,核固缩变性,数量显著减少;免疫组化结果显示,VWF、Occludin的表达较假手术组明显减少,而GFAP则明显增多(P<0.05)。结论 MCAO会导致eNOS解偶联。eNOS解偶联后NO合成受限,而具有毒性作用的3-NT产生增多,炎症反应加重,从而对神经血管单元结构及功能产生破坏作用。
神经血管单元; 内皮型一氧化氮合酶; 3-硝基酪氨酸; 动脉自旋标记
脑卒中是全球范围内第二大致死性疾病[1],在卒中发病的类型中,87%为缺血性卒中[2]。近30年来,针对缺血性卒中发生后脑细胞不可逆损伤的机制出现了大量的研究,重点探讨了导致神经元死亡的原因以及使神经元抵御死亡的策略。总结过往脑卒中治疗的得失,孤立地讨论卒中发病过程中神经元细胞病理生理变化,局限地研究某种治疗方案对神经元细胞的保护所用效果,所得的结果往往与临床所见大相径庭[3]。近来的研究着眼于通过血管和细胞机制来减轻组织损伤,研究血管系统与大脑细胞之间如何相互通讯。基于对血管和神经系统的功能的重新认识,形成了神经血管单元(neuro vascular unit,NVU) 的概念[4]。NVU的结构基础是神经元、血脑屏障( blood brain barrier,BBB,包括内皮细胞、基底膜、星形胶质细胞的足突和周细胞)、小胶质细胞以及维持脑组织完整性的细胞外基质。
无论在分子、细胞水平,还是在整体动物模型上看,卒中发病后,不仅仅存在相应核心脑区供血中断而引起的缺血缺氧以及能量代谢障碍,缺血半暗带内神经元的随之触发的包括氧化应激、兴奋性毒性、炎症反应等各种病理生理改变也是卒中发病的重要机制和治疗靶点[5]。其中一氧化氮合酶(nitric oxide synthase,NOS)-一氧化氮(NOS-NO)系统与卒中及其他神经退行性疾病关系密切,尤其是在缺血再灌注过程区域尤为明显[6,7],是目前卒中致病机制研究的新热点。NOS作为NO合成的限速酶,主要有3种异构体:内皮型一氧化氮和酶(eNOS)、神经性一氧化氮和酶(nNOS)、诱导型一氧化氮合酶(iNOS)。NOS-NO已被证实在中枢神经系统生理病理条件下发挥着重要作用,如缺血性脑卒中,NO可能由于细胞来源和缺血过程阶段的不同而发挥的作用不同[8]。研究显示,eNOS在维持脑血流量、防治神经元损伤以及血小板和白细胞的聚集和粘附,从而防止卒中的作用尤其突出[9~11]。在缺血后2~72 h,eNOS的表达显著增加[12]。也有相关报道称eNOS有单体和二聚体两种偶联状态,二聚体可以减少局灶性脑缺血后NO以及超氧化物歧化酶的产生,而单体则可以增加缺血区超氧化物产生,从而加重脑损伤[13]。
1 材料和方法
1.1 实验动物及材料 雄性清洁级SD大鼠,体重250±20g,购于军事医学科学院实验动物中心,术前禁食24 h,自由饮水。Rabbit anti GAPDH antibody(GB11002,谷歌生物);eNOS(Ab-1177)antibody(21170,Signalway Antibody);Anti-nitrotytosine(N 0409,Sigma);vWF(H-300)(SC-14014,santa cruz,血管内皮细胞标记物);Occludin(H-279)(SC-5562,santa cruz,紧密连接标记物);Anti-GFAP antibody(ab7260,abcam,星形胶质细胞标记物); Goat anti-rabbit IgG-HRP(M21002,Abmart)。尼氏染色液(C0117,碧云天)。硅胶线栓(北京西浓科技有限公司)40根。SDS-PAGE凝胶配制试剂盒(P0012A,碧云天)。7.0T核磁(Bio Spec,首都医科大学)。
1.2 方法
1.2.1 实验分组及模型制作 将80只SD大鼠随机分成两组。MCAO组(40只):参照Longa等[14]制备大脑中动脉栓塞模型(middle cerebral artery occlusion,MCAO),10%水合氯醛400 mg/kg,腹腔注射麻醉,手术区域皮肤消毒,暴露颈总动脉(common carotid artery,CCA)、颈内动脉(ICA)以及颈外动脉(ECA),结扎CCA近心端及ECA,用血管钳夹闭ICA,然后预留一根丝线(距离CCA分叉2 mm左右)打结不拉紧,然后在此丝线近心端将CCA剪一小口,将尼龙栓线从此口插入,进过CCA分叉进入ICA,插入深度以栓线顶端距离分叉(1.8±0.2)cm为宜,然后拉紧预留丝线固定线栓,剪断多余栓线及丝线,缝合组织及皮肤。假手术组(40只):仅分离CCA、ICA、ECA,不结扎也不栓塞。
1.2.2 蛋白电泳 采用蛋白电泳(Western blot,WB)检测梗死区域脑组织eNOS不同偶联状态及3-NT的表达。MCAO后6 h,每组各取10只处死,快速取脑,于缺血半暗带周围取等量脑组织,加入裂解液匀浆,至组织完全裂解,冰上孵育30 min,之后离心取上清液,按1∶4加入上样缓冲液,煮沸10 min变性。然后进行SDS-聚丙烯酰胺凝胶电泳。于BIO-RAD显影仪上显影,结果采用Image J图像软件进行分析各条带密度值。
1.2.3 免疫组化 采用免疫组织化学方法对星形胶质细胞、微血管内皮细胞及紧密连接的特异性标记物GFAP、VWF、Occludin进行染色。MCAO后6 h,每组取10只大鼠,水合氯醛腹腔注射麻醉,剪开腹腔、胸腔,充分暴露心脏,先后经心脏灌注500 ml生理盐水及500 ml、4%多聚甲醛,完整取脑,依次用4%多聚甲醛、20%蔗糖、30%蔗糖固定脑组织。然后行冰冻切片(厚度为10 μm)。将切好的脑片在90 ℃抗原修复液中修复10 min,然后进行免疫组织化学染色,荧光显微镜拍照。
1.2.4 尼氏染色 采用尼氏染色法对神经元进行染色分析。制片过程同上。制作好的冰冻切片置于焦油紫中染色3 min,然后依次置入70%、80%、100%酒精中脱色各15 s,接着在二甲苯中透明15 s,用滤纸吸干,滴加树脂胶封片。在光学显微镜下观察。
1.2.5 MRI 采用7.0 T MRI评价栓塞效果及局部血流情况。术后6 h,进行核磁扫描,T2加权序列显示栓塞的部位及范围,动脉自旋标记(arterial spin-labeling,ASL)显示栓塞部位血流。
2 结 果
2.1 栓塞区域及血流 栓塞区域在T2序列上呈高信号,在ASL上血流信号减低甚至无血流(见图1),表明MCAO造模成功。
2.2 eNOS单体、二聚体及3-NT的表达 MCAO组栓塞区域脑组织3-NT表达水平,明显高于对照组,差距具有统计学意义(P<0.05);MCAO组与假手术组eNOS无明显差异(P>0.05),表明eNOS在两种情况下内皮细胞中的表达较恒定,eNOS二聚体/单体的比例在MCAO组明显减少,差异具有统计学意义(P<0.05,见图2)。
2.3 神经血管单元各组分的变化 尼氏染色结果显示,MCAO组较假手术组神经元数量明显减少,神经元皱缩变形(P<0.05,见图3)。免疫组化染色,MCAO组,栓塞区GFAP阳性星形胶质细胞数明显增多,表明炎症反应加重;VWF阳性内皮细胞及Occludin阳性紧密连接明显减少(P<0.05,见图4)。

图1 MCAO后6 h,假手术组和MCAO组MRI扫描。A、B为T2加权序列;C、D为ASL序列

图2 MCAO后6 h,Western blot显示MCAO组eNOS二聚体与单体的比值以及eNOS解偶联时的催化产物3-NT与假手术组的差异

图3 尼氏染色结果显示MCAO后神经元大量空泡形成,核固缩变性,数量显著减少
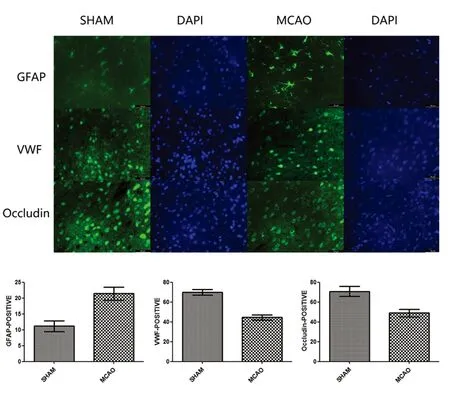
图4 免疫荧光结果显示,MCAO后6 h,GFAP阳性星形胶质细胞数量增多,VWF阳性内皮细胞及Occludin表达减少
3 讨 论
2003年,美国学者Lo EH等[15]首次提出神经血管单元的概念,强调了内皮细胞、周细胞、星型胶质细胞、小胶质细胞、基膜、细胞外基质和神经元之间的动态相互作用,以及这种相互作用对卒中病理生理学的重要性,并将这一动态复合体称为“NVU”[16]。薛强等[17]通过神经元、微血管内皮细胞以及星形胶质细胞体外共培养建立NVU模型,结果表明,该模型具有与在体相似的血脑屏障功能及在缺氧复氧损伤等的病理改变,NVU已经作为研究脑的病例生理、检测新的药物、寻找新的治疗方法的焦点。大脑的正常生理功能依赖于中枢神经系统各组分之间相互协调,星形胶质细胞和神经元可以通过释放多种物质如血管内皮生长因子、促红细胞生成素、血管生成素等调节内皮细胞的迁移、增殖和再生[18]。
一氧化氮合酶与脑缺血缺氧损伤有着密切的联系。脑卒中的病程中受多种因素的影响,而内源性NO产生增加对脑血管和神经元损伤发挥着重要作用[19]。很多研究证明NOS抑制剂(L-NAME)可以减少血脑屏障的破裂从而减轻脑急性缺血缺氧损伤[20]。但是,也有学者认为添加NO供体(L-精氨酸)可以通过扩张血管、增加局部脑血流来减轻缺血性脑损伤[21]。上述研究结果看似是矛盾的,实则是因为在不同的状态下eNOS的结构不同,催化产物也大相径庭。
内皮型一氧化氮合酶主要表达于内皮细胞,是正常生理条件下血管系统中NO的主要来源[22]。而在病理条件下,如高血压[23]、糖尿病[24]、减压病[25]等,eNOS出现功能障碍,二聚体解离为单体,则不能正常合成产生NO,而是产生大量的超氧阴离子,超氧阴离子再与NO结合生成ONOO-,进而产生细胞毒性作用。国内外对eNOS解偶联进行了大量的研究。很多数据表明,心脏、肾脏以及其他器官在缺氧复氧损伤时,eNOS在这些器官处于解偶联状态。而eNOS解偶联可以释放毒性ROS、增加微血管的通透性、血栓形成,导致细胞水肿甚至凋亡[26],eNOS解偶联还可以引起酪氨酸硝化,导致蛋白质功能减低或失活[27]。本文通过建立大脑中动脉栓塞模型,探究eNOS解偶联对脑缺血缺氧损伤的作用及机制。
综上,本研究结果显示,大脑中动脉栓塞后,ASL显示栓塞部位血流明显减少,eNOS单体/二聚体的比例增加,而eNOS总量与对照组没有明显差异,表明eNOS发生解偶联。尼氏染色结果显示,栓塞区域神经元明显减少。免疫组化结果提示MCAO后星形胶质细胞的标记分子GFAP增多,表明栓塞区域炎症反应加重,内皮细胞及血脑屏障紧密连接的标记分子VWF及Occludin都减少,提示微血管内皮细胞及血脑屏障的结构受损。eNOS解偶联(单体比例增加)作为一个非常重要的因素,通过减少栓塞部位血流、增加超氧化物产生、加重栓塞区域炎症反应等机制,破坏神经血管单元的结构及功能,破坏血脑屏障的通透性。另外,eNOS解偶联可能成为缺血性卒中一个新的治疗靶点,干预该过程能否改善脑缺氧复氧损伤后神经血管单元的功能还有待于进一步研究。
[1]Arai K,Lok J,Guo S,et al.Cellular mechanisms of neurovascular damage and repair after stroke[J].Journal of Child Neurology,2011,26(9):1193-1198.
[2]Roger VL,Go AS,Lloyd-Jones DM,et al.Heart disease and stroke statistics-2011 update:a report from the American Heart Association.Circulation,2011,123:e18-e209.
[3]Liu Z,Chopp M.Astrocytes,therapeutic targets for neuroprotection and neurorestoration in ischemic stroke[J].Progress in Neurobiology,2015,144:103-120.
[4]del Zoppo GJ.The neurovascular unit in the setting of stroke[J].Intern Med,2010,267(2):156-171.
[5]Kitagawa K.CREB and cAMP response element-mediated gene expression in the ischemic brain[J].The FEBS,2007,274(13):3210-3217.
[6]Garry PS,Ezra M,Rowland MJ,et al.The role of the nitric oxide pathway in brain injury and its treatment-from bench to bedside[J].Experimental Neurology,2015,263:235-243.
[7]Lundberg JO,Weitzberg E,Gladwin MT.The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics[J].Nature Reviews Drug Discovery,2008,7(2):156.
[8]Moro MA,Cardenas A,Hurtado O,et al.Role of nitric oxide after brain ischaemia[J].Cell Calcium,2004,36(3~4):265-275.
[9]Jiang MH,Kaku T,Hada J,et al.Different effects of eNOS and nNOS inhibition on transient forebrain ischemia[J].Brain Research,2002,946(1):139-147.
[10]Chen SH,Cheung RT.Neuropeptide Y and its receptor analogs differentially modulate the immunoreactivity for neuronal or endothelial nitric oxide synthase in the rat brain following focal ischemia with reperfusion[J].Journal of Biomedical Science Online,2005,12(2):267-278.
[11]Ayata C,Ma J,Meng W,et al.L-NA-sensitive rCBF augmentation during vibrissal stimulation in type Ⅲ nitric oxide synthase mutant mice[J].Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism,1996,16(4):539-541.
[12]Hua Q,Zhu X,Li P,et al.Refined qing kai ling,traditional Chinese medicinal preparation,reduces ischemic stroke-induced infarct size and neurological deficits and increases expression of endothelial nitric oxide synthase[J].Biological & Pharmaceutical Bulletin,2008,31(4):633-637.
[13]Yagita Y,Kitagawa K,Oyama N,et al.Functional deterioration of endothelial nitric oxide synthase after focal cerebral ischemia[J].Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism,2013,33(10):1532-1539.
[14]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[15]Lo EH,Dalkara T,Moskowitz MA.Mechanisms,Challenges and opportunities in stroke[J].Nat Rev Neurosci,2003,4(5):399-415.
[16]夏明武,秦 勇,刘祖欣.神经血管单元与脑缺血的研究进展[J].中国脑血管病杂志,2011,8(10):553-556.
[17]Qiang X,Yang L,Hongyi Q,et al.A novel brain neurovascular unit model with neurons,astrocytes and microvascular endothelial cells of rat[J].International Journal of Biological Sciences,2013,9(2):174.
[18]Haseloff RF,Blasig IE,Bauer HC,et al.In search of the astrocytic factor(s) modulating blood-brain barrier functions in brain capillary endothelial cells in vitro[J].Cellular and Molecular Neurobiology,2005,25:25-39.
[19]Mohammadi MT,Shidmoosavi SM,Dehghani GA.Contribution of nitric oxide synthase (NOS) in blood-brain barrier disruption during acute focal cerebral ischemia in normal rat[J].Pathophysiology,2012,19(1):13-20.
[20]Ding ZL,Marchand VCN,Plotkine M,et al.L-NAME reduces infarction,neurological deficit and blood-brain barrier disruption following cerebral ischemia in mice[J].European Journal of Pharmacology,2002,457(2-3):137.
[21]Dalkara T,Morikawa E,Panahian N,et al.Blood flow-dependent functional recovery in a rat model of focal cerebral ischemia.[J].Am J Physiol,1994,267(2):678-83.
[22]Bian K,Murad F.Nitric oxide (NO)-biogeneration,regulation,and relevance to human diseases[J].Frontiers in Bioscience,2003,8(1):264.
[23]Victorio JA,Clerici SP,Roberto P,et al.Spironolactone prevents endothelial nitric oxide synthase uncoupling and vascular dysfunction induced by β-adrenergic over stimulation:role of perivascular adipose tissue[J].Hypertension,2016,68(3):726-735.
[24]Youn JY,Zhou J,Cai H.Bone morphogenic protein 4 mediates NOX1-dependent eNOS uncoupling,endothelial dysfunction,and COX2 induction in type 2 diabetes mellitus[J].Molecular Endocrinology,2015,29(8):1123.
[25]林海珊,欧 敏,方以群.eNOS解偶联对减压病大鼠肺动脉内皮功能损伤的影响[J].解放军医学杂志,2015,40(6):502-506.
[26]Bauersachs J,Bouloumie A,Fraccarollo D,et al.Endothelial dysfunction in chronic myocardial infarction despite increased vascular endothelial nitric oxide synthase and soluble guanylate cyclase expression[J].Circulation,1999,100(3):292.
[27]Chen G L,Liu J,Bian K.Research progress on the relationship between protein specific oxidation and diseases[J].Chinese Pharmacological Bulletin,2009,25(5):561-565.
Effects and mechanism of eNOS uncoupling on the neurovascular unit in rats with middle cerebral artery occlusion
ZENGJing,LIDandan,ZHAOHongyi,etal.
(ShaanxiUniversityofChineseMedicine,Xianyang712046,China)
Objective To investigate the effect and mechanism of eNOS uncoupling on neurovascular unit in the rats model of middle cerebral artery occlusion.Method Eighty male SD rats were randomly distributed into two groups:sham operation and middle cerebral artery occlusion(MCAO).MCAO was made by Longa’s method.At 6 h after MCAO,the expression of uncoupling endothelial nitric oxide synthetase (eNOS) and 3-nitrotyrosine(3-NT) in the ischemic area were analysis by Western blotting.The survival of neurons in ischemic region was compared by Nissl staining.The expression of GFAP,VWF and occludin were represented astrocytes,endothelial cells and tight junction of blood brain barrier(BBB) were analyzed by immunohistochemistry.The range and blood flow of brain tissue were detected by MRI T2sequence and ASL sequence.Results After MCAO,the ischemic area showed low signal on T2sequence and the blood high signal decreased on ASL sequence.The ratio of eNOS dimer/monomer significantly decreased in MCAO group than in sham group and the expression of 3-NT significant increased in MCAO group.Immunohistochemistry showed that VWF and Occludin were decreased but GFAP increased.Conclusions MCAO may lead to uncoupling of eNOS dimers in the ischemic area.eNOS uncoupling restricted NO synthesis but increased the toxic effect of 3-NT,the inflammatory response is aggravated which can damage the structure and function of neurovascular unit.
Neurovascular unit; eNOS; 3-NT; ASL
1003-2754(2017)06-0500-04
2017-04-11;
2017-06-03
(1.陕西中医药大学,陕西 咸阳 712046;2.中国人民解放军陆军总医院神经内科,北京 100700;3.中国人民解放军第四五一医院神经内科,陕西 西安 710054)
迟丽屹,E-mail:chi603@foxmail.com
R743.3
A
