非酮症性高血糖合并偏侧舞蹈症1例报告及文献复习
2017-07-19张国峰赵曼丽董晓雪张伦忠兰希福
张国峰, 赵曼丽, 董晓雪, 张伦忠, 兰希福
非酮症性高血糖合并偏侧舞蹈症1例报告及文献复习
张国峰1, 赵曼丽2, 董晓雪1, 张伦忠2, 兰希福2
糖尿病高血糖可引起的神经系统症状包括幻觉、谵妄、昏迷、癫痫、类卒中综合征等,而偏侧舞蹈症较少见[1]。我们临床诊治了1例患者,既往有糖尿病病史,以偏侧舞蹈症为主要临床表现,现汇报如下。
1 病例介绍
患者,女,61岁,退休。以“右侧肢体不自主运动1 m”为主诉收住院。患者1 m前出现右上肢及右侧足趾不自主运动,右面部不自主挤眉弄眼,症状持续时间不定,每日发作1~4次,睡眠时症状消失,无肢体麻木及无力,无肢体抽搐,无行走不能,无发热寒战,无意识障碍,患者入院前无劳累、情绪波动、感染等明显原因及诱因,平素纳睡可,二便调。患者既往患有2型糖尿病,病史10余年,平素服用降糖药物治疗,血糖控制不佳,患者无吸烟、饮酒史,患者47岁绝经,配偶及子女体健,否认家族中有同类疾病。神经系统查体:患者神志清,高级智能正常,脑神经未见明显异常,四肢肌力约为Ⅴ级,肌张力正常,腱反射(+),深浅感觉未见异常,右侧上肢可见不自主运动,表现为上下拍打,耸肩,右脚足趾不自主扭转,右侧面部不自主的挤眉弄眼,双侧共济运动未见异常,闭目难立征(-),双侧巴氏征未引出,脑膜刺激征(-)。实验室检查:空腹血糖9.6 mmol/L,糖化血红蛋白12.7%,尿常规:尿糖()、酮体(-),血常规、血凝、甲功、肝肾功、血脂、电解质正常,乙肝、抗O正常;血清铜蓝蛋白正常范围,入院后行头部CT:左侧基底节区见片状略高密度影,边界欠清,相邻脑实质未见明显受压征象,CT值约45 Hu(见图1A)。头部MRI+DWI:左侧基底节见片短T1信号(见图1B),略长T2异常信号,T2flair序列呈略高信号,DWI序列未见明显弥散受限。头部MRI增强扫描+SWI+ASL:左侧基底节区短T1信号,未见对比强化,SWI序列示双侧基底节区对称性片状低信号(见图1C),ASL示左侧基底节区局部血流量较对侧减少(见图1D),余脑实质内未见异常信号。
2 诊疗过程
结合患者病史、症状、体征、辅助检查,临床诊断为糖尿病非酮症偏侧舞蹈症。给予胰岛素控制血糖,并监测患者血糖变化,并给予氟哌啶醇2 mg bid口服治疗,1 d后患者右上肢不自主运动明显减轻,仍见右脚足趾不自主屈伸,住院期间症状逐渐好转。对症处理10 d后患者未再发作不自主运动,出院,嘱患者及时监测血糖,继续服用药物,3个月余后随诊患者偏侧舞蹈症消失,头部MRI T1左侧基底节见,短T1信号较前明显减少(见图2A),略长T2异常信号较前明显较少,SWI序列示双侧基底节区仍见对称性片状低信号(见图2B),ASL序列示左侧基底节区局部血流量仍较对侧减少(见图2C)。
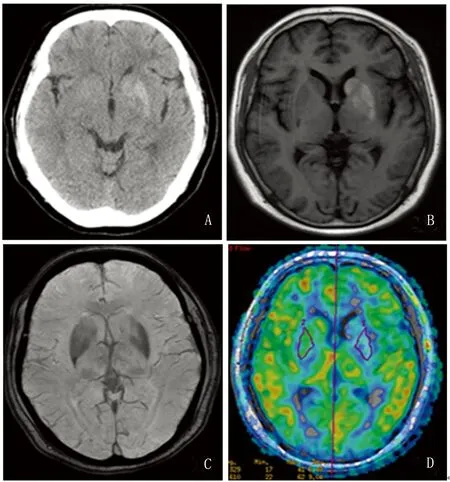
图1 患者女,61岁,非酮症性高血糖合并偏身舞蹈症(左侧)初诊。头部CT(1A)示左侧基底节区见片状略高密度影,T1WI(1B)示左侧基底节呈片状高信号,SWI(1C)示双侧基底节区对称性片状低信号,ASL(1D)示左侧基底节区局部血流量较对侧减少

图2 患者女,61岁,非酮症性高血糖合并偏身舞蹈症(左侧)3 m余后复诊。患者T1WI(2A)示左侧基底节片状高信号较前明显较少,SWI(2B)示双侧基底节区仍见对称性片状低信号,ASL(2C)示左侧基底节区局部血流量仍较对侧减少
3 讨 论
1960年,Bedwell SF首次报道非酮症性高血糖合并偏身舞蹈症[2]。本病多急性或亚急性起病,常见于亚裔女性,男女比例范围是1∶1.8~5,提示本病可能有种族和性别差异[3],多发生于血糖控制不佳的糖尿病患者或既往未发现糖尿病而以舞蹈症为首发者[4]。目前文献中尚无本病的统一命名及诊断标准,且发病机制尚无统一认识。总结以前文献报道,均具有以下相似特点:(1)患者以老年女性居多,既往有或无糖尿病病史,均无酮症;(2)患者以偏侧肢体舞蹈症表现居多,部分患者可累及双侧肢体,或面部肌肉;(3)大多数患者头部MRI示病变肢体对侧基底节区T1WI呈高信号;(4)大部分患者在控制血糖或同时应用药物如氟哌啶醇或氯硝西泮后,偏侧舞蹈症状明显好转或消失,突变病变基底节区T1WI高信号减弱或消失。
关于非酮症性高血糖合并偏身舞蹈症的病理生理机制目前尚未明确。目前文献主要提出以下可能机制:(1)GABA(γ-氨基丁酸)传导阻滞是非酮症性高血糖合并偏身舞蹈症的发病机制之一。患者处于高血糖状态时,脑组织以无氧代谢获得能量,三羧酸循环被抑制,能量产生显著减少,脑细胞以GABA为能量来源。GABA是一种可直接、间接作用于基底节的抑制性神经递质。非酮症患者的GABA被很快耗竭又无法重新合成,导致其作用于基底节的抑制作用减弱,进而引起大脑皮质兴奋性增加,从而发病[5]。(2)多巴胺能神经元活性的改变参与了非酮症性高血糖合并偏身舞蹈症的发生。高血糖状态时,多巴胺(dopamine,DA)能神经元活性改变,使DA受体上调,DA分解代谢减少,DA水平增高,通过增强基底核神经环路中直接环路的易化作用和减弱间接环路的抑制作用,使基底核神经环路对正常运动的调节紊乱,导致偏身舞蹈症的发生。临床上应用多巴胺受体拮抗剂,如氟哌啶醇能够缓解患者的临床症状,在某种程度上证明了此发病机制[3]。(3)非酮症性高血糖合并偏身舞蹈症的发病以老年女性患者居多,表明女性是一个诱发因素。雌激素对黑质纹状体系统中DA有抑制作用,同时也可以增加脑内多巴胺受体的浓度。女性绝经期后雌激素水平下降,对DA的抑制作用减弱,多巴胺受体浓度增加及其敏感性增强,导致舞蹈症的发生[6]。这或许是老年女性多发的原因之一。
非酮症性高血糖合并偏身舞蹈症的影像学表现具有特征性。主要表现为病变肢体对侧基底节区,主要是尾状核头和壳核,在发病初期CT表现为高密度,并可在短时间内减弱或消失;MRI T1WI相应区域呈高信号,可持续较长时间,且病灶具有可逆性,共同特点是边界清晰,无明显水肿及占位效应,不累及内囊。Fujioka等通过动物实验研究证实,高血糖状态能使Mn2+通过血脑屏障,并聚集在反应性增多肿胀的肥胖型星形胶质细胞内,Mn2+可以在神经突触间传递并在神经细胞内沉积,一旦进入细胞,其滞留时间变得很长,此为Mn2+的“快进慢退”特性[7]。Mn2+为顺磁性物质,致使T1弛豫时间缩短,因此,影像学上,T1WI呈高信号。并且因Mn2+具有脑内基底节选择性沉积和这种“快进慢退”的积聚特性,可以解释基底节高T1信号持续较长时间且信号会逐渐减小的现象。本例患者初诊的头部MRI T1WI左侧基底节区的异常信号在3 m余后显示明显减少,提示经药物积极治疗后,左侧基底节区信号的变化可能有上述机制的参与,但其中具体机制仍需要进一步研究。有学者认为MRI的T1WI高信号可能是出血性过程,Mestre等[8]对1例患者进行尸解发现病变区纹状体周围有局灶性微出血。但是神经病理学研究在基底节异常信号区仅仅发现了星形胶质细胞增生,未发现含铁血黄素沉积[9],并且通过磁共振磁敏感加权成像技术SWI,研究认为缺血性脑梗死可能为主要发病原因[10]。本例患者头部SWI双侧基底节区呈对称性片状低信号,未见含铁血黄素沉积,且ASL序列示左侧基底节区局部血流量较对侧减少,说明病变部位存在缺血机制。Ondo还认为T1WI高信号的原因在于锌沉积,而非钙沉积[11],具体机制目前尚不清楚,仍需大量病例资料予以证实。
总之,非酮症性高血糖合并偏侧舞蹈症的发病机制及影像学表现原因仍然不明确,但在临床上遇到以偏身不自主运动为主要症状就诊的患者,尤其老年女性,应注意患者血糖的检测,如患者头部MRI示病变肢体对侧基底节区T1WI呈高信号,应想到诊断本病的可能。通过本组病例报告,期望增加临床医师对该病的认识,以便及时诊断治疗。
[1]Mugundhan K,Maski A,Elanchezhian JA,et al.Mixed movement disorder as the presenting manifestation of non-ketotic hyperglycemia[J].Assoc Physicians India,2010,58:387-388.
[2]Bedwell SF.Some observations on hemiballismus[J].Neurology,1960,10(6):619-622.
[3]Oh SH,Lee KY,Im JH,et al.Chorea associated with non-ketotic hyperglycemia and hyperintensity basal ganglia lesion onT1-weighted brain MRI study: a meta-analysis of 53 cases including four present cases[J].Neurol Sci,2002,200(1/2):57-62.
[4]高 欢,徐德友,徐家立.非酮症高血糖性舞蹈症2例临床及影像学特点分析[J].中西医结合心脑血管病杂志,2016,14(15):1820-1822.
[5]Ahlskog JE,Nishino H,Evidente VG,et al.Persistent chorea triggered by hyperglycemic crisis in diabetics[J].Mov Disord,2001,16(5):890-898.
[6]Sitburana O,Ondo WG.Tetrabenazine for hyperglycemic-induced hemichorea-hemiballismus[J].Mov Disord,2006,21(11):2023-2025.
[7]黄婷婷,王兆新,肖壮伟,等.锰离子增强磁共振成像在动物神经系统研究中的应用[J].中国医学影像技术,2007,23:1734.
[8]Mestre TA,Ferreira JJ,Pimentel J.Putaminal petechial haemorrhage as the cause of non-ketotic hyperglycaemic chorea: a neuropathological case correlated with MRI findings[J].J Neurol Neurosurg Psychiatry,2007,78(5):549-550.
[9]Ohara S,Nakagawa S,Tabata K,et al.Hemiballism with hyperglycaemia and striatal T1-MRI hyperintensity:an autopsy report[J].Mov Disord,2001,16(3):521-525.
[10]Cherian A,Thomas B,Baheti NN,et al.Concepts and controversies in nonketotic hyperglycemia-induced hemichorea:further evidence from susceptibility-weighted MR imaging[J].J Magn Reson Imaging,2009,29(3):699-703.
[11]Ondo WG.Hyperglycemic nonketotic states and other metabolic imbalances[J].Handb Clin Neurol,2011,100:287-291.
1003-2754(2017)06-0559-02
R745.1
2017-02-23;
2017-05-28
(1.山东中医药大学第一临床医学院,山东 济南 250000;2.山东省潍坊市中医院脑病科,山东 潍坊 261041 )
张伦忠,E-mail:zhanglunzhong@163.com
