大兴安岭金莲花不同部位黄酮抗氧化活性研究
2017-07-18刘洋周鸿立马先红邓敏君覃媚媚隋新
刘洋,周鸿立,马先红,邓敏君,覃媚媚,隋新,*
(1.吉林化工学院生物与食品工程学院,吉林吉林132022;2.吉林化工学院化学与制药工程学院,吉林吉林132022)
大兴安岭金莲花不同部位黄酮抗氧化活性研究
刘洋1,周鸿立2,马先红1,邓敏君1,覃媚媚1,隋新1,*
(1.吉林化工学院生物与食品工程学院,吉林吉林132022;2.吉林化工学院化学与制药工程学院,吉林吉林132022)
对金莲花花瓣和花茎中黄酮进行抗氧化对比研究。用醇提法分别提取金莲花花瓣和花茎黄酮,采用D101大孔树脂进行纯化,以L-抗坏血酸(VC)作对比,分别用还原力法、DPPH法、羟基自由基法、ABTS法对其进行抗氧化性进行研究。结果显示:花瓣与花茎的总黄酮含量分别为14.83%和13.3%。花瓣与花茎黄酮对DPPH自由基与ABTS自由基都有较好的清除作用。其中花瓣黄酮与花茎黄酮在选定浓度范围内,对DPPH自由基清除能力差异不显著,但都低于VC的清除率;当浓度大于0.16 mg/mL时,花瓣黄酮清除ABTS自由基略高于花茎黄酮,接近VC的清除率。花瓣与花茎黄酮的还原能力与清除羟基自由基能力较弱,远低于照品VC的抗氧化能力。
金莲花;黄酮;抗氧化
金莲花为毛莨科植物长瓣金莲花的干燥花,多分布于我国北方高山地区,资源丰富,株高30cm~100 cm[1-2]。目前对金莲花的研究多集中于花瓣提取物的提取及活性,大量研究表明,花瓣中富含黄酮类、多糖等多种活性物质,具有抗菌消炎、治疗咽炎及上呼吸道感染等作用[3-5],研究表明,其主要活性成分为金莲花黄酮类物质。金莲花黄酮多分布于植物的茎叶及花瓣中,少部分以游离形式存在,多数研究证实,金莲花黄酮具备较好的抗氧化作用[6-9]。但由于目前对金莲花的研究多集中于花瓣,花瓣提取物也多用于药物开发,民间也常以花代茶饮用的习惯,而对金莲花茎的研究较为少见。若金莲花30 cm~100 cm高的花茎与花瓣类似,具有同样的活性成分及作用,实现花茎的开发与利用,将会提升金莲花附加值,实现变废为宝[10-12]。本文以大兴安岭地区野生金莲花为研究对象,分别提取金莲花花瓣、花茎黄酮,并对其抗氧化活性进行对比研究,这将为金莲花花瓣、花茎在食品、医药、保健领域的开发与应用,奠定良好的理论基础。
1 材料与方法
1.1 试验原料
野生金莲花:采自大兴安岭地区,经过干燥、分离花瓣与花径,碾磨粉碎后备用。
1.2 试验设备
JYL-D0料理机:九阳股份有限公司;AL204电子天平(0.0001 g):梅特勒托利多仪器(上海)有限公司;AKHL-Ⅲ.5804R离心机:德国Eppendo公司;UV-6100型紫外可见分光光度计:上海美谱达仪器有限公司。
1.3 标准曲线的确定
精密称取120℃干燥至质量恒定的芦丁标准品75.0 mg,用体积分数60%乙醇溶液定容至100 mL,得到质量浓度0.75 mg/mL的标准品溶液。精密吸取上述标准品溶液 0.2、0.4、0.6、0.8、1.0、1.2 mL 分别置于10 mL容量瓶中,加入5%NaNO2溶液0.4 mL,摇匀放置6 min,加入10%Al(NO3)3溶液0.4 mL,摇匀,放置6 min,加入4%NaOH溶液4 mL,摇匀放置15 min,定容后,在510nm波长处测定吸光度A值,以对照品质量浓度为横坐标、吸光度A值为纵坐标绘制标准曲线。
1.4 黄酮的提取及测定
分离金莲花花瓣和花茎,碾磨粉碎,以团队前期研究所得最佳提取工艺条件进行提取:乙醇浓度为60%,温度为70℃,提取时间为3.5 h,料液比为1∶60(g/mL),分别提取金莲花花瓣和花茎粗黄酮。分别吸取上述金莲花花瓣和花茎黄酮提取液0.2 mL置于10 mL容量瓶中,按1.3步骤进行含量测定。利用回归方程,计算出总黄酮浓度。
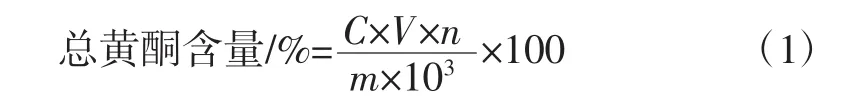
式中:C为根据标准曲线计算出的总黄酮质量浓度,mg/mL;V为提取液体积,mL;n为提取溶液稀释倍数;m为提取金莲花的质量,g。
1.5 黄酮的纯化
依据前期研究所选用的最佳纯化工艺进行纯化:选用D101大孔树脂吸附金莲花黄酮的最佳工艺条件(上样浓度为2.7 mg/mL、上样流速为2.50 BV/h、上样pH 5.09)分别对金莲花花瓣和花茎黄酮进行纯化。
1.6 抗氧化试验方法
1.6.1 还原力法
依次在试管中加入浓度为 0.2、0.4、0.6、0.8、1.0mg/mL金莲花花瓣和花茎的黄酮样品溶液和浓度为0.04、0.08、0.12、0.16、0.20 mg/mL 的 VC样品溶液 1.0 mL,磷酸盐缓冲溶液(0.2 mol/L,pH=6.6)2.5 mL和1%铁氰化钾2.5 mL,置于50℃水浴中反应20 min,然后加入10%的三氯乙酸(TCA)2.5 mL,混匀后以3 000 r/min离心10 min,取上清液2.5 mL,加入0.1%三氯化铁溶液0.5 mL和2.5 mL的蒸馏水,摇匀后在700 nm处测定吸光值,每个浓度3个平行,取平均值。
1.6.2 DPPH法
依次在试管中加入浓度为 0.04、0.08、0.12、0.16、0.20 mg/mL金莲花花瓣、花茎和VC样品液1 mL,再加入5 mL浓度为0.2 mmol/L的DPPH(1,1-二苯基-2-三硝基苯肼)醇溶液(无水乙醇配制),混匀后在室温下避光反应30 min,在517 nm下测定吸光度,空白组中用1 mL蒸馏水代替样品液,根据如下公式计算样品和VC对DPPH自由基清除率:
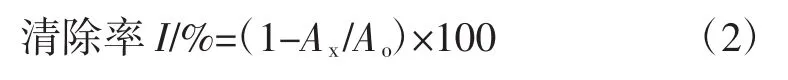
式中:Ao为空白组吸光度;Ax为样品组吸光度。
1.6.3 清除羟基自由基法
水杨酸比色法:在试管中加入浓度为0.04、0.08、0.12、0.16、0.20 mg/mL金莲花花瓣、花茎和VC样品液2 mL,加入 1 mL 2.5 mmol/L 的 FeSO4,1 mL 2.5 mmol/L的水杨酸溶液,在37℃下水浴30 min。再加入1 mL 2.5mmol/L的H2O2,37℃下水浴30min,再分别加入1mL蒸馏水,在530 nm处测其吸光度。

式中:Ao为空白组吸光度;Ax为样品组吸光度。
1.6.4 ABTS法
向20 mL5 mmol/L ABTS(3-乙基-苯并噻唑-6-磺酸)溶液中加入1 g MnO2,在室温下保存30 min,形成ABTS储备液,向储备液中加入pH=7.4的磷酸盐缓冲溶液,至混合液的吸光度为7.0±0.02,即为ABTS工作液。依次在试管中加入浓度为 0.04、0.08、0.12、0.16、0.20 mg/mL金莲花花瓣、花茎和VC样品液0.1 mL,加入7 mL ABTS溶液,以蒸馏水作为空白组对照,将溶液混合均匀,避光保存10 min,在734 nm处测吸光度。按下式计算样品对ABTS自由基的清除率。
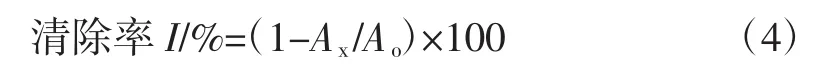
式中:Ao为空白组吸光度;Ax为样品组吸光度。
2 结果与分析
2.1 金莲花总黄酮标准曲线
对照品芦丁标准曲线,如图1所示。
从图1中曲线可以得出芦丁浓度与吸光度A值之间的回归方程:y=10.4x-0.035,相关系数R2=0.999 75。y为样品液在波长510 nm处的吸光度A值,x为总黄酮质量浓度(mg/mL)。结果表明,在芦丁质量浓度为0.015 mg/mL~0.090 mg/mL范围内线性关系良好。
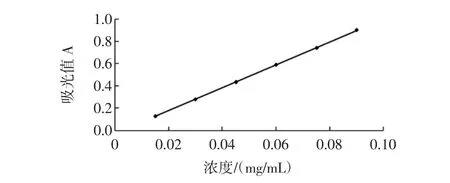
图1 对照品芦丁的标准曲线Fig.1 Standard curve of rutin
2.2 金莲花花瓣、花茎总黄酮含量
根据式(1),测定时定容体积为10 mL,提取液定容体积为500 mL,吸取测定体积为0.2 mL,样品质量为10 g,计算花瓣、花茎黄酮含量分别为14.83%与13.3%。
2.3 金莲花花瓣、花茎黄酮纯化前后纯度变化
经过纯化后的金莲花花瓣、花茎纯度变化如表1所示。

表1 金莲花花瓣、花茎黄酮纯化结果Table 1 Purification results of flavonoids in lotus petals,stems
金莲花花瓣纯化前纯度为55.76%,纯化后纯度为82.8%,纯度提高了0.48倍;金莲花花茎纯化前纯度为52.2%,纯化后纯度为79.09%,纯度提高了0.51倍。
2.4 抗氧化试验结果
2.4.1 金莲花花瓣、花茎黄酮还原力作用
采用还原力方法,对金莲花花瓣、花茎黄酮进行抗氧化研究,并以L-抗坏血酸(VC)作对比。按上述1.6.1的方法测得吸光值,并建立浓度与吸光值曲线如图2所示。
从图2可知,金莲花花瓣和花茎黄酮具有一定的还原能力,其还原能力随着样品浓度的增大而增大。在浓度为0.04 mg/mL时,花瓣、花茎和VC的还原能力差别不是很大;当浓度大于0.04 mg/mL时,VC的还原能力远远大于花瓣和花茎黄酮的还原能力。金莲花花瓣、花茎黄酮虽然具备一定的还原能力,但是都远低于VC的还原能力。
2.4.2 金莲花花瓣、花茎DPPH自由基清除作用
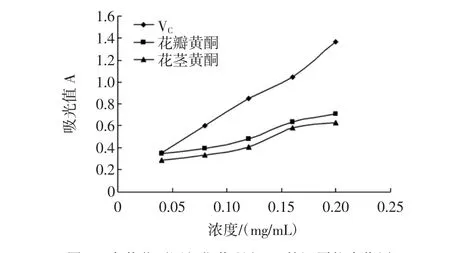
图2 金莲花不同部位黄酮和VC的还原能力作用Fig.2 Effect of reduction ability of Trollius flavonoids and VCin different parts
采用清除DPPH自由基方法对金莲花花瓣、花茎黄酮进行抗氧化研究[10-11],并以VC作对比。按照1.6.2的方法测定吸光度并计算出其对DPPH自由基清除率,建立浓度与清除率的曲线,结果如图3所示。

图3 金莲花不同部位黄酮和VC清除DPPH自由基作用Fig.3 DPPH radical scavenging activity of flavonoids and VCin different parts of Trollius
由图3可知,金莲花花瓣与花茎黄酮对DPPH自由基清除率随着其浓度的增加而逐渐升高。当浓度小于0.08 mg/mL时,花茎黄酮的清除率与VC差距比较小,且两者的清除率高于花瓣黄酮的清除率;当浓度大于0.08 mg/mL时,花茎黄酮的清除率逐渐与花瓣黄酮清除率接近,但小于VC的清除率。当浓度为0.08 mg/mL~0.16 mg/mL时,花瓣黄酮的清除率与花茎差距逐渐减小,差别不显著。当浓度为0.20mg/mL时,花瓣黄酮、花茎黄酮、VC的DPPH清除率分别为80.42%、78.90%、95.78%。此结果表明花瓣和花茎中黄酮对DPPH自由基具有一定的清除作用,但两者对DPPH清除率都低于VC,且两者差异不显著。
2.4.3 金莲花花瓣、花茎黄酮清除羟基自由基作用
采用清除羟基自由基方法对金莲花花瓣、花茎黄酮进行抗氧化研究,并以VC作对比[12-13]。按照1.6.3的方法测定吸光度并计算出其对羟基自由基清除率,建立浓度与清除率的曲线,结果如图4所示。

图4 金莲花不同部位黄酮和VC清除羟基自由基作用Fig.4 Hydroxyl radical scavenging activity of flavonoids and VCin different parts of Trollius
由图4可知,金莲花花瓣、花茎黄酮都具有清除羟基自由基的能力,且随着黄酮质量浓度的逐渐增加。当浓度为0.04 mg/mL时,花茎黄酮的清除率与VC差距较小,且都高于花瓣黄酮的清除率,当浓度大于0.04 mg/mL时,花茎黄酮的清除率与VC差距逐渐增大,且花茎黄酮的清除率始终高于花瓣黄酮的清除率。当浓度为0.20 mg/mL时,金莲花花瓣、花茎黄酮和L-抗坏血酸的清除率分别为25.55%、38.34%、97.23%。此结果表明金莲花花瓣、花茎黄酮具有一定的清除羟基自由基的能力,但清除率不超过40%,远远低于VC的清除羟基自由基能力。
2.4.4 金莲花花瓣、花茎黄酮清除ABTS自由基能力
ABTS 自由基(ABTS+·)是由 ABTS-(NH3)2通过强氧化剂氧化而得的一种相对稳定的自由基,当向溶液中加入自由基清除剂时,溶液在752 nm处的吸光度变小或消失,其变化程度与样品浓度呈良好的线性关系[14-15]。按照1.6.4的方法测定吸光度,对金莲花花瓣、花茎黄酮进行抗氧化活性的研究,并用VC作对比,计算出其对ABTS自由基清除率,建立浓度与清除率的曲线,结果如图5所示。

图5 金莲花不同部位黄酮和L-抗坏血酸的清除ABTS自由基能力Fig.5 ABTS free radical scavenging ability of flavonoids and VCin different parts of Trollius
由图5可知,金莲花花瓣、花茎黄酮都具有清除ABTS自由基能力,并且随着黄酮浓度的增加,清除ABTS自由基能力也随之增强。在浓度为0.04 mg/mL时,花茎黄酮与花瓣黄酮的清除率相差较小,且花茎黄酮的清除率高于花瓣黄酮的清除率;当浓度大于0.12 mg/mL时,花瓣黄酮的清除率逐渐大于花茎黄酮的清除率,且差距越来越大;当浓度0.08 mg/mL~0.16 mg/mL时,金莲花花瓣、花茎黄酮清除率与VC差距较大;当浓度大于0.16 mg/mL时,花瓣黄酮的ABTS自由基清除率与VC差距越来越小,且VC的ABTS自由基清除能率始终高于金莲花花瓣和花茎的清除率。当浓度为0.20 mg/mL时,金莲花花瓣、花茎黄酮和VC的ABTS自由基清除率分别为64.18%、46.09%、71.07%,结果表明金莲花瓣黄酮与VC都有良好的清除ABTS自由基能力,花茎黄酮的清除ABTS自由基能力较弱。当浓度低于0.12 mg/mL时,花瓣黄酮与花茎黄酮都较低,且差异不显著。当浓度大于0.12 mg/mL时,花瓣黄酮的清除ABTS自由基能力高于花茎黄酮的清除ABTS自由基能力。
3 结论
本试验采用醇提法分别对金莲花花瓣和花茎进行提取,采用D101大孔树脂进行纯化,并以VC作对比,对纯化后的金莲花花瓣、花茎进行抗氧化研究。结果显示:花瓣与花茎的总黄酮含量分别为14.83%和13.3%。花瓣与花茎黄酮对DPPH自由基与ABTS自由基都有较好的清除作用。其中花瓣黄酮与花茎黄酮在选定浓度范围内,对DPPH自由基清除能力差异不显著,但都低于VC的清除率;当浓度大于0.16 mg/mL时,花瓣黄酮清除ABTS自由基略高于花茎黄酮,接近VC的清除率。花瓣与花茎黄酮的还原能力与清除羟基自由基能力较弱,与对照品VC的差距较大。
通过对比研究发现,金莲花花茎中的黄酮含量与花瓣中黄酮接近,两者对DPPH自由基与ABTS自由基都有较好的清除作用,抗氧化能力接近。这为金莲花茎的开发与利用提供了一定的理论支撑。
[1]吴一飞,袁东亚,巩江,等.金莲花药学研究概况[J].山东中医药大学学报,2011,34(6):544-545
[2]曲彩红,颜娟,田嘉铭,等.HPLC测定金莲花中三种黄酮苷的含量[J].中成药,2012,32(3):500-502
[3]钱俊臻,王伯初,谭君,等.黄酮类化合物的金属配合物及其药理作用[J].中国药理学通报,2012,28(8):58-62
[4]刘爱华,田慧群,覃晓琳,等.木瓜总黄酮抗肿瘤活性研究[J].中国药房,2014(7):599-601
[5]Hongyan Li,Yang Liu.Research Progress on the Extraction,Purification and Pharmacological Action of Flavonoids in Trollius chinensis Bunge[J].Applied Mechanics and Materials,2013,295:283-286
[6]李鸿飞,卿德刚,张娟,等.甘草渣中总黄酮清除羟自由基能力的研究[J].新疆医科大学学报,2015,38(2):182-186
[7]王如峰,刘瑞凝,赓迪.短瓣金莲花的挥发性成分研究[J].时珍国医国药,2011,22(6):1382-1383
[8]侯滨滨.金莲花中黄酮类物质对食用油脂的抗氧化性能研究[J].天津化工,2011,25(2):42-43
[9]唐津忠.金莲花中黄酮类化合物的提取及其抗氧化性研究[J].食品科学,2003,24(6):89-91
[10]丰永红,于淑娟,李国基,等.DPPH法测甘蔗提取物抗氧化活性研究[J].甘蔗糖业,2003(1):31-33,50
[11]佘世望.60种药食两用植物抗氧化作用的研究[J].食品科学,1995,16(11):3-5
[12]L R Fukumoto,G Mazza.Assessing antioxidant and prooxidant activities of phenolic compounds[J].JournalofAgriculturalFoodChemistry,2000,48(8):97-104
[13]张汇慧.刺梨黄酮的提取、分离及抗氧化活性研究[D].南京:南京林业大学,2015
[14]乐薇,张思思.箬叶总黄酮体外抗氧化活性的研究[J].食品科技,2015,40(11):204-209
[15]应瑞峰,季苏杰,李婷婷,等.青钱柳叶黄酮的分离纯化与抗氧化性研究[J].食品科技,2015,40(12):174-178
Total Flavonoids Antioxidation Activity of Trollius chinensis Bunge in Different Parts
LIU Yang1,ZHOU Hong-li2,MA Xian-hong1,DENG Min-jun1,QIN Mei-mei1,SUI Xin1,*
(1.College of Biological and Food Engineering,Jilin Institute of Chemical Technology,Jilin 132022,Jilin,China;2.College of Chemical and Pharmaceutical Engineering,Jilin Institute of Chemical Technology,Jilin 132022,Jilin,China)
Trollius chinensis Bunge;flavonoids;antioxidation
2016-10-12
10.3969/j.issn.1005-6521.2017.14.003
吉林市科技发展计划资助项目(20162011);吉林化工学院校级项目(2016065)
刘洋(1984—),男(汉),讲师,博士,研究方向:天然产物开发及现代食品检测技术。
*通信作者:隋新,副教授,主要研究方向:真菌资源化开发与利用。
Abstract:In this paper mainly,comparative study of antioxidant flavonoids in stems and flower petals of Trollius chinensis Bunge was studied.Ethanol extraction and D101 macroporous resin were used to extract and purified flavonoids respectively.Reducing power method,DPPH,hydroxyl free radical,ABTS method were used to study the anti-oxidation activity of flavonoids in stems and flower petals of Trollius chinensis Bunge,compared with L-ascorbic acid (VC).The results shows that:total flavonoids content of petals and stems were 14.83%and 13.3%.They have strong scavenging effect on DPPH radical with ABTS.In the selected concentration range,the DPPH free radical scavenging ability difference of them is not significant,but lower than the VCclearance rate;when the concentration is larger than 0.16 mg/mL,petal flavonoids scavenging ABTS free radical was stronger than that the stems flavonoids,close to VCclearance rate.Petals and stems of flavonoids in reducing capacity and scavenging ability is weak,far less than the antioxidant capacity of VC.
