Taqman-探针荧光定量PCR鉴定溶藻弧菌方法的建立
2017-07-18陈昌国侯兵兵陈秋圆郭建巍赵强元
陈昌国 侯兵兵 陈秋圆 郭建巍 赵强元
临床研究
Taqman-探针荧光定量PCR鉴定溶藻弧菌方法的建立
陈昌国 侯兵兵 陈秋圆 郭建巍 赵强元
目的 建立一种基于DNA回旋酶B亚单位基因(gyrB)基因的Taqman-探针荧光定量聚合酶链式反应(PCR)鉴定溶藻弧菌的方法。方法 以溶藻弧菌标准株(ATCC)和溶藻弧菌野生株(WT)为研究对象,通过软件设计溶藻弧菌gyrB基因的特异性PCR引物及Taqman-探针,采用荧光定量PCR仪进行检测,评价该检测方法的特异性和灵敏度。结果 Taqman-探针荧光定量PCR检测方法对溶藻弧菌gyrB基因的检测灵敏度为10-3mg/L;在检测粪肠球菌、金黄色葡萄球菌、腐生葡萄球菌、霍氏肠杆菌、铜绿假单胞菌、大肠埃希氏菌6种其他常见致病菌时未出现阳性扩增,特异性均为100%。结论 成功建立Taqman-探针荧光定量PCR是一种特异性、灵敏度均较好的鉴定溶藻弧菌的方法,该方法适用于溶藻弧菌的快速检测,具有应用价值。
Taqman-探针; 荧光定量PCR; 溶藻弧菌; gyrB基因
溶藻弧菌(Vibrio alginolyticus)由Miyamoto在1961年命名,属弧菌科弧菌属,是一种革兰阴性(G-)嗜盐性弧菌[1],广泛存在于海洋、河水等水体环境中,是水生动物弧菌病的主要条件致病菌[2-3]。对于人类,部分致病力较强的弧菌如创伤弧菌可以造成致命性感染[4],溶藻弧菌主要导致食物中毒和胃肠炎,严重时可引起脓毒症[5-6]。溶藻弧菌作为一种致腹泻菌和影响食品安全的病原菌日益受到重视[7-8]。
溶藻弧菌常规检测方法大多要经过分离培养与生化鉴定,不仅用时较长且不能快速鉴别病原菌。随着分子生物学技术的快速发展,荧光定量聚合酶链式反应(PCR)技术被广泛应用于病原菌的鉴定和检测[9-10]。我们针对溶藻弧菌DNA回旋酶B亚单位基因(gyrB)高度保守区设计荧光定量引物和Taqman-探针,建立Taqman-探针荧光定量PCR检测溶藻弧菌的方法。
1 材料与方法
1.1 实验菌株 本实验使用的菌株包括:溶藻弧菌ATCC-17749(由李艳君博士提供);溶藻弧菌野生株-WT(由本实验室采集并保存);粪肠球菌ATCC-29212、金黄色葡萄球菌(金葡菌)ATCC-25293、腐生葡萄球菌ATCC-BAA750、铜绿假单胞菌ATCC-27853、霍氏肠杆菌ATCC-700323、大肠埃希氏菌ATCC-25922菌株6种其他菌株均为本科室保存。
1.2 仪器与试剂 SYBR®Green QPCR Master Mix购自天根生物科技(北京)有限公司;荧光定量PCR仪为上海宏石公司SLAN-96P Real Time PCR System生产,引物及Taqman-探针由北京奥科鼎盛生物科技有限公司合成,按照引物合成单要求进行后期处理。
1.3 细菌核酸粗提物制备 菌种存放在-80 ℃的冰箱里,取出后置于37 ℃水浴快速复温,复温后的菌种冻存液接种在硫代硫酸盐柠檬酸盐蔗糖琼脂培养基(TCBS)和哥伦比亚血平板上,在37 ℃孵箱中培养12 h。用无菌接种环取适量细菌至1.5 mL离心管中,加入100 μL核酸裂解液后室温裂解15 min,100 ℃恒温金属浴加热10 min,室温13 000 r/min离心5 min(离心半径=9.5 cm),取上清作为模板。
1.4 引物及Taqman-荧光探针设计 在NCBI网站输入基因名称获取相应基因序列,运用生物软件Beacon Designer 7和 Primer Premier 5.0进行荧光定量PCR引物及Taqman-荧光探针设计,探针5'端标记FAM,3'端标记BHQ1。上游引物:5'-GCT AACACGTACATTGA-3',下游引物:5'-GCTTGAG AACTTAGGATCA-3',荧光探针:FAM-CCGCAGTT AGACCTTCACGC-BHQ1。
1.5 PCR反应体系及扩增条件 取1 μL提取液上清为模板,以gyrB特异性引物及Taqman-探针进行荧光定量PCR检测。PCR反应体系为:2× Mix 10 μL、引物对1 μL、模板1 μL、ddH2O 7 μL。PCR反应条件为:95 ℃ 5 min(94 ℃ 30 s~58 ℃ 40 s收集荧光),35个循环,25 ℃ 10 s。
1.6 引物浓度的优化 上下游引物浓度分别配置成20 nmol/L、15 nmol/L、10 nmol/L工作液进行荧光定量PCR检测,扩增条件同前。
1.7 探针浓度的优化 合成的荧光探针按照合成单加入ddH2O配成母液,然后取5 μL探针母液至95 μL ddH2O中作为工作液。在20 μL PCR反应体系中分别加入1 μL、0.5 μL荧光探针,扩增条件同前。
1.8 特异性评价 以优化后的反应体系检测溶藻弧菌标准菌株及其他6种细菌的标准株。
1.9 灵敏度评价 以标准菌株系列浓度梯度为模板(102mg/L~10-5mg/L),每个浓度梯度取1 μL核酸为模板,以优化后的反应体系和反应条件进行荧光定量PCR。以出现典型扩增曲线并在循环数内出现Ct值为阳性。
2 结果
2.1 实验参数的优化
2.1.1 引物浓度的优化 经过多次实验引物最佳浓度约为10 nmol/L,经2%凝胶电泳显示引物二聚体较少且扩增效率能够满足实验要求。见图1。

图1 PCR产物2%凝胶电泳图
2.1.2 探针浓度的优化 实验结果显示,20 μL PCR反应体系中加入0.5 μL荧光探针,其反应曲线较加入1 μL荧光探针的效果更好,见图2。优化后的溶藻弧菌Taqman-探针荧光定量PCR反应条件为:20 μL体系(ddH2O 7.5 μL、2× Mix 10 μL、模板1 μL、引物对1 μL、探针0.5 μL),95 ℃ 5 min(94 ℃ 30 s~58 ℃ 40 s收集荧光),35个循环,25 ℃ 10 s。
2.2 Taqman-探针荧光定量PCR反应体系评价
2.2.1 特异性评价 用优化后的反应体系检测溶藻弧菌标准菌株与野生株以及其他6种细菌的标准菌株,以溶藻弧菌的标准菌株为阳性对照。结果除溶藻弧菌标准株及野生株出现阳性扩增外,其他6种细菌标准株均无阳性扩增。因此,该方法的特异性为100%。见图3~4。

图2 不同浓度的探针PCR扩增曲线
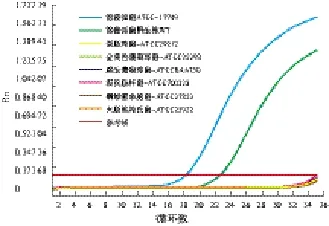
图3 溶藻弧菌标准菌株与野生株以及其他6种细菌PCR扩增曲线

注:1为溶藻弧菌ATCC-17749;2为溶藻弧菌野生株WT;3为粪肠球菌ATCC-29212;4为金黄色葡萄球菌ATCC-25293;5为腐生葡萄球菌ATCC-BAA750;6为霍氏肠杆菌ATCC-700323;7为铜绿假单胞菌ATCC-27853;8为大肠埃希氏菌ATCC-25922图4 溶藻弧菌Taqman-探针荧光定量PCR特异度检测
2.2.2 灵敏度评价 以溶藻弧菌标准株核酸系列稀释样本为模板进行荧光定量PCR,当模板浓度为102~10-3mg/L时,每个浓度均有典型扩增曲线,当模板浓度为10-4~10-5mg/L时,每个浓度未出现典型扩增曲线。所以,本研究建立的方法对溶藻弧菌gyrB基因的检测灵敏度为10-3mg/L,有较好的检测灵敏度。见图5~6。
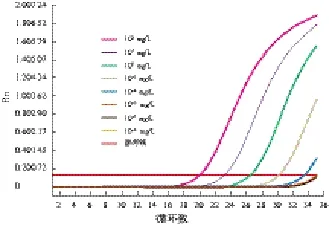
图5 溶藻弧菌(ATCC)Taqman-探针荧光定量PCR灵敏度检测
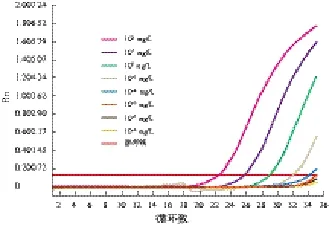
图6 溶藻弧菌(WT)Taqman-探针荧光定量PCR灵敏度检测
3 讨论
溶藻弧菌传统的检测方法检测时间长且特异性和灵敏度均受到不同程度的限制。因此,建立快速、准确、实用的检测和鉴定方法是必要的。
随着分子生物学技术快速发展,目前已经有很多技术如PCR、SYBRGreen荧光定量PCR、随机引物PCR、酶联反应吸附试验(ELISA)、斑点杂交以及多重荧光PCR等用于弧菌的检测[10]。而分子分型技术以分辨率高、特异性强、重复率好的特点在弧菌感染的溯源及防控方面发挥了十分重要的作用[11-12]。Taqman-探针荧光定量PCR技术近年来被广泛应用于病原菌检测,该技术在普通PCR基础上加入一条特异的荧光探针,因而较其他PCR方法具有更高的特异性[13]。本研究针对溶藻弧菌gyrB基因高度保守区设计荧光定量PCR引物和荧光探针,建立了Taqman-探针荧光定量PCR鉴定溶藻弧菌的体系,并对反应体系进行了优化。
16S rRNA基因、colH基因、dnaJ40基因以及hsp60基因等都曾被应用于溶藻弧菌的检测[5]。其中,16S rRNA基因测序虽然是细菌分子系统鉴定的“金标准”,但对于一些种属关系比较密切的细菌(如弧菌属、气单胞菌属、芽孢杆菌属和分枝杆菌属)缺乏足够的鉴辨能力[14]。然而,gyrB基因在弧菌中具有较高的同源性,不同弧菌之间具有明显遗传距离,对于弧菌来说是一个很好的系统发育标记。因此,基于gyrB基因的研究方法比16S rRNA基因测序方法更适用于弧菌种的鉴定,该方法具有特异性[15]。
目前,在国内研究中对溶藻弧菌进行Taqman-探针荧光定量PCR鉴定的报道较少。我们建立的基于gyrB基因的Taqman-探针荧光定量PCR鉴定溶藻弧菌的方法,通过对标准株进行灵敏度检测发现该体系检测的灵敏度为10-3mg/L,具有很好的检测灵敏度。该体系在特异性检测中标准株全阳性,其他6种病原菌全阴性,在区分溶藻弧菌与其他6种病原菌中具有较好的特异性,为临床检测溶藻弧菌提供了可靠的技术依据。
综上所述,本研究建立的Taqman-探针荧光定量PCR技术在2 h内可完成对溶藻弧菌的检测工作。与传统分离培养、生化鉴定的方法相比,其检测速度快、特异性和灵敏度高,适用于溶藻弧菌的快速检测,具有应用价值。但是本研究中特异性验证中其他菌株数较少,仍需进一步试验和验证。
1 Ramesh KP, Kalidas C, Tamilmani G, et al. Microbiological and histopathological investigations of Vibrio alginolyticus infection in cobia Rachycentron canadum (Linnaeus, 1766) cultured in sea cage[J]. Indian J Fish, 2014, 61(1): 124-127.
2 Sadok K, Mejdi S, Nourhen S, et al. Phenotypic characterization and RAPD fingerprinting of Vibrio parahaemolyticus and Vibrio alginolyticus isolated during Tunisian fish farm outbreaks [J]. Folia Microbiol (Praha),2013,58(1):17-26.
3 Balcázar JL, Gallo-Bueno A, Planas M, et al. Isolation of Vibrio alginolyticus and Vibrio splendidus from captive-bred seahorses with disease symptoms [J]. Antonie Van Leeuwenhoek,2010,97(2):207-210.
4 卢中秋,卢才教,邱俏檬,等.创伤弧菌脓毒症诊疗方案(草案)[J].中华危重病急救医学,2008,20(1):4-6.
5 Ottaviani D, Leoni F, Rocchegiani E, et al. Prevalence and virulence properties of non-O1 non-O139 Vibrio cholerae strains from seafood and clinical samples collected in Italy [J]. Int J Food Microbiol,2009,132(1):47-53.
6 苏婷,罗鹏,陈偿,等.溶藻弧菌溶血活性检测及溶血素基因、启动子区功能[J].微生物学通报,2013,40(7):1138-1144.
7 王海波,张京云,王多春,等.溶藻弧菌TaqMan实时PCR快速检测体系的建立[J].中国卫生检验杂志,2011,21(5):1150-1152.
8 Li XC, Xiang ZY, Xu XM, et al. Endophthalmitis caused by Vibrio alginolyticus [J]. J Clin Microbiol,2009,47(10):3379-3381.
9 Wei S, Zhao H, Xian Y, et al. Multiplex PCR assays for the detection of Vibrio alginolyticus, Vibrio parahaemolyticus, Vibrio vulnificus, and Vibrio cholerae with an internal amplification control [J]. Diagn Microbiol Infect Dis,2014,79(2):115-118.
10 李宏,杨大伟,刘云国,等.多重荧光定量PCR同时检测霍乱弧菌、副溶血性弧菌和创伤弧菌的方法研究[J].中国卫生检验杂志,2011,21(5):1180-1182.
11 曲业敏,马淑青,孙梅,等.副溶血性弧菌分子分型的研究进展[J].实用检验医师杂志,2016,8(3):181-183.
12 张金金,李迎慧,石晓路,等.副溶血弧菌的多位点可变数目串联重复序列分型方法的研究[J].实用检验医师杂志,2012,4(4):211-215.
13 金东,王艺婷,白雪梅,等.弗氏枸橼酸杆菌TaqMan实时荧光定量-聚合酶链反应检测方法的建立[J].疾病监测,2013,28(6):451-455.
14 Teh CS, Chua KH, Thong KL. Simultaneous differential detection of human pathogenic and nonpathogenic Vibrio species using a multiplex PCR based on gyrB and pntA genes [J]. J Appl Microbiol,2010,108(6):1940-1945.
15 Luo P, Hu C. Vibrio alginolyticus gyrB sequence analysis and gyrB-targeted PCR identification in environmental isolates [J]. Dis Aquat Organ,2008,82(3):209-216.
(本文编辑:李银平)
Establishment of a method for the identification of Vibrio alginolyticus by Taqman-Probe fluorescencequantitative PCR analysis
Chen Changguo, Hou Bingbing, Chen Qiuyuan, Guo Jianwei, Zhao Qiangyuan. Department of Clinical Laboratory, Navy General Hospital PLA, 100048 Beijing, China
Objective To establish a method for the identification of Vibrio alginolyticus by Taqmanprobe fluorescence quantitative PCR analysis based on gyrB gene. Methods The standard strain of Vibrio algae-lysing (ATCC) and wild strains (WT) were studied as the research object, using the bio-software to design specific PCR primers and Taqman probe of Vibrio alginolyticus gyrB gene and detected by fluorescence quantitative PCR instrument. Results The detection sensitivity of gyrb gene of Vibrio alginolyticus by Taqman fluorescence quantitative PCR was 10-3mg/L. The detection method did not show positive amplification in detection of Enterococcus faecalis, Staphylococcus aureus, Saprophytic staphylococcus, Enterobacter hormaechei, Pseudomonas aeruginos, Escherichia coli 6 other common pathogenic bacteria. The specificity was 100%. Conclusions The fluorescence quantitative PCR method for the identification of Vibrio alginolyticus was successfully established. The method is specific and sensitive, it is suitable for rapid detection of Vibrio alginolyticus and has application value.
Taqman fluorescence probe; Fluorescence quantitative PCR; Vibrio alginolyticus; gyrB gene
国家自然科学基金青年基金项目(81401311);军队后勤科研重点项目(BHJ14J005);首都临床特色应用研究(吴阶平专项:Z141107006614009)
100048 北京,中国人民解放军海军总医院检验科
陈昌国,Email:1234_chen@sina.com
10.3969/j.issn.1674-7151.2017.01.001
2017-01-18)
