环割对杉木和马尾松人工林土壤微生物群落结构的影响*
2017-07-18贺同鑫孙建飞李艳鹏俞有志胡宝清王清奎
贺同鑫 孙建飞 李艳鹏 俞有志 胡宝清 王清奎
(1.广西师范学院 北部湾环境演变与资源利用教育部重点实验室 广西地表过程与智能模拟重点实验室 南宁 530001;
环割对杉木和马尾松人工林土壤微生物群落结构的影响*
贺同鑫1,2孙建飞1李艳鹏2俞有志2胡宝清1王清奎2
(1.广西师范学院 北部湾环境演变与资源利用教育部重点实验室 广西地表过程与智能模拟重点实验室 南宁 530001;
2.中国科学院会同森林生态实验站 会同 418307)
杉木; 马尾松; 人工林; 磷脂脂肪酸; 环割; 微生物群落结构
土壤微生物通过调控陆地生态系统元素转化和物质循环过程,对土壤肥力的形成和保育产生重要影响,进而影响土壤健康和生态服务功能。土壤微生物通过种群的消长与植物的养分吸收形成互补,维持和调节着生态系统的元素生物地球化学过程(方丽娜等, 2011)。土壤微生物能够调控土壤碳库,反之,土壤碳有效性也能影响土壤微生物群落结构(Brantetal., 2006; Tóthetal., 2007)。植物最新固定的光合产物约有30%~60%被输送到根系,其中约20%会以根系分泌物的形式进入到土壤中(Muchaetal., 2005; Yarwoodetal., 2009)。根系及根系分泌物是土壤微生物可利用碳的重要来源(Wangetal., 2013),光合产物供应的变化可能会通过改变根系分泌物进而影响土壤微生物群落结构。因此了解光合产物供应对土壤微生物的影响有助于更好地探索碳输入的改变对土壤碳循环的影响。
自Högberg等(2001)利用环割法研究改变光合产物供应对土壤呼吸的影响之后,因其对土壤-根系-生物系统的扰动较少,因而被越来越多的学者采用。前人研究表明环割通过阻断光合产物供应,改变土壤理化性质(尤其是活性碳库和氮库),从而对土壤微生物群落结构产生重要影响(Högbergetal., 2007; 2010; Kaiseretal., 2010; Chenetal., 2012; Keeletal., 2012)。然而不同生态系统中环割对土壤微生物的影响有很大的差别,如在欧洲赤松(Pinussylvestris)和欧洲云杉(Piceaabies)林中环割导致微生物生物量显著下降30%~40% (P< 0.05)(Högbergetal., 2001; Subkeetal., 2004)。而在尾叶桉(Eucalyptusurophylla)和厚荚相思(Acaciacrassicarpa)2个人工林中,环割对土壤微生物生物量并没有产生显著影响,同时其研究表明环割降低了真菌含量,但增加了细菌含量,因而改变了土壤微生物群落结构,然而环割对2种人工林的影响程度具有较大的差异(Chenetal., 2012)。这表明土壤微生物群落结构对环割的响应可能存在树种差异,但是这方面的研究还较少,限制了深入理解光合产物供应的改变对土壤微生物群落结构的影响。
目前,利用环割的方法探讨光合产物供应对土壤碳库、土壤呼吸及树干呼吸影响的研究较多(Högbergetal., 2001; Chenetal., 2010; Maieretal., 2010; Trahanetal., 2015),而对土壤微生物群落影响的研究则相对较少,尤其是树种差异性更是鲜有报道。为了研究环割对土壤微生物群落结构的影响是否具有树种差异性,且其时间效应又是怎样的?本研究在湖南中国科学院会同森林生态实验站选择了亚热带地区常见的杉木(Cunninghamialanceolata)和马尾松(Pinusmassoniana)2种人工纯林,在林中分别设置6个6 m × 6 m样方,并进行环割试验。环割1个月和1年后利用磷脂脂肪酸的方法测定土壤微生物群落结构,探讨环割对不同树种土壤微生物的影响,环割1个月后测定土壤基本理化性质,探讨环割后土壤碳氮有效性的变化及其对土壤微生物的影响,以期揭示环割对土壤微生物群落结构的影响。
1 研究区概况
研究区位于湖南省西南部的中国科学院会同森林生态实验站(110°08′E,27°09′N)。该地区为低山丘陵地貌类型,海拔200~500 m,属于典型的亚热带湿润气候,年均气温16.5 ℃,年降水量1 200~1 400 mm,土壤为山地红黄壤,pH值为4~6。地带性植被为以丝栗栲(Castanopsisfargesii)、青冈(Cyclobalanopsisglauca)和刨花润楠(Machiluspauhoi)等为建群种的天然常绿阔叶林; 主要人工林类型为杉木、毛竹(Phyllostachysedulis)和马尾松人工纯林。
2 研究方法
2.1 试验设置、环割方法和植被管理
2012年6月,分别在26年生杉木及23年生马尾松2个人工纯林内开展试验,2个人工林的密度均为1 200株·hm-2。在每个林中选取6个6 m × 6 m样方,每个样方至少包含5棵树。样地坡度约为23°,坡向为南坡,坡位为中坡。土壤厚70~80 cm,土壤密度为1.2 g·cm-3,土壤孔隙度约为35%。土壤质地较黏重,为中黏壤至重黏壤,土体中石砾含量约15%。杉木和马尾松平均树高分别为16.3和15.3 m,平均胸径分别为18.5和17.2 cm。杉木林和马尾松林的枯落物层厚度分别约为5和2 cm,郁闭度分别为0.7和0.8。
每种林分6个样方中随机选3个为对照(CK),3个进行环割处理。环割处理是指在树木胸径处去除10 cm宽的树皮及韧皮部。环割处理后杉木和马尾松在环割部位下方萌芽,因此每个月去掉萌芽。马尾松环割后3个月开始掉叶,掉在地上的叶子尽快移除样地外以避免在样地内积累。杉木的凋落物比较特殊,叶同枝一起掉落,且一般即使叶子枯萎也不会立马掉落,因此杉木林中的凋落物层没有太大变化。
杉木林中林下植被主要有杜茎山(Maesajaponica)、蔷薇叶悬钩子(Rubusrosifolius)、蕨(Pteridiumaquilinum)、中华金星蕨(Parathelypterischinensis)和边缘鳞盖蕨(Microlepiamarginata),在试验期间每月都在环割和对照小区用砍刀清除林下植被,为避免对土壤干扰,只去掉地上部分,并移除。马尾松林中的林下植被很少,没有进行处理。
2.2 土壤样品采集及室内处理

2.3 土壤理化指标测定
2.4 土壤微生物群落结构分析
土壤微生物群落结构的测定采用磷脂脂肪酸(phospholipid fatty acid, PLFA)分析方法,采用改进后的简单提取法(Frostegårdetal., 1996; Bossioetal., 1998),主要分为脂类提取、分离及甲基化3个步骤。1)按照1∶4的比例加入提取液(柠檬酸缓冲液、氯仿和甲醇按0.8∶1∶2体积比混合)于黑暗中充分震荡3 h,然后离心取上清液(2 500 r·min-1离心10 min)。重复此过程,将2次上清液合并。向上清液中加入氯仿及缓冲液,混匀,静止过夜。吸取氯仿层,N2吹干。2)依次采用氯仿、丙酮和甲醇分离出中性脂、糖脂和磷脂,收集甲醇相,N2吹干。3)甲基化: 将磷脂溶于1∶1的甲醇和甲苯溶液中,加入0.2 mol·L-1的氢氧化钾甲醇溶液进行皂化,最后用正己烷萃取,收集正己烷相,即为磷脂脂肪酸甲酯。在测定前2~3天,加入19∶0的内标以定量。采用气相色谱质谱仪(安捷伦GC-MS,6 890 N-5 973 N)测定每个样品中的磷脂脂肪酸甲酯。PLFA含量用 nmol·g-1表示。从土壤中提取的PLFA的量可表征土壤微生物的群落结构。PLFA的群落分类详见贺同鑫等(2015),PLFA的命名方式中的i、a、cy和Me,分别表示异、反异、环丙基和甲基分枝脂肪酸; ω、c和t分别表示脂肪端、顺式空间构造和反式空间构造。
2.5 数据处理
所有数据统计分析基于SPSS 17.0软件进行。采用独立样本t检验分析土壤微生物群落各组分(细菌、真菌和放线菌)和土壤基本理化性质的差异。相关分析采用Pearson检验法。在统计检验过程中,显著水平为P< 0.05,极显著水平为P< 0.01。
3 结果与分析
3.1 树木生长变化
杉木具有很强的萌发能力,环割1个月后,其枝叶没有显著变化; 环割1年后仍具萌芽能力,大部分枝叶仍是绿色的,因此表明杉木仍有大部分根系存活。马尾松萌芽能力很弱,环割3个月内,树木80%的枝叶已经死亡; 环割1年后枝叶全部凋落,树木已经全部死亡。
3.2 土壤性质变化

3.3 土壤微生物群落结构
杉木和马尾松2种人工纯林的土壤微生物生物量表现为细菌>真菌>放线菌含量(图1b,c,h),表明在亚热带人工林中土壤微生物是以细菌为主体的群落结构。环割处理1个月后和1年后杉木和马尾松土壤总微生物生物量(总磷脂脂肪酸含量)、细菌、真菌和放线菌含量总体呈现降低趋势,而且其群落结构均发生了显著变化(图 1)。环割处理1个月后,杉木林土壤微生物生物量和群落结构变化比马尾松林大; 但1年后,马尾松比杉木变化大(图1a,d,i)。
杉木林中,环割1个月后总磷脂脂肪酸、细菌、真菌含量、真菌∶细菌和革兰氏阴性细菌含量分别下降了10.3%,10.9%, 20.0%,10.1%和13.4%(P< 0.05); 环割1年后,细菌和革兰氏阴性细菌含量分别下降了20.3%和22.1%(P< 0.05)。马尾松林中,环割1个月后真菌和革兰氏阳性细菌含量分别下降21.9%和14.5%(P< 0.05); 环割1年后,总磷脂脂肪酸、细菌和放线菌含量下降了17.8%,15.9%和27.4%(P< 0.05)。此外,杉木林中环割处理1个月后磷脂脂肪酸cy17∶0/16∶1ω7c显著升高,而在马尾松林中环割处理1年后该比值显著升高(P< 0.05,图1i)。
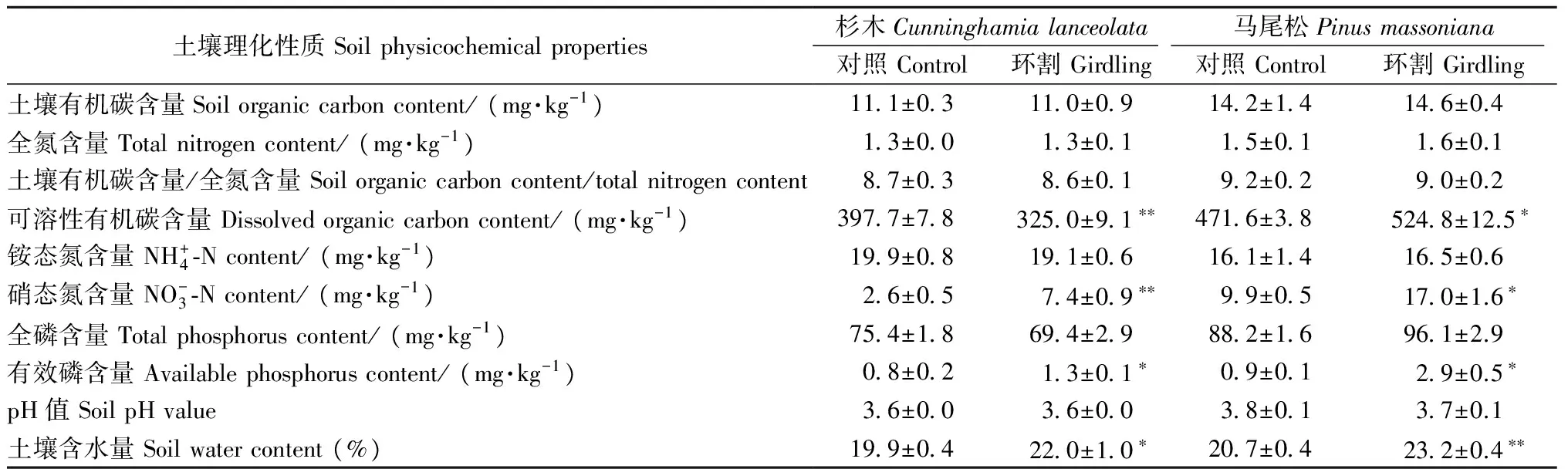
表1 环割1个月后土壤理化性质变化①Tab. 1 Variation of soil physicochemical properties after one month of girdling
① *:P< 0.05;**:P< 0.01.下同The same below.
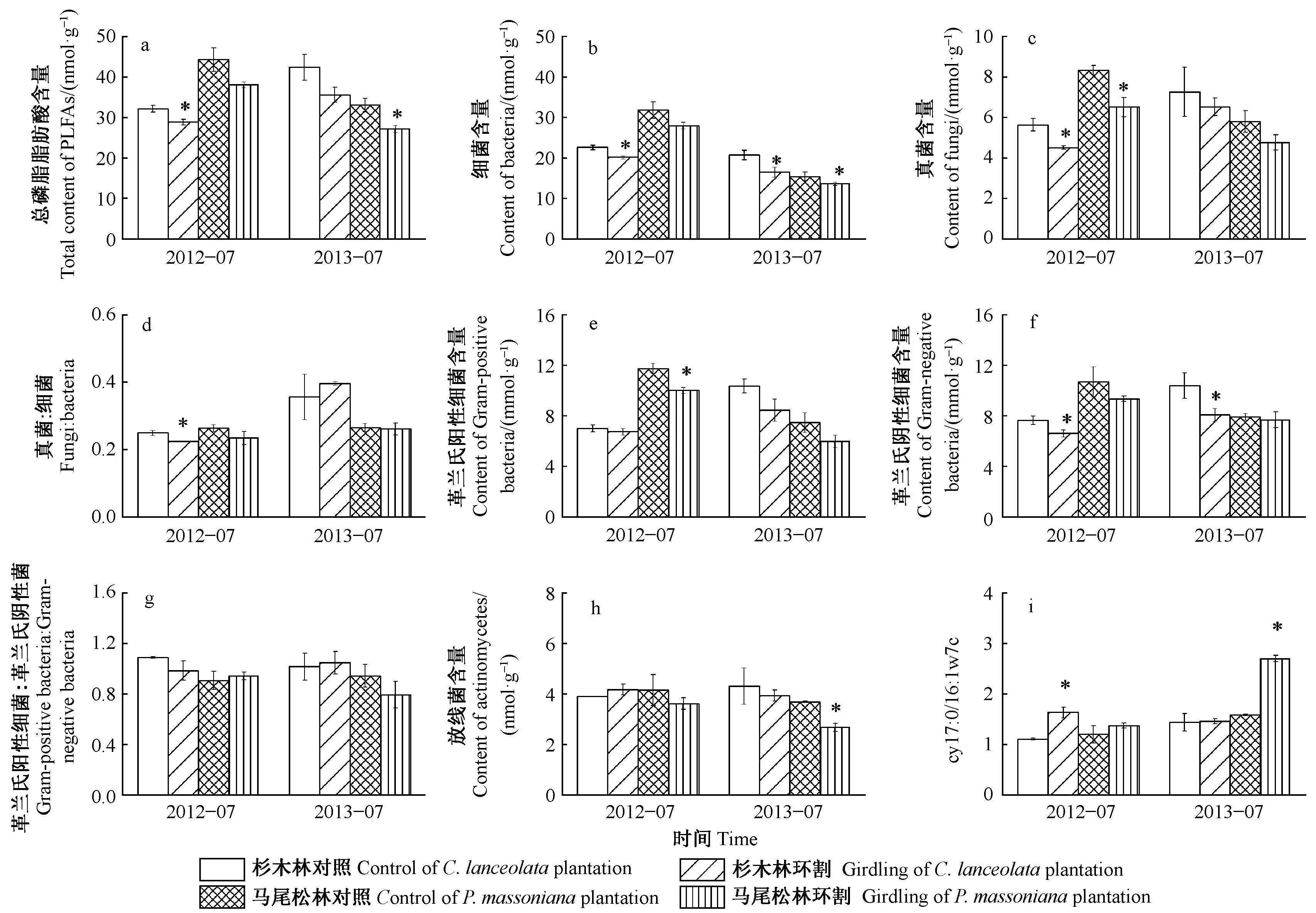
图1 环割处理1个月后和1年后土壤微生物群落结构变化Fig.1 Variation of soil microbial community composition after one month and one year of girdling
3.4 土壤微生物和土壤性质的相关性分析

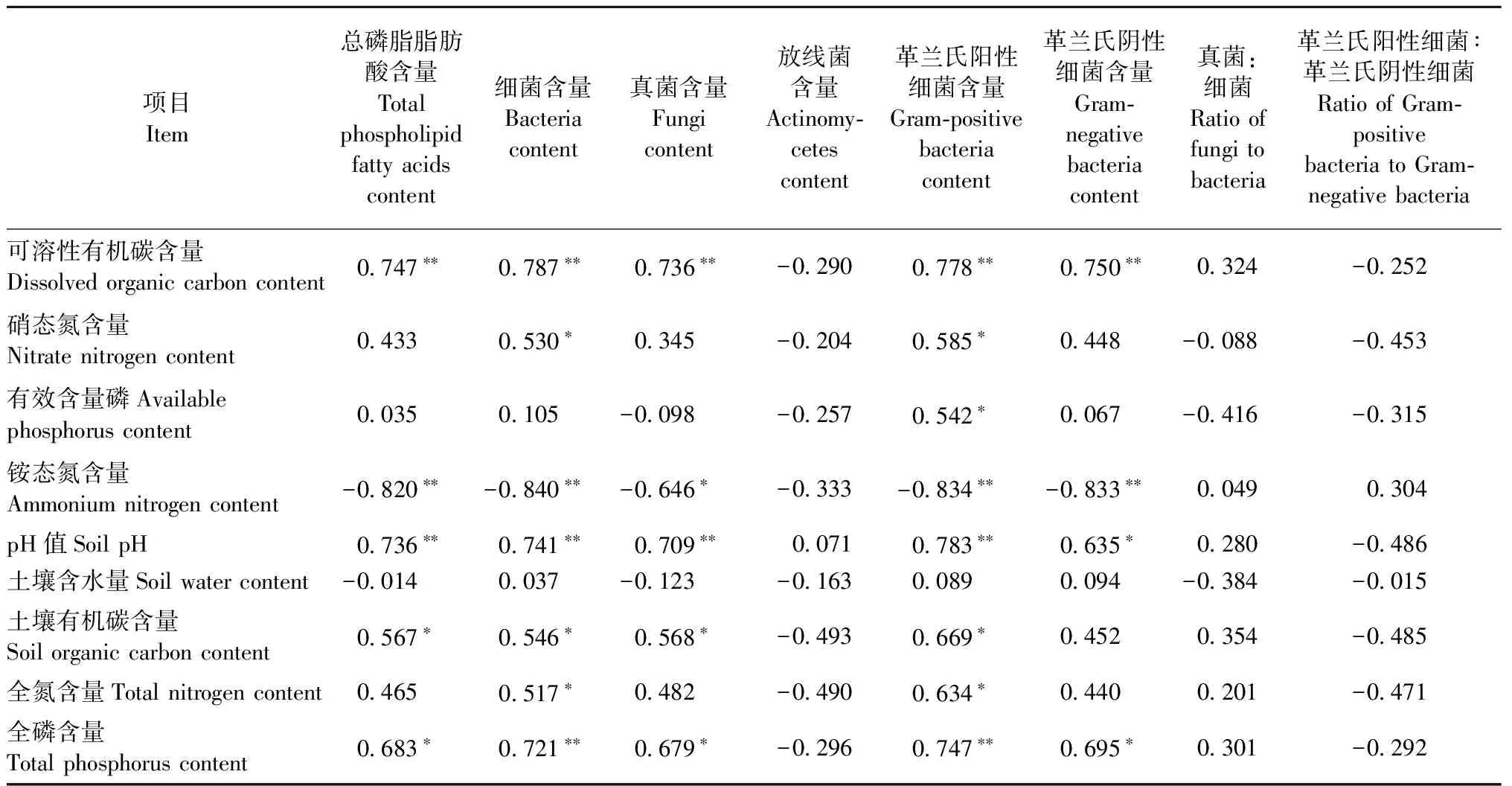
表2 土壤微生物群落结构与土壤性质相关性①Tab. 2 Correlations between soil microbial community composition and soil properties
①**:P<0.01; *:P<0.05.
4 讨论
4.1 土壤养分有效性的变化
4.2 土壤微生物群落结构的变化
本研究结果表明环割处理后,土壤总微生物生物量、真菌和细菌含量均显著降低,表明土壤微生物对地上光合产物具有依懒性,而且光合碳输入的改变对真菌群落的影响要显著高于细菌群落。环割处理1个月显著降低了2种人工林中真菌含量,但是并没有对马尾松土壤细菌群落产生显著影响; 而且尽管杉木林中环割导致细菌生物量下降了10.9%,但真菌下降的程度(20.3%)显著高于细菌(图1b,c)。这主要是由于真菌比其他微生物群落更依赖于光合产物供应(Keith-Roachetal., 2002),而且前人的研究也表明地下光合碳输入的降低导致依赖于根系分泌物的菌根真菌数量显著下降(Högbergetal., 2007; 2010; Kaiseretal., 2010; Chenetal., 2012)。此外,本研究结果表明环割1个月后,杉木土壤革兰氏阴性细菌含量显著下降(图1f),也说明光合产物供应的重要性,因为革兰氏阴性细菌更倾向于利用根系分泌的活性碳(Treonisetal., 2004)。
本研究发现环割对土壤微生物群落的影响具有树种差异性。在杉木林中环割1个月后,总磷脂脂肪酸、细菌、真菌、革兰氏阴性细菌含量和真菌∶细菌都显著下降,而在马尾松林中,环割1个月仅降低了真菌和革兰氏阳性细菌的含量。这表明短期时间内阻断光合产物供应后,杉木林土壤微生物的响应大于马尾松林,这归结于树种本身的生理特性。杉木具有很强的萌芽作用,大部分根系一直保持活性,杉木在环割1年后仍有大部分树枝是活的也支持这一观点。在同样具有萌芽作用的尾叶桉人工林中,Chen等(2010)发现环割6个月后其根系生物量仅下降了18%,这主要是由于尾叶桉根系中存储的大量淀粉使得根系在环割后很长的时间都不会死亡,并且有利于促进尾叶桉树木萌芽(Binkleyetal., 2006)。环割减弱了植物地下碳输入,但并没有造成植物根系的大量死亡,而且植物活根系中储存的碳更多地用于维持根系生长和促进植物萌芽,因而减少向土壤中的碳输入(表1),导致微生物生长受到碳限制。前人的研究表明磷脂脂肪酸cy17∶0/16∶1ω7c可以用来指示基质可利用性的限制作用(Moore-Kuceraetal., 2007; Fengetal., 2009),该比值的升高表明基质有效性不足增加了微生物生长压力。杉木林中显著升高的微生物磷脂脂肪酸cy17∶0/16∶1ω7c也说明环割1个月后微生物受到可利用性碳的限制。而马尾松萌芽能力较弱,环割后大部分根系死亡,尽管环割降低了植物光合碳供应,但是死亡的根系为微生物提供了分解底物,增加土壤可利用性碳(表1),从而在短时间内降低了环割对微生物的影响。然而,环割1年对马尾松土壤微生物的影响要高于杉木林。这主要是由于环割1年后,杉木的萌芽能力逐渐减弱,因而减少了对根系碳的消耗,而且死亡的根系量增加,两者为土壤微生物提供较充足的碳(图1i),有利于维持微生物的生长。而在马尾松林中,环割1年后,死亡根系中的可利用性碳已被微生物消耗,而且缺乏新的碳输入导致微生物受到碳限制,从而抑制了微生物生长(图1i)。
环割对土壤微生物的树种差异性影响具有时间效应,主要是由于2个树种的萌芽能力不同,导致环割后短期和长期时间段内土壤碳输入发生变化。本研究中土壤DOC含量与微生物生物量之间的显著正相关关系也证明了土壤可利用性碳的变化是导致土壤微生物发生变化的主要原因(表2)。Chen等(2012)在尾叶桉和厚荚相思人工林的研究结果也表明,由于植物光合碳供应和死根分解碳补给的变化,导致环割对土壤微生物的影响随时间发生变化。
5 结论
通过在亚热带杉木和马尾松2种人工林中为期1年的环割试验发现: 1)环割降低了土壤微生物生物量,且改变了土壤微生物群落结构,这表明土壤微生物在很大程度上依赖于光合产物地下碳分配,而且真菌对植物光合碳的依赖高于细菌; 2)杉木和马尾松林土壤微生物对环割的响应具有较大的差异,表明环割对土壤微生物群落结构的影响具有树种差异性,而且这种差异性在时间尺度上受到植物光合碳供应和死根分解碳补给的调控。本研究表明采用环割的方法改变光合产物碳供应是一种有效的方法,但是由于其对土壤微生物的影响具有树种差异性,因此在今后的研究中应将树种本身的特性及测定时间考虑在内。此外,这一结果也在一定程度上解释了目前研究中不同生态系统中结果差异较大的原因。但是由于本研究中重复数量偏少,而且由于对树木的破坏性使得小区面积也偏小,且研究时间不够长使得对环割的时间效应的研究不是很深入,因此在今后的研究中应加强此方面的研究,从而更好地探索光合产物供应变化对土壤微生物群落结构的影响,以期为研究碳循环提供更准确的基础数据。
方丽娜,杨效东,杜 杰. 2011. 土地利用方式对西双版纳热带森林土壤微生物生物量碳的影响. 应用生态学报,22(4): 837-844.
(Fang L N,Yang X D,Du J. 2011. Effects of land use pattern on soil microbial biomass carbon in Xishuangbanna. Chinses Journal of Applied Ecology,22(4): 837-844.[in Chinese])
贺同鑫,李艳鹏,张方月,等. 2015. 林下植被剔除对杉木林土壤呼吸和微生物群落结构的影响.植物生态学报, 39(8): 797-806.
(He T X,Li Y P,Zhang F Y,etal. 2015. Effects of understory removal on soil respiration and microbial community composition structure in a Chinese fir plantation.Chinese Journal of Plant Ecology,39(8): 797-806. [in Chinese])
Binkley D,Stape J L,Takahashi E N,etal. 2006. Tree-girdling to separate root and heterotrophic respiration in twoEucalyptusstands in Brazil. Oecologia, 148(3): 447-454.
Bossio D A,Scow K M,Gunapala N,etal. 1998. Determinants of soil microbial communities: effects of agricultural management, season, and soil type on phospholipid fatty acid profiles. Microbial Ecology,36 (1): 1-12.
Brant J B,Sulzman E W,Myrold D D. 2006. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation. Soil Biology and Biochemistry, 38(8): 2219-2232.
Carrillo Y,Dijkstra F A,Pendall E,etal. 2012. Controls over soil nitrogen pools in a semiarid grassland under elevated CO2and warming. Ecosystems, 15(5): 761-774.
Chen D M,Zhang Y,Lin Y B,etal. 2010. Changes in belowground carbon inAcaciacrassicarpaandEucalyptusurophyllaplantations after tree girdling. Plant and Soil, 326(1/2): 123-135.
Chen D M,Zhou L X,Wu J P,etal. 2012. Tree girdling affects the soil microbial community by modifying resource availability in two subtropical plantations. Applied Soil Ecology, 53(10): 108-115.
Dannenmann M,Simon J,Gasche R,etal. 2009. Tree girdling provides insight on the role of labile carbon in nitrogen partitioning between soil microorganisms and adult European beech. Soil Biology and Biochemistry, 41(8): 1622-1631.
Feng X,Simpson M J. 2009. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality. Soil Biology and Biochemistry, 41(4): 804-812.
Frostegård Å,Bååth E. 1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 22(1): 59-65.
Högberg M N,Briones M J,Keel S G,etal. 2010. Quantification of effects of season and nitrogen supply on tree below-ground carbon transfer to ectomycorrhizal fungi and other soil organisms in a boreal pine forest. New Phytologist, 187(2): 485-493.
Högberg M N,Högberg P,Myrold D D. 2007. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three?.Oecologia, 150(4): 590-601.
Högberg P,Nordgren A,Buchmann,etal. 2001. Large-scale forest girdling shows that current photosynthesis drives soil respiration. Nature, 411(6839): 789-792.
Kaiser C,Koranda M,Kitzler B,etal. 2010. Belowground carbon allocation by trees drives seasonal patterns of extracellular enzyme activities by altering microbial community composition in a beech forest soil. New Phytologist, 187(3): 843-858.
Keel S G,Campbell C D,Högberg M N,etal. 2012. Allocation of carbon to fine root compounds and their residence times in a boreal forest depend on root size class and season. New Phytologist, 194(4): 972-981.
Keith-Roach M J,Bryan N D,Bardgett R D,etal. 2002. Seasonal changes in the microbial community of a salt marsh, measured by phospholipid fatty acid analysis. Biogeochemistry, 60(1): 77-96.
Maier C A,Johnsen K H,Clinton B D,etal. 2010. Relationships between stem CO2efux, substrate supply, and growth in young loblolly pine trees. New Phytologist, 185(2): 502-513.
Moore-Kucera J,Dick R P. 2007. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence. Microb Ecology, 55(3): 500-511.
Mucha A P,Almeida C M R,Bordalo A A,etal. 2005. Exudation of organic acids by a marsh plant and implications on trace metal availability in the rhizosphere of estuarine sediments. Estuarine Coastal and Shelf Science, 65(1/2): 191-198.
Scott-Denton L E,Rosenstiel T N,Monson R K. 2006. Differential controls by climate and substrate over the heterotrophic and rhizospheric components of soil respiration. Global Change Biology, 12(2): 205-216.
Subke J A,Hahn V,Battipaglia G,etal. 2004. Feedback interactions between needle litter decomposition and rhizosphere activity. Oecologia, 139(4): 551-559.
Tóth J A,Lajtha K,Kotroczó Z,etal. 2007. The effect of climate change on soil organic matter decomposition. Acta Silvatica et Ligniaria Hungaric, (3): 75-85.
Trahan N A,Dynes E L,Pugh E,etal. 2015. Changes in soil biogeochemistry following disturbance by girdling and mountain pine beetles in subalpine forests. Oecologia, 177(4): 981-995.
Treonis A M,Ostle N J,Stott A W,etal. 2004. Identification of groups of metabolically-active rhizosphere microorganisms by stable isotope probing of PLFAs. Soil Biology and Biochemistry, 36(3): 533-537.
Wang Q K,He T X,Wang S L,etal. 2013. Carbon input manipulation affects soil respiration and microbial community composition in a subtropical coniferous forest. Agricultural and Forest Meteorology, 178-179(4): 152-160.
Yarwood S A,Myrold D D,Högberg M N. 2009. Termination of belowground C allocation by trees alters soil fungal and bacterial communities in a boreal forest. FEMS Microbiol Ecology, 70(1): 151-162.
Zeller B,Liu J,Buchmann N,etal. 2008. Tree girdling increases soil N mineralisation in two spruce stands. Soil Biology and Biochemistry, 40(5): 1155-1166.
(责任编辑 于静娴)
Effects of Girdling on Soil Microbial Community Composition inCunninghamialanceolataandPinusmassonianaPlantations
He Tongxin1,2Sun Jianfei1Li Yanpeng2Yu Youzhi2Hu Baoqing1Wang Qingkui2
(1.KeyLaboratoryofEnvironmentChangeandResourcesUseinBeibuGulfofMinistryofEducationGuangxiKeyLaboratoryofEarthSurfaceProcessesandIntelligentSimulationGuangxiTeachersEducationUniversityNanning530001;2.HuitongExperimentalStationofForestEcology,ChineseAcademyofSciencesHuitong418307)

Cunninghamialanceolata;Pinusmassoniana; plantation; phospholipid fatty acid; girdling; microbial community composition
10.11707/j.1001-7488.20170609
2015-10-08;
2017-01-20。
中国科学院战略性先导科技专项 (XDB15010301); 国家自然科学基金项目(31570466); 国家重点研发计划 (2016YFA0600801); 广西科学研究与技术开发计划 (14125008-2-24)。
S714.3
A
1001-7488(2017)06-0077-08
*王清奎为通讯作者。
