转舞毒蛾LdCYP6AN15v1基因果蝇品系对氯虫苯甲酰胺胁迫响应*
2017-07-18党英侨殷晶晶陈传佳孙丽丽曹传旺
党英侨 殷晶晶 陈传佳 孙丽丽 刘 鹏 曹传旺
(东北林业大学林学院 哈尔滨 150040)
转舞毒蛾LdCYP6AN15v1基因果蝇品系对氯虫苯甲酰胺胁迫响应*
党英侨 殷晶晶 陈传佳 孙丽丽 刘 鹏 曹传旺
(东北林业大学林学院 哈尔滨 150040)
【目的】 舞毒蛾是林业重要害虫,细胞色素P450是昆虫体内广泛分布的参与外源化合物代谢关键酶系,探讨P450家族基因CYP6AN15v1对杀虫剂代谢解毒功能,为舞毒蛾有效治理提供依据。【方法】 通过RT-PCR法获得LdCYP6AN15v1基因cDNA全长,采用传统酶切连接的方法构建转CYP6AN15v1基因果蝇载体,通过转基因技术获得表达LdCYP6AN15v1果蝇品系(命名为attP40>CYP6AN15v1)。采用分光光度计法研究低剂量氯虫苯甲酰胺(7.17 mg·L-1)处理对转基因和非转基因果蝇品系细胞色素P450活性的影响,并采用qRT-PCR法测定其对CYP6AN15v1基因表达的影响。【结果】 从舞毒蛾无参照转录本文库中克隆获得CYP6AN15v1全长基因,编码512个氨基酸,蛋白分子质量为59.02 kDa; 系统进化树分析表明CYP6AN15v1与甜菜夜蛾和棉铃虫关系较近。以DNA和cDNA为模板,attP40>CYP6AN15v1果蝇品系均检测到1 539 bp目的基因,表明LdCYP6AN15v1基因成功整合到果蝇基因组。与非转基因attP40果蝇品系相比,转基因attP40>CYP6AN15v1果蝇品系对氯虫苯甲酰胺的敏感性显著降低,致死中浓度LC50为非转基因果蝇的2.92倍; 低剂量(7.17 mg·L-1)氯虫苯甲酰胺胁迫下,舞毒蛾细胞色素P450酶活性和CYP6AN15v1基因的诱导作用呈现时间效应,attP40>CYP6AN15v1果蝇品系P450活性为非转基因果蝇的1.09~1.93倍,主要表现为诱导效应; attP40>CYP6AN15v1果蝇品系的CYP6AN15v1基因mRNA表达量呈诱导激活,其表达量为非转基因的44.54~137.80倍。【结论】 利用转基因技术成功构建了转LdCYP6AN15v1果蝇品系attP40>CYP6AN15v1; 氯虫苯甲酰胺可能通过诱导LdCYP6AN15v1基因mRNA的上调表达而增强黑腹果蝇P450酶活性,从而参与对氯虫苯甲酰胺的解毒作用。关键词: 舞毒蛾; 转基因果蝇; 氯虫苯甲酰胺;CYP6AN15v1; 诱导表达
Responses of TransformantDrosophilaExpressingLdCYP6AN15v1 Gene to
舞毒蛾(Lymantriadispar)是分布很广的世界性害虫,国外报道可危害300多种植物(Leonard, 1981),国内报道可危害500多种植物,分布于东北、华北、西北、华东、华中、华南、西南等地区(侯雅芹等, 2009; 许娜等, 2009)。目前,使用广泛、杀虫效果好、作用迅速的方法是利用氯氰菊酯、高效氯氰菊酯、溴氰菊酯、氧化乐果等化学杀虫剂进行防治,但这些杀虫剂易产生“3R”问题(侯雅芹等, 2009; 倪鸣等, 2009),易对环境造成严重的危害。以鱼尼丁受体为靶标的双酰胺类杀虫剂的出现,改变了传统农药高毒性、高残留、环境不友好的局面(刘熠等, 2009)。
双酰胺类杀虫剂与鱼尼丁受体结合后,会刺激胞内Ca2+从肌肉细胞的肌质网释放和消耗,使昆虫肌肉细胞的收缩功能瘫痪(Cordovaetal., 2006),而鱼丁尼受体则是调节Ca2+释放的选择性通道。氯虫苯甲酰胺是美国杜邦公司2008年推出的一种新型邻甲酰氨基苯甲酰胺类杀虫剂,用于各种作物对鳞翅目(董波等, 2009; 陈伟国等, 2010)、鞘翅目(Bassietal., 2008; 2009; Koppenhöferetal., 2008; Kuharetal., 2008)、双翅目(Teixeiraetal., 2009)、等翅目(Yeohetal., 2007; Spomeretal., 2009)、半翅目(Dhawanetal., 2009; Lahmetal., 2009)等害虫的防治,而对非靶标节肢动物具有良好的选择性,且对哺乳动物、鸟类、鱼等的毒性低,此外也有研究表明氯虫苯甲酰胺对一些鳞翅目的害虫有显著杀卵作用(Ioriattietal., 2009; Lahmetal., 2009),在亚致死浓度处理下,会影响雌性苹果蠹蛾(Cydiapomonella)的交配比例(Knightetal., 2007)。
细胞色素P450(cytochrome P450)是参与杀虫剂代谢重要解毒酶系之一,在杀虫剂的氧化、还原等化学反应及杀虫剂抗性的形成中发挥重要作用(Zhouetal., 2010),其中昆虫已有超过1 000个细胞色素P450基因被确定(Nelson, 2009),主要分布在CYP4、CYP6、CYP9、CYP28、CYP321和CYP12家族(Feyereisen, 2005),常参与杀虫剂代谢和抗性相关的P450基因分布于CYP4、CYP6、CYP9、CYP12亚家族中(Feyereisen, 2006; Lietal., 2007)。大量研究表明, 细胞色素P450过表达是昆虫产生抗药性的重要机制之一(Liuetal., 1998; Lietal., 2006)。Bautista等(2007)研究发现氯菊酯小菜蛾(Plutellaxylostella)抗性品系中CYP6BG1和CYP6BG2的转录水平较高。已有研究表明CYP321E1参与了小菜蛾对氯虫苯甲酰胺的抗性形成(Huetal., 2014)。笔者实验室前期研究发现舞毒蛾CYP6AN15v1基因在杀虫剂溴氰菊酯、甲萘威、氧化乐果(15 mg·L-1)胁迫下主要以下调表达为主(Sunetal., 2014); 并采用RNA干扰(RNAi)技术通过体外合成CYP6AN15v1的dsRNA显微注射至舞毒蛾3龄幼虫体内,发现dsRNA可以在特定时间内高效特异的沉默舞毒蛾体内CYP6AN15v1基因的mRNA表达,且舞毒蛾幼虫对有机磷类杀虫剂的敏感性显著提高(曹传旺等, 2015)。然而,RNAi不能稳定遗传,只能达到瞬时干扰基因表达的目的,转基因昆虫技术是在昆虫基因组中插入具有特定的基因,分析这些基因功能。黑腹果蝇(Drosophilamelanogaster)作为重要的模式生物,其所具有的转基因技术优势,促进了生物学诸多领域的研究进展(周秀娟等, 2008)。目前,已有昆虫学者将与杀虫剂作用相关基因转入黑腹果蝇中,以验证其参与杀虫剂代谢(孙丽丽等,2016; 薛绪亭等, 2016)。Riveron等(2013; 2014)借助于GAL4/UAS系统将按蚊(Anophelesfunestus)CYP6P9a、CYP6P9b和CYP6M7基因分别表达于果蝇体内,证实其参与氯菊酯和溴氰菊酯的抗性形成。本文在分析舞毒蛾转录本文库的基础上,克隆分析了CYP6AN15v1基因的cDNA全长,并通过转基因技术研究CYP6AN15v1在舞毒蛾对氯虫苯甲酰胺类杀虫剂的胁迫响应,旨在深入探索舞毒蛾CYP6AN15v1参与鱼尼丁受体抑制剂类杀虫剂抗药性形成机制以及为在生产实践中进行抗药性监测和治理提供理论依据。
1 材料与方法
1.1 供试昆虫
供试舞毒蛾卵块和人工饲料均购自于中国林业科学研究院森林生态环境与保护研究所,放置于温度(25±1)℃、光照14 L∶10D、相对湿度75%的条件下人工饲养。
黑腹果蝇来源于中国科学院上海生命科学研究院生物化学与细胞生物学研究所果蝇资源与技术平台,置于(25±1)℃、相对湿度60%、光照14 L∶10D人工养虫室内饲养。所用人工饲料主要成分为蔗糖10 g,玉米粉10 g,酵母粉0.5 g,琼脂1 g,100 mL蒸馏水,丙酸0.7 mL,每4天将虫子换入新饲料瓶中,保持瓶内空气流通。
黑腹果蝇品系: attP40果蝇品系(即25C)基因型为y[1] M {vas-int.Dm}ZH-2A w[*], P{CaryP}attP40; 杂交果蝇品系为ywR13 s=yw, sp/Cyo, MKRS/TM2。
1.2 主要试剂
考马斯亮蓝G-250、牛血清白蛋白(BSA)、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、丙基硫氧嘧啶(PTU)、还原性辅酶Ⅱ(NADPH)和二甲基亚砜(DMSO)均购自于SIGMA公司; 磷酸二氢钠、磷酸氢二钠、浓盐酸、氯仿、乙醇、磷酸、氢氧化钠、丙酮均为分析纯级,购自天津永大试剂有限公司。氯虫苯甲酰胺原药(96%,国家生物农药工程中心);XhoI和XbaI限制性内切酶、T4 DNA连接酶、DNase I均购自于Promega公司; RNA提取试剂盒购自Qiagen公司; pMD18-T载体和PrimeScriptTMRT reagent Kit cDNA合成试剂盒购自TaKaRa公司,SYBR Green Real-time PCR Master mix购自Toyobo公司,西班牙琼脂糖购自Gene公司; pUAST-attB载体为美国奥本大学刘喃喃教授赠予; 大肠杆菌(Escheriacoli)DH5α为本实验室保存。
1.3LdCYP6AN15v1基因克隆与分析
根据舞毒蛾幼虫cDNA文库获得的舞毒蛾CYP6AN15v1基因序列(命名为LdCYP6AN15v1)。设计全长cDNA引物进行PCR,切胶回收后连接于pMD18-T 载体上,转化至大肠杆菌DH5α,在含氨苄抗性的平板上挑取重组克隆,获得的阳性菌株,进一步进行测序分析,最终确定所获得的LdCYP6AN15v1基因cDNA序列,并将此重组载体记为CYP6AN15v1/pMD18-T。
应用ORF founder(http://www.ncbi.nlm.nih.gov/gorf.html)程序确定其开放读码框。用NCBI的Conserved Domains程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守区,并检查蛋白质序列的结构域及功能基序; 利用Blast 程序(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列同源性搜索,选择与其相似程度高的其他昆虫GPCR蛋白氨基酸序列,用多序列联配程序Clustalx(1.83)进行多序列比对。应用Clustalx(1.83)和MEGA(5.1),采用邻接法(Neighbor-Joining, N-J)构建系统发育树,
1.4 果蝇表达载体构建及转LdCYP6AN15v1果蝇品系的建立
分别用限制性内切酶XhoI和XbaI酶切CYP6AN15v1/pMD18-T质粒和 pUAST-attB载体质粒,酶切产物进行1.5%琼脂糖凝胶电泳检测后,分别回收LdCYP6AN15v1基因片段和pUAST-attB载体,通过T4 DNA连接酶,16 ℃连接16 h,转化至大肠杆菌DH5α,在含氨苄抗性的平板上挑取重组克隆,经质粒PCR和双酶切消化后的阳性克隆,送至北京六合华大生物技术科技有限公司测序验证,成功构建的重组质粒命名为pUAST-attB-CYP6AN15v1。
转基因果蝇定点注射委托中国科学院上海生命科学研究院生物化学与细胞生物学研究所果蝇资源与技术平台完成,具体步骤如下: 将重组质粒经Qiagen质粒提取试剂盒去内毒素抽提后,注射至带attp背景的亲本果蝇胚胎中,定点微量注射入2#染色体; y[1] M {vas-int.Dm}ZH-2A w[*], P{CaryP}attP40] G0代果蝇胚胎中,羽化后的G0代果蝇雄蝇与yw, sp/Cyo, MKRS/TM2处女蝇单杂交(或者羽化后的G0代果蝇处女蝇与yw, sp/Cyo, MKRS/TM2雄单杂交); 约2周后,检查这些果蝇的G1代,从中挑选眼睛为红色或橘黄色的果蝇,可初步认定为转基因果蝇。挑取带balancer红眼(或橘黄色)雄果蝇,再与yw, sp/Cyo, MKRS/TM2处女蝇杂交; 挑选带Cyo的转基因红眼果蝇自交,杂合或纯合保种,查红眼获得稳定的转基因果蝇品系,命名为attP40>CYP6AN15v1,目的基因均以单拷贝插入到果蝇的2#染色体上。
1.5 转LdCYP6AN15v1果蝇品系分子验证
采用Omega 试剂盒提取attP40>CYP6AN15v1、attP40(25C)果蝇品系DNA,以DNA为模板,用全长特异性引物进行RT-PCR扩增(引物见表1)。采用RNeasy Mini动物组织总RNA提取试剂盒(Qiagen)提取attP40>CYP6AN15v1、attP40(25C)果蝇品系总RNA,利用反转录试剂盒PrimeScriptTMRT reagent Kit(TaKaRa)合成cDNA,以cDNA为模板用全长特异性引物进行RT-PCR扩增(引物见表1)。反应体系如下: 10×LA Buffer 1 μL,正向和反向引物各0.5 μL,dNTP 0.2 μL,cDNA(或DNA)1.0 μL,LATaq酶 0.2 μL,ddH2O补足至10 μL。PCR扩增程序为: 94 ℃预变性 3 min; 94 ℃变性 30 s,60 ℃退火 30 s,72 ℃ 延伸2 min,35个循环; 72 ℃ 延伸10 min。1.0%琼脂糖凝胶电泳检测目的基因扩增产物。

表1 本文中所用的引物Tab. 1 Primer sequences used in this experiment
1.6 转LdCYP6AN15v1果蝇致毒处理
参考王晓军等(2006)和薛绪亭等(2016)方法采用药膜法生物测定,取200 μL不同浓度的氯虫苯甲酰胺药液在闪烁瓶中形成均匀药膜,挑取30头不同品系果蝇放入瓶中,以G0代果蝇品系为对照,每个处理3次重复,于24 h统计死亡率,采用POLO软件,计算致死中浓度LC50。
取200 μL氯虫苯甲酰胺(LC20=7.17 mg·L-1)药液于闪烁瓶中,水平转动形成均匀药膜,加入少许的人工饲料(约1 cm3)。分别取180头大小、颜色一致的对照和转基因果蝇成虫置于处理的闪烁瓶中,以丙酮处理为对照组,每个处理30头,6个重复,分别于6,12,24,48和72 h挑取20头活泼的果蝇放于离心管中,液氮速冻后,置于-80 ℃冰箱内,分别用于实时荧光RT-PCR和细胞色素P450酶活性测定。1.7 细胞色素P450活性测定
1.7.1 酶液制备 从超低温冰箱内依次取出不同时间点处理的果蝇品系,以冷冻状态轻敲装有果蝇成虫的离心管,随机挑选10头快速倒至5 mL玻璃匀浆器内,加入4.0 mL 0.1 mol·L-1pH 7.5的磷酸缓冲液(含0.1 mmol·L-1DTT、1 mmol·L-1EDTA、1 mmol·L-1PTU、1 mmol·L-1PMSF),冰上研磨充分,12 000 g离心15 min,上清液即为原酶液。蛋白质含量测定参照Bradford(1976)的考马斯亮蓝G-250法。
1.7.2 细胞色素P450活性测定 将1 mL原酶液、800 μL 0.1 mol·L-1pH 7.5磷酸缓冲液、100 μL 4.8 mmol·L-1NADPH,100 μL 20 mmol·L-1对硝基苯甲醚底物放入10 mL离心管中充分振荡混匀,30 ℃水浴温育30 min,加入40 μL浓盐酸终止反应,再加入5 mL氯仿,剧烈振荡20 min,静置3~5 min,4 200 g,4 ℃离心15 min,吸取下层清液3 mL并转移至10 mL离心管中,加入3 mL 0.5 mol·L-1氢氧化钠溶液,剧烈震荡15 min,静置5 min,吸取上层萃取液为待测液。空白对照组采用3 mL氢氧化钠溶液,每个处理3次重复,于412 nm测定生成对硝基苯酚OD值,再根据对硝基苯酚标准曲线求出对硝基苯酚含量。以3 mL 0.5 mol·L-1氢氧化钠溶液中加入不同浓度对硝基苯酚,剧烈震荡15 min,静置5 min,吸取上层萃取液测定412 nm下OD值,根据OD值和对硝基苯酚浓度制作标准曲线。根据反应时间、对硝基苯酚的生成量和蛋白质含量计算细胞色素P450比活力(nmol·min-1mg-1)。
1.8 实时荧光定量RT-PCR


图1 舞毒蛾LdCYP6AN15v1基因的cDNA及由此推导的氨基酸序列Fig.1 The cDNA and deduced amino acid sequence of LdCYP6AN15v1 in L. dispar
采用RNeasy Mini动物组织总RNA提取试剂盒提取对照(丙酮)、氯虫苯甲酰胺(LC20=7.17 mg·L-1)处理的果蝇成虫总RNA,采用PrimeScriptTMRT reagent Kit cDNA合成试剂盒合成cDNA,将此cDNA模板稀释10倍,作为实时荧光定量RT-PCR模板。实时荧光定量RT-PCR使用试剂盒SYBR Green Real-time PCR Master mix,内参为RpL32、ATP基因(Willisetal., 2010),引物序列见表1。实时荧光定量RT-PCR反应体系为: 10 μL 2×SYBR premix ExTaq酶、正向和反向引物(10 μmol·L-1)各1,2 μL稀释后cDNA模板,加去离子水补至20 μL。实时荧光定量PCR反应条件为: 94 ℃预变性30 s,94 ℃变性12 s,60 ℃退火30 s,72 ℃延伸40 s,81 ℃读板1 s,45个循环,每个样品重复3次,用2-△△Ct方法进行基因的相对定量分析(Pfaffletal., 2002)。1.9 数据统计分析
运用SPSS17.0软件,采用Duncan方法对氯虫苯甲酰胺胁迫下不同处理时间P450酶活性和LdCYP6AN15v1基因转录水平进行显著性差异分析(P< 0.05)。
2 结果与分析
2.1LdCYP6AN15v1基因分析
获得的舞毒蛾LdCYP6AN15v1基因的阅读框(ORF)长1 539 bp,编码512个氨基酸(图1)。用SignalP4.1软件对LdCYP6AN15v1氨基酸序列前70个氨基酸残基进行信号肽预测。预测结果如图2 所示,在信号肽切割位点位于第17~18个氨基酸之间即VYF-TR间,表明这种蛋白是分泌型蛋白。采用NCBI的CDD软件分析LdCYP6AN15v1蛋白的保守结构域表明该蛋白属于P450家族。

图2 舞毒蛾LdCYP6AN15v1基因的保守结构域Fig.2 The cDNA and deduced amino acid sequence of LdCYP6AN15v1 in L. dispar
通过BLASTP多序列比对,选择与舞毒蛾LdCYP6AN15v1蛋白相似程度极高的16种昆虫P450蛋白进行多序列比对,构建的16种昆虫P450基因系统进化树表明P450蛋白聚为2大类,其中舞毒蛾CYP6AN15v1蛋白与甜菜夜蛾(Spodopteralittoralis)和棉铃虫(Helicoverpaarmigera)亲缘关系近而聚为一类(图3)。
2.2 转LdCYP6AN15v1基因果蝇载体构建
将LdCYP6AN15v1基因连接至pUAST-attB载体,获得重组转基因质粒pUAST-attB-CYP6AN15v1,重组质粒分别经XhoI和XbaI双酶切检测,可见1 539 bp目的基因条带。将重组质粒进行测序,其结果与目的基因序列完全一致,没有序列发生缺失或突变,表明pUAST-attB-CYP6AN15v1载体构建成功。
2.3 转LdCYP6AN15v1基因果蝇验证
图4显示表达LdCYP6AN15v1基因果蝇纯合品系表现型。提取表征为红眼的转基因果蝇总RNA,反转录合成cDNA,以cDNA为模板,引物见表1,PCR检测CYP6AN15v1基因,结果显示转基因果蝇品系中CYP6AN15v1基因得以表达。以DNA为模板进行PCR扩增时,attP40>CYP6AN15v1果蝇品系的PCR产物片段大小为1 539 bp(图5),非转基因attP40果蝇品系未见目的条带,这表明舞毒蛾的CYP6AN15v1基因成功整合到黑腹果蝇的基因组中。
2.4 氯虫苯甲酰胺对转LdCYP6AN15v1基因果蝇毒力
与非转基因attP40果蝇品系相比,表达LdCYP6AN15v1果蝇品系attP40>CYP6AN15v1对氯虫苯甲酰胺的敏感性增加,LC50值高于亲本,为对照亲本的2.92倍(表2)。
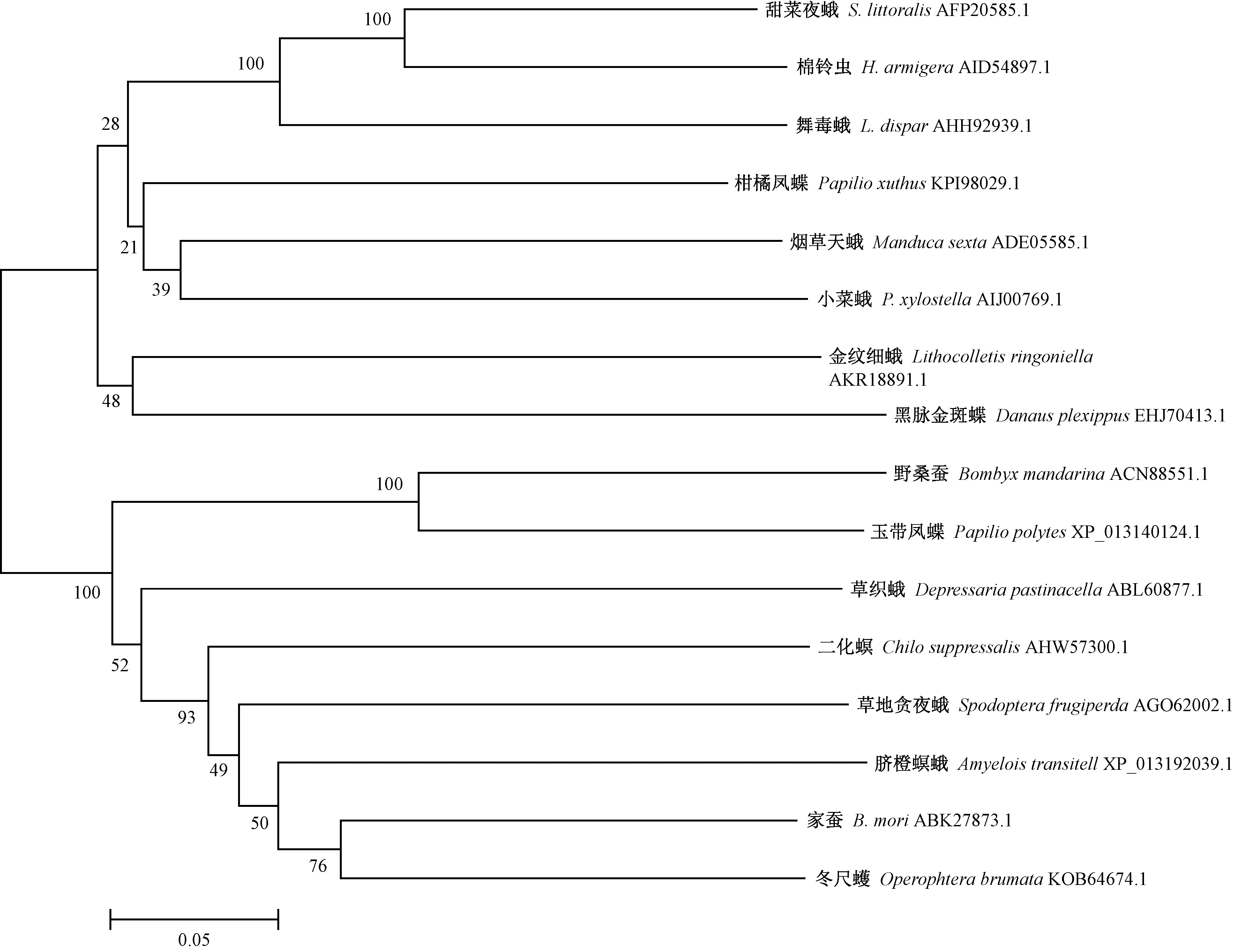
图3 16种昆虫P450蛋白系统进化树Fig.3 Phylogenetic analysis of P450 proteins from 16 insects

图4 转LdCYP6AN15v1基因和非转基因黑腹果蝇品系表现型Fig.4 Phenotype of transformant and untransformant D.melanogaster A: 转基因果蝇attP40>CYP6AN15v1 Transformant D.melanogaster attP40>CYP6AN15v1; B: 非转基因果蝇attP40 Untransformant D.melanogaster attP40.
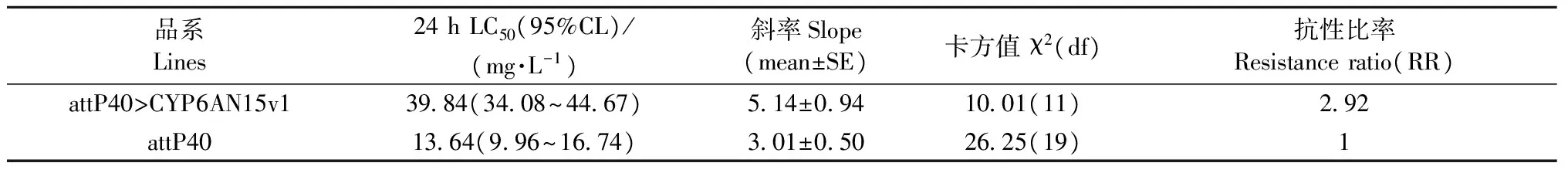
品系Lines24hLC50(95%CL)/(mg·L-1)斜率Slope(mean±SE)卡方值χ2(df)抗性比率Resistanceratio(RR)attP40>CYP6AN15v13984(3408~4467)514±0941001(11)292attP401364(996~1674)301±0502625(19)1
① χ2(11,0.05)=19.68; χ2(19,0.05)=30.14。

图5 转基因果蝇品系LdCYP6AN15v1 基因PCR检测Fig.5 PCR analysis of LdCYP6AN15v1 in transformant D.melanogaster 1: attP40>CYP6AN15v1果蝇品系DNA为模板DNA of attP40>CYP6AN15v1 D.melanogaster line as template; 2: attP40>CYP6AN15v1果蝇品系cDNA为模板cDNA of attP40>CYP6AN15v1 D.melanogaster line as template; 3: attP40果蝇品系DNA为模板 DNA of attP40 D.melanogaster line as template; 4: attP40果蝇品系cDNA为模板 cDNA of attP40 D.melanogaster line as template.
2.5 氯虫苯甲酰胺对转LdCYP6AN15v1果蝇P450活性影响
氯虫苯甲酰胺(7.17 mg·L-1)胁迫下转基因果蝇和非转基因果蝇品系体内的P450活性结果显示,除12 h外,其余各时间点转基因果蝇品系P450比活力均高于对照果蝇品系。处理初期0 ~ 12 h, attP40>CYP6AN15v1果蝇品系的总酶活性与对照组attP40的相比,均无显著性差异(P> 0.05)(图6),随胁迫时间的延长(24 ~ 72 h),attP40>CYP6AN15v1果蝇品系的P450活性显著高于对照组attP40品系(P< 0.05); 胁迫72 h,转基因果蝇品系的P450活性显著高于对照组,活性增加93.08%,为未处理转基因果蝇品系的2.55倍。
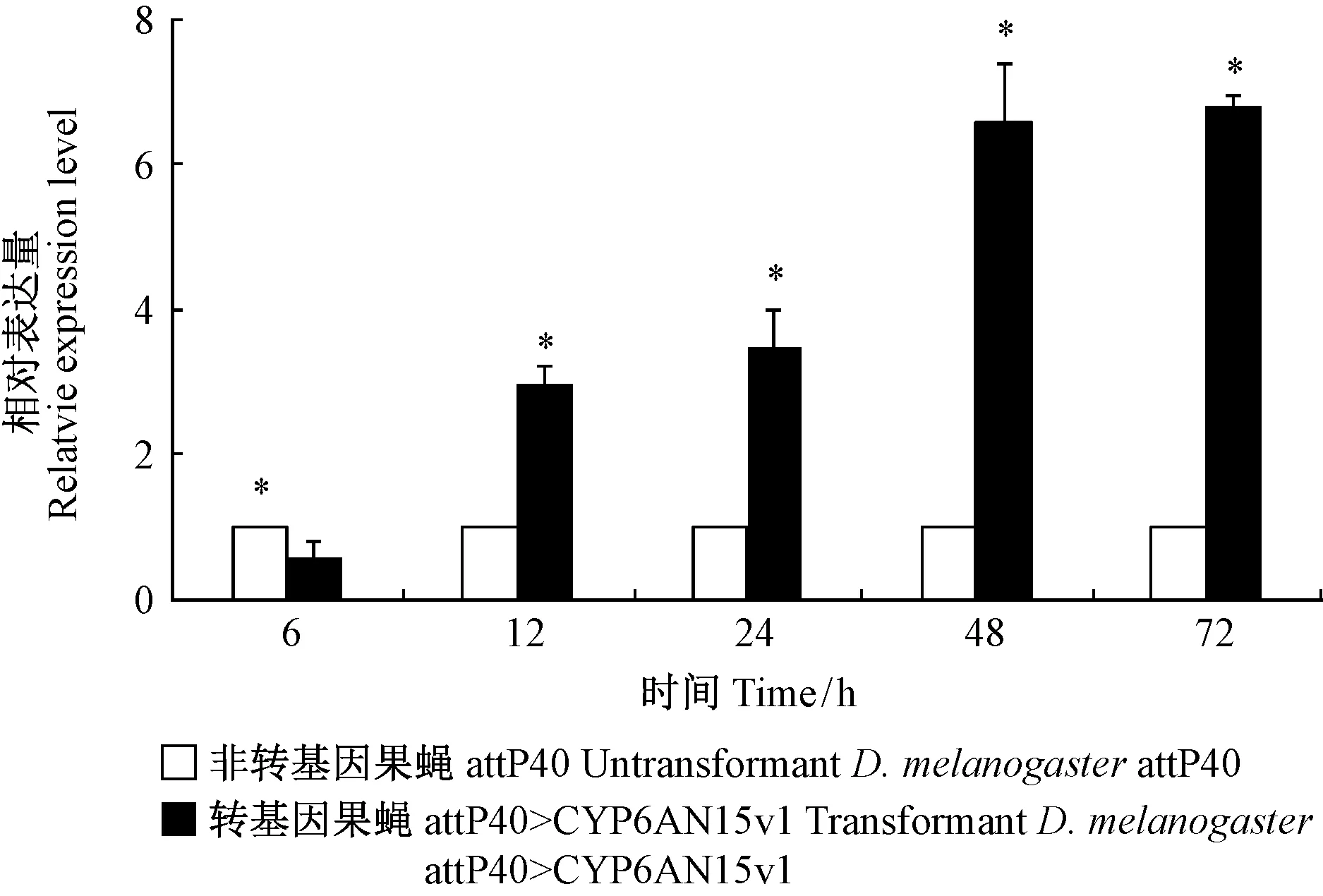
图6 氯虫苯甲酰胺对黑腹果蝇品系P450活性影响Fig.6 Effects of chlorantraniliprole on cytochrome P450 activities in D.melanogaster *表示同一时间转基因和对照组果蝇品系P450活性差异显著(P<0.05),下同。 * indicates the P450 activities between transgenic- and control-D.melanogaster are significant at the same time at 0.05 level. The same below.
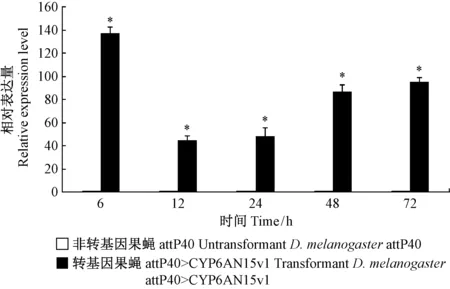
图7 氯虫苯甲酰胺对黑腹果蝇品系CYP6AN15v1表达量影响Fig.7 Effects of chlorantraniliprole on CYP6AN15v1 gene expression in transformant D.melanogaster
2.6 氯虫苯甲酰胺对转基因果蝇CYP6AN15v1表达量影响
采用qRT-PCR法测定了氯虫苯甲酰胺(7.17 mg·L-1)胁迫下转基因和非转基因果蝇品系CYP6AN15v1的转录水平影响。氯虫苯甲酰胺显著诱导了attP40>CYP6AN15v1果蝇品系体内CYP6AN15v1的表达(P<0.05),相对表达量为对照组44.54~137.80倍; 其中,12 hCYP6AN15v1的诱导表达水平最低,为对照组的44.54倍(图7)。
3 讨论
昆虫细胞色素P450兼具单加氧酶和氧化酶的功能,参与许多生物体内内源性化合物(如昆虫激素、脂肪酸和甾醇等)的生物合成(Lietal., 2007),也具有对外源性化合物的催化代谢能力(Lvaylo, 2001; Zhaoetal., 2002; Lietal., 2004),在昆虫的生长发育和对环境的适应性方面具有重要的作用(Feyereisen, 2012)。昆虫产生抗药性的主要机制是P450介导的杀虫剂代谢解毒作用,P450增强杀虫剂代谢解毒作用一是与酶量增加相关,二是由于酶结构变化导致解毒活性的增强。细胞色素P450表达量的增加主要有2种机制: 一是基因组层面上的基因拷贝数增加,二是基因转录水平的基因上调表达,其中第2种机制更为普遍(邱星辉, 2014)。已有研究证实P450参与了对有机磷类、拟除虫菊酯类、新烟碱类、氨基甲酸酯类等化学合成杀虫剂以及天然的植物防御化合物的代谢解毒(Guengerich, 2004)。Chiu等(2008)通过原核表达CYP6Z1蛋白具有代谢DDT的作用,证实该基因的上调表达参与了冈比亚按蚊(Anophelesgambiae)对DDT的抗性; Zhu等(2010)报道赤拟谷盗(Triboliumcastaneum)QTC279品系对溴氰菊酯的抗性是源于脑部特异性过量表达CYP6BQ9。
本文利用模式动物果蝇转基因技术研究了舞毒蛾CYP6AN15v1基因对氯虫苯甲酰胺诱导解毒功能,结果表明氯虫苯甲酰胺胁迫下转基因果蝇品系CYP6AN15v1基因表达和P450活性均显著高于非转基因果蝇品系,且转CYP6AN15v1基因果蝇品系对氯虫苯甲酰胺的敏感性降低,这可能是由于CYP6AN15v1基因诱导表达增加解毒能力导致的。曹传旺等(2015)利用RNAi技术体外合成CYP6AN15v1 dsRNA微量注射入经饥饿处理12 h舞毒蛾3龄幼虫体内,并将沉默后的幼虫置于混有40 mg·L-1的氧化乐果饲料中,48 h时试验组舞毒蛾幼虫死亡率为60.00%,比对照组ddH2O、GFPdsRNA分别高出26.67%和40.00%,表现出对氧化乐果高敏感性,这表明CYP6AN15v1基因表达量减少降低了细胞色素P450对氧化乐果的解毒能力。
近些年来,已有研究报道了细胞色素P450家族基因参与氯虫苯甲酰胺解毒代谢。邢静等(2011)采用亚致死剂量(LC10和LC25)氯虫苯甲酰胺连续处理小菜蛾5代后,发现细胞色素P450 O-脱乙基(ECOD)的比活力显著高于对照,为对照组的1.65和1.56倍; Liu等(2015)筛选52代氯虫苯甲酰胺抗性品系小菜蛾P450酶活性是敏感品系的4.26倍。氯虫苯甲酰胺抗性品系和敏感品系小菜蛾转录组中,发现19个P450、3个GST解毒酶基因和鱼丁尼受体基因均上调表达(Lin等, 2013)。欧善生等(2012)研究表明亚致死剂量氯虫苯甲酰胺(LC10、LC25和LC50)处理棉铃虫3龄幼虫时,P450-ECOD比活力为LC10> LC25> LC50。王学贵等(2015)研究发现以0.02 mg·kg-1氯虫苯甲酰胺处理甜菜夜蛾,3种P450基因(CYP9A9、CYP4G37、CYP6B)和细胞色素P450还原酶基因HQ852049 mRNA上调表达以及P450酶活表达增加,其中中肠的P450基因CYP9A9、CYP4G37、CYP6B的相对表达量为对照的1.53 ~ 4.48倍,而处理组P450酶活性为对照组1.90 ~ 2.92倍。这些研究结果表明双酰胺类氯虫苯甲酰胺杀虫剂作用靶标为鱼尼丁受体外,众多细胞色素P450家族基因参与了抗性形成和诱导代谢。
4 结论
利用转基因技术成功构建了转舞毒蛾P450基因CYP6AN15v1的果蝇品系attP40>CYP6AN15v1; 明确了氯虫苯甲酰胺可能通过诱导CYP6AN15v1基因mRNA的上调表达而增加了黑腹果蝇细胞色素P450酶活性,转舞毒蛾CYP6AN15v1果蝇对氯虫苯甲酰胺敏感性降低可能源于P450活性的增加解毒能力增强导致的。有关舞毒蛾CYP6AN15v1表达P450蛋白对氯虫苯甲酰胺解毒机制还有待于进一步研究。
曹传旺, 高彩球, 孙丽丽, 等. 2015. 舞毒蛾CYP6AN15v1基因dsRNA及其在无公害防治中的应用. 申请号: 201510054278.1
(Cao C W, Gao C Q, Sun L L,etal. 2015. dsRNA ofCYP6AN15v1 inLymantriadisparand its application in friendly control. Application No. 201510054278.1.
陈伟国, 董瑞华, 孙海燕, 等. 2010. 农用杀虫剂氯虫苯甲酰胺对家蚕的毒性研究. 蚕业科学, 36(1):84-90.
(Chen W G, Dong R H, Sun H Y,etal. 2010. An investigation on toxicity of the agricultural pesticide chlorantraniliprole to the silkworm,Bombyxmori. Science of Sericulture, 36(1): 84-90. [in Chinese])
董 波, 孙国俊, 蒋林忠, 等. 2009. 茚虫威15%乳油和氯虫苯甲酰胺20%悬浮剂对稻纵卷叶螟的防效试验. 农药科学与管理, 30(3):31-32.
(Dong B, Sun G J,Jiang L Z,etal. 2009. Effect tests of indoxacarb and chlorantraniliprole onCnaphalocrocismedialisGuenee. Pesticide Science and Administration, 30(3): 31-32. [in Chinese])
侯雅芹, 南 楠, 李镇宇. 2009. 舞毒蛾研究进展. 河北林果研究, 24(4):439-444.
(Hou Y Q, Nan N, Li Z Y. 2009.Research advances ofLymantriadispar. Hebei Journal of Forestry and Orchard Research, 24(4):439-444. [in Chinese])
刘 熠, 王国胜. 2009. 鱼尼丁受体类新型杀虫剂氯虫酰胺的研究概述.化学工程师, 171(11):44-47.
(Liu Y, Wang G S. 2009. Summary of chlorantraniliprole—a new type of ryanodines receptor insecticide. Chemical Engineer, 171(11):44-47. [in Chinese])
倪 鸣, 柴汝松, 张 鹏, 等. 2009. 不同药剂对舞毒蛾和春尺蠖的毒力测定. 东北林业大学学报, 37(5):121-122.
(Ni M, Chai R S, Zhang P,etal. 2009. Toxicity test of different kinds of insecticides toLymantriadisparandApocheimacinerarius. Journal of Northeast Forestry University, 37(5):121-122. [in Chinese])
欧善生, 梁 沛, 宋敦伦, 等. 2012. 氯虫苯甲酰胺亚致死剂量对棉铃虫生长发育和解毒酶活性的影响. 植物保护, 38(4):1-8.
(Ou S S, Liang P, Song D L,etal. 2012. Effects of sublethal dosage of chlorantraniliprole on development and detoxifying enzymes activity ofHelicoverpaarmigera. Plant Protection, 38(4):1-8. [in Chinese])
邱星辉. 2014. 细胞色素 P450介导的昆虫抗药性的分子机制. 昆虫学报, 57(4):477-482.
(Qiu X H. 2014. Molecular mechanisms of insecticide resistance mediated by cytochrome P450s in insects. Acta Entomologica Sinica, 57(4):477-482. [in Chinese])
孙丽丽,刘 鹏,王志英,等.2016.转LdOA1基因果蝇品系GSTs基因表达及对溴氰菊脂胁迫响应.北京林业大学学报,38(6):72-78.
(Sun L L, Liu P, Wang Z Y,etal. 2016. Glutathione S-transferase gene expression in transformantDrosophilaexpressing ocular albinism type 1 from gypsy moth and its response to deltamethrin stress.Journal of Beijing Forestry University,38(6):72-87.[in Chinese])
王晓军, 张宗俭, 姜 辉, 等. 2006. NY/T1154.7-2006农药室内生物测定试验准则. 北京: 中国标准出版社.
(Wang X J, Zhang Z J, Jiang H,etal. 2006. NY/T1154.7-2006 Guidelines for indoor bioassay of pesticide. Beijing: China Standard Press.[in Chinese])
王学贵, 余慧灵, 梁 沛, 等. 2015. 氯虫苯甲酰胺诱导甜菜夜蛾细胞色素P450 基因上调表达. 昆虫学报, 58(3): 281-287.
(Wang X G, Yu H L, Liang P,etal. 2015. Chlorantraniliprole induces up-regulated expression of cytochrome P450 genes inSpodopteraexigua(Lepidoptera: Noctuidae). Acta Entomologica Sinica, 58(3): 281-287. [in Chinese])
邢 静, 梁 沛, 高希武. 2011. 亚致死浓度氯虫苯甲酰胺对小菜蛾药剂的敏感度和解毒酶活性的影响. 农药学学报, 13(5): 467-470.
(Xing J, Liang P, Gao X W,etal. 2011. Effects of sublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity inPlutellaxylostella. Chinese Journal of Pesticide Science, 13(5): 464-470. [in Chinese])
许 娜, 孙宝丽. 2009. 舞毒蛾的发生及防治. 现代农业科技, 17:172-173.
(Xu N,Sun B L. 2009. Occurrence and control ofLymantriadispar. Modern Agricultural Science and Technology, 17:172-173. [in Chinese])
薛绪亭,孙丽丽,刘 鹏,等.2016.表达LdCYP6B53果蝇品系建立及对杀虫剂的敏感性.中国农学通报,32(19):97-101.
(Xue X T,Sun L L, Liu P,etal. 2016. Construction of transgenicDrosophilaexpressingLdCYP6B53 and its susceptibility to insecticides.Chinese Agricultural Science Bulletin,32(19):97-101.[in Chinese])
周秀娟,牛长缨,雷朝亮. 2008. 转基因昆虫的应用研究进展. 昆虫知识,45(3): 368-373.
(Zhou X J, Niu C Y, Lei C L.2008. The application of transgenic insect technology. Chinese Bulletin of Entomology, 45(3):368-373.)
Bassi A, Molnar I, Zielinski D,etal. 2008. Chlorantraniliprole (Rynaxypyr®, Coragen®): a novel anthranilic diamide insecticide with outstanding control of Colorado Potato Beetle (Leptinotarsadecemlineata)∥Proceedings of the 17th Triennial Conference of the EAPR-International Potato Conference, 6-10, July 2008, Brasov, Romania.
Bassi A, Rison J L, Wiles J A. 2009. Chlorantraniliprole (DPX-E2Y45, Rynaxypyr®, Coragen®), a new diamide insecticide for control of codling moth (Cydiapomonella), Colorado potato beetle (Leptinotarsadecemlineata) and European grapevine moth (Lobesiabotrana). Zbornik predavanj in referatov 9 slovenskega posvetovanja o varstvu rastlin z mednarodno udeležbo.
Bautista M A M, Tanaka T, Miyata T. 2007. Identification of permethrin-inducible cytochrome P450s from the diamondback moth,Plutellaxylostella(L.) and the possibility of involvement in permethrin resistance. Pesticide Biochemistry and Physiology, 87(1): 85-93.
Chiu T L, Wen Z, Rupasinghe S G,etal. 2008. Comparative molecular modeling ofAnophelesgambiaeCYP6Z1, a mosquito P450 capable of metabolizing DDT. Proceeding of the National Academy of Sciences USA, 105(26): 8855-8860.
Cordova D, Benner E A, Sacher M D,etal. 2006. Anthranilic diamides: a new class of insecticides with a novel mode of action, ryanodine receptor activation. Pesticide Biochemistry and Physiology, 84: 196-214.
Dhawan A, Saini S, Singh K,etal. 2009. Persistence and residual toxicity of some insecticides againstPhenacoccussolenopsison cotton (Gossypiumspp.). Indian Journal of Agricultural Sciences, 79(3): 203-206.
Feyereisen R. 2005. Insect cytochrome P450 in comprehensive molecular insect science∥Gilbert L I, Iatrou K, Gill S S. Comprehensive Molecular Insect Science.Elsevier, Oxford, UK, 1-77.
Feyereisen R. 2006. Evolution of insect P450. Biochemical Society Transactions, 34(6): 1252-1255.
Feyereisen R, Jindra M. 2012. The silkworm coming of age-early. PLoS Genetics, 8(3):e1002591.
Guengerich F R, Krauser J A, Johnson W W. 2004.Rate-limiting steps in oxidations catalyzed by rabbit cytochrome P450 1A2. Biochemistry, 43(33): 10775-10788.
Hu Z,Lin Q, Chen H,etal. 2014. Identification of a novel cytochrome P450 gene,CYP321E1 from the diamondback moth,Plutellaxylostella(L.) and RNA interference to evaluate its role in chlorantraniliprole resistance. Bulletin of Entomological Research, 104 (6): 716.
Ioriatti C, Anfora G, Angeli G,etal. 2009. Effects of chlorantraniliprole on eggs and larvae ofLobesiabotrana(Denis & Schiffermüller) (Lepidoptera: Tortricidae). Pest Management Science, 65(6): 717-722.
Knight A L, Flexner L. 2007. Disruption of mating in codling moth (Lepidoptera: Tortricidae) by chlorantranilipole, an anthranilic diamide insecticide. Pest Management Science, 63(2): 180-189.
Koppenhöfer A M, Fuzy E M. 2008. Effect of the anthranilic diamide insecticide, chlorantraniliprole, onHeterorhabditisbacteriophora(Rhabditida: Heterorhabditidae) efficacy against white grubs (Coleoptera: Scarabaeidae). Biological Control, 45: 93-102.
Kuhar T, Doughty H, Hitchner E,etal. 2008. Evaluation of foliar insecticides for the control of Colorado potato beetle in potatoes in Virginia,2007. Arthropod Management, 17(1):140-145.
Lahm G, Cordova D, Barry J. 2009. New and selective ryanodine receptor activators for insect control. Bioorganic & Medicinal Chemistry, 17(12): 4127-4133.
Leonard D E. 1981. Bioecology of the gypsy moth∥Doane C C, McManus M L. The gypsy moth: Research toward integrated pest management. Washington, D.C.: U.S. Department of Agriculture, Forest Service, Science and Education Agency, Animal and Plant Health Inspection Service, 9-29.
Li X C, Baudry J, Berenhaum M R,etal. 2004. Structural and functional divergence of insect CYP6B proteins: From specialist to generalist cytochrome P450. Proceeding of the National Academy of Sciences USA, 101(9):2939-2944.
Li X C, Schuler M A, Berenbaum M R. 2007. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics. Annual Review of Entomology, 52: 231-253.
Li A, Yang Y, Wu S,etal. 2006. Investigation on the resistance mechanisms to fipronil in diamondback moth. Journal of Economic Entomology, 99(3): 914-919.
Lin Q, Jin F, Hu Z,etal. 2013. Transcriptome analysis of chlorantraniliprole resistance development in the diamondback mothPlutellaxylostella. PLoS One, 8(8):e72314.
Liu X, Wang H Y, Ning Y B,etal. 2015. Resistance selection and characterization of chlorantraniliprole resistance inPlutellaxylostella(Lepidoptera: Plutellidae). Journal of Economic Entomology, 108(4):1978-1985.
Liu N, Scott J G. 1998. Increased transcription ofCYP6D1 causes cytochrome P450-mediated insecticide resistance in housefly. Insect Molecular Biology, 28(8): 531-535.
Lvaylo S. 2001.Cytochrome P450s: coupling development and environment. Trends in Genetics, 17(11):629-632.
Nelson D R.2009.The cytochrome P450 homepage.Human Genomics,4(1):59-65.
Pfaffl M W, Horgan G W, Dempfle L. 2002. Relative expression software tool (REST) for group-wise comparison and statistical analysis of relative expression results in real-time PCR. Nucleic Acids Research, 30(9):e36.
Riveron J M, Ibrahim S S, Chanda E,etal. 2014. The highly polymorphicCYP6M7 cytochrome P450 gene partners with the directionally selectedCYP6P9aandCYP6P9bgenes to expand the pyrethroid resistance front in the malaria vectorAnophelesfunestusin Africa. BMC Genomics, 15: 817.
Riveron J M, Irving H, Ndula M,etal. 2013. Directionally selected cytochrome P450 alleles are driving the spread of pyrethroid resistance in the major malaria vectorAnophelesfunestus. Proceeding of the National Academy of Sciences USA, 110(1): 252-257.
Spomer N A, Kamble S T, Siegfried B D. 2009. Bioavailability of chlorantraniliprole and indoxacarb to eastern subterranean termites (Isoptera: Rhinotermitidae) in various soils. Journal of Economic Entomology, 102(5): 1922-1927.
Sun L L, Wang Z Y, Zou C S,etal. 2014. Transcription profiling of 12 Asian gypsy moth(Lymantriadispar)cytochrome P450 genes in response to insecticides. Archives of Insect Biochemistry and Physiology, 85(4):181-194.
Teixeira L A F, Gut L J, Wise J C,etal. 2009. Lethal and sublethal effects of chlorantraniliprole on three species ofRhagoletisfruit flies (Diptera: Tephritidae). Pest Management Science, 65(2): 137-143.
Willis D K, Wang J, Lindholm J,etal. 2010. Microarray analysis of juvenile hormone response inDrosophilamelanogasterS2 cells. Journal Insect Science, 10: 66.
Yeoh B, Lee C Y. 2007. Tunneling responses of the Asian subterranean termite,Coptotermesgestroiin termiticide-treated sand (Isoptera: Rhinotermitidae). Sociobiology, 50(2): 457-468.
Zhao Y, Hull A K, Gupta N R,etal. 2002. Trp-dependent auxin biosynthesis inArabidopsis: involvement of cytochrome P450sCYP79B2 andCYP79B3. Genes & Development, 16(23): 3100-3112.
Zhou X J, Ma C X, Li M,etal. 2010.CYP9A12 andCYP9A17 in the cotton bollwormHelicoverpaarmigera: sequence similarity, expression profile and xenobiotic response. Pest Management Science, 66(1):65-73.
Zhu F, Parthasarathy R, Bai H,etal. 2010. A brain-specific cytochrome P450 responsible for the majority of deltamethrin resistance in the QTC279 strain ofTriboliumcastaneum. Proceeding of the National Academy of Sciences USA, 107(19):8557-8562.
(责任编辑 朱乾坤)
Chlorantraniliprole Stress
Dang Yingqiao Yin Jingjing Chen Chuanjia Sun Lili Liu Peng Cao Chuanwang
(CollegeofForestry,NortheastForestryUniversityHarbin150040)
【Objective】Lymantriadisparis a major forest pest. Cytochrome P450 is ubiquitous key metabolic detoxification enzyme for xenobiotics in insects. This study onCYP6AN15v1 detoxifying pesticides aims to provide theoretical basis forL.disparcontrol. 【Method】 The full length cDNA ofLdCYP6AN15v1 was cloned by RT-PCR technology. The transformantDrosophilavector expressingCYP6AN15v1 gene was constructed with the method of traditional restriction endonuclease digestion and ligation. Homozygous transformantDrosophilalines withLdCYP6AN15v1 were successfully constructed by using transformant technology. The effects of low dosage of chlorantraniliprole on cytochrome P450 activity andCYP6AN15v1 expression levels in transformant and untransformantDrosophilawere examined using spectrophotometry and real-time RT-PCR technology, respectively. 【Result】 The full length cDNA ofCYP6AN15v1 (namelyLdCYP6AN15v1) was isolated fromL.dispartranscriptome. The open reading frame (ORF) ofLdCYP6AN15v1 was 1 539 bp encoding a protein of 512 amino acid residues with the molecular mass of 59.02 kDa. Phylogenetic analysis of CYP proteins showed CYP6AN15v1 ofL.disparclustered into a group withSpodopteraexiguaandHelicoverpaarmigera. The transformantDrosophilaattP40>CYP6AN15v1 was detected 1 539 bp of target gene using DNA and cDNA as template showing successful expression ofLdCYP6AN15v1 into transformantDrosophila. Compared to untransformant attP40Drosophila, the susceptibility of attP40>CYP6AN15v1Drosophilato chlorantraniliprole was significantly decreased by 2.92-fold of untransformantDrosophilafor LC50. Under 7.17 mg·L-1chlorantraniliprole stress, the cytochrome P450 activity andCYP6AN15v1 expression inL.disparwere dependent on time effects. The cytochrome P450 activity of attP40>CYP6AN15v1Drosophilawas from 1.09- to 1.93-fold of untransformantDrosophilawhile mRNA expression levels ofCYP6AN15v1 in attP40>CYP6AN15v1Drosophilawere 44.54- to 137.80-fold of untransformantDrosophilashowing induction effects. 【Conclusion】 The transformantDrosophilaline attP40>CYP6AN15v1 was successfully constructed by using transgenic technology. The results suggest that the up-regulated expression ofLdCYP6AN15v1 gene induced by chlorantraniliprole could enhance P450 activity inL.disparlarvae to detoxify the chlorantraniliprole.
Lymantriadispar; transformantDrosophila; chlorantraniliprole;CYP6AN15v1; induced expression
10.11707/j.1001-7488.201706011
2016-08-13;
2017-01-20。
国家自然科学基金项目(31570642); 黑龙江省自然科学基金项目(C201409); 东北林业大学本科生创新项目(201510225183)。
S763.306
A
1001-7488(2017)06-0094-11
*曹传旺为通讯作者。
