多孔掺杂型钛系离子筛的制备及吸附性能
2017-07-18董殿权王永顺房超
董殿权,王永顺,房超
(青岛科技大学化工学院,山东 青岛 266042)
多孔掺杂型钛系离子筛的制备及吸附性能
董殿权,王永顺,房超
(青岛科技大学化工学院,山东 青岛 266042)
用52.40 nm的PMMA纳米微球作模板,用配制好的前驱液进行填充,并通过程序升温焙烧的方法去除模板,合成多孔掺杂型的Li4Ti4.98Zr0.02O12离子筛;用0.100 mol·L-1的盐酸对离子筛进行酸改型,并用XRD、SEM、饱和交换容量、pH滴定曲线等进行表征,考察离子筛的结构以及选择吸附性能。结果表明:制备的离子筛为尖晶石结构,平均孔径约为50 nm;酸改型后其尖晶石结构未被破坏;离子筛对Li+的饱和交换容量为6.43 mmol Li+·g-1,对Li+有较高的选择吸附性。
纳米模板;Li4Ti4.98Zr0.02O12;吸附;离子交换;选择性
引 言
锂具有比热容大、密度小、膨胀系数低等优良特性,广泛应用于电池、玻璃陶瓷、润滑脂、空气处理和铝冶炼等行业。2005~2015年全球锂的需求量平稳上升,年均增速为 7%,而其中电池领域锂需求年均增速则高达 25%[1]。全球大部分的锂存在于盐湖卤水和海水中,从海水和盐湖卤水等低锂的环境中提锂成了现今锂行业研究的热点[2]。离子筛有无污染、吸附性高和可循环的优点,因此备受人们的关注[3]。制备选择性高、稳定性好、表面积大的离子筛成为研究的热点[4-8]。近年来,钛酸锂(Li4Ti5O12)作为一种锂离子电池的负极材料受到了越来越多的关注[9-13]。赵鹏等[14]采用共沉淀法,Parkash 等[15]、Venkateswarlu 等[16]、Wang 等[17]采用溶胶-凝胶法制得 Li4Ti5O12,将 Li4Ti5O12用作锂离子筛的报道比较少。由于尖晶石结构的Li4Ti5O12是一种对锂离子有特殊记忆性的交换材料,且饱和交换容量较大,有望在未来用于海水及卤水中提锂[18]。用少量的 Zr、Ni、Al等对钛系离子筛和锰系离子筛进行掺杂,可以改良其吸附性能[19-20]。本文采用溶胶-凝胶法合成出溶损率小于0.05%(质量分数)的掺杂型离子筛(Li4Ti4.98Zr0.02O12),并测定其结构和离子交换选择性。
1 实验材料和方法
1.1 主要仪器以及试剂
试剂:十二烷基硫酸钠,过硫酸钾,甲基丙烯酸甲酯(MMA),无水乙醇,钛酸丁酯,乙酸锂,柠檬酸,硝酸氧锆,盐酸,氢氧化锂,氯化锂,氯化钠,氢氧化钠,氢氧化钾,氯化钾,以上试剂均为分析纯试剂,去离子水。
仪器:Nano-ZS90型纳米粒度及zeta电位分析仪,英国马尔文(Malvern)公司;D/max-rA型 X射线衍射仪,日本理学公司,测试条件为,管电压40 kV,电流100 mA,CuKa射线=0.15405 nm,扫描范围 10°~80°;DX-120型离子色谱仪,美国戴安(Dionex)公司;pHS-3C型精密pH计,上海雷磁公司;T-1200NT程序控温管式电阻炉,郑州天纵电气有限公司;JSM-6700F扫描电子显微镜,日本电子公司,加速电压为20~25 kV。
1.2 模板制备及离子筛前体的制备
以甲基丙烯酸甲酯为单体,十二烷基硫酸钠为乳化剂,过硫酸钾为引发剂,通过乳液聚合的方法制备PMMA微球[21],用Nano-ZS90型纳米粒度及zeta电位分析仪测其粒径分布,并将制备的乳液倒入蒸发皿中自然蒸干,然后放入干燥箱在60℃下干燥2 h制得PMMA纳米微球模板,研磨备用。
用柠檬酸作螯合剂,将乙酸锂、钛酸丁酯、硝酸氧锆按照分子式(Li4Ti4.98Zr0.02O12)比例加入50 ml的无水乙醇中,配制金属离子总离子浓度为0.50 mol·L-1的前驱液备用[22-25]。
将制备好的PMMA纳米模板放入抽滤漏斗中,然后用前驱液进行填充,待模板完全浸润 15 min后,抽滤出多余的前驱液,便得到模板和前驱液的复合物。将填充后的模板放入60℃的烘箱中干燥。将干燥后的复合物在管式炉中程序升温:先以 2℃·min-1由室温升温到 300℃,在 300℃焙烧 120 min,用来去除纳米模板,再以2℃·min-1分别升到500、600、700和800℃并在各温度焙烧4 h,制得不同焙烧温度下的复合氧化物,选择合适的、尖晶石结构的复合氧化物作为离子筛前体。其理论组成为Li4Ti4.98Zr0.02O12。
参照上述方法制备出不加模板的离子筛前体,以作对比。
用扫描电镜和X射线衍射仪对制备的离子筛前体进行分析表征。
1.3 离子筛前体的酸改型
称取9份0.1000 g离子筛前体放入锥形瓶中,分别加入50 ml浓度为0.020、0.040、0.060、0.080、0.100、0.200、0.300、0.400、0.500 mol·L-1的盐酸溶液,在25℃下恒温振荡浸取72 h,测定上清液中的 Li+和 Ti4+含量,得出离子筛在不同酸浓度下的Li+浸出率以及Ti4+溶损率。根据实验结果确定合适的盐酸溶液浓度,并采用此浓度对离子筛前体进行酸改型,即制得离子筛。
1.4 饱和交换容量的测定
称取3份0.1000 g酸改型后的离子筛,分别加入 0.100 mol·L-1的 Li+、Na+、K+的溶液(pH=10)50 ml,在25℃下恒温振荡浸取,7 d后测定上清液中的离子浓度,根据各离子的减少量[26],计算出各离子的饱和交换容量。
1.5 吸附脱附循环实验
将0.1000 g酸改型后的离子筛放入锥形瓶中,加入 50 ml、0.100 mol·L-1的 LiCl溶液,在 25℃恒温振荡24 h,测定上清液中Li+的浓度,通过Li+的减少量计算出离子筛吸附Li+的量。
将离子筛过滤,用去离子水洗至滤液无 Cl-后放入锥形瓶中,加入50 ml、0.100 mol·L-1的盐酸溶液,在25℃振荡24 h,测定上清液中Li+的浓度。通过Li+的增加量计算出洗脱Li+的量。
按照上述步骤共循环5次。
1.6 离子筛的离子交换选择性
称取1份0.1000 g酸改型后的离子筛加入50 ml Li+、Na+、K+浓度均为 0.100 mol·L-1的混合溶液(pH=10)中,在 25℃下恒温振荡 7 d,测定上清液中各离子浓度,计算出离子筛对各离子的吸附量,分析离子筛的离子交换选择性。
1.7 pH滴定曲线
称取0.1000 g酸改型后的锂离子筛14份,放入锥形瓶中,加入50 ml、用0.100 mol·L-1LiOH和0.100 mol·L-1LiCl按不同比例配制的混合溶液中。在25℃下恒温振荡浸取7 d,用pH计测定上清液的pH,得到离子筛对Li+的pH滴定曲线[27-29]。
按同样的实验方法,得到离子筛对Na+和K+的pH滴定曲线。
2 结果与讨论
2.1 模板制备及离子筛前体的制备
用纳米粒度及 zeta电位分析仪测定的 PMMA模板粒径分布如图1所示。
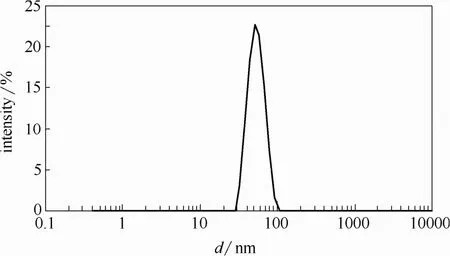
图1 PMMA粒径分布Fig.1 PMMA particle size distribution
由图1可见,制备的PMMA纳米模板,平均粒径为52.40 nm,PDI为0.02。
PMMA纳米模板的扫描电镜如图2所示。

图2 微球模板Fig.2 Microspheres template
由图2可以看出,PMMA模板小球排列比较均匀,且表面较规整,有一定的孔结构,有利于填充前驱液。
采用 PMMA模板和不用模板制备离子筛前体的电镜照片如图3所示,焙烧温度均为800℃。
由图3可见,不用模板制备的离子筛前体为粒状结构,没有微孔。采用模板制备的离子筛前体结构是由30 nm左右的孔壁交联而成,平均孔径约为50 nm,孔状结构明显,提高了液固接触的表面积,有利于离子的吸附交换。

图3 离子筛前体Fig.3 Ion sieve precursor
所制备的离子筛前体的XRD图如图4所示。
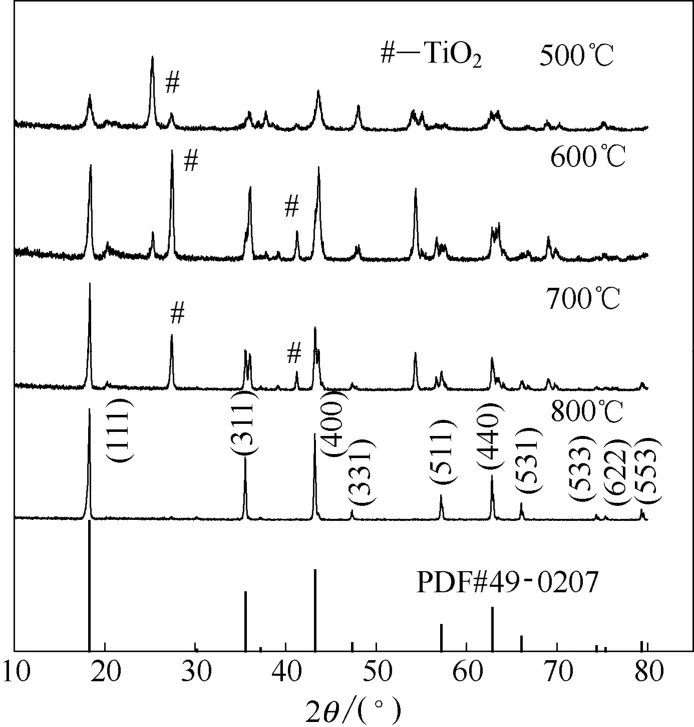
图4 离子筛前体的XRD图Fig.4 XRD patterns of ion sieve precursors
由图4可见,随着焙烧温度的提高,其衍射峰的强度也逐渐升高。500~700℃焙烧制备出的离子筛前体含有 TiO2杂峰,结晶不理想。当温度达到800℃时无TiO2的衍射峰,衍射峰较好,结晶度较高。其数据与国际衍射数据中心(ICDD)中尖晶石结构的PDF#49-0207数据一致,所制备的离子筛前体为尖晶石结构。因此选择在 800℃焙烧,可制得到结晶较好的、具有尖晶石结构的离子筛前体,其理论组成为Li4Ti4.98Zr0.02O12。
2.2 离子筛前体的酸改型
盐酸浓度与Li+、Ti4+抽出率的关系见图5。
由图5可以看出,在盐酸浓度较低时,Li+的浸出率随酸浓度的增加而逐渐增加,在盐酸浓度为0.100 mol·L-1时,Li+的浸出率达到74.3%(质量分数),盐酸浓度再增加,Li+的浸出率增加较小,变化不大。
从图中还可以看出,随着盐酸浓度的增加,Ti4+的浸出率(即 Ti4+溶损率)逐渐增加,在盐酸浓度大于0.100 mol·L-1时,Ti4+溶损率增加较快。
综合考虑,离子筛酸改型选择盐酸浓度为0.100 mol·L-1,这时 Li+的浸出率较高,达到 74.3%,钛的溶损率较低,为0.049%。在此条件下离子筛溶损率较少,且较多的Li+能被洗脱出来。
酸改型前和酸改型后离子筛的XRD图见图6。
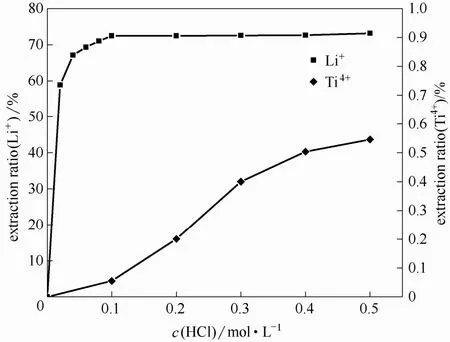
图5 盐酸浓度与Li+、Ti4+的抽出率的关系Fig.5 Variability of Li+, Ti4+extraction ratios with change of hydrochloric acid concentration
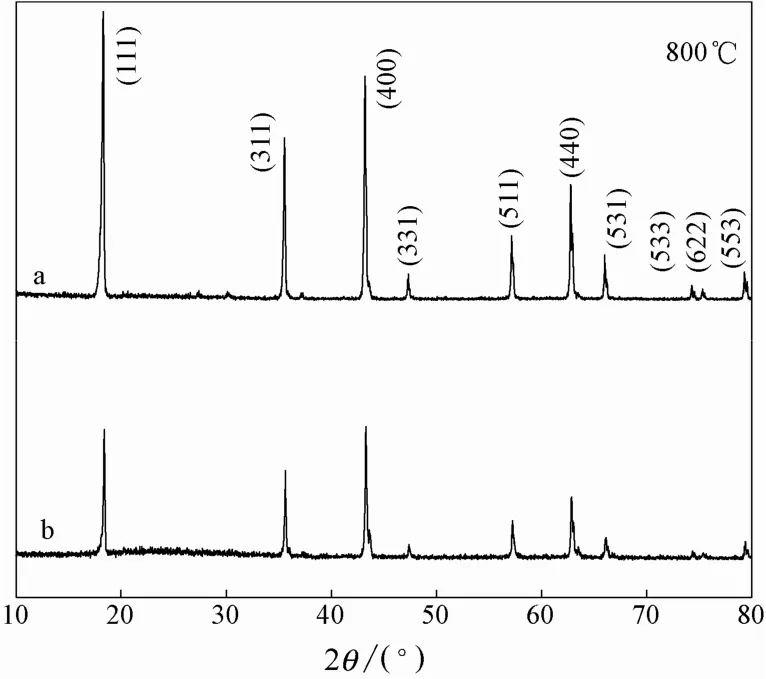
图6 离子筛XRD图Fig.6 XRD patterns ion sieve
由图可以看出酸改型后的衍射峰和酸改型前的衍射峰一致,在酸改型后的离子筛仍保持尖晶石结构。
2.3 饱和交换量的测定
饱和交换容量与离子半径的关系见图7。
由图7可以看出,离子筛对Li+的饱和交换容量达到了 6.43 mmol Li+·g-1,对 Na+和 K+的饱和交换容量为 0.56 mmol Na+·g-1、0.53 mmol K+·g-1。离子筛对Li+的饱和交换容量大于对Na+、K+的饱和交换容量。
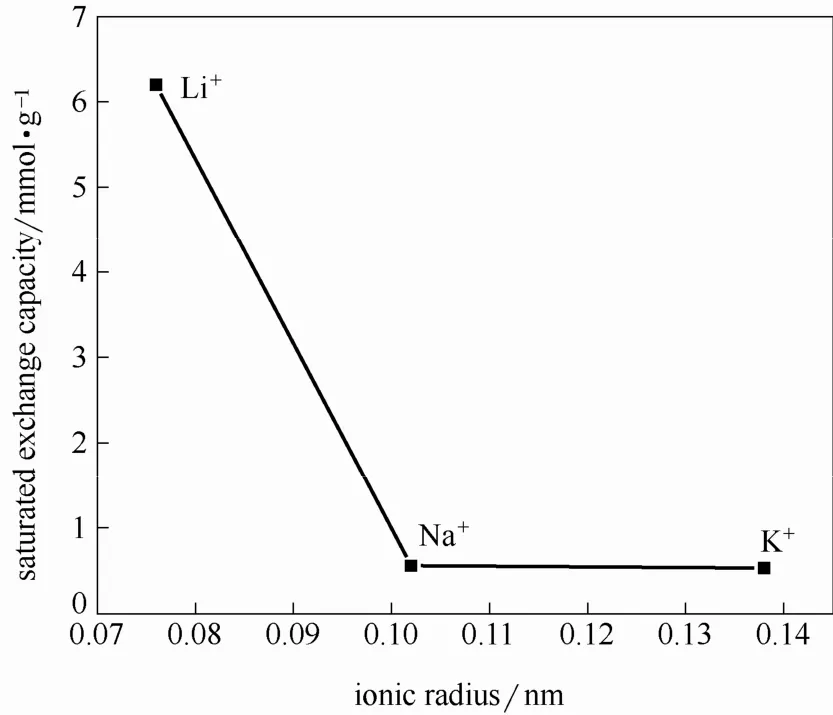
图7 饱和交换容量与离子半径的关系Fig.7 Relationship between saturation exchange capacity and ionic radius
离子筛对 Li+的饱和交换容量达到离子筛理论含锂量(8.69 mmol Li+·g-1)的73.99%。这是因为Li4Ti5O12属于尖晶石结构,空间群为 Fd13m,Li4Ti5O12也可表示为Li4/3Ti5/3O4,其结构为[Li]8a[Li1/3Ti5/3]16d[O4]32e[30-32]。其中8a位置的Li+占Li+总量的 3/4,位于尖晶石结构的四面体间隙中,容易被交换。Li4Ti4.98Zr0.02O12的结构也是尖晶石结构,处在8a位置的Li+容易被交换。Li4Ti4.98Zr0.02O12在进行酸改型且不破坏其尖晶石结构的情况下 8a位置的Li+较容易被交换,理论上有75%的Li+容易被交换,实际交换的Li+达到73.99%,与75%接近。
2.4 离子筛的吸附脱附循环实验

表1 离子筛吸附脱附循环实验Table 1 Adscription and desorption experiments of ion sieve
离子筛的吸附脱附循环实验结果见表1。
由表1可以看出,离子筛吸附Li+的量为4.24~4.37 mmol Li+·g-1,为饱和吸附量(6.43 mmol Li+·g-1)的65.94%~67.96%。在脱附时,洗脱下Li+的量为4.12~4.17 mmol Li+·g-1,能将所吸附95%以上的Li+洗脱出来。经过5次的吸附-脱附循环实验,离子筛对 Li+吸附和脱附的量变化不大,离子筛的循环利用性能较好。
2.5 离子筛的离子交换选择性
离子筛的离子交换选择性实验结果见表2。

表2 离子交换选择性实验Table 2 Ion exchange selectivity experiment
由表2可见,在Li+、Na+、K+浓度相同的溶液中,离子筛对 Li+的交换容量达到了 5.97 mmol Li+·g-1,对 Na+的交换容量为 0.23 mmol Na+·g-1,对 K+的交换容量为 0.17 mmol K+·g-1。在 Li+、Na+、K+浓度相同的混合溶液中,离子筛优先选择吸附Li+,离子筛对Li+有较好的离子交换选择性。
2.6 pH滴定曲线
离子筛对Li+、Na+、K+的pH滴定曲线如图8所示。
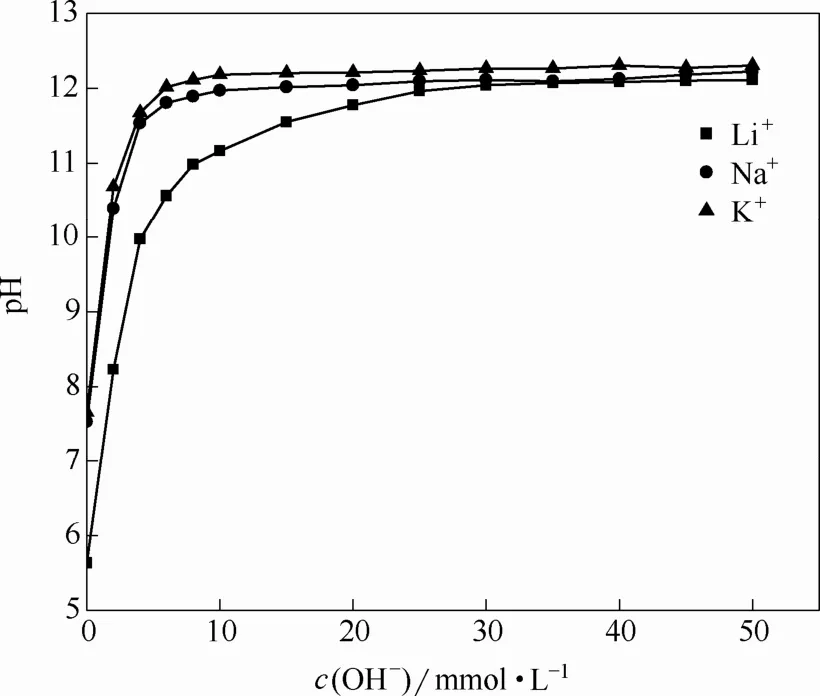
图8 pH滴定曲线Fig.8 pH titration curve
由图8可见,离子筛对Li+、Na+、K+的pH滴定曲线都存在一个突跃,而后趋于平衡,表明离子交换达到饱和。在实验范围内,Na+、K+的pH滴定曲线在OH-浓度很低时就存在突跃,交换达到饱和,交换容量较小。Li+的pH滴定曲线在OH-浓度为25 mmol·L-1时趋于平衡,交换接近饱和,离子筛对Li+的交换容量高于对Na+、K+的交换容量。说明离子筛对锂有较高的选择性及吸附量。
3 结 论
(1)用平均粒径为52.40 nm的PMMA模板制备出掺杂型、多孔结构的离子筛前体Li4Ti4.98Zr0.02O12,其为尖晶石结构。用 0.100 mol·L-1的盐酸可将离子筛前体中 74.3%的 Li+浸出,Ti4+溶损率小于 0.05%,酸改型后的离子筛仍为尖晶石结构。
(2)离子筛对 Li+的饱和交换容量达到 6.43 mmol Li+·g-1,比 Na+和 K+的交换容量大,离子筛对Li+有较好的离子交换选择性。
(3)经过5次的吸附-脱附循环实验,离子筛吸附Li+的量为饱和交换容量的65.94%~67.96%,在脱附时,能将所吸附 95%以上的 Li+洗脱出来。循环性能较好。
[1] 邢佳韵, 彭浩, 张艳飞, 等. 世界锂资源供需形势展望[J]. 资源科学, 2015, 37(5): 988-997.XING J Y, PENG H, ZHANG Y F, et al. Prospects for the world lithium resource supply and demand[J]. Resources Science, 2015,37(5): 988-997.
[2] HAN Y, KIM H, PARK J. Millimeter-sized spherical ion-sieve foams with hierarchical pore structure for recovery of lithium from seawater[J]. Chem. Eng. J., 2012, 210(11): 482-489.
[3] TIAN L Y, MA W, HAN M. Adsorption behavior of Li+onto nano-lithium ion sieve from hybrid magnesium/lithium manganese oxide[J]. Chem. Eng. J., 2010, 156(1): 134-140.
[4] CHUNG K S, LEE J C, KIM W K, et al. Inorganic adsorbent containing polymeric membrane reservoir for the recovery of lithium from seawater[J]. J. Membrane Sci., 2008, 325(2): 503-508.
[5] 刘骆峰, 张雨山, 黄西平, 等. 海水卤水提锂高效吸附剂的合成及应用研究[J]. 化学工业与工程, 2010, 27(2): 138-143.LIU L F, ZHANG Y S, HUANG X P, et al. Synthesis and application of efficient adsorbent for lithium extraction from seawater and brines[J]. Chemical Industry and Engineering, 2010, 27(2): 138-143.
[6] 董殿权, 刘维娜, 刘亦凡. LiNi0.05Mn1.95O4的合成及其对 Li+的离子交换热力学[J]. 物理化学学报, 2009, 25(7): 1279-1284.DONG D Q, LIU W N, LIU Y F. Synthesis of LiNi0.05Mn1.95O4and its ion-exchange kinetics for Li+[J]. Acta Phy.-Chim.Sin., 2009, 25(7):1279-1284.
[7] KENTA O, TAKAHIDE N, SYOUHEI N, et al. Synergistic solvent impregnated resin for adsorptive separation of lithium ion[J]. Ind Eng Chem. Res., 2010, 49(14): 6554-6558.
[8] 李超, 肖伽励, 孙淑英, 等. 球形离子筛吸附剂的制备及其锂吸附性能评价[J]. 化工学报, 2014, 65(1): 220-226.LI C, XIAO J L, SUN S Y, et al. Preparation and lithium adsorption evaluation for spherical ion-sieve granulated by agarose[J]. CIESC Journal, 2014, 65(1): 220-226.
[9] ALLEN J L, JOW T R, WOLFENSTINE J. Low temperature performance of nanophase Li4Ti5O12[J]. J. Power Sources, 2006,159(2): 1340-1345.
[10] HAO Y J, LAI Q, LU J Z, et al. Synthesis and characterization of spinel Li4Ti5O12anode material by oxalic acid-assisted sol-gel method[J]. J. Power Sources, 2006, 158(2): 1358-1364.
[11] HU X B, DENG Z H, SUO J H, et al. A high rate, high capacity and long life (LiMnO4+AC)/Li4Ti5O12hybrid battery-supercapacitor[J]. J.Power Sources, 2009, 187(2): 635-639.
[12] SHI X, ZHENG Z B, ZHOU D F, et al. Synthesis of Li+adsorbent(H2TiO3) and its adsorption properties[J]. Trans. Nonferrous Met. Soc.China, 2013, 23(1): 253-259.
[13] ALIAS N A, KUFIAN M Z, TEO L P, et al. Synthesis and characterization of Li4Ti5O12[J]. J. Alloy Compd., 2009, 486(1/2):645-648.
[14] 赵鹏, 姚彩珍, 樊小勇. 共沉淀法合成 Li4Ti5O12及其性能研究[J].无机盐工业, 2010, 42(8): 34-36.ZHAO P, YAO C Z, FAN X Y. Synthesis of Li4Ti5O12by co-precipitation method and study on its performances[J]. Inogeanic Chemicals Industry, 2010, 42(8): 34-36.
[15] PRAKASH A S, MANIKANDAN P, RAMESHA K.Solution-combustion synthesized nanocrystalline Li4Ti5O12as high-rate performance Li-ion battery anode[J]. Chem. Mater., 2010,22(9): 2857-2863.
[16] VENKATESWARLU M, CHEN C H, DO J S, et al. Electrochemical properties of nano-sized Li4Ti5O12powders synthesized by a sol-gel process and characterized by X-ray absorption spectroscopy[J]. J.Power Sources, 2005, 146(1/2): 204-208.
[17] WANG X J, LI X H, WANG Z X, et al. Preparation and characterization of Li4Ti5O12from ilmenite[J]. Powder Technol., 2010,204(2/3): 198-202.
[18] ALDON L, KUBIAK P, WOMES M, et al. Chemical and electrochemical Li-insertion into the Li4Ti5O12spinel[J]. Chem.Mater., 2004, 16(26): 5721-5725.
[19] ZHANG Y Y, WANG D, WANG Y Y. Synthesis of Zr doped Li4Ti5O12by a high-energy ball-milling modified solid-state method[J]. Rare Metal Mat. Eng., 2014, 43(9): 2237-2240.
[20] MA L, CHEN B Z , SHI X C, et al. Stability and Li+extraction/adsorption properties of LiMxMn2-xO4(M=Ni, Al, Ti:0≤x≤1) in aqueous solution[J]. Colloid Surface A, 2010, 369(1/2/3):88-94.
[21] MARKUS A, WOLFGANG B, DOROTHEA M, et al. Synthesis and size control of polystyrene latices via polymerization in microemulsion[J]. Macromolecules, 1991, 24(25): 6636-6643.
[22] ZAGHIB K, SIMONEAU M, ARMAND M, et al. Electrochemical study of Li4Ti5O12as negative electrode for Li-ion polymer rechargeable batteries[J]. J. Power Sources, 1999, 8l/82(9): 300-305.
[23] PROSINI P P, MANCINI R, PETRUCCI L, et al. Li4Ti5O12as anode in all-solid-state, plastic, lithium-ion batteries for low-power applications[J]. Solid State Ionics, 2001, 144(1/2): 185-192.
[24] MATSUI E, ABE Y, SENNA M, et al. Solid-state synthesis of 70 nm Li4Ti5O12particles by mechanically activating intermediates with amino acids[J]. J. Eur. Ceram. Soc., 2008, 91(5): 1522-1527.
[25] YANG L X, CHENG L H. Preparation method of three-dimensional ordered macroporous titanium oxide “lithium ion sieve”:101342479[P]. 2008-10-03.
[26] 童辉, 孙育斌, 陈永熙, 等. 溶胶-凝胶法合成锂离子筛前体LiMn2O4的研究[J]. 化工新型材料, 2004, 32(4): 33-35.TONG H, SUN Y B, CHEN Y X, et al. Study on synthesis of Li ionic sieve precursor LiMn2O4by sol-gel method[J]. New Chemical Materials, 2004, 32(4): 33-35.
[27] 纪志永, 许长春, 袁俊生, 等. 尖晶石型锂离子筛研究进展[J]. 化工进展, 2005, 24(12): 1336-1341.JI Z Y, XU C C, YUAN J S, et al. Progress of study on spinel lithium ion-sieve[J]. Chem. Ind. Eng. Prog., 2005, 24(12): 1336-1341.
[28] DONG D Q, ZHENG J G, HAN X L. Synthesis and ion exchange properties for Cs+of ammonium-type mordenite[J]. Rare Metals,2015, 34(10): 752-756.
[29] WANG L, MENG C G, MA W. Study on Li+uptake by lithium ion-sieve via the pH technique[J]. Colloid. Surface A, 2009,334(1/2/3): 34-39.
[30] 董殿权, 张凤宝, 张国亮, 等. Li4Ti5O12的合成及对Li+的离子交换动力学[J]. 物理化学学报, 2007, 23(6): 950-954.DONG D Q, ZHANG F B, ZHANG G L, et al. Synthesis of Li4Ti5O12and its kinetics for lithium ion exchange[J]. Acta Phy. -Chim. Sin.,2007, 23(6): 950-954.
[31] 董殿权. 离子交换剂的合成及交换机理研究[D]. 天津: 天津大学,2006.DONG D Q. Study on synthesis and exchange mechanism of ion exchangers[D]. Tianjin: Tianjin University, 2006.
[32] SEARS J A, YANG Z G, GRAFF G L, et al. Lithium diffusion in Li4Ti5O12at high temperatures[J]. J. Power Sources, 2011, 196(4):2211-2220.
Preparation and adsorption properties of porous doped titanium series
DONG Dianquan, WANG Yongshun, FANG Chao
(College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, Shandong, China)
With 52.40 nm PMMA microspheres as template, the templates were filled with the prepared precursor solution. The template removed by the method of temperature-programmed roasting to synthesize the porous doped Li4Ti4.98Zr0.02O12ion sieve. The ion sieve was acid-modified with 0.100 mol·L-1hydrochloric acid and characterized by XRD, SEM, saturated exchange capacity, pH curve to test the structure of the ion sieve and adsorption performance. The results show that the prepared ion sieve has a spinel structure with a pore size of about 50 nm. The spinel structure after acid modification has not been destroyed. Ion-sieve exchange capacity is 6.43 mmol Li+·g-1, and it has higher selectivity to Li+.
nano-template; Li4Ti4.98Zr0.02O12; adsorption; ion exchange; selectivity
date:2016-11-07.
Prof. DONG Dianquan, dongdianquan@sohu.com
supported by the National Natural Science Foundation of China (51272114), the Qingdao City Science and Technology Program Basic Research Project (12-1-4-3-(8)-jch) and the Qingdao University of Science and Technology to Introduce Talent Research Fund project(00223222).
TQ 131.1;TQ 028.3+3
A
0438—1157(2017)07—2812—06
10.11949/j.issn.0438-1157.20161571
2016-11-07收到初稿,2017-03-14收到修改稿。
联系人及第一作者:董殿权(1969—),男,博士,教授。
国家自然科学基金项目(51272114);青岛市科技计划基础研究项目(12-1-4-3-(8)-jch);青岛科技大学引进人才科研启动基金项目(00223222)。
