芍药内酯苷对放射线辐照法致血虚免疫抑制小鼠的补血作用及机制研究
2017-07-18王成龙王林元朱映黎瞿研吴丽王莎费文婷张建军
王成龙 王林元 朱映黎 瞿研 吴丽 王莎 费文婷 张建军
芍药内酯苷对放射线辐照法致血虚免疫抑制小鼠的补血作用及机制研究
王成龙 王林元 朱映黎 瞿研 吴丽 王莎 费文婷 张建军
目的 研究芍药内酯苷对放射线辐照诱导血虚小鼠的补血作用及调控机制。方法 采用放射线辐照法复制小鼠血虚模型,以四物颗粒和芍药苷为阳性对照药,灌胃芍药内酯苷,检测外周血象、脾脏指数及分离血清,用放射免疫法检测其白细胞介素-1、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)的含量变化并采用实时荧光定量聚合酶链式反应法检测脾脏中GM-CSF和TNF-α的基因表达。结果 与模型组比较,芍药内酯苷30 mg/kg组对白细胞数、脾脏指数均有升高作用(P<0.05),对GM-CSF含量水平亦有升高作用(P<0.05),但降低TNF-α的含量水平(P<0.01)及脾脏中TNF-α mRNA的表达(P<0.01)。结论 芍药内酯苷作为白芍的特征性有效成分,通过对造血细胞因子的调控作用对抗放射线辐照所致的血虚状态,提示其为白芍养血敛阴功效的物质基础之一。
芍药内酯苷; 放射线辐照法; 血虚证; 造血细胞因子
白芍[1]有养血敛阴之功,常用于血虚萎黄,月经不调。赤芍[1]有清热凉血之效,常用于热入营血,血热发斑。究其原因,可能与药材的生长方式、地域分布、生态环境等因素密切相关[2]。现代药理研究表明[3-4],白芍含有单萜及其他苷类化合物,其中含量相对较多的两个成分分别为芍药苷与芍药内酯苷,中国药典规定芍药苷为白芍的标志性成分,但芍药苷同时也是赤芍的标志性成分[1]。李强等[5]发现白芍对于失血法所致的小鼠血虚证的血红蛋白、红细胞、血细胞比容值均有升高作用;在环磷酰胺致血虚模型中同样具有该作用[6],高月等[7]采用基因芯片技术的研究显示,芍药苷可促进骨髓基质细胞分泌造血因子粒细胞集落刺激因子、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、血小板衍生生长因子-α等;抑制造血抑制因子巨噬细胞炎性蛋白的分泌,从而发挥补血作用。朱映黎等[8-9]、屈胜胜等[10]及张建军等[11]揭示芍药内酯苷可以作为区分赤芍和白芍的差异性成分,但由于芍药苷制备方法较为成熟而芍药内酯苷难于分离纯化,文献中对芍药内酯苷的药理研究报道较少。本实验在课题组前期实验研究的基础上,通过芍药内酯苷对放射线辐照致血虚小鼠影响的研究,探讨白芍特征成分芍药内酯苷补血作用的特点及机制。
1 材料与方法
1.1 实验动物
清洁级健康雄性昆明种小鼠,体重(20±2) g,购自北京斯贝福(北京)实验动物科技有限公司[许可证号:SCXK(京)2014-0004]。并以清洁级小鼠维持饲料饲养,由北京科澳协力饲料有限公司提供[合格证号:京饲审(2012)06166]。小鼠饲养于北京中医药大学SPF级动物房,整个实验过程中大鼠自由摄食和饮水(特殊实验期除外),室温20~22℃,相对湿度为60%~70%,灯照周期为12小时,7:00~19:00灯照,19:00~7:00黑暗。实验符合相关伦理学要求。
1.2 照射单位及照射剂量
军事医学科学院放射与辐射医学研究所,根据需要采用60Coγ射线全身辐照1次,辐照剂量3.5Gy,剂量率1.60 Gy/min。
1.3 实验药物
实验用芍药内酯苷、芍药苷:自制,纯度均高于96%;阳性药四物颗粒[吉泰安(四川)药业有限公司生产,批号:1307045],经本室HPLC测定,本品四物颗粒每袋含芍药苷量为32 mg;芍药内酯苷含量为16.45 mg,符合2015版药典四物颗粒规定要求[23],并由本实验室制成药粉备用,用时根据实验需要用去离子水配制成小鼠用药所需浓度。
1.4 仪器与试剂
60Coγ放射源由军事医学科学院放射与辐射医学研究所提供;Beckman Coulter Ac.T5血细胞分析仪(美国Beckman Coulter Inc);Beckman Coulter Ac.T5 diff Rinse(批号:05202C2),Ac. T5 diff WBC Lyse(批号:20402B),Ac. T5 diff Fix(批号:21802E),Ac.T5 diff Hgb Lyse(批号:06902A2);试剂由北京华英生物技术研究所提供,Stat Fax 2100全自动酶标仪(Awareness Technology Inc.USA);IL-1测试盒:北京华英生物技术研究所(批号:201510729),GM-CSF测试盒:北京华英生物技术研究所(批号:201510730),TNF-α测试盒:北京华英生物技术研究所(批号:201510732)。

表1 引物序列
1.5 动物分组与给药方法
将72只小鼠随机分成6个组,即空白组、模型组、四物颗粒2.5 g/kg组(相当于人用量15 g/日,2.5 g四物颗粒中含芍药内酯苷8.225 mg、芍药苷16 mg)、芍药苷30 mg/kg组,芍药内酯苷30 mg/kg 组、芍药内酯苷15 mg/kg组,每组12只。预防给药7天,按每10 g体重灌胃0.2 mL给药,每天1次。空白组、模型组每天灌胃去离子水。
1.6 造模方法
动物适应性喂养5天后,预先给药7天,于第8天上午9:00-11:00按要求进行60Coγ射线全身辐照1次,辐照剂量3.5 Gy,剂量率1.60 Gy/min辐照,造成血虚证模型。
1.7 观察指标
1.7.1 一般观察 观察小鼠的口唇、眼睛、皮毛、尾巴的颜色,精神状态等。
1.7.2 体重测试 实验开始前测体重,以其原始体重作为随机分组的参考标准,取材前一天,禁食不禁水12小时后测体质量并记录。
1.7.3 外周血象测定 辐照后小鼠连续灌胃14天,于第14天末,目内眦取血1 mL,并室温静置3~4 小时后以4500 r/min离心20分钟,移取上清液,测定外周血液中白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、红细胞比容(hematocrit,HCT)数量。
1.7.4 血清中IL-1、GM-CSF、TNF-α含量测定 在体重称重全部结束后,随即用水合氯醛麻醉,摘眼球取血,EDTA抗凝,室温下静置、凝固、离心(3500 r/min,15分钟)、取上清,样品存于-20℃存放待测。用放射免疫法,按试剂盒说明书操作要求进行血清中IL-1、GM-CSF、TNF-α含量测定。
1.7.5 脾脏指数和胸腺指数的测定 小鼠颈椎脱臼死亡后,迅速开腹腔并在冰上分离摘取脾脏和胸腺、快速取出脾脏及胸腺即用电子天平称重,分别计算与体重的比值。指数计算采用以下公式:脾脏(或胸腺)指数=100×脾脏(或胸腺)重量/体质量。
1.7.6 实时荧光定量聚合酶链式反应法(RT-qPCR)检测脾脏中CM-CSF、TNF-α mRNA表达 每组取3只小鼠脾脏组织按Trizol试剂说明,采用异硫氰酸胍一步法抽提总RNA,总RNA经1%的琼脂糖凝胶电泳确定其完整性,采用紫外分光光度计检测总RNA的含量和纯度。取3 μg总RNA为模板,加入Oligo(dT)和M-MLV逆转录酶后以50 μL反应体系在42℃下反应1小时合成cDNA第一链,80℃加热3分钟灭活逆转录酶。采用SYBR Green I荧光染料技术,在20 μL反应体系中,加入cDNA 2 μL、ddH2O 13 μL、SYBR Green荧光定量PCR Mix 4 μL、相应上下游引物各0.5 μL。反应条件为:94℃ 10分钟、94℃ 10秒、X℃(相应基因退火温度)10秒、72℃10秒,45个循环。同时做溶解曲线以确认是否是单一峰。反应结束后,通过琼脂糖凝胶电泳确认扩增产物是否符合原设计片段长度。PCR反应及数据采集在Light Cycler 2.0系统上进行,记录其循环阈值(CT),基因表达结果采用相对定量公式2-ΔΔCT计算,其中Δ(Ct)值=靶基因的(Ct)值-β-actin的(Ct)值。测定脾脏组织CM-CSF、TNF-α mRNA表达水平。引物设计使用Primer 3.0软件,计算机辅助设计,引物序列见表1。
1.8 统计学处理
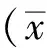
2 结果
2.1 动物的一般体征观察结果
模型组小鼠从辐照第3天后即出现耳朵、尾巴苍白,喘促,逃避、尖叫、直立等现象减少,安静时拱背,反应迟钝,大部分出现懒动,食量减少,毛蓬竖而少光泽,血色暗红。四物颗粒组和芍药苷组小鼠行动敏捷,腰背平直,眼睛明亮,鼻唇洁净潮湿呈淡粉红色,尾圆色粉红,毛色正常,与空白组无明显区别。从致病原因和模型组小鼠的一般体征及症状表现来看,本方法所建立动物模型能反映血虚证的特点和本质。
2.2 芍药内酯苷对血虚小鼠体重和胸腺指数及脾脏指数的影响
与空白组相比,模型组体重、胸腺指数、脾脏指数显著低于空白组(P<0.01,P<0.05,P<0.01)。与模型组相比,四物颗粒组体重、脾脏指数明显高于模型组(P<0.01,P<0.01);芍药苷30 mg/kg和芍药内酯苷30 mg/kg组体重、脾脏指数明显高于模型组(P<0.01),除四物颗粒组外,各给药组都有升高胸腺指数的趋势,但差异无统计学意义(P>0.05)。见表2。
2.3 芍药内酯苷对血虚小鼠外周血象的影响
与空白组比较,模型组的WBC及RBC数量显著降低(P<0.01)、HGB数量降低(P<0.05)、HCT百分比明显降低(P<0.01);与模型组相比,四物颗粒组和芍药苷30 mg/kg组WBC和RBC数量显著升高(P<0.01,P<0.05)、HCT百分比明显升高(P<0.01);芍药内酯苷30 mg/kg组WBC和RBC数量明显升高(P<0.01,P<0.01)、HCT百分比升高(P<0.05)。各给药组HGB数有升高趋势,但差异无统计学意义(P>0.05)。结果见表3。

表2 芍药内酯苷和芍药苷对放射线辐照所致血虚小鼠的胸腺指数、脾脏指数的影响±s,n=12)
注: 与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。

表3 芍药内酯苷和芍药苷对放射线辐照法所致血虚小鼠的WBC、RBC、HGB、HCT的影响
注: 与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
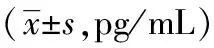
表4 芍药内酯苷和芍药苷对放射线辐照所致血虚小鼠的IL-1、GM-CSF、TNF-α的影响
注: 与空白组比较,bP<0.01;与模型组比较,cP<0.05,dP<0.01;
2.4 芍药内酯苷对血虚小鼠血清IL-1、GM-CSF、TNF-α含量变化的影响
与空白组比较,模型组GM-CSF的含量显著降低(P<0.01);与模型组比较,四物颗粒组的GM-CSF的含量显著升高(P<0.01),芍药苷30 mg/kg组和芍药内酯苷30 mg/kg组GM-CSF的含量明显升高(P<0.05,P<0.05)。与空白组比较,模型组TNF-α的含量显著增加(P<0.01);与模型组比较,四物颗粒组、芍药苷30 mg/kg组及芍药内酯苷30 mg/kg组的TNF-α的含量明显减少(P<0.01,P<0.05,P<0.05),IL-1有升高的趋势,但无统计学意义(P>0.05),芍药内酯苷15 mg/kg组TNF-α的含量有减少的趋势但无统计学意义(P>0.05)。结果见表4。
2.5 芍药内酯苷对放射线辐照法致血虚小鼠脾脏组织CM-CSF、TNF-αmRNA表达水平变化的影响
与空白组比较,模型组GM-CSF mRNA的含量显著降低(P<0.01);与模型组比较,四物颗粒组GM-CSF mRNA的含量明显升高(P<0.01),芍药苷30 mg/kg组GM-CSF mRNA含量升高(P<0.05),芍药内酯苷30 mg/kg组GM-CSF mRNA含量有升高的趋势,但无统计学意义(P>0.05)。与空白组比较,模型组TNF-α mRNA的含量显著增加(P<0.01);与模型组比较,四物颗粒组和芍药苷30 mg/kg组TNF-α mRNA的含量减少(P<0.05,P<0.05),芍药内酯苷30 mg/kg组TNF-α mRNA的含量明显减少(P<0.01),芍药内酯苷15 mg/kg组TNF-α mRNA的含量的也有减少趋势,但无统计学意义(P>0.05)。结果见表5。

表5 芍药内酯苷和芍药苷对放射线辐照所致血虚小鼠GM-CSF、TNF-αmRNA表达水平的影响
注: 与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
3 讨论
血虚证[12]是临床常见病症,现阶段制作血虚证模型的实验方法较多,常用的有综合放血法、放射线辐照法和腹腔注射环磷酰胺法。其中放射线辐照法是公认的动物血虚证模型的造模方法之一[13],此法制备的血虚模型小鼠胸腺和脾脏萎缩,在一定程度上体现了血虚证的临床表现特点和病理的基本变化,现已广泛地应用于血虚发病机制和改善造血机能药物筛选的研究[10]。四物汤为中医治疗血虚证的首选药,由当归、白芍等四味药组成,笔者采用其成方颗粒剂型作为阳性对照药,并经本实验室HPLC测定芍药内酯苷(32 mg/袋)及芍药苷含量(16.45 mg/袋),表明在本实验给药剂量下,二者在四物颗粒成方制剂中的用量与本实验二者的单一成分给药剂量相当。高月[14]、马增春等[15]研究表明,四物汤治疗血虚证与骨髓造血机制相关,主要通过促进骨髓造血干细胞的增殖和抑制骨髓造血干细胞的凋亡来实现。
放射线辐照法致血虚证的实质为骨髓造血功能的损伤,使骨髓超微结构发生变化,造血微环境遭到破坏,骨髓造血重建活性下降,导致血细胞数量的减少[16]。药物影响骨髓造血功能的反应及表现,最终都会反映在血象上,所以通过观察药物对血象的影响,可以作为评价药物对造血功能影响的重要指标。本研究表明芍药内酯苷对放射线辐照法致血虚小鼠具有明确的补血作用,证实芍药内酯苷的补血作用与芍药苷相似,二者均能升高血虚小鼠的白细胞且对脾脏指数也有提高作用,因本实验所选辐照模型对白细胞敏感,但对红细胞不稳定,有时可减少,有时有变化但不大[7,10]。同时,骨髓造血功能受多种造血生长因子调节。GM-CSF是对早期造血祖细胞具有广泛增殖促进活性的集落刺激因子,主要作用于髓系祖细胞,通过与其高亲和力受体结合发挥生物学效应,使其迅速进入细胞周期向粒系及巨噬系分化,最后成为成熟细胞,并能延长成熟细胞的寿命,增强成熟细胞的功能[17]。TNF-α是一种单核因子,主要由单核细胞和巨噬细胞产生,是一种重要的促炎因子和免疫调节因子,能抑制细胞克隆的形成,是造血系统的负向调控因子之一[7]。而IL-1是迄今为止对抗放射线效应最强的细胞因子,其通过直接参与启动造血干细胞、组细胞的活化过程[18-19]。因此,细胞因子的活化,能够在一定程度阐明保护及修复造血干/祖细胞的机理[20-21]。脾脏是主统血,就与血液系统的关系而言,脾脏参与造血、贮血,并能调节外周血液的成分。因此本实验依据血清中IL-1、GM-CSF、TNF-α检测结果,选取脾脏中GM-CSF、TNF-α的基因表达进行研究。本实验结果显示,芍药苷的补血作用与四物颗粒相似,均通过促进GM-CSF造血细胞因子的产生来实现。芍药内酯苷也能升高血清GM-CSF含量水平和脾脏中GM-CSF的基因表达,表明其三者的共有机制可能为通过刺激正向调控因子的分泌,在造血干/祖细胞增殖和分化、免疫细胞的成熟、活化和免疫调节等一系列过程中发挥作用。同时,芍药内酯苷与芍药苷还能降低TNF-α的含量水平和脾脏中TNF-α的基因表达,且芍药内酯苷作用优于芍药苷,则提示白芍的补血作用可能还与通过降低TNF-α的含量和脾脏中TNF-α的基因表达,来促进造血细胞进入增殖周期,并抑制其过度表达Fas受体抑制早期造血功能[22]即对负向造血细胞因子抑制有关。据此结果推测,芍药内酯苷作为白芍的特征成分,能够从调控正向、负向细胞因子2个方面来调节放射线辐照致小鼠血虚状态;而其主要有效性成分芍药苷更倾向于通过调控正向细胞因子来进行调节,这与本课题组前期研究结果相一致[7、23],并提示芍药内酯苷的补血机制与骨髓造血系统及机体的免疫调节有关。据笔者推测,因本次实验中选择的造模辐照剂量偏大,或给药期间小鼠状态欠佳等因素,导致本次血虚小鼠造模程度较重,而给药组未能完全对抗其血虚状态,提高给药组小鼠RBC、HGB的数量以及血清中IL-1含量的水平。同时,为进一步研究芍药内酯苷对放射辐照法致血虚小鼠的补血作用及相关机制还需从免疫器官(包括胸腺、骨髓等淋巴器官组织)造血细胞因子基因及蛋白水平进行深入探讨。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:104-159.
[2] 张建军,李伟,王丽丽,等.赤芍和白芍品种、功效及临床应用述评[J].中国中药杂志,2013,38(20):3595-3601.
[3] 谭菁菁,赵庆春,杨琳,等.白芍化学成分研究[J].中草药,2010,41(8):1245-1248.
[4] 周红涛,骆亦奇,胡世林,等.赤芍与白芍的化学成分含量比较研究[J].中国药学杂志,2003,38(9):16-19.
[5] 李强,周荣,杨伟鹏,等.赤芍、白芍补血作用比较研究(Ⅰ)[J].中医药信息,2010,27(6):11-13.
[6] 李强,周荣,杨伟鹏,等.赤芍、白芍对环磷酰胺所致的血虚证小鼠补血作用比较研究[J].中医药信息,2011,28(1):19-21.
[7] 高月,马增春,谭洪玲,等.四物汤及其提取物对辐射致血虚证小鼠造血作用的研究[J].天津中医药,2003,20(6):47-51.
[8] 朱映黎,张建军,黄银峰,等.白芍和赤芍对环磷酰胺致血虚小鼠的补血作用及对IL-3、TNF-α影响的比较研究[J].中华中医药杂志,2014,(4):1058-1060.
[9] 朱映黎,张建军,王景霞,等.芍药内酯苷和芍药苷对环磷酰胺致血虚小鼠的补血作用及对GM-CSF,IL-3,TNF-α影响的比较研究[J].中国中药杂志,2015,40(2):330-333.
[10] 屈胜胜,张建军,黄银峰,等.芍药苷、芍药内酯苷对放射线辐照法致血虚小鼠的补血作用[J].中国中药杂志,2014,39(15):2952-2955.
[11] 张建军,黄银峰,王丽丽,等.白芍、赤芍及芍药苷、芍药内酯苷对综合放血法致血虚小鼠补血作用的比较研究[J].中国中药杂志,2013,38(19):3358-3362.
[12] 刘卫民,韩艳欣.血虚证病因学的流行病学调查[J].中国中医基础医学杂志,1995,(2):48-50.
[13] 陈奇.中药药理研究方法学[M].3版.人民卫生出版社,2011:1054.
[14] 高月.血虚证实质及四物汤反证研究[J].中国实验方剂学杂志,2003,9(4):58-60.
[15] 马增春,高月,刘永学,等.四物汤对γ射线照射致血虚证小鼠造血细胞作用的研究[J].中国实验方剂学杂志,2001,7(3):41-44.
[16] 李欣娜,李魏.骨髓抑制动物模型建立方法综述[J].黑龙江医药,2008,21(2):24-27.
[17] 陈陵,邹霓,段美华.造血生长因子的临床应用[J].中国实用儿科杂志,1996,(4):241-242.
[18] 黄向东,汤家骥,张卿西.细胞因子抗放作用的研究进展—Ⅰ.细胞因子的辐射防护作用[J].国外医学(放射医学核医学分册),1992,(3):97-101.
[19] 祝红焰,谭允育.八珍汤对(60)Co照射小鼠骨髓细胞及相关细胞因子影响的实验研究[J].中国免疫学杂志,2000,(2):25-27.
[20] Haiyang Gong, Ping Shen, Li Jin,et al.Therapeutic Effects of Lycium barbarum Polysaccharide (LBP) on Irradiation or Chemotherapy-Induced Myelosuppressive Mice[J]. CANCER BIOTHERAPY & RADIOPHARMACEUTICALS,2005,20(2):155-162.
[21] Zeng-Chun Ma,Qian Hong,Yu-Guang Wang,et al.Effects of ferulic acid on hematopoietic cell recovery in whole-body gamma irradiated mice[J]. Int. J. Radiat. Biol,2011,87(5):499-505.
[22] ZHANG M,YIN L J,ZHANG K Z,et al.Response patterns of cytokines/chemokines in two murine strains after irradiation[J].Cytokine,2012,58(2):177.
[23] 朱映黎,王林元,张建军,等.芍药内酯苷、芍药苷对血虚免疫抑制小鼠的补血作用及机制[J].北京中医药大学学报,2016,39(3):204-207.
(本文编辑: 禹佳)
Effects and mechanism of paeoniflorin on mouse model of blood deficiency syndrome induced by radioactive rays
WANGChenglong,WANGLinyuan,ZHUYingli,etal.
BeijingUniversityofChineseMedicine,Beijing100029,China
ZHANGJianjun,E-mail:zjj59@163.com
Objective To explore the effects and mechanism of paeoniflorin on mouse model of blood deficiency syndrome induced by60Co-γ irradiation. Methods Mouse model of blood deficiency syndrome induced by60Co-γ irradiation,Siwugranules and albiflorin was regarded as positive control. Paeoniflorin was given during modeling. The peripheral hemogram and index of thymus gland and spleen were detected, the levels of IL-1, GM-CSF, and TNF-α in serum were detected by radioimmunoassay. The mRNA expressions of hematopoietic-related factors in spleen were detected by RT-qPCR. Results Compared with the model group, the amount of WBC and the index of spleen in paeoniflorin group at the dose of 30 mg/kg were increased obviously (P<0.01,P<0.05) and the levels of GM-CSF in serum in paeoniflorin group(30 mg/kg) was increased obviously (P<0.01,P<0.05), but the level of TNF-α in serum in groups of 30 mg/kg paeoniflorin were reduced (P<0.05) and the expression of TNF-α mRNA in spleen were decreased (P<0.01). Conclusion Paeoniflorin is the characteristic effective constituents of paeoniae radix alba, has regulating effect on hematopoietic cytokine to against blood deficiency induced by radioactive rays. It reminders that paeoniflorin is one of the basic nourishing materials basis for nourishing blood and astringing yin in paeoniae radix alba.
Paeoniflorin; Irradiation; Blood deficiency syndrome; Hematopoietic cytokine
国家自然科学基金(81473370)
100029 北京中医药大学中医学院[王成龙(硕士研究生)、王林元、朱映黎、瞿研、吴丽、王莎、费文婷、张建军]
王成龙(1988- ),2014级在读硕士研究生。研究方向:基于中药基础理论的药效机理及物质基础研究。E-mail:18810900709@163.com
张建军(1965- ),女,博士,研究员,博士生导师,中华中医药学会中药基础理论分会秘书长。研究方向:基于中药基础理论的药效机理及物质基础研究。E-mail:zjj59@163.com
R364.7
A
10.3969/j.issn.1674-1749.2017.07.002
2016-07-03)
