高血压患者血清脂蛋白(a)浓度与颈动脉粥样硬化斑块的相关性研究
2017-07-18连士杰张宝和徐洪涛
杨 莹,连士杰,张宝和,徐洪涛
·临床医学· ·论著·
高血压患者血清脂蛋白(a)浓度与颈动脉粥样硬化斑块的相关性研究
杨 莹,连士杰,张宝和,徐洪涛
目的 观察在低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是否达标的高血压患者中血浆脂蛋白(a)[lipoprotein(a),Lp(a)]的浓度,及其与颈动脉粥样硬化斑块形成的相关性。方法 入选高血压病史5年以上的高血压患者530例,按照LDL-C达标与否进行分层,再将每层按照有无颈动脉斑块进行分组,分为LDL-C达标有斑块组(A组)、LDL-C达标无斑块组(B组)、LDL-C未达标有斑块组(C组)和LDL-C未达标无斑块组(D组),观察各组Lp(a)的浓度。结果 (1)LDL-C达标组患者的Lp(a)浓度低于LDL-C未达标组,其差异有统计学意义(P<0.01);(2)在LDL-C达标组中,A组患者Lp(a)浓度大于B组,但差异无统计学意义(P>0.05);在LDL-C未达标组中,C组患者Lp(a)浓度大于D组,差异具有统计学意义(P<0.01)。结论 对于入院时LDL-C已达标的患者,基线Lp(a)浓度与颈动脉粥样硬化斑块发生无明显相关。然而,对于入院时LDL-C未达标的患者,基线Lp(a)浓度升高可能是颈动脉粥样硬化斑块形成的预测因素。
低密度脂蛋白胆固醇;脂蛋白(a);颈动脉粥样硬化斑块
1963年Berg分离血浆脂蛋白时发现脂蛋白(a)[lipoprotein(a),Lp(a)],由载脂蛋白(a)[Apo(a)]和低密度脂蛋白中载脂蛋白B100(ApoB100)通过二硫键连接而成[1]。众多研究提示Lp(a)是动脉粥样硬化形成的独立危险因素,且独立于胆固醇等传统的危险因子[2-5];但较少报道在低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)达标与否的高血压患者中,其浓度与颈动脉粥样硬化斑块形成的关系。
1 资料与方法
1.1 病例选择 选择2012年9月至2016年9月在我院心内科住院的高血压病史5年及以上患者作为研究对象,共530例,其中男298例,女232例,年龄37~88岁,平均(62.88±8.70)岁,所有患者均符合卫生部2010年《高血压防治指南》中高血压诊断标准,既往未规律使用他汀类药物;所有患者排除继发性高血压、家族性高胆固醇血症、糖尿病、肝肾功能明显异常、甲状腺功能异常。
1.2 研究分组 首先按患者基线LDL-C是否达标将患者分层,再按有无颈动脉斑块形成将患者分为以下4组:LDL-C达标有斑块组(A组)、LDL-C达标无斑块形成组(B组)、LDL-C未达标有斑块形成组(C组)、LDL-C未达标无斑块形成组(D组)。LDL-C是否达标定义:根据2007年中国成人血脂异常防治指南[6],其中高血压未合并动脉粥样硬化性心血管疾病者LDL-C浓度<2.6 mmol/L定义为达标;高血压合并动脉粥样硬化性心血管疾病者LDL-C浓度<1.8 mmol/L定义为达标。LDL-C达标合并斑块组122例,LDL-C达标无斑块形成组131例;LDL-C未达标合并斑块组137例;LDL-C未达标无斑块形成组140例。各组之间基本资料情况见表1。
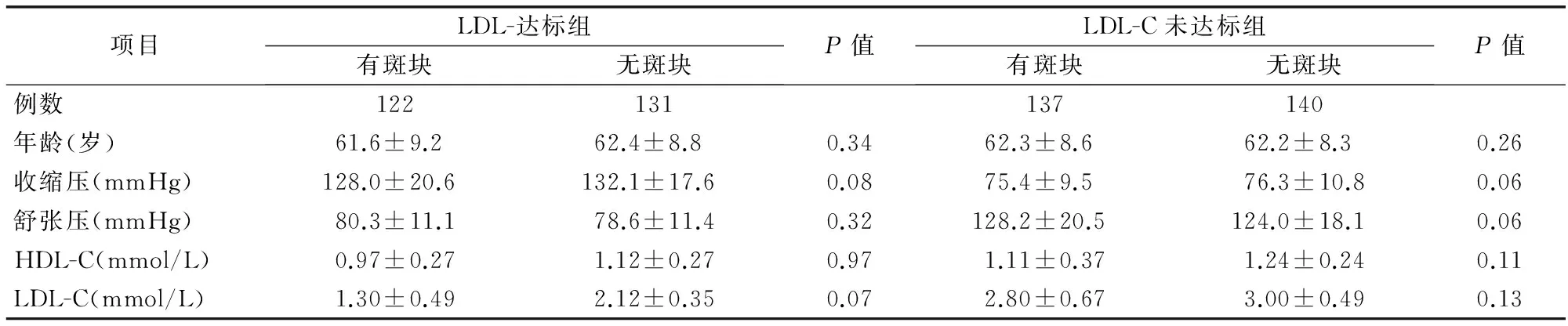
表1 各组患者基本资料比较(x±s)
注:HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇
1.3 相关生化指标的采集 入选的所有患者抽血前夜禁食至少12 h,取同侧肘静脉血2 ml,送我院检验科采用BECKMAN产DXC800全自动生化分析仪,2 h内完成三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、LDL-C、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、Lp(a)、肌酐(serum creatinine,Scr)的测定,其中血浆Lp(a)浓度的测定采用酶联免疫吸附自动乳胶增强免疫测定法[Quantia Lp(a)试剂盒]。
1.4 颈动脉粥样硬化的诊断标准及分类 采用Prosounda10型彩色多普勒超声诊断仪器,UST-5411高频线阵探头频率为5~13 MHz,逐次检测双侧颈总动脉及分叉处、颈内、外动脉颅内段纵横轴实时二维图像,观察每一段的内-中膜厚度(IMT),有无粥样硬化斑块及斑块形态特点。当管壁平整光滑,IMT<0.9 mm时,即视为正常;如发现任意一个血管节段突入管腔,并形成回声结构,表面粗糙或局部IMT≥1.3 mm时,即视为颈动脉斑块。根据颈动脉内-中膜厚度分为颈动脉无斑块形成(IMT<0.9 mm)和颈动脉斑块形成(IMT≥1.3 mm)2类。
1.5 统计学处理 应用SPSS 21.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示;应用独立样本t检验对各组计量资料进行统计学处理,P<0.05表示差异具有统计学意义。
2 结果
2.1 LDL-C达标组与非达标组中Lp(a)的血浆浓度 LDL-C达标组与非达标组中Lp(a)血浆浓度分别为(125.5±11.34)mg/L、(223.4±23.92)mg/L,达标组血浆Lp(a)浓度低于非达标组,差异有统计学意义(P<0.05)。
2.2 各组Lp(a)血浆浓度水平 各组Lp(a)血浆浓度分别为:A组:(114.1±16.13)g/L、B组:(139±15.61)g/L、C组:(128.5±31.09)g/L、D组:(289.5±27.09)g/L;其中LDL-C达标组中,有颈动脉斑块组其Lp(a)血浆浓度高于无颈动脉斑块组,但差异不具有统计学意义(P>0.05);未达标组中,有颈动脉斑块组其Lp(a)血浆浓度高于无颈动脉斑块组,差异有统计学意义(P<0.01)。
3 讨论
Lp(a)是与LDL-C类似的颗粒,是动脉粥样硬化性心血管疾病的独立于其他已知危险因素的预测因子。本研究LDL-C达标组Lp(a)浓度低于未达标组,Lp(a)与LDL-C相似的生理功能未被广大临床医生所重视。关于Lp(a)促进血管粥样硬化斑块形成的可能机制,Sotiriou等[7]认为,Lp(a)和载脂蛋白(a)作为配体与巨噬细胞1的β2整合蛋白结合,激发炎症细胞容易聚集到动脉粥样硬化的斑块周围,激发炎症级联反应,从而促进动脉粥样硬化的形成,并进一步促进斑块的发展。亦有部分学者认为,活化的转化生长因子β1(TGF-β1)的生理功能可以减少平滑肌细胞的增殖,同时抑制其迁移,Lp(a)在血管壁积聚后,TGF-β1的激活受阻,进而平滑肌细胞的过度增殖、迁移,血管粥样硬化病变逐渐形成[8]。除上述两种机制以外,有实验表明Lp(a)在血管壁与LDL-C形成具有高度致动脉粥样硬化的复合物,增加氧化率,摄取并贮留LDL-C[9]。在本研究中,当LDL-C控制达标后,即入院时LDL-C已达标的患者,有颈动脉斑块组其Lp(a)的血浆浓度高于无颈动脉斑块组,但差异无统计学意义。然而,对于入院时LDL-C浓度未达标的患者,有颈动脉斑块组其Lp(a)血浆浓度高于无颈动脉斑块组,差异具有统计学意义。有学者用“血脂假说”解释上述现象,认为动脉粥样硬化形成的主要因素是胆固醇,尤其是LDL-C,降低LDL-C使得动脉粥样硬化斑块形成率减低,已为大量的临床试验所支持。临床研究表明,使用较大剂量他汀类药物将LDL-C降低超过基线50%以上,可以使原来已经形成的动脉粥样硬化斑块逆转[10-11]。LDL-C达标的患者在他汀药物治疗过程中,动脉粥样硬化进程得到延缓、甚至逆转。此时,Lp(a)浓度升高在动脉粥样硬化发生、发展过程中发挥作用有限。但是本研究只是依据入院时LDL-C水平,并没有对患者既往LDL-C水平进行回顾性分析,尚不能知道LDL-C降幅对颈动脉粥样硬化斑块形成的影响。
综上所述,对于入院时LDL-C未达标的高血压患者,基线Lp(a)浓度升高可能是颈动脉粥样硬化斑块形成的预测因素,可以指导临床上是否有必要进一步行颈动脉血管超声检查,以更好地对动脉粥样硬化性心血管疾病(ASCVD)进行一级和(或)二级预防治疗。
[1] Berg K. A new serum type system in man-the lp system[J]. Acta Pathol Microbiol Scand, 1963, 59: 369-382. DOI:10.1111/j.1699-0463.1963.tb01808.x.
[2] Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status[J]. Eur Heart J, 2010, 31(23): 2844-2853. DOI:10.1093/eurheartj/ehq386.
[3] Nasr N, Ruidavets JB, Farghali A, et al. Lipoprotein (a) and carotid atherosclerosis in young patients with stroke[J]. Stroke, 2011, 42(12): 3616-3618. DOI:10.1161/STROKEAHA.111.624684.
[4] Kotani K, Yamada S, Yamada T, et al. The relationship between oxidized lipoprotein(a) and carotid atherosclerosis in asymptomatic subjects: a comparison with native lipoprotein(a)[J]. Lipids Health Dis, 2011, 10: 174. DOI:10.1186/1476-511X-10-174.
[5] Langer C, Tambyrayah B, Thedieck S, et al. Testing for lipoprotein(a) concentration and apolipoprotein(a) phenotypes: method standardization and pediatric reference values[J]. Semin Thromb Hemost, 2011, 37(7): 810-813. DOI:10.1055/s-0031-1297172.
[6] 中国成人血脂异常防治指南制订联合委员会. 中国成人血脂异常防治指南[J]. 中国实用乡村医生杂志, 2012, 19(18): 5-15. DOI:10.3969/j.issn.1672-7185.2012.18.003.
[7] Sotiriou SN, Orlova VV, Al-Fakhri N, et al. Lipoprotein(a) in atherosclerotic plaques recruits inflammatory cells through interaction with Mac-1 integrin[J]. FASEB J, 2006, 20(3): 559-561. DOI:10.1096/fj.05-4857fje.
[8] Lippi G, Guidi G. Lipoprotein(a): from ancestral benefit to modern pathogen[J]. QJM, 2000, 93(2): 75-84. DOI:10.1093/qjmed/93.2.75.
[9] Enas EA, Chacko V, Senthilkumar A, et al. Elevated lipoprotein(a)-a genetic risk factor for premature vascular disease in people with and without standard risk factors: a review[J]. Dis Mon, 2006, 52(1): 5-50. DOI:10.1016/j.disamonth.2006.01.002.
[10] Nissen SE, Nicholls SJ, Sipahi I, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial[J]. JAMA, 2006, 295(13): 1556-1565. DOI:10.1001/jama.295.13.jpc60002.
[11] Nicholls SJ, Ballantyne CM, Barter PJ, et al. Effect of two intensive statin regimens on progression of coronary disease[J]. N Engl J Med, 2011, 365(22): 2078-2087. DOI:10.1056/NEJMoa1110874.
(本文编辑:甘辉亮)
Relationship between the level of lipoprotein(a)and carotid atherosclerotic plaques in patients with high blood pressure
YangYing,LianShijie,ZhangBaohe,XuHongtao
(DepartmentofCadreHealthCare,NavyGeneralHospital,Beijing100048,China)
Objective To observe the serum level of lipoprotein(a)in high blood pressure patients with low density lipoprotein cholesterol (LDL-C) standards and its association with carotid atherosclerotic plaques.Methods Five hundred and thirty patients with history of hypertension for over 5 years were recruited for the study. They were stratified by depending on whether or not they reached the LDL-C standards. Then, by depending on whether there was presence of carotid plaques in each layer, they were divided into 4 groups: Group A with LDL-C standards and plaques, Group B with LDL-C standards but without plaques, Group C without LDL-C standards but with plaques, Group D without LDL-C standards but without plaques. Close observations were made on the levels of Lp(a)in each groups.Results (1) The Lp (a) levels of the groups with LDL-C standards were lower than those of the groups without LDL-C standards. Statistical significance could be noticed when comparisons were made between them(P<0.01). (2) In the group with LDL-C standards, the Lp (a) level in the patients of Group A was higher than that in the patients of Group B, but there was no statistical significance when comparisons were made between them(P>0.05). In the group without LDL-C standards, the Lp (a) level in the patients of Group C was higher than that in the patients of Group D, with statistical significance(P<0.01).Conclusion For the patients with LDL- C level reaching the required standards at the admission, baseline level of Lp (a) seemed to have no obvious correlation with carotid atherosclerotic plaques. However, for the patients without LDL-C level reaching the required standards at the admission, elevated baseline LDL-C level might be a predicting factor in the formation of carotid atherosclerotic plaques.
Low-density lipoprotein cholesterol; Lipoprotei(a); Carotid atherosclerotic plaque
海军后勤科研项目(CHJ12L024)
100048 北京,海军总医院干部保健科(杨莹、连士杰、张宝和),院办 (徐洪涛)
徐洪涛,电子信箱:laohushanshang@163.com
R543
A
10.3969/j.issn.1009-0754.2017.03.015
2016-11-23)
