口服补液的微生物限度检查方法学验证
2017-07-18戴宇婷倪兆武侯晋芳
戴宇婷 倪兆武 侯晋芳
口服补液的微生物限度检查方法学验证
戴宇婷 倪兆武 侯晋芳
目的建立医院制剂口服补液的微生物限度检查方法,确保该方法所得结果可靠准确。方法根据2015年版《中国药典》四部(通则1105、1106)对口服补液的微生物限度检查法进行方法学验证。结果微生物计数法(需氧菌计数及霉菌酵母菌计数):采用常规法进行微生物计数的检查时原液有抑菌作用,1:10稀释后5种实验菌的回收率均达到要求;采用薄膜过滤法进行实验5种实验菌回收率均达到要求。控制菌的检查法:可以采用常规法进行。结论对本品进行微生物限度检查时,应充分考虑采用一定的方法,消除其抑菌性后再依法检查。
医院制剂;口服补液;微生物限度检查;方法学验证
口服补液是该地区医院常用医院制剂,用于呕吐、腹泻等引起的轻中度脱水,可补充体内电解质及水分。微生物限度检查作为控制药品质量的一项重要指标,由于不同药品对微生物的抑制作用差别较大,为了保证方法的可靠性,使实验结果与药品中所含微生物的真实值尽可能接近,按照《中国药典》2015年版规定对口服补液的微生物限度检查方法进行验证。本实验参考相关研究[1-5],选择适当的检查方法,以建立适合口服补液的微生物限度检查方法,保证结果可靠准确。本研究根据《中国药典》2015年版规定的检查方法,加入5种标准菌株(铜绿假单胞菌、枯草芽孢杆菌、金黄色葡萄球菌、黑曲霉菌、白色念珠菌)于制剂中,验证各试验菌的回收率,建立本品的微生物计数方法。加入大肠埃希菌进行检出实验,从而建立本品的控制菌检查方法。
1 仪器与材料
1.1 样品、培养基及试药口服补液(批号:20160310、20160603),由昭通市第一人民医院提供;胰酪大豆胨液体培养基 TSB(批号:1601132)、胰酪大豆胨琼脂培养基TSA(批号:151223)、沙氏葡萄糖液体培养基SDB(批号:151102)、沙氏葡萄糖琼脂培养基 SDA(批号:1512292)、麦康凯琼脂培养基(批号:1512163)、麦康凯液体培养基(批号:160111)、pH 7.0氯化钠-蛋白胨缓冲液(批号:1512292),以上均为北京三药科技开发公司产品,并进行过培养基适用性检查;其他试剂均为分析纯或化学纯。
1.2 仪器与设备LRH-250F生化培养箱(上海一恒科技有限公司),Htysteritest-601集菌仪(杭州泰林生物技术设备有限公司),HH-S24恒温水浴锅(金坛市大地自动化仪器厂),YJ-1450 DA超净工作台(苏州净化设备厂),BHC-1300ⅡA2生物安全柜(苏净集团苏州安泰空气技术有限公司),GZX- 9246MBE鼓风电热干燥箱、YXQ-LS-75G压力蒸汽灭菌器(上海博迅实业有限公司),全自动微生物鉴定系统 Vitek2 Compact(法国梅里埃公司)。
1.3 试验菌株大肠埃希菌[CCMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、铜绿假单胞菌[CMCC(B)10104]、黑曲霉[CMCC(F)98003]、白色念珠菌[CMCC(F)98001],以上均由中国食品药品检定研究院提供,且菌株传代次数均不超过5代。
2 方法及结果
2.1 菌液的制备分别接种大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的新鲜培养物至TSB中,35 ℃培养24 h;接种白色念珠菌的新鲜培养至SDB中,25 ℃培养 3d;接种黑曲霉新鲜培养物接种于SDA上,25 ℃培养5 d,加入无菌0.9%氯化钠溶液5 ml,将孢子洗脱到无菌0.9%氯化钠溶液中制成孢子悬液,转移至无菌试管内。取上述培养物,用无菌0.9%氯化钠溶液制成每1毫升含菌或孢子数<100 CFU的菌或孢子悬液,备用。
2.2 供试品的制备原液供试液:分别取2个最小包装的样品,混合均匀即锝。1:10供试液:取上述原液供试液10 ml,加无菌pH 7.0氯化钠-蛋白胨缓冲液至100 ml,混合均匀即锝。
2.3 微生物计数法
2.3.1 倾注法回收率测定 ①实验组:取上述原液供试液 1 ml分别与金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、黑曲霉和白色念珠菌试验菌悬液1 ml,注入平皿中。倾注TSA,每株试验菌平行制备2个平板。待凝固后,35 ℃培养3 d,逐日观察结果,分别计数前3种菌的平板;35 ℃培养5 d,逐日观察结果,计数白色念珠菌和黑曲霉的平板。取上述原液供试液1 ml、白色念珠菌和黑曲霉试验菌悬液各1 ml,分别注入平皿中,倾注SDA,每株试验菌平行制备2个平板。待凝固后,25 ℃培养5 d,逐日观察结果并计数。取上述1:10供试液照上述方法操作。
②供试品对照组:以稀释液代替菌液,分别取上述制备好的原液供试液和1:10供试液,同实验组操作,测定供试品本底菌数。
③菌液对照组:取不含中和剂及灭活剂的稀释液(无菌pH 7.0氯化钠-蛋白胨缓冲液)替代供试液,按实验组操加入试验菌液,进行微生物回收试验。测定每一菌株试验菌1 ml中所含的菌数。
④结果:回收率计算方法:实验组菌回收率(%)=(实验组菌落数-供试品对照组菌落数)/菌液对照组菌落数×100%。本品采用常规法检查,在TSA培养基中:原液供试品对铜绿假单胞菌、枯草芽孢杆菌、黑曲霉和白色念珠菌的人工染菌回收率均<50%,对金黄色葡萄球菌的人工染菌回收率在0.5~2.0范围内;1:10供试品对5种菌的人工染菌回收率均在0.5~2.0范围内。在SDA培养基中:原液供试品对白色念珠菌的人工染菌回收率在 0.5~2.0范围内,对黑曲霉的人工染菌回收率<50%;1:10供试品对两种菌的人工染菌回收率均在 0.5~2.0范围内。因此,本品原液需氧菌和霉菌及酵母菌的计数均未达到要求,需要消除其抑菌活性或重新选择适当的方法再进行验证。但1:10的细菌和霉菌及酵母菌的计数结果符合要求。结果见表1-4。
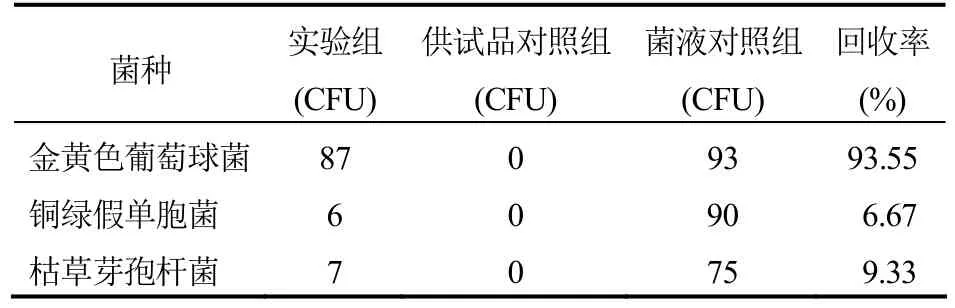
表1 常规法验证原液回收率结果(TSA)

表2 常规法验证1:10供试液回收率结果(TSA)

表3 常规法验证原液回收率结果(SDA)
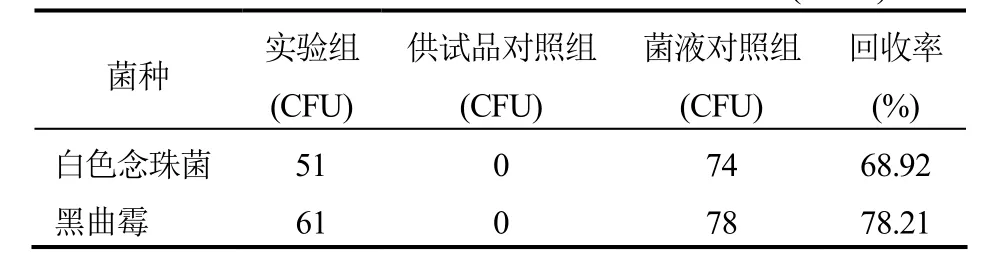
表4 常规法验证1:10供试液回收率结果(SDA)
2.3.2 薄膜过滤法 稀释液和冲洗液均为无菌 pH 7.0氯化钠-蛋白胨缓冲液以下简称缓冲液。
①实验组:加入50 ml缓冲液过滤润湿滤膜,取原液供试液1 ml加入50 ml稀释液中,经薄膜过滤,用缓冲液冲洗,100 ml/次,反复3次,分别在最后一次冲洗液中加入铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、黑曲霉和白色念珠菌菌液各1 ml,抽滤。取膜置TSA平板上,金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌35 ℃培养3 d,黑曲霉和白色念珠菌35 ℃培养5 d;另制备白色念珠菌和黑曲霉各1张滤膜,置SDA平板上,25 ℃培养5 d;逐日观察结果。
②供试品对照组:取制备好的供试液,同实验组操作,最后一次冲洗液中以稀释液代替菌液加入,逐日观察结果。测定供试品本底菌数。
③菌液对照组:取不含中和剂及灭活剂的缓冲液代替供试液,按实验组操作,加入菌液,逐日观察结果。测定每1毫升各实验菌所含菌数。
④结果:按倾注法回收率测定所述的计算公式,代入实验结果计算。本品采用薄膜过滤法进行测定,需氧菌总数:铜绿假单胞菌、枯草芽孢杆菌、金黄色葡萄球菌、黑曲霉和白色念珠菌的回收率均在0.5~2.0范围内;霉菌和酵母总数:黑曲霉和白色念珠菌的回收率均在 0.5~2.0范围内。因此,本品的微生物计数方法可以采用薄膜过滤法(冲洗 3次,100 ml/次)。结果见表5-6。
2.4 控制菌检查方法大肠埃希菌:①实验组:取1:10供试液10 ml(相当于1 ml)及1 ml的大肠埃希菌菌液,接种至100 ml的TSB中,混匀,于35 ℃培养18 h。取TSB培养物1 ml接种至100 ml麦康凯液体培养基中,42 ℃培养24 h。再划线接种至麦康凯琼脂培养基平板上,35 ℃培养18 h,记录结果,并进行生化鉴定。②供试品对照组:取1:10的供试液10 ml,以稀释液1 ml代替菌液,同实验组操作方法。③菌液对照组:取10 ml不含中和剂及灭活剂的稀释液替代供试液,加入1 ml的大肠埃希菌菌液按实验组操作方法。④阴性对照组:以稀释剂代替供试液,接种至100 ml的胰酪大豆胨液体培养基中,余同实验组操作方法。
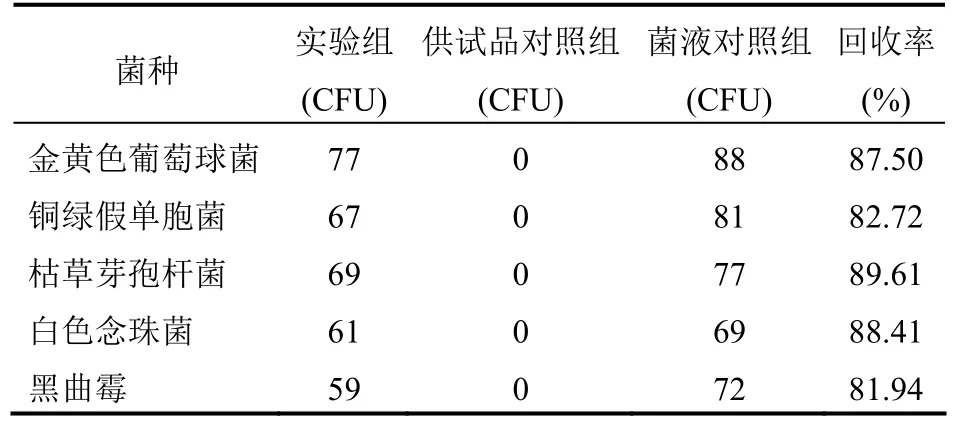
表5 薄膜过滤法验证回收率结果(TSA)
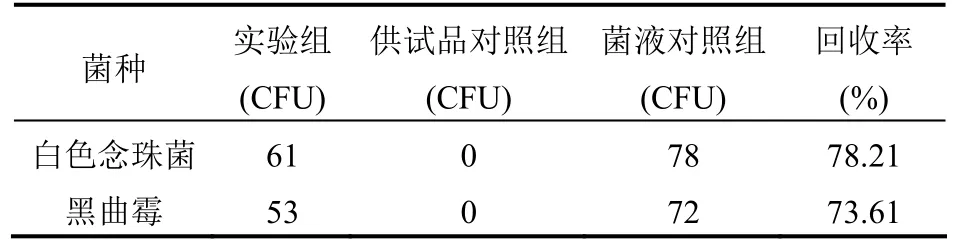
表6 薄膜过滤法验证回收率结果(SDA)
结果:上述供试品对照组和阴性对照组均未检出大肠埃希菌,而实验组和菌液对照组检出试验菌,说明该方法成立。
3 讨论
依据2015年版《中国药典》的规定,为了确认所采用的方法适合用于某制剂的微生物限度检查,必须对相应检验方法进行方法学验证。口服补液为复方制剂,含有多种成分,其中任何一种成分具有抑制微生物生长繁殖作用均可影响微生物限度检查的结果。为保证微生物限度检查实验结果真实可靠,以控制该医院制剂的质量,本研究对该产品的微生物计算法和控制菌检查法进行了方法验证。
笔者不能直接判定口服补液对需氧菌、霉菌和酵母菌以及控制菌大肠埃希菌的抑菌程度,因此考察了不同稀释级的常规法。2015版药典中微生物计数法的计数方法新增了最可能数法(Most-Probable-Number Method,简称MPN法),可能是更适合于某些微生物污染量很小的供试品方法,用于微生物计数时MPN法的精确度比较差。MPN法的准确度和精密度不及平皿计数法和薄膜过滤法,而且霉菌计数也不能使用该方法,仅在没有适宜计数方法对供试品需氧菌总数进行实验的情况下方能使用。因此,本研究未对MPN法进行方法验证。
[1] 中华人民共和国国家药典委员会.中华人民共和国药典(二部)[S].北京, 2010:附录107-116.
[2] 中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010:351-382.
[3] 严晓明,刘萌,朱燕.四种医院制剂微生物限度检查方法学验证[J].中国药事,2015,29(5):485-491.
[4] 张国庆,程龙,杜建红,等.稀戊二醛溶液的微生物限度检查方法的建立及方法学验证[J].中国现代应用药学,2014,31(8):977-981.
[5] 孙莺,郭朝晖,宋京都.8种医院制剂微生物限度检查方法验证[J].中国药事,2014,28(8):839-842.
10.12010/j.issn.1673-5846.2017.02.006
昭通市食品药品检验所,云南昭通 657000
