维生素D受体在C57BL/6小鼠十二指肠中的定位表达分析
2017-07-18程佳刘少伟曹婉莹杨祎琦姚望
程佳,刘少伟,曹婉莹,杨祎琦,姚望
(陕西理工大学 维生素D生理与应用研究所,陕西 汉中 723000)
研究报告
维生素D受体在C57BL/6小鼠十二指肠中的定位表达分析
程佳,刘少伟,曹婉莹,杨祎琦,姚望
(陕西理工大学 维生素D生理与应用研究所,陕西 汉中 723000)
目的 为探讨维生素D受体(vitamin D receptor, VDR)在C57BL/6小鼠十二指肠中的定位与表达,研究维生素D系统与肠道发育过程的相关性。方法 利用实时定量PCR(quantitative PCR, qPCR)、苏木精伊红染色、免疫荧光染色、免疫印迹 (Western blotting, WB) 的检测技术,对C57BL/6小鼠十二指肠中VDR定位表达做定性与定量的分析。结果 VDR的mRNA在C57BL/6小鼠十二指肠组织中的表达在其出生的第21 天达到峰值。此外,VDR主要分布在C57BL/6小鼠十二指肠上皮细胞和平滑肌细胞的胞质中。对组织样品的WB检测显示,C57BL/6小鼠十二指肠发育过程中,VDR没有发生明显的核转位。结论 从分子生物学角度分析了VDR在C57BL/6小鼠十二指肠不同生长发育阶段的表达规律,为了解和完善VDR在肠道中的作用奠定理论基础。
维生素D受体;十二指肠;表达;小鼠
自1928年发现维生素D以来,生物医学界对维生素D的研究越来越深入,主要是由于它与机体的健康密切相关[1]。维生素D是所有生物活性物质中非常独特的成员,除可以调节机体的钙、磷代谢外,还具有调控细胞增殖、分化和凋亡过程,介导免疫反应,调节多种内分泌激素的分泌等作用[2]。然而,维生素 D 本身并没有生理活性,只是活性维生素 D 的前体(prohormone)[3]。机体内的维生素D需要经过2次羟化作用才能转变为1,25(OH)2D3。而活性1,25(OH)2D3的功能主要是通过维生素D受体(vitamin D receptor, VDR)实现的,因此对VDR的研究也已成为近年来研究的热点[4]。研究已证实 VDR与糖尿病、高血压、肥胖症、甲状旁腺功能亢进、骨质疏松症以及乳腺癌、肺癌等多种癌症之间的发生发展密切相关[5-9]。
一般情况下,VDR存在的细胞或组织是活性1,25(OH)2D3发挥生物学效应的主要靶标。研究显示,VDR 在肺癌、乳腺癌、肝癌及前列腺癌等癌细胞中有不同程度的表达[10-12]。同时,VDR也高表达于小肠、肾、骨和甲状旁腺等正常的组织[13,14]。值得注意的是,小鼠从出生到性成熟的发育过程中,要经历空白期、母乳期和饲喂期3个阶段性的饮食变化。而十二指肠作为重要的消化场所,其肠道菌群的组成、蛋白因子的分泌和基因的表达等都会对机体饮食的改变而发生适应性调整,故推测VDR在小鼠十二指肠中的表达与分布会随机体的发育和饮食的改变出现差异。因此,本研究旨在以C57BL/6小鼠十二指肠中VDR表达为研究目标,期望从分子生物学角度阐明VDR在C57BL/6小鼠十二指肠不同发育阶段的表达规律,明确饮食改变与VDR表达之间的相关性,完善对VDR的认识,为维生素D药物的研发和动物模型给药阶段的相关研究提供参考。
1 材料与方法
1.1 材料
SPF级C57BL/6小鼠,1.5月龄,雌雄各3只,均购于西安交通大学实验动物中心【SCXK(陕)2011-008】。TRI Reagent、多聚甲醛、1% Triton X-100、牛血清蛋白 (BSA)、DAPI均购于Sigma公司,VDR抗体、购于Santa Cruz,其他试剂如梯度乙醇、二甲苯、Tween-20、苏木精染液、1%盐酸乙醇、伊红染液、双氧水、0.01 mol/L柠檬酸缓冲液、甘油、氯仿、异丙醇、定影液、显影液等均为国产分析纯。
1.2 方法
1.2.1 收集C57BL/6小鼠十二指肠组织样品
收集清洁级C57BL/6小鼠从出生(0 d)到性成熟(35 d)的十二指肠样品,每7 d采集一次,每次3个重复,实验于西安交通大学实验动物中心【SYXK(陕)2012-005】 进行。将实验材料一部分固定于4%的多聚甲醛溶液中,以备制作组织切片;另一部分经液氮迅速脱水后,存放于 -80℃,以用于提取总RNA和总蛋白。
1.2.2 组织包埋和切片
组织经4%的多聚甲醛溶液固定,先经梯度乙醇逐级脱水,再分别用 100%乙醇/二甲苯(1∶1)和二甲苯处理30 min,二甲苯处理 20 min,二甲苯处理 10 min后,分别用蜡Ⅰ、蜡Ⅱ、蜡Ⅲ浸埋40 min。将包埋好的蜡块修整后切片,存放备用。
1.2.3 石蜡切片的染色
H&E染色的石蜡切片用二甲苯脱蜡2 次,各 10 min,乙醇溶液浸泡复水,苏木精染色 30 min,洗去苏木精(流水 1 min,1% 盐酸乙醇 5 s,再水洗 10 s),进行胞质脱色(70% 乙醇,2 min; 80% 乙醇,2 min; 90% 乙醇,2 min),随后进行伊红染色(6 min),染色后脱水(95%乙醇、100%乙醇、二甲苯,每个溶液浸泡 2 次,每次 5 min),脱水后盖上盖玻片,用中性树胶封固,在显微镜下观察结果。
免疫荧光染色的石蜡切片经脱蜡、复水后,分别用3% 双氧水和1% Triton X-100 浸泡数分钟。随后,用0.01 mol/L柠檬酸缓冲液加热进行抗原修复。自然冷却后用3% BSA室温封闭30 min,进行一抗孵育,室温2 h;二抗孵育,室温2 h或4℃过夜。最后,用0.1%的DAPI染核,室温避光30 min,清洗后以50%甘油封片,晾干,荧光显微镜观察结果。1.2.4 quantitative PCR (qPCR)
将组织在液氮中速冻后研磨,Trizol法提取各样本总RNA。按照反转录试剂盒说明书,将RNA反转录为cDNA后用于qPCR分析。各基因引物序列如表1所示。qPCR反应体系为20 μL:Master mix 10 μL(ABI),上下游引物各0.5 μL,cDNA模板1 μL,灭菌ddH2O 8 μL。反应程序为:95℃变性30 s,60℃退火30 s,72℃延伸2 min,共40个循环。各基因均以相同的条件进行qPCR,重复3次,以β-actin为内参基因,根据各样品的CT值计算基因表达量并分析结果。
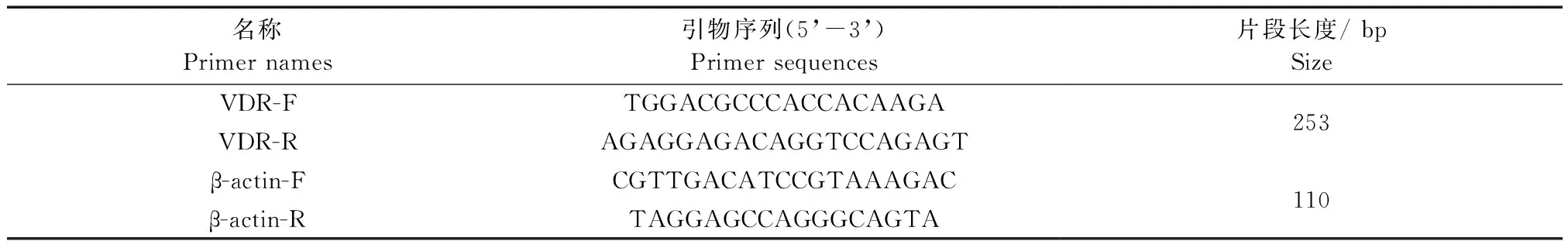
表1 各基因qPCR引物信息Tab.1 Primer sequences and parameters of the genes for qPCR
1.2.5 Western blotting (WB)
分离提取各样品内的核质蛋白和胞质蛋白:将速冻的组织研磨后,放入离心管,加PBS清洗,于4℃,500 r/min,离心5 min;弃去上清液,控干沉淀水分。按比例加入CERI,涡旋混匀,冰内静置10 min。加入预冷的CERII,涡旋5 s,冰内静置1 min,于4℃,16 000 r/min,离心5 min。分离上清液(胞质蛋白)至干净预冷的离心管中,编号使用。在沉淀中加入NER,每次涡旋15 s后冰内静置10 min,重复4次,于4℃,16 000 r/min,离心10 min。分离上清液(核质蛋白)至干净预冷的离心管中,编号使用。进行WB检测:SDS-PAGE凝胶电泳用12%分离胶和6%浓缩胶,每孔点样30 μL,浓缩胶电压为100 V,分离胶电压为120 V。转PVDF膜,电流200 mA,冰浴2 h。5%脱脂奶粉室温封闭2 h,TBST清洗。一抗1∶500稀释,室温孵育2 h,TBST清洗,二抗1∶2000稀释,室温孵育2 h,TBST清洗。压片曝光并进行灰度分析。
2 结果
2.1 C57BL/6小鼠十二指肠VDR的qPCR分析
VDR在十二指肠组织中的定量分析结果如图1所示。随着C57BL/6小鼠十二指肠的生长发育,VDR相对量表达也逐渐发生变化。0~7 d,C57BL/6小鼠刚出生,VDR相对表达量较少,14 d VDR相对表达量有所增加,到21 d达到最大,说明此时VDR在组织细胞中的表达最多;21 d之后VDR相对表达量又呈现下降趋势。
为了进一步研究VDR在C57BL/6小鼠十二指肠中的具体作用,后续实验分别采用免疫荧光染色和免疫印迹的方法,从定性和定量两方面明确C57BL/6小鼠十二指肠的发育与VDR表达之间的相关性。
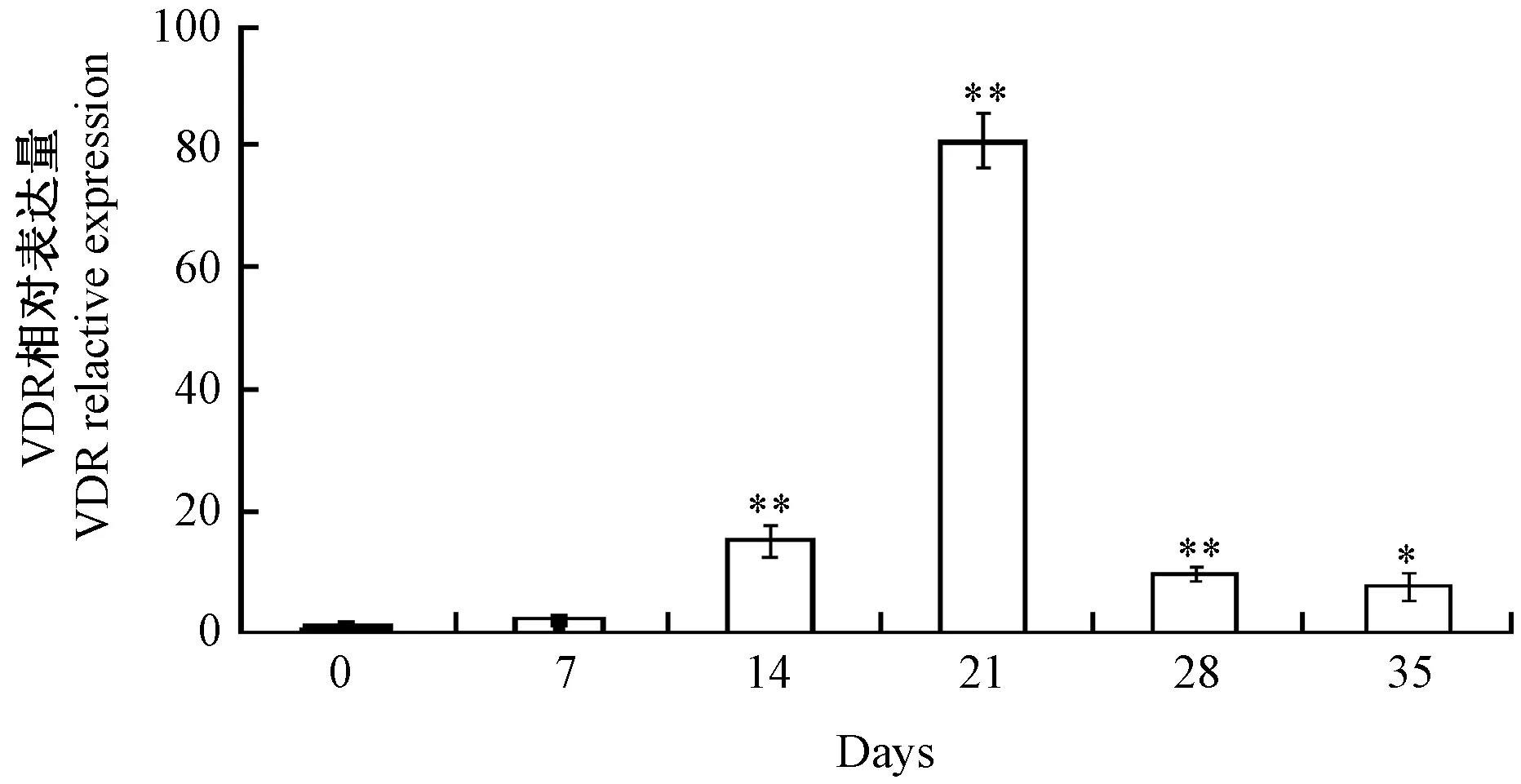
注:与对照组相比*P<0.05;与对照组相比**P<0.01。图1 VDR在C57BL/6小鼠十二指肠组织中的定量分析Note. compared with the control group, *P<0.05; compared with the control group, **P<0.01.Fig.1 Quantitative analysis of VDR in the mouse duodenum tissues
2.2 C57BL/6小鼠十二指肠的H&E 染色
由于细胞核为嗜碱性物质,可被苏木精染成蓝色,胞质主要为嗜酸性物质,可被伊红染成红色,从而与细胞核区分开来;通过镜检,核质分离明显,说明同批次的石蜡切片可以用于后续免疫荧光检测。
结果显示,不同时期的十二指肠组织的细胞形态有明显不同(图2)。刚出生(0 d)C57BL/6小鼠的十二指肠较小,经脱水处理后,组织变脆,制成的切片易产生脱片现象,视野下能观察到的组织较少(图2 A和B);随着C57BL/6小鼠的生长发育,视野下观察到的组织密度逐渐增加(图2 C和D);待C57BL/6小鼠生长发育到一定时期,脱片现象逐渐减少,组织形态完整,视野下观察到的组织较多(图2 E和F)。
2.3 C57BL/6小鼠十二指肠VDR的免疫荧光染色
VDR作为抗原,可与特异性强、灵敏度高的一抗(D-6)结合;一抗与VDR形成复合物作为另一抗原,可特异地与带有荧光标记的二抗结合。能更好地对目标蛋白进行定位。同时,DAPI是含有特定AT序列DNA的一种嵌入剂,与核染色质结合。
C57BL/6小鼠十二指肠的免疫荧光染色如图3所示。VDR和DAPI着色清晰;低倍镜下,观察到各个时期C57BL/6小鼠十二指肠组织完整形态;高倍镜下,可确定VDR在C57BL/6小鼠十二指肠中具体定位。其中,发红色荧光的是VDR蛋白,主要分布在C57BL/6小鼠十二指肠上皮细胞和平滑肌细胞的胞质中。从组织着色的明暗程度分析,VDR在0~14 d的表达趋势与qPCR一致,即随着十二指肠的发育,VDR的表达逐渐增加。但VDR的表达在21 d略有降低,随后维持在稳定水平,这与qPCR的结果呈负相关,其原因很有可能是VDR蛋白的翻译过程滞后于mRNA的产生造成的。
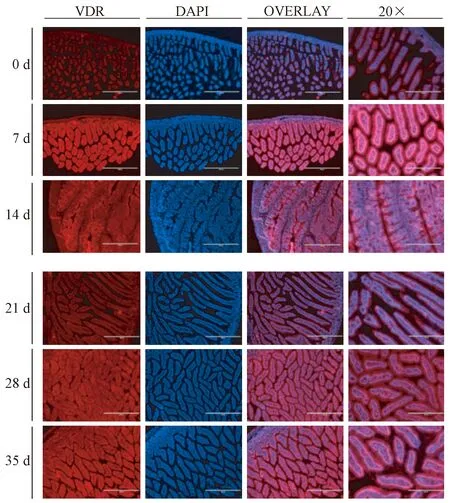
注:红光:VDR;蓝光:DAPI;叠加:Overlay。图3 C57BL/6小鼠十二指肠的免疫荧光染色Note. Red: VDR. Blue: DAPI. Overlay.Fig.3 Immunofluorescence staining of the mouse duodenal tissues
2.4 C57BL/6小鼠十二指肠VDR蛋白的WB分析
免疫荧光染色的结果只能定性的反映VDR在C57BL/6小鼠十二指肠各阶段的定位与表达,为了进一步明确在十二指肠发育过程中是否存在VDR的核转位,对收集的各样品进行了WB检测,并分析了VDR蛋白在核质与胞质中的表达情况。结果显示,VDR的表达量在C57BL/6小鼠十二指肠的各个发育阶段没有明显差别,核质中的VDR比胞质中的VDR略多,但差异无显著性(图4A)。同时,VDR蛋白的总体含量在C57BL/6小鼠十二指肠的各个发育时期基本保持相同水平(图4B)。
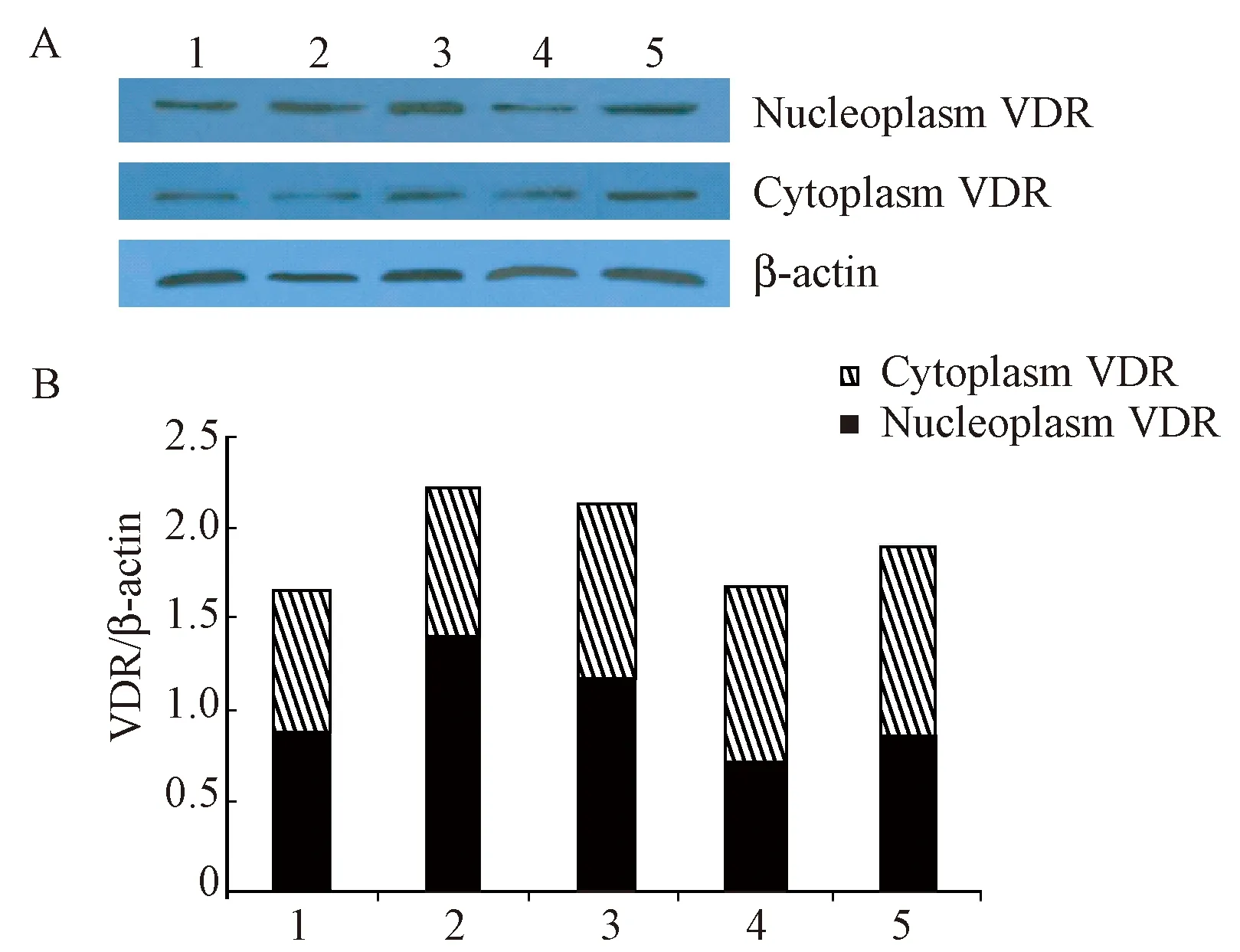
注:1~5分别代表C57BL/6小鼠十二指肠发育第7、14、21、28、35天的样本;β-actin为内参;A为WB检测VDR表达;B为灰度分析。图4 C57BL/6小鼠十二指肠各阶段VDR蛋白的表达Note. 1-5: The samples of mice at 7, 14, 21,28, 35 postnatal days, respectively. β-actin is the control.A: VDR protein expression detected by WB. B: Gray density analysis.Fig.4 Expression of VDR protein in different developmental stages of the mouse duodenum
3 讨论
活性维生素D在维持机体钙磷代谢,调节细胞增殖、分化等方面起重要作用,但其许多生物学功能都是通过VDR介导调节靶基因转录实现的[3]。一般情况下,1,25(OH)2D3信号分子会在靶组织与VDR结合形成复合物,该复合物作用于靶基因的特定DNA序列上,对其下游功能基因的表达产生调节作用[2]。因此,VDR存在的细胞或组织是活性维生素D的主要靶标。
研究证实,十二指肠是VDR表达的阳性组织,其对维生素D的代谢功能影响以及对小肠吸收钙磷的平衡有关键作用[15,16]。在比较医学范围内,针对十二指肠的研究主要为各类动物模型在某些病理情况下,其十二指肠的消化功能、组织病理和关键基因的变化等相关方面[17,18]。但对于VDR在十二指肠发育过程中的基础研究缺乏实验数据。因此,该研究通过一系列分子生物学的检测技术,对C57BL/6小鼠十二指肠VDR的表达进行了定性与定量的分析。qPCR的结果表明,在C57BL/6小鼠生长发育过程中,VDR在C57BL/6小鼠十二指肠中的表达呈正态分布的趋势(VDR在C57BL/6小鼠出生的第21天达到峰值)。由于十二指肠的独特生理位置,能同时混合胃液、胰液和胆汁,因此十二指肠的消化功能十分重要[19]。在采样过程中,C57BL/6小鼠经历了从出生到断奶以及性成熟的阶段,因此推断VDR的表达变化很可能与C57BL/6小鼠的肠道发育、饮食结构改变和性激素的分泌有关。此外,C57BL/6小鼠是肿瘤学、生理学、免疫学、遗传学研究的常用品系,是广泛用于模拟人类的某些代谢性或免疫性疾病的动物模型[20]。实验动物类型的选择也有可能会对研究结果造成一定程度的影响。
同时,免疫荧光染色的结果在一方面验证了qPCR的结果,另一方面也证实VDR主要存在于C57BL/6小鼠十二指肠上皮细胞和平滑肌细胞的胞质中。组织样品的WB结果显示,C57BL/6小鼠十二指肠发育过程中,VDR在胞质与核质的定位没有发生明显变化,其总体水平在各个发育时期基本保持相同。但需要强调的是,出生0 d的C57BL/6小鼠十二指肠组织较小,采样困难,经组织研磨后的剩余量太少,因此WB检测没有该时期的条带。
综上所述,通过实验研究发现的VDR在C57BL/6小鼠十二指肠中的定位表达趋势,有助于完善对VDR在小肠中的作用认识,同时为饮食改变与VDR表达之间的相关性提供理论依据,也为后期维生素D药物的研发和动物模型给药阶段的相关研究提供参考。
[1] 祁秋霞, 祝大丽. 维生素D对免疫系统影响的研究进展 [J]. 中国现代医生, 2015, 22: 157-160.
[2] Christakos S, Dhawan P, Verstuyf A, et al. Vitamin D: Metabolism, molecular mechanism of action, and pleiotropic effects [J]. Physiol Rev, 2016, 1: 365-408.
[3] 程佳, 王永吉. 维生素D功能的再认识 [J]. 陕西理工学院学报 (自然科学版), 2014, 30(3): 52-58.
[4] 姚骥如, 孙莹, 罗顺葵, 等. 维生素D的临床研究进展 [J]. 中国新药与临床杂志, 2010, 29(7): 484-489.
[5] Consiglio M, Destefanis M, Morena D, et al.The vitamin D receptor inhibits the respiratory chain,contributing to the metabolic switch that is essential for cancer cell proliferation [J]. PLoS ONE, 2014, 12: e115816.
[6] Klampfer L. Vitamin D and colon cancer [J]. World J Gastrointest Oncol, 2014, 11: 430-437.
[7] Bikle DD.The vitamin D receptor: a tumor suppressor in skin [J]. Discovery Med, 2011, 56: 7-17.
[8] Clinckspoor I, Verlinden L, Mathieu C, et al. Vitamin D in thyroid tumorigenesis and development [J]. Prog Histochem Cytochem, 2013, 48(2): 65-98.
[9] Doig CL, Singh PK, Dhiman VK, et al.Recruitment of NCOR1 to VDR target genes is enhanced in prostate cancer cells and associates with altered DNA methylation patterns [J]. Carcinogenesis, 2013, 2: 248-256.
[10] Feldman D, Krishnan AV, Swami S, et al. The role of vitamin D in reducing cancer risk and progression [J]. Nature Rev Cancer, 2014, 14: 342-357.
[11] Ditsch N, Toth B, Mayr D, et al. The association between vitamin D receptor expression and prolonged overall survival in breast cancer[J]. J Histochem Cytochem, 2012, 60: 121-129.
[12] Kong J, Xu F, Qu J, et al. Genetic polymorphisms in the vitamin D pathway in relation to lung cancer risk and survival [J]. Oncotarget, 2015, 6: 2573-2582.
[13] Wang Y, Borchert ML, DeLuca HF. Identification of the vitamin D receptor in various cells of the mouse kidney [J]. Kidney Int, 2012,10: 993-1001.
[14] Wang Y, DeLuca HF. Is the vitamin D receptor found in muscle? [J]. Endocrinology, 2011, 2: 354-363.
[15] Christakos S, Lieben L, Masuyama R, et al. Vitamin D endocrine system and the intestine [J]. Bone Key Reports, 2014, 3: 496.
[16] Replogle RA, Li Q, Wang L, et al. Gene-by-diet interactions influence calcium absorption and bone density in mice [J]. J Bone Miner Res, 2014, 29: 657-665.
[17] 高倩, 李蔓, 张万山, 等. 肥胖对小鼠十二指肠DMT1和FPN1表达的影响 [J]. 中国比较医学杂志, 2014, 24(9): 18-22.
[18] 刘颖, 朱华, 代小伟, 等. SHIV感染恒河猴十二指肠黏膜活检组织病理学观察 [J]. 中国比较医学杂志, 2009, 19(3): 28-31, 85.
[19] 袁海鹏. 功能性消化不良十二指肠免疫激活及神经递质变化的研究 [D]. 山东大学, 2012.
[20] 关东升, 高颖, 朱陵群. C57BL/6J小鼠实验性自身免疫性脑脊髓炎模型的建立及其病理特征 [J]. 中国实验动物学报, 2008, 16(6): 406-409, 490.
Location and expression of vitamin D receptor in the duodenum of C57BL/6 mice at different developmental stages
CHENG Jia, LIU Shao-wei, CAO Wan-ying, YANG Yi-qi, YAO Wang
(Vitamin D Research Institute, Shaanxi University of Techndogy,Hanzhong Shaanxi 723000,China)
Objective To investigate the relationship of vitamin D with the intestinal development and study the expression of vitamin D receptor (VDR) in the duodenum of C57BL/6 mice at different developmental stages. Methods Quantitative PCR (qPCR), histology using H&E staining and immunofluorescence staining, and Western blotting (WB) were performed to elucidate the expression of VDR in mice intestine at different growth and developmental stages. Results The peak of VDR mRNA expression reached on 21 d. The pathological result showed that VDR mainly distributed in the cytoplasm of epithelial cells and smooth muscle cells in the mouse duodenum. WB result indicated that there was no nuclear translocation of VDR protein in the mouse duodenum. Conclusions This study demonstrates the regularity of expression of VDR in the mouse duodenum during its development, and contributes to understanding the function of VDR in the intestines.
Vitamin D receptor; Duodenum; Expression; Mouse
CHENG Jia. E-mail: bobos410@126.com
陕西省教育厅项目 (No.14JK1159);汉中市科技局项目(No.2014ZKC47-07);陕理工博士启动项目(No.SLGQD13(2)-22);大学生创新创业训练计划项目 (No.UIRP15068)。
程佳 (1983-),女,讲师,博士研究生,研究方向:维生素D受体的细胞生物学效应。Email: bobos410@126.com
Q95-33
A
1005-4847(2017)03-0320-05
10.3969/j.issn.1005-4847.2017.03.016
2016-09-13
