小鼠循环肝癌细胞模型的建立与评价
2017-07-18罗桂芳张娟娟邓青曾贵荣姜德建信红亚
罗桂芳,张娟娟,邓青,曾贵荣,姜德建,信红亚
(1. 湖南省药物安全评价研究中心,新药药效与安全性评价湖南省重点实验室,长沙 410331; 2. 中南大学湘雅医院血液科,长沙 410008)
研究报告
小鼠循环肝癌细胞模型的建立与评价
罗桂芳1,张娟娟1,邓青1,曾贵荣1,姜德建1,信红亚2*
(1. 湖南省药物安全评价研究中心,新药药效与安全性评价湖南省重点实验室,长沙 410331; 2. 中南大学湘雅医院血液科,长沙 410008)
目的 采用小鼠肝癌Hepa 1-6细胞建立小鼠肝癌循环肿瘤细胞(CTCs)模型。方法 采用雄性C57BL/6小鼠108只,按照体重分为3组,每组36只。3个组分别每只尾静脉接种0.2 mL的浓度为1×106、5×106和1×107个/mL的小鼠肝癌Hepa 1-6细胞单细胞悬液。各组分别于接种后第1、5、9、13、17、21天检测采血,采用流式细胞术检测,计算2万个有核细胞中CTCs数目及比例、相对CTCs抑制率,记录动物死亡率。②采用雄性C57BL/6小鼠80只,按体重分为2组,分别为模型对照组、甲苯磺酸索拉菲尼组,每组40只。每只尾静脉接种0.2 mL的浓度为5×106个/mL的Hepa 1-6细胞单细胞悬液,接种后第2天开始灌胃给予甲苯磺酸索拉菲尼(50 mg/kg),连续21 d,并于给药第3、8、15、21天采血进行CTC检测。结果 ①接种浓度为1×106个/mL的细胞悬液后,第1、5、9、13、17、21天的动物CTCs比例为:25.1%、18.1%、8.9%、4.4%、2.9%、0.3%,未出现动物死亡;接种浓度为5×106个/mL的细胞悬液后,第1、5、9、13、17、21天的动物CTCs比例为:40.4%、35.4%、15.4%、9.0%、6.6%、4.1%,未出现动物死亡;接种浓度为1×107个/mL的细胞悬液后,第1、5天的动物CTCs比例为:39.1%、33.5%,在接种完毕之后立即出现动物死亡,且所有动物在接种后第7天全部死亡。②甲苯磺酸索拉菲尼给药期间D3、D8、D15、D21相对循环肿瘤细胞清除率分别为:-7.5%、4.6%、55.3%、-94.5%,与模型对照组比较差异有显著性(P<0.05或P<0.01)。结论 采用浓度为5×106个/mL小鼠肝癌细胞Hepa 1-6悬液尾静脉注射可建立小鼠肝癌CTC模型,可用于抑制循环肿瘤细胞药物的筛选与评价。
肝癌;循环肿瘤细胞;小鼠模型
根据世界卫生组织(WHO)的数据,原发性肝癌(HCC)是世界上发生率最高的癌症之一,占癌症发病率第五位、死亡率第三位,中国肝癌的发病率就占了全球的50%以上[1]。从原始肿瘤上脱落癌细胞入血形成循环肿瘤细胞(circulating tumor cells,CTCs),能够随血液转移至其他组织或器官,是原发性肝癌术后出现复发和远处转移的重要机制[2-7]。通过药物减少肝癌CTCs数目,有助于改善肝癌术后患者的预后,因此研究减少CTCs的药物是抗癌药物开发的热点之一[2]。CTCs在外周血中的数量稀少,106~107个外周血单核细胞中才发现一个CTCs,且检测CTCs的技术要求高而且价格昂贵,在药效学动物实验研究上应用较为有限。本实验室根据肝癌细胞的特性,采用甲胎蛋白(AFP)标记肝癌细胞,采用流式细胞术进行检测,探索建立小鼠肝癌循环肿瘤细胞模型,旨在为建立一个简单、经济和可靠的循环肝癌细胞动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级C57BL/6小鼠,雄性,188只,体重13~15 g,购自于湖南斯莱克景达实验动物有限公司【SCXK(湘)2011-0003】,饲养于湖南省实验动物中心【SYXK(湘)2016-0010】。
1.1.2 仪器设备
DMIL型倒置显微镜(德国Leica公司),3111型CO2培养箱(美国Thermo公司),CJ-1F型医用净化工作台(苏州冯氏实验动物设备有限公司),Accrui C6型流式细胞仪(美国BD公司)。
1.1.3 细胞及试剂
小鼠肝癌细胞Hepa 1-6购自于中科院细胞库,高糖DMEM培养基、胎牛血清购自于HyClone公司,小鼠甲胎蛋白流式抗体Mouse alpha-Fetoprotein/AFP Antibody购自于R&D公司,甲苯磺酸索拉菲尼(德国Bayer Schering Pharma AG)。
1.2 方法
1.2.1 小鼠肝癌Hepa 1-6细胞的培养及细胞悬液制备
采用含10%胎牛血清的高糖DMEM培养基,于37℃、5% CO2培养箱中培养Hepa1-6细胞,每2 d以1∶3比例进行传代培养。取对数生长期细胞,PBS 清洗细胞2遍,加入0.25% 胰蛋白酶(每瓶500 μL)消化3 min,加入DMEM+10% FBS培养基(每瓶2 mL),轻轻吹打细胞,将Hepa 1-6细胞消化成单个细胞悬液,用1000 r/min离心3 min,弃上清,加入2 mL PBS溶液重悬细胞后再次离心。细胞计数后制备细胞悬液。
1.2.2 不同接种细胞浓度对小鼠肝癌循环肿瘤细胞模型成模率的影响
108只雄性C57BL/6小鼠,按体重随机分为3组,每组36只。常规培养Hepa 1-6细胞,调整细胞浓度为1×106、5×106、1×107个/mL 3个浓度,将不同浓度的细胞液,经尾静脉注射分别接种于3组动物体内,每只小鼠接种0.2 mL,即分别接种2×105、1×106、2×106个细胞/只动物。观察动物死亡情况,并分别于接种后第1、5、9、13、17、21天分别采血进行CTC检测。
1.2.3 小鼠肝癌细胞Hepa 1-6循环肿瘤细胞模型建立及分组给药
80只雄性C57BL/6小鼠,按体重随机分为模型组和甲苯磺酸索拉菲尼组,每组40只。取对数生长期的小鼠肝癌Hepa 1-6细胞,用PBS洗涤2次,再用生理盐水重悬后计数,调整细胞浓度为1.2.2中最适宜浓度的细胞液,经尾静脉接种于C57BL/6小鼠体内,每只小鼠接种0.2 mL(即1×106个细胞/只)。接种后第2天开始灌胃给予甲苯磺酸索拉菲尼(50 mg/kg),连续21 d,并于给药第3、8、15、21天采血进行CTCs检测。
1.2.4 动物生存质量及存活时间评价
试验期间每天观察动物的饮食、饮水、行为活动的状况,并于每次处死动物前记录各组动物的体重变化及死亡情况。
1.2.5 CTCs的测定和计算
模型建立过程中,从接种后第1、5、9、13、17、21天经眼眶采血,EDTA-K2抗凝,AFP流式抗体标记后,用流式细胞仪进行AFP阳性细胞检测,并计算CTCs比例。相对循环肿瘤细胞清除率=(模型对照组平均循环肿瘤细胞数-给药组平均循环肿瘤细胞数)/模型对照组平均循环肿瘤细胞数×100%。
1.3 统计分析
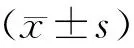
2 结果
2.1 不同接种细胞浓度对小鼠肝癌CTCs模型成模率的影响
如表1所示:经尾静脉接种浓度为1×106个/mL细胞的动物,接种后第1、5、9、13、17、21天循环肿瘤细胞比例为:25.1%、18.1%、8.9%、4.4%、2.9%、0.3%,未出现动物死亡。经尾静脉接种浓度为2×106个/mL细胞后第1、5、9、13、17、21天的动物循环肿瘤细胞比例为:40.4%、35.4%、15.4%、9.0%、6.6%、4.1%,未出现动物死亡。经尾静脉接种浓度为1×107个/mL细胞后第1、5天的动物循环肿瘤细胞比例为:39.1%、33.5%,在接种完毕之后立即出现动物死亡,且所有动物在接种后第7天全部死亡。见图1。
2.2 甲苯磺酸索拉菲尼对小鼠肝癌Hepa 1-6 CTCs模型体重的影响
小鼠灌胃给予甲苯磺酸索拉菲尼(50 mg/kg),连续21 d,小鼠的外观体征、行为活动及动物的一般状况未见明显异常,经大体解剖肉眼观察未见明显的异常脏器。造模并给药后体重未出现明显下降,模型组及给药组体重分别为:D3体重为(14.8±0.9)g、(15.0±0.8)g;D8体重为(16.4±0.9)g、(16.4±0.8)g;D15体重为(18.0±0.9)g、(18.0±0.8)g;D21体重为(19.3±0.9)g、(19.4±0.8)g。除定期处死动物外,给药期间未出现动物死亡。
2.3 甲苯磺酸索拉菲尼对小鼠肝癌Hepa 1-6 CTCs的影响
如表2所示,甲苯磺酸索拉菲尼能明显降低给药后D15相对CTCs清除率,与模型对照组比较差异有显著性(P<0.05或P<0.01)。甲苯磺酸索拉菲尼组给药期间D3、D8、D15、D21相对CTCs清除率分别为D3为-7.5%;D8为4.6%;D15为55.3%;D21相对CTCs清除率为-94.5%。见图2,3。

表1 小鼠肝癌Hepa 1-6循环肿瘤细胞模型的建立Tab.1 Establishment of a mouse model of circulating hepatoma cells
注:循环肿瘤细胞数为在20 000个有核细胞中的AFP阳性细胞数目。“—”表示动物已经在得到数据前已经死亡。
Note. The number of CTCs is AFP-positive cells in 20 000 nucleated cells. “—”indicates that the animal died before the day of blood collection.

表2 甲苯磺酸索拉菲尼对小鼠肝癌Hepa 1-6循环肿瘤细胞的影响Tab.2 Effect of sorafenib tosylate on circulating Hepa 1-6 cells in the mice
注:循环肿瘤细胞数为在20 000个有核细胞中的AFP阳性细胞数目,每个时间点各组10只动物。与模型对照组比较,▲P<0.05,▲▲P<0.01。
Note. The number of CTCs is AFP-positive cells in 20 000 nucleated cells, 10 mice in a group at each time point. Compared with the control group,▲P<0.05,▲▲P<0.01.

图1 小鼠肝癌Hepa 1-6循环肿瘤细胞模型的建立(C57 L/6小鼠循环系统中AFP阳性细胞随时间的变化(接种细胞浓度为5×106/mL)Fig.1 Establishment of a mouse model of circulating hepatoma cells. Changes of AFP-positive cells in the circulatory system of the C57 L/6 mice (5×106/mL of HepA 1-6 cells was injected)

注:Pic a、b、c、d为模型对照组AFP阳性细胞随时间的变化,Pic A、B、C、D为甲苯磺酸索拉菲尼组AFP阳性细胞随时间的变化。图2 AFP阳性细胞检测结果Note. Pic a, b, c, d are the changes of AFP-positive cells in the control group, Pic A, B, C, D are the changes of AFP-positive cells in the Sorafenib Tosylate group.Fig.2 Results of detected AFP-positive cells

图3 模型对照组与甲苯磺索拉菲尼组AFP阳性细胞检测结果Fig.3 Comparison of AFP-positive cells in the control group and sorafenib tosylate group
3 讨论
肝癌的发病率非常高,且死亡率在常见癌症中排在第三位,如果肝癌患者没有接受有效治疗,大部分患者将在3~6个月内死亡[3]。在患者接受了肝移植或肝切除等手术等有效治疗后,而肝癌复发及转移的概率依然非常高,导致预后差。据有关报道,肝切除术后5年内肝癌的复发率高达61.5%,而肝移植术后的1年内肝癌复发率也达到了10%,一旦复发,则病情进展非常快,并且段时间内死亡[4]。大量研究证实,肝癌的复发与CTCs有密切关系[5],在治疗前后,CTCs在血液中的数量变化与肝癌的治疗敏感度、复发率、增殖速度有密切关系[6]。通过靶向治疗等治疗手段的患者可通过检测CTCs的变化,来判断疗效。
关于癌症动物模型中检测循环肿瘤细胞的研究则很少报道,而建立一个方便、可靠的CTC动物模型在CTC的病理生理作用以及相关的药物开发中起重要作用。本实验通过C57BL/6小鼠尾静脉接种不同浓度的小鼠肝癌细胞,采用流式细胞术标记AFP蛋白检测CTCs的数量变化结合动物生存率的观察,发现C57BL/6小鼠静脉注射5×106个/mL浓度肝癌Hep1-6细胞不仅能很好的检测出循环癌细胞,而且不影响动物的生存率,是造模最佳的细胞浓度。从造模后不同时间点来看,静脉注射肝癌细胞后21 d内循环中可检测的AFP蛋白阳性细胞逐渐减低,从第1天的(40.4±6.8)%降低到第21天的(4.1±5.1)%,因此观察药物疗效宜在注射细胞后21 d之内。在给予靶向药物甲苯磺酸索拉菲尼后能检测出随给药时间的增加CTCs的变化。在给予甲苯磺酸索拉菲尼后15 d内对CTCs进行多次检测,得出随着给药时间的推移,CTCs在血液中的清除率明显增加,说明该靶向药物有效,但随着时间推移,在第21天检测发现CTCs反跳升高,说明在长时间给药过程中CTCs已经产生耐药。
本实验采用的小鼠肝癌细胞注射是避免异种排斥反应,但与临床有一定差距。接下来,我们拟采用联合免疫缺陷小鼠进行人源化的肿瘤细胞进行建模,更好的反映临床。此外,本实验我们采用AFP标记Hepa 1-6细胞来检测CTCs,甲胎蛋白是最早发现的用于诊断原发性肝癌的特异性肿瘤标记物。在原发性肝癌中AFP与肿瘤大小、数目等密切相关[8],但是AFP在肝炎病人中的阳性率也很高,同时AFP在检测小肝癌时不敏感,高达30%~40%的患者AFP检测为阴性,另外亦有部分原发性肝癌不分泌AFP[9],因此采用AFP阳性细胞检测CTCs存在一定的局限性。因此,建立多标记蛋白联合标记进行检测CTC的方法更有临床意义。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer, 2015, 136(5): E359-E386.
[2] Gupta GP, Massagué J. Cancer metastasis: building a framework[J]. Cell, 2006, 127(4): 679-695.
[3] Shariff MI, Cox J, Gomaa AI, et al. Hepatocellular carcinoma: current trends in worldwide epidemiology, risk factors, diagnosis and therapeutics [J]. Hepat Med Evidence Res, 2009, 3(4): 353-367.
[4] Wang JH, Wang CC, Hung CH, et al. Survival comparison between surgical resection and radiofrequency ablation for patients in BCLC very early/early stage hepatocellular carcinoma [J]. J Hepatol, 2012, 56(2): 412-418.
[5] Stott SL, Lee RJ, Nagrath S, et al. Isolation and characterization of circulating tumor cells from patients with localized and metastatic prostate cancer [J]. Sci Translat Med, 2010, 2(25): 25ra23-25ra23.
[6] Gorges TM, Pantel K. Circulating tumor cells as therapy-related biomarkers in cancer patients [J]. Cancer Immunol Immunother, 2013, 62(5): 931-939.
[7] Liberko M, Kolostova K, Bobek V. Essentials of circulating tumor cells for clinical research and practice [J]. Crit Rev Oncol/hematol, 2013, 88(2): 338-356.
[8] Fujiki M, Takada Y, Ogura Y, et al. Significance of des-gamma-carboxy prothrombin in selection criteria for living donor liver transplantation for hepatocellular carcinoma [J]. Am J Transplant, 2009, 9(10): 2362-2371.
[9] Zhao L, Mou DC, Wu ZA, et al. Diagnostic value of cancer-testis antigen mRNA in peripheral blood from hepatocellular carcinoma patients [J]. World J Gastroenterol, 2010, 16(32): 4072-4078.
Establishment and evaluation of a mouse model of circulating hepatoma cells
LUO Gui-fang1, ZHANG Juan-juan1, DENG Qing1, ZENG Gui-rong1, JIANG DE-JIAN1, XIN Hong-ya2*
(1. Hunan Center for Safety Evaluation And Research of Drugs, Hunan Key Laboratory for Drug Pharmacodynamics and Safety Evaluation,Changsha 410331,China; 2. Department of Hematology, Xiangya Hospital, Central South University,Changsha 410008)
Objective To establish a mouse model of circulating tumor cells (CTCs) by applying mouse hepatoma Hapa 1-6 cells. Methods 108 healthy male C57BL/6 mice were randomly divided into 3 groups according to their body weights. Hepa 1-6 cell suspension was intravenously injected to each mouse in the three groups at a concentration of 1×106, 5×106and 1×107/mL, 0.2 mL per mouse, respectively. Blood samples were collected from the mice on the 1st, 5th, 9th, 13th, 17th and 21st days after tumor cell injection. The number, ratio and relative inhibition rate of CTCs were calculated in 20,000 nucleated cells. The mortality of mice was recorded. ②80 male C57BL/6 mice were averaged into 2 groups according to their body weight: control and sorafenib tosylate groups.0.2 mL of Hepa 1-6 single cell suspension was injected to each mouse through the caudal vein at a concentration of 5×106/mL. The mice were gavaged with sorafenib tosylate (50 mg/kg) for 21 days and blood samples were collected at the 3rd, 8th, 15th, and 21st days for CTC assessment. Results For the 1×106/mL group, the CTC inhibition rate was 25.1%, 18.1%, 8.9%, 4.4%, 2.9% and 0.3% on the 1st, 5th, 9th, 13th, 17th and 21st days, respectively, and all the mice were alive. For the 5×106/mL group, the CTC inhibition rate was 40.4%, 35.4%, 15.4%, 9.0%, 6.6% and 4.1% on the 1st, 5th, 9th, 13th, 17th and 21st days, respectively, and all the mice were alive. For the 1×107/mL group, the CTC inhibition rate was 39.1% and 33.5% on the 1st and 5th days, respectively. Some mice died immediately after intravenous injection and all mice died within 7 days. ②The relative clearance of CTCs was -7.5%, 4.6%, 55.3% and -94.5% on the 3rd, 8th, 15th and 21st days of sorafenib tosylate administration. Compared with the control group, there were significant differences among the three groups (P<0.05 orP<0.01). Conclusions A mouse model of circulating hepatoma cells has been established by intravenous injection of 0.2 mL of 5×106/mL mouse Hepa 1-6 cell suspension. This mouse model can be used for screening and evaluation of drugs for circulating tumor cell inhibition.
Hepatoma; Circulating tumor cells; Mouse model
XIN Hong-ya. E-mail: xinhongya@163.com
湖湘青年创新创业平台专项(2014);湖南省科技计划重点项目(2012TT1002)。
罗桂芳(1987-),男,实习研究员,研究方向:肿瘤药理学及遗传毒理学研究。E-mail: luoguifang@hnse.org
信红亚(1976-),女,博士,主治医师,研究方向:血液病研究。E-mail: xinhongya@163.com
Q95-33
A
1005-4847(2017)03-0301-06
10.3969/j.issn.1005-4847.2017.03.012
2016-10-14
