替米沙坦对非酒精性脂肪肝大鼠肝组织PPARs及脂联素受体2表达的影响
2017-07-18黄晓慈蒋树林刘复娜
黄晓慈,蒋树林,刘复娜
(河北医科大学第二附属医院消化内科,石家庄 050000)
研究报告
替米沙坦对非酒精性脂肪肝大鼠肝组织PPARs及脂联素受体2表达的影响
黄晓慈,蒋树林*,刘复娜
(河北医科大学第二附属医院消化内科,石家庄 050000)
目的 探讨替米沙坦对非酒精性脂肪肝大鼠肝组织PPARs及脂联素受体2表达的影响。方法 40只雄性SD大鼠随机分为正常对照组(NC,n=15)、高脂对照组(FC,n=15)、高脂+替米沙坦干预组(FT,n=10)。NC 组给予普通饲料,FC和FT组予高脂饲料喂养。12周末时随机取NC组和FC组各5只做正葡萄糖高胰岛素嵌夹实验和肝组织HE染色,确定造模成功后,FT组给予替米沙坦5 mg/(kg·d)灌胃,NC和FC组以等容量生理盐水灌胃,共4周。16周时应用高胰岛素正葡萄糖嵌夹实验技术稳态葡萄糖输注速率测定胰岛素敏感性,检测血清转氨酶、血脂及空腹血糖水平;应用逆转录聚合酶链反应法测定肝组织中过氧化物本酶体增殖活化受体(PPARs)、脂联素受体2(AdipoR2)和血管紧张素II 1型受体(AT1R)的表达。结果 与NC组相比,FC组肝组织PPARα、PPARγ、AdipoR2 mRNA表达显著下降(P<0.01),AT1R mRNA表达较NC组升高(P<0.01);FT组PPARα、PPARγ、AdipoR2 mRNA表达较FC组升高(P<0.01);FT组血清转氨酶、血脂及空腹血糖水平较FC组改善。结论 替米沙坦能降低NASH大鼠的体重和肝指数,调节糖脂代谢并改善胰岛素抵抗状态,对NASH大鼠肝脏具有保护作用。
替米沙坦;非酒精性脂肪性肝病;胰岛素抵抗;PPARs;脂联素受体2
非酒精性脂肪性肝炎(NASH)是一种与胰岛素抵抗(insulin resistance, IR)和遗传易感性密切相关的代谢应激性肝损伤,为非酒精性脂肪性肝病(NAFLD)活动性进展期类型,可进展为肝硬化或肝癌。NASH的发病率在我国逐年上升,已成为一种危害人类健康的常见慢性肝脏疾病。广东、北京、上海等地健康人群普查发现,NAFLD患病率达10%~25%,与一些发达国家的NAFLD发病近似[1,2]。NAFLD已成为仅次于病毒性肝炎的第二大肝病病因,其中发展为肝硬化和肝癌者分别有5%~10%和1%~2%[3,4],是代谢综合征在肝脏的表现[5]。美国临床内分泌医师协会提出IR是NAFLD的始动及中心环节[6]。我们的研究旨在复制NAFLD IR大鼠模型,给予兼有血管紧张素受体阻滞剂(ARB)与可能具有激活过氧化物酶增殖活化受体(PPARs)双重作用的替米沙坦干预,探讨其对NASH大鼠肝脏脂肪变性及炎症程度和胰岛素敏感性的作用,为临床应用替米沙坦防治NASH/NAFLD提供理论和实验依据。
1 材料与方法
1.1 实验动物与分组
选用清洁级成年雄性SD(Sprague Dawley)大鼠40只,体重(200±20)g,由河北医科大学实验动物中心提供【SCXK(冀)2013-1-003】,饲养于河北医科大学第二医院实验室【SYXK(冀)2016-003】,自由饮食。准确称重、标记,适应性喂养1周后,随机分为3组,正常对照组(NC,n=15),高脂对照组(FC,n=15),高脂+替米沙坦干预组(FT,n=10)。
1.2 动物饲养与标本采集
全部动物均在同一实验室按清洁级大鼠分笼饲养,温度22~28℃,明暗周期12 h(06:00 ~ 18:00),自由进食水。NC组饲以普通饲料16周。FC及FT组予高脂饮食(84%普通饲料+1%胆固醇+5%蛋黄粉+10%猪油),胆固醇购于南京新百药业有限公司,蛋黄粉及猪油购于广州金益食品有限公司,普通饲料由河北医科大学实验动物中心提供。于12周末时,随机取NC和FC组各5只做高胰岛素正葡萄糖嵌夹实验和肝组织HE染色,确定造模成功(平均葡萄糖输注速率每分钟mg/kg,NC组vs. FC组:(20.98±2.13)vs.(12.81±1.73),P<0.01)。FT组以替米沙坦(美卡素,由勃林格殷格翰公司生产)5 mg/(kg·d)灌胃4周,FC和FT组继续高脂饮食至16周,NC和FC组予等量生理盐水灌胃。16周末,2%戊巴比妥钠腹腔麻醉,钳夹实验前股静脉取血,结束后分离并取出肝脏,称重,计算肝指数(肝湿重/体重×100%),于肝右叶中部取肝组织1 cm × 1 cm × 0.5 cm大小,4%多聚甲醛固定制备石蜡切片,另取肝组织约100 mg放入EP管内,立即投入液氮中,后于-70℃冰箱保存,用于RT-PCR测定。
1.3 高胰岛素正常葡萄糖钳夹实验
大鼠禁食12 h,2%戊巴比妥钠(60 mg/kg)腹腔麻醉。仰卧位固定,切开左侧腹股沟皮肤,分离股静脉,取血约1 mL用于转氨酶、血脂等生化指标的测定。后于股静脉插入静脉留置针,葡萄糖和胰岛素(恒速)由微量泵经股静脉泵入。静置30 min,剪尾法尾静脉取血1滴,罗氏血糖仪测定血糖,记录基础血糖(BBG)。先进行持续胰岛素输注,速率为每分钟10 mU/kg。每5 min测血糖1次,如低于基础值0.5 mmol/L,开始输注10%葡萄糖,速度从每分钟4~6 mg/kg开始,根据血糖值不断调整葡萄糖的输注速率,使血糖维持在BBG±0.5 mmol/L范围至稳态,共120 min(从胰岛素输注计),并计算达到稳态后平均葡萄糖输注速率VGIR60-120。
1.4 光镜标本的制备和观察
将肝组织用4%的多聚甲醛固定制备石蜡切片,苏木精-伊红(HE)染色,光镜下观察肝细胞脂肪变性分度、炎症活动度[7],切片均由有经验的病理科医师评分,每张切片选取5个高倍视野。
1.5 血清转氨酶、血脂、血糖和胰岛素敏感性测定
采用德国Bayer公司全自动生化分析仪测定转氨酶、血脂,罗氏血糖仪测定空腹血糖。实验中60 min至120 min的13个GIR平均值,即为GIR60-120,GIR越小,机体IR越严重,反应了大鼠胰岛素的敏感性。
1.6 RT-PCR方法检测肝组织中PPARα、PPARγ、AdipoR2、AT1R mRNA表达
用Trizol试剂盒(北京赛百盛基因有限公司)提取肝组织总RNA,在逆转录酶MMLV(北京赛百盛基因有限公司)的催化下合成cDNA,取2 μL cDNA为模板在TaqDNA聚合酶(北京赛百盛基因有限公司)催化下进行PCR扩增,引物由北京赛百盛基因有限公司合成。PPARα上游引物:5′-gattcggaaactgcagacctc-3′,下游引物:5′-ttaggaactctcgggtggatga-3′,扩增产物大小为444bp。PPARγ上游引物:5′-atggagcctaagtttgagtttgct-3′,下游引物:5′-ggatgtcctccgatgggcttca-3′,扩增产物大小139bp。AdipoR2上游引物:5′-atgtttggcc-acccctcagta-3′,下游引物:5′-agcctatctgccctatggt-3′,扩增产物大小140bp。AT1R上游引物:5′-ccagcgtaagt-ttcaatc-3′,下游引物:5′-tagggctttccaaataagagta-3′,扩增产物大小350bp。内参照GAPDH上游引物:5′-ccttcattgacctcaactac-3′,下游引物:5′-ggaaggcc-atgccagtgagc-3′,扩增产物大小594bp。扩增条件:94℃预变性4 min,94℃变性40 s,退火温度分别为56℃、60℃、55℃、57℃及59℃ 50 s,72℃延伸90 s,循环30次,72℃延伸10 min。PCR产物6 μL在1%琼脂糖凝胶电泳,紫外透射仪观察,应用Quantity One凝胶图象分析软件对目的电泳条带分析,以相应内参电泳条带作为参照,结果以两者积分吸光度比值表示。
1.7 统计学处理
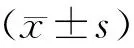
2 结果
2.1 体重和肝指数
各组大鼠初始体重差异无显著性(P=0.075>0.05),至造模结束,各组动物均无死亡。FC组大鼠性情温顺,喜卧懒动,皮毛凌乱,光泽度差,大便稀松,其体重、肝指数随周龄增加而增加,与NC组相比差异有显著性(P<0.01)。FT组体重、肝指数较FC组显著降低(P<0.01)。(表1、2)

表1 各组大鼠体重变化比较Tab.1 Comparison of the body weight of rats in the three groups
注:与NC组比较,**P<0.01;与FC比较,##P<0.01。
Note. Compared with the NC group,**P<0.01;compared with the FC group,##P<0.01.
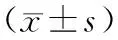
表2 各组大鼠肝湿重和肝脏指数变化Tab.2 Comparison of liver weight and liver index in the rats of each group
注:与NC比较,**P<0.01;与FC组比较,##P<0.01。
Note. Compared with the NC group,**P<0.01;compared with the group FC,##P<0.01.
2.2 肝组织HE染色
NC组大鼠肝细胞形态、小叶结构及汇管区无异常。FC组大鼠呈弥漫性大泡性为主的脂肪变,以中央静脉周围最明显,可见程度不等的小叶内及汇管区炎症,小叶内可见灶性坏死,甚至部分坏死灶融合形成桥接坏死。FT组肝细胞脂肪变性及炎症分级较FC组减轻(P<0.05)。(图1,表3)
2.3 血清生化、血糖及胰岛素敏感性变化
FC组血清ALT、AST、TC、TG、空腹血糖水平较NC组明显升高(P均<0.01),血清HDL水平及GIR较NC组明显下降(P<0.01)。与FC组相比,FT组血清ALT、AST水平均明显下降(P<0.01),血清TC、TG水平与FC组相比存在下降趋势,但差异无显著性(P>0.05),血清HDL水平较FC组上升但差异无显著性(P>0.05);FT组空腹血糖较FC下降(P>0.05),GIR较FC组升高(P<0.01)。(表4)

注:A:正常对照组;B:高脂对照组;C:干预组。图1 各组大鼠肝脏病理学变化(HE染色,×400)Note. A:a rat from the NC group;B:a rat from the FC group;C:a rat from the FT group.Fig.1 Pathological changes of liver tissues in the rats

分组Groups肝细胞脂肪变性(F)Steatosisofhepatocytes肝组织炎症分级(G)HistologicalinflammatorygradeF0F1F2F3F4meanrankG0G1G2G3meanrankA1000005.5100006.0B0023523.65**025323.15**C0342117.35**#162117.35**#
注:与NC组比较,**P<0.01;与FC组比较,#P<0.05。
Note. Compared with the NC group,**P<0.01;compared with the FC group,#P<0.05.
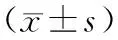
表4 16周末三组间各参数比较Tab.4 Comparison of parameters between the three groups at the end of 16th week
注:与NC组比较,*P<0.05,**P<0.01;与FC组比较,#P<0.05,##P<0.01。
Note. Compared with the NC group,*P<0.05,**P<0.01;compared with the FC group,#P<0.05,##P<0.01.
2.4 肝组织PPARα、PPARγ、AdipoR2及AT1R mRNA的表达
与NC组比较,FC组肝组织PPARα、PPARγ、AdipoR2 mRNA的表达均显著下降(P<0.01),AT1R mRNA的表达较NC组升高(P<0.01)。与FC组比较,FT组肝组织PPARα、PPARγ、AdipoR2mRNA的表达均升高(P<0.01),AT1R mRNA的表达较FC组升高,差异无显著性(P>0.05)。(图2,表5)
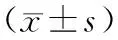
表5 各组大鼠肝组织PPARα和PPARγ mRNA表达Tab.5 RT-PCR of PPARα and PPARγ’s mRNA content in rat livers of each group
注:与NC组比较,**P<0.01;与FC组比较,##P<0.01。
Note. Compared with the NC group,**P<0.01; compared with the FC group,# #P<0.01.
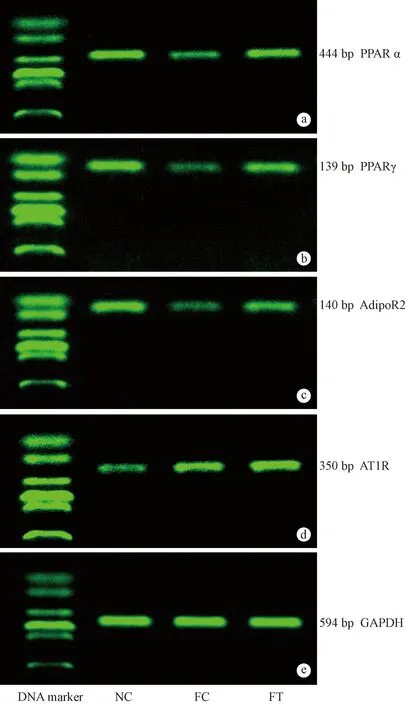
图2 各观察指标在各组肝组织中的表达(a.PPARα mRNA,b.PPARγ mRNA,c.AdipoR2 mRNA,d.AT1R mRNA)Fig.2 Expression of the indexes in hepatic tissues (a.PPARα mRNA,b.PPARγ mRNA,c.AdipoR2 mRNA,d.AT1R mRNA)
3 讨论
NAFLD已经成为我国除慢性乙型病毒性肝炎外另一重要的慢性肝病[8]。研究表明,肝细胞线粒体功能障碍在NAFLD的形成过程中起重要作用[9];IR不仅是NAFLD的发病因素,也与NASH的发生密切相关[10]。在IR的状态下,由于胰岛素对脂肪代谢的调节作用减弱,脂肪组织分解增加,血中游离脂肪酸(FFA)增多,肝细胞对FFA的摄取及TG合成增多,肝内脂肪合成增加,超过了肝细胞氧化利用和合成脂蛋白转运出去的能力。此外,增多的FFA可导致高胰岛素血症,血中的胰岛素又促进脂肪的合成,抑制其分解,进一步使血脂升高,肝细胞内脂肪沉积,肝细胞肿大变性形成脂肪肝。可见高胰岛素血症、IR与脂肪肝形成密切相关[11]
PPARα是一类主要在肝脏表达由配体激活的核转录因子,参与调节脂肪酸β氧化及脂蛋白合成中相关基因的表达,促进肝脏脂代谢,改善IR[12]。Konig等[13]研究发现活化的PPARα可抑制固醇调节元件结合蛋白(SREBPs)的活性,从而减少脂肪酸和TG的合成。PPARγ具有脂肪组织特异性,参与脂肪细胞的分化[14],调节脂肪酸代谢的多个环节,使脂肪酸转运蛋白和脂肪酸转运酶表达增加,刺激肝细胞对脂肪酸的摄取和向脂酰CoA的转化,促进脂质代谢,使血脂浓度降低。PPARγ可选择性的促进FFA被脂肪摄取,使葡萄糖在肌肉和肝脏中利用增加,改善糖代谢。PPARγ可下调脂肪特异蛋白瘦素的表达,抑制食物的摄取[15]。以上研究表明PPARα及PPARγ低表达与NASH的发生发展关系密切。
脂联素受体有两种异构体,即脂联素受体1 (AdipoR1)和脂联素受体2(AdipoR2)[16]。脂联素与主要表达于肝脏的AdipoR2结合后,激活AMP激酶,并使乙酰辅酶A羧化酶的活性降低,丙酰辅酶A含量减少,减轻肝脏脂肪沉积。它主要参与炎症和能量代谢等病理生理过程,与受体结合后发挥胰岛素增敏、保护肝脏、抗炎和抗动脉粥样硬化等作用。NASH时,由于IR和高胰岛素血症发生,通过磷酯酰肌醇-3激酶途径使脂肪组织和骨骼肌AdipoRs的表达下调[17],脂联素与AdipoRs的结合减少,降低了脂联素的效应,进一步加重IR,形成恶性循环,促进NASH发生发展。Shinizu等[18]研究发现14例NAFLD患者与7例健康人比较,肝脏AdipoR2表达显著下降,而AdipoR1表达两组间无差异。国内研究发现[19]NAFLD大鼠肝脏AdipoR1表达增加而AdipoR2表达减少,推断脂联素受体在肝脏表达异常,尤其AdipoR2表达少与NAFLD形成和发展密切相关。
以上分析表明,肝脏细胞PPARs和AdipoRs的表达水平是NAFLD/ NASH发生发展的细胞分子学基础。本实验通过高脂饮食复制NASH大鼠模型,发现FC组大鼠体重明显增加,肝脏脂肪变性及炎症程度明显,且存在IR。肝组织PPARα、PPARγ、AdipoR2 mRNA表达水平明显低于NC组(P<0.01),由此推断PPARα、PPARγ及AdipoR2低表达状态在NASH的发生发展过程中同时存在,改善三者在肝组织中的表达可能对改善NASH和IR有益;至于三者在NASH和IR发生时同时低表达状态的发生机制以及三者间的关系,本研究未涉及。
替米沙坦是一种非肽类血管紧张素Ⅱ受体阻滞(ARBs),与血管紧张素Ⅱ受体1(AT1)结合后,阻断AngII的生物学作用,降低肾素-血管紧张素系统(renin-angiotensin system, RAS)的活性。阻断RAS后血清脂联素水平显著升高,过度激活的RAS可使机体胰岛素敏感性明显减低。本研究表明,经替米沙坦干预后肝组织PPARα、PPARγ及AdipoR2mRNA表达明显上调,三者在肝组织中的低表达状态明显改善。PPARα表达增强,可促进肝细胞对摄取的脂肪β氧化,减轻肝细胞脂肪变性;肝组织PPARγ上调,尽管通过促进肝细胞对FFA摄取和TG的合成,对肝细胞脂肪变的恢复不利,而在周围组织如肌肉和脂肪组织中PPARγ高表达则可调节血脂,减少脂质经血向肝脏的流动从而间接减轻肝脏脂肪沉积。
综上所述,替米沙坦可使IR-NASH大鼠肝组织PPARα、PPARγ及AdipoR2三者低表达状态明显改善,从而改善模型大鼠的糖脂代谢,提高胰岛素敏感性,减轻肝脏脂肪沉积及肝细胞损伤。NAFLD/NASH时PPARs与AdipoRs表达与肝细胞线粒体功能失调相关细胞分子学机制及调节因子研究,是今后深化研究的方向。
[1] Erickson SK. Nonalcoholic fatty liver disease[J]. J Lipid Res, 2009, 50(Suppl): S412-S416.
[2] Nobili V, Bedogni G, Alisi A, et al. A protective effect of breast feeding on the progression of non-alcoholic fatty liver disease [J]. Arch Dis Child, 2009, 94(10): 801-805.
[3] Caldwell S, Argo C. The natural history of non-alcoholic fatty liver disease [J].Dig Dis, 2010, 28(1): 162-168.
[4] Neuschwander-Tetri BA, Clark JM, Bass NM, et al. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease [J], Hepatology, 2010, 52(3): 913-924.
[5] Gervois P, Kleemann R, Pilon A, et al. Global suppression of IL-6 induced acute phase response gene expression after in vivo chronic treatment with the peroxisome proliferator-activated receptor-α activator fenofibrate[J]. J Biol Chem, 2004, 279(16): 16154-16160.
[6] Hanley AJ, Williams K, Festa A, et al. Liver markers and development of the metabolic syndrome the insulin resistance atherosclerosis study [J]. Diabetes, 2005, 54(11): 3140-3147.
[7] Schwimmer JB, Behling C, Newbury R, et al. Histopathology of pediatric nonalcoholic fatty liver disease[J], Hepatology, 2005, 42(3): 641-649.
[8] 邹傲, 史登平. 非酒精性脂肪性肝病的相关危险因素研究进展[J]. 胃肠病学和肝病学杂志, 2012, 21(1): 92-94.
[9] Serviddio G, Sastre J, Bellanti F, et al. Mitochondrial involvement in non-alcoholic steatohepatitis[J]. Mol Aspects Med, 2008, 29(1-2): 22-35.
[10] Bugianesi E, Manzini P, DAntico S, et al. Relative contribution of iron burden, HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty liver [J]Hepatology, 2004, 39(1): 179-187.
[11] 唐欣, 徐路. 2型糖尿病合并非酒精性脂肪肝的临床研究[J]. 医学临床研究, 2010, 27(12): 2254-2255.
[12] 尹玉, 赵卫华, 胡健. 替米沙坦与非诺贝特对高脂饮食大鼠血清脂联素水平的影响[J].中国医科大学学报, 2009, 38(9): 674-676.
[13] Konig B, Koch A, Spielmann J, et al. Activation of PPARalpha and PPARgamma reduces triacylglycerol synthesis in rat hepatoma cells by reduction of nuclear SREBP [J]. Eur J Pharmacol, 2009, 605(1-3): 23-30.
[14] 杨智, 刘昭前. PPARγ在脂肪细胞分化和糖脂代谢中的作用[J].国际病理科学与临床杂志, 2008, 28(1): 14-17.
[15] Berger J, Moller DE. The mechanisms of action of PPARs [J].Annu Rev Med, 2002, 53: 409-435.
[16] Yamauchi T, Kamon J, Ito Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects [J], Nature, 2003, 423(6941): 762-769.
[17] Inukai K, Nakashima Y, Watanabe M, et al. Regulation of adiponectin receptor gene expression in diabetic mice [J].Am J Physiol Endocrinol Metab, 2005, 288(5): 876-882.
[18] Shimizu A, Takamura T, Matsuzawa N, et al. Regulation of adiponectin receptor expression in human liver and a hepatocyte cell line [J]. Metabolism, 2007, 56(11): 1478-1485.
[19] 刘苏, 谢笑娟, 赵雪倩, 等. 非酒精性脂肪性肝病大鼠肝脏脂联素受体的表达[J]. 胃肠病学和肝病学杂志, 2008, 17(10): 802-805.
Effects of telmisartan on the expressions of PPARs and adiponectin receptor2 in the liver tissue of rat with nonalcoholic steatohepatitis
HUANG Xiao-ci, JIANG Shu-lin*, LIU Fu-na
(Department of Gastroenterology, Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
Objective To explore the effects of telmisartan on expression of peroxisome proliferators PPARs activated receptors and adiponectin receptor 2 in rats with nonalcoholic steatohepatitis (NASH). Methods Forty male SD rats were randomized into normal-diet control group (NC,n=15), high fat-diet control group (FC,n=15), and high fat-diet with telmisartan group (FT,n=10). NC group was given standard diet and the other two groups were given high-fat diet.At the end of the 12th week, 5 rats which were randomly selected from both the NC and FC groups were given euglycermic hyperinsulinemia clamp to see if fat-liver model of rats with insulin resistance was successfully induced, and rat livers were removed for pathological examination to determine the extents of NASH. Afterwards, rats in the FT group was given telmisartan (5 mg/kg·d) while rats in both the NC and FC groups were given the same volume of 0.9% saline solution by intragastric gavage for another 4 weeks.After glucose infusion rates (GIRs) were obtained by the euglycermic hyperinsulinemia clamp technique at the end of the 16th week, all rats were sacrificed and the body weight was recorded, and serum lipids, aminotransferases and fasting blood glucose were measured. The mRNA expressions of peroxisome proliferator activated receptors (PPARs), adiponectin receptor-2 and angiotensin II type-1 receptor in the liver tissue were assessed by semi-quantitative reverse transcriptase polymerase chain reactions. Results The expressions of PPARα, PPARγ and AdipoR2 mRNA in the liver tissue of FC group were decreased significantly compared with the NC group (P<0.01), and the expression of AT1R mRNA of the liver tissue in FC group was increased significantly compared with NC group (P<0.01). Compared with the FC group, the expressions of PPARα, PPARγ and AdipoR2 mRNA in the FT group were increased (P<0.01).Serum aminotransferases, lipids and fasting blood glucose level in the rats of FC group were increased significantly compared with rats of the NC group (P<0.01), and serum aminotransferases, lipids and fasting blood glucose level in the rats of FT group were greatly improved compared with the FC group. Conclusions Telmisartan can improve glucose and lipid metabolism, stop weight gain, decrease liver index, and alleviate steatosis and inflammation of NASH rats by improving insulin resistance. Telmisartan may play an effective role in the protection of rat liver with NASH.
Nonalcoholic fatty liver hepatitis; Insulin resistance; Peroxisome proliferators activated receptor; PPAR; Telmisartan; Adiponectin receptor 2
JIANG Shu-lin. Email: shulinjiang1@aliyun.com
黄晓慈(1984-),女,硕士研究生。研究方向:非酒精性脂性肝病。
蒋树林(1965-),男,教授,主任医师,硕士研究生导师。主要从事慢性肝病、幽门螺杆菌及消化内镜临床及科研工作。Email: shulinjiang1@aliyun.com
Q95-33
A
1005-4847(2017)03-0289-06
10.3969/j.issn.1005-4847.2017.03.010
2016-09-19
