静息能量代谢率用于评价糖皮质激素肾阴虚肾阳虚证模型的作用
2017-07-18陶林琳孙贤俊段晓虹周文江黄建华
陶林琳,孙贤俊,段晓虹,周文江*,黄建华*
(1. 复旦大学 药学院, 上海 201203; 2. 复旦大学附属华山医院, 上海 200040; 3. 复旦大学 中西医结合研究院基础理论与应用研究所,上海 200040)
研究报告
静息能量代谢率用于评价糖皮质激素肾阴虚肾阳虚证模型的作用
陶林琳1,孙贤俊2,3,段晓虹2,3,周文江1*,黄建华2,3*
(1. 复旦大学 药学院, 上海 201203; 2. 复旦大学附属华山医院, 上海 200040; 3. 复旦大学 中西医结合研究院基础理论与应用研究所,上海 200040)
目的 观察静息能量代谢率(resting metabolic rate, RMR)在评价糖皮质激素肾阴虚及肾阳虚证模型中的作用。方法 BALB/c雄性小鼠分为对照组、模型组、金匮肾气丸组、知柏地黄丸组,后三组小鼠均给予含皮质酮的饮用水,对照组给予含1%乙醇的饮用水。采用封闭式流体压力呼吸计测定动物RMR。实验结束,处死小鼠,检测肾周脂肪、附睾脂肪、股四头肌、胫骨前肌重量指数;采用ELISA法检测血清激素水平;肝脏、肾脏组织HE染色观察;检测肝组织丙二醛(malondialdehyde,MDA)含量、琥珀酸脱氢酶(succinate dehydrogenase, SDH)活性、细胞色素c氧化酶(cytochrome-c-oxidase,COX)活性、ATP水平。结果 与对照组比较,模型组能量代谢率在实验开始第2天即显著升高,第4天达最高(P<0.01),之后逐渐降低,至第66天显著降低(P<0.05)。皮质酮造模66 d显著降低小鼠血清甲状腺素(T4)含量,升高脂肪重量指数、降低肌肉重量指数、升高MDA水平、抑制SDH、COX活性及ATP水平。两补肾药均能降低动物死亡率,降低肝组织MDA含量,并且金匮肾气丸能升高模型组第4天及66天的能量代谢率(P<0.05),能显著提高肝组织SDH活性、COX活性及ATP水平(P<0.01),知柏地黄丸未观察到类似作用。结论 静息能量代谢率对评价糖皮质激素肾阴虚/肾阳虚证模型具有一定作用。
糖皮质激素;肾阴虚;肾阳虚;动物模型;能量代谢率
糖皮质激素是临床最常用的药物之一,很早就观察到使用大量激素的患者,早期出现面红升火、兴奋失眠、五心烦热、头痛口干等症状, 中医辨证为“阴虚火旺”[1];随着治疗时间延长或认为由于后期激素撤停,患者出现了“气阴两虚”,最后出现“阴阳两虚”[2]。借鉴上述临床观察,有研究给动物短期使用糖皮质激素,造成的模型被称为“肾阴虚证模型”,一般造模周期为4~14 d[3]。但使用糖皮质激素也是制备肾阳虚证模型的最常用方法。上世纪60年代邝安堃等给小鼠肌注醋酸皮质素(0.25 mg/d),发现第9~10 天后动物出现竖毛、毛不光洁、弓背少动、反应迟钝、抗冻力下降等,作者视其为“阳虚证”动物模型[4],此后,该模型被认为是“肾阳虚证”模型,使用的动物涵盖小鼠、大鼠、豚鼠,注射糖皮质激素成模的时间从3~60 d不等,注射所用糖皮质激素的种类包括氢化可的松、醋酸可的松、皮质酮、地塞米松等[5]。
应用糖皮质激素既能造成肾阴虚证,也能造成肾阳虚证模型,但区别二者的标准往往是动物形态,如动物是否亢奋、是否倦怠等;另外一个辅助判断的因素是造模时间,认为激素使用早期、晚期分别造成了肾阴虚/肾阳虚证模型,显然还缺乏相对客观的标准用于糖皮质激素肾阴虚/肾阳虚证动物模型的判定。肾阴虚/肾阳虚证是中医学的重要证型,其动物模型制备与阐明其科学基础可能有密切关系,故本文对该模型重新进行了深入研究并引入能量代谢率指标对肾阴虚/肾阳虚证模型进行评价。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性BALB/c小鼠100只,6周龄,体重22~24 g; SPF级雌性BALB/c小鼠10只,10周龄,体重27~30 g,均由上海斯莱克实验动物有限公司提供[SCXK(沪)2012-0002]。动物饲养于复旦大学药学院实验动物中心[SYXK(沪)2015-0023],环境温度20~23℃,相对湿度50%~ 70%,12 h/12 h明暗交替,自由摄食饮水。动物适应性喂养1周后开始实验。
1.1.2 药物与试剂
皮质酮购自默克生物公司(德国);金匮肾气丸为北京同仁堂科技发展股份有限公司制药厂产品(产品批号:15031456)。知柏地黄丸为兰州佛慈制药股份有限公司产品(产品批号:14G39)。甲状腺素(T4)、三碘甲状腺原氨酸(T3)、游离T4、游离T3、皮质酮(corticosterone)、睾酮(testosterone)、酶联免疫吸附(ELISA)检测试剂盒购自德国Labor Diagnostika Nord (LDN) 公司。细胞裂解液、蛋白酶抑制剂Cocktail、BCA法蛋白浓度测定试剂盒购自美国Pierce公司。丙二醛(malondialdehyde, MDA)含量测定试剂盒购自中国海门碧云天生物技术有限公司。呼吸链琥珀酸脱氢酶(succinate dehydrogenase, SDH)、细胞色素氧化酶(cytochrome c oxidase, COX)测定试剂盒购自美国Abcam公司。
1.1.3 仪器
酶标仪(美国BioTek公司)、倒置光学显微镜(中国Motic公司AE3.0型)、神经生理记录系统TDT system 3(含TDT ES1扬声器、Startle reflex软件、Biosig软件、压电转换器、LP-4电热毯)(美国TDT公司)、超低温冰箱(美国Thermo公司)、透射电子显微镜(荷兰Philips公司CM120型)、人工气候箱(中国上海博讯实业有限公司)。
1.2 方法
1.2.1 小鼠分组及药物处理
实验一:观察糖皮质激素对小鼠静息能量代谢率(resting metabolic rate, RMR)的动态影响。分组:BALB/c小鼠20只,随机分为2组,对照组、模型组各10只。药物处理:对照组小鼠给予含1%乙醇的灭菌饮用水,其余组小鼠给予含皮质酮饮用水,皮质酮先溶于乙醇,再稀释于灭菌饮用水中(饮水中皮质酮终浓度为100 μg/mL,乙醇浓度为1%),给药时间为66 d。期间动态监测小鼠形态、体重、日进食量、日饮水量及RMR,给药期满后进行寒冷应激测试、性行为测试及听觉脑干诱发电位(ABR)测试。
实验二:观察补肾方对短期(4 d)和长期(66 d)应用糖皮质激素引起RMR变化的干预作用。分组:小鼠随机分为8组,短期对照组、短期模型组、金匮肾气丸-短期模型组、知柏地黄丸-短期模型组、长期对照组、长期模型组、金匮肾气丸-长期模型组、知柏地黄丸-长期模型组各10只。药物处理:对照组小鼠给予含1%乙醇的灭菌饮用水,其余组小鼠给予含皮质酮饮用水,皮质酮处理同实验一。知柏地黄丸组、金匮肾气丸组则分别将药溶于上述含皮质酮饮用水中,剂量按说明书每日人用量的5倍换算。短期组给药时间为1~4 d,长期组给药时间为50~66 d。期间动态监测小鼠RMR、体温及死亡情况,给药期满后即牺牲小鼠取材。
1.2.2 RMR测定
在小鼠造模及药物干预的过程中进行动态监测。RMR采用封闭式流体压力呼吸计在动物的正常饲养温度(20~25℃)测定,呼吸室容积为1.0 L,用碱石灰吸收呼吸室内CO2,方法参见文献[7]。动物放入呼吸室内适应15 min,稳定后开始记录含氧量。每隔5 min记录1次,连续测定45 min,计算平均耗氧量·min/g体重,作为RMR。测试前后分别测定小鼠的肛内温度。
1.2.3 血清激素浓度测定
颈动脉取血,自然凝集1 h后,于4℃、3000 r/min离心20 min,取血清,置于-80℃保存备用。T4、游离T4、T3、游离T3、皮质酮、睾酮浓度检测分别按照试剂盒说明书操作。
1.2.4 肝组织MDA及线粒体呼吸链酶活性检测
处死小鼠,取肝组织约50 mg,加入细胞裂解液1 mL并按1∶100比例加入蛋白酶抑制剂Cocktail,匀浆器匀浆,4℃,15 000 r/min离心15 min,取上清,BCA法测定蛋白浓度。每个样本MDA含量测定按试剂盒说明书操作,MDA含量采用nmol/mg蛋白计算。用于肝组织线粒体呼吸链SDH、COX活性测定的样本处理过程同上,酶活性操作过程按说明书进行,酶活性表示为mU/mg蛋白。
1.2.5 病理形态学观察
光学显微镜观察:小鼠处死后,取小鼠肝、肾,4%多聚甲醛固定。常规石蜡包埋切片、HE染色,光学显微镜下观察、摄片。
透射电镜观察:处死小鼠,取其肾,切成体积<1 mm3的组织块,立即放入2.5%戊二醛固定液(用0.1 mol/L磷酸缓冲液配制)固定2 h,经清洗液冲洗后,于1%锇酸固定液(用0.1 mol/L磷酸缓冲液配制)固定2 h,经浓度梯度乙醇脱水,用618环氧树脂制成包埋块后,使用LKB-I型超薄切片机切片,超薄切片经过枸缘酸铅、醋酸铀双重染色后,在CM 120透射电子显微镜下观察、摄片。
1.2.6 寒冷应激测试
给药66 d后,对照组、模型组小鼠取6只,进行测试。将小鼠放入4℃人工气候箱,观察动物的行为变化,并检测15 min内小鼠能量代谢率变化,能量代谢率检测与RMR检测相同。
1.2.7 性行为测试
给药66 d后,对照组、模型组小鼠取6只,进行测试。准备工作:10周龄雌性BALB/c小鼠10只手术切除卵巢,术后休息两周,挑选术后恢复好状态佳的6只进行后续测试。测试前2 d雌性小鼠给予苯甲酸雌二醇10 μg皮下注射,每天1次。测试前3 h皮下注射孕酮500 μg。测试开始后,雄鼠在新鼠笼中适应5 min,随后放入雌性小鼠,关闭日光灯,在弱红光下观测性行为,观察:①捕捉潜伏期,即自雌鼠投入至雄鼠第一次捕捉雌鼠的时间。②扑捉次数,即雄鼠扑捉雌鼠或爬背次数。
1.2.8 听觉脑干诱发电位(ABR)测试
给药66 d后,对照组、模型组小鼠随机取6只,进行测试。采用短纯音刺激诱发,短纯音上升、下降时间为0.5 ms,时程为10 ms,刺激重复率为11.1次/秒。小鼠经盐酸氯胺酮肌肉注射麻醉后置于恒温电热毯上,保证小鼠体温在37.5℃左右,1%利多卡因于小鼠颅顶及两侧乳突皮下局部注射,记录电极刺入颅顶皮下,参考及接地电极分别刺入左右乳突皮下。刺激声从90 dB SPL开始,5 dB下降一档,以刚刚诱发出可辨认的波V的最小声强为ABR反应阈值。
1.3 统计分析
2 结果
2.1 小鼠体重、日进食量、日饮水量、RMR的动态变化
实验发现对照组小鼠精神状态、进食、活动量均正常,毛发有光泽。模型组小鼠饮用含皮质酮水第2天就表现出活动增多、不易捕捉、喜打斗,一直持续到第7天左右。之后,动物逐渐出现毛发稀疏、缺少光泽、精神状态变差等。模型组小鼠在应用激素35 d以前,体重小于对照组,第7、14天差异有显著性(P<0.05, 图1 A)。第35天以后,两组小鼠体重大致相当。模型组小鼠日进食量、日饮水量在应用激素第1天即显著增加(P<0.05,图1B C),模型组小鼠日饮水量在第49天以后又显著高于对照组(P<0.05,图1C)。RMR观察发现,模型组小鼠在第2、4天显著高于对照组(P<0.05,图1D),之后差异无显著性,但仍高于对照组,一直持续到第37天。第60天观察到模型组静息能量代谢率低于对照组,第66天差异有显著性(P<0.05,图1D)。模型小鼠静息能量代谢率出现特征性的先升高后逐渐降低的现象。

注:A:体重;B:每克体重日进食量;C:每克体重日饮水量;D:耗氧率。*P<0.05,** P<0.01,与对照组比较。图1 小鼠体重、日饮食量及RMR的动态变化Note. A: Body weight; B: Daily food intake per gram of body weight; C: Daily drinking per gram of body weight; D: Oxygen consumption rate.*P<0.05,** P<0.01, compared with the control group.Fig.1 Dynamic changes of the body weight, daily food intake and resting metabolic rate of the mice
2.2 经典补肾方剂对小鼠RMR、体温、死亡的影响
金匮肾气丸、知柏地黄丸分别是中医学温肾阳、滋肾阴泻虚火的代表方,中医学有用方剂的治疗效应推断证候的传统。研究发现,在激素应用第4天,金匮肾气丸组RMR与模型组相比,进一步升高(P<0.05,图2A),而知柏地黄丸组RMR与对照组相当。自激素应用第50天起,再次药物干预,结果显示,金匮肾气丸组RMR显著高于模型组(P<0.05,图2B),与对照组相近。各组小鼠肛门内温度无差异。使用激素第66天,动物的死亡率高达30%,金匮肾气丸组合知柏地黄丸组死亡率均仅10%。
2.3 各组小鼠血清激素水平
RMR的改变和甲状腺激素含量变化有密切关系。实验发现,模型组第4天各激素水平与对照组相比差异无显著性(表1)。模型组第66天各激素水平与对照组比较,T4含量显降低(P<0.01,表2)。金匮肾气丸、知柏地黄丸对血清激素水平无显著干预作用(表1,表2)。

注:*P< 0.05,与对照组比较;#P< 0.05,与模型组比较。图2 金匮肾气丸和知柏地黄丸对小鼠RMR的干预Note. JKSQ: Jinkuishenqi pill; ZBDH: Zhibaidihuang pill.*P< 0.05, compared with the control group; # P< 0.05, compared with the model group.Fig.2 Effects of Jinkuishenqi pill and Zhibaidihuang pill on the resting metabolic rate in the mice

组别Groups甲状腺素T4mg/mL三碘甲状腺原氨酸T3ng/mL游离甲状腺素FT4pg/mL游离三碘甲状腺原氨酸FT3pg/mL皮质酮Corticosteroneng/mL睾酮Testosteroneng/mL对照组Control15.85±4.160.78±0.249.52±2.273.42±0.5447.29±16.7713.27±17.97模型组Model13.09±2.950.650±.337.16±2.223.43±0.75117.56±101.347.15±12.07金贵肾气丸组JKSQW12.48±2.410.69±0.226.85±2.483.53±1.21131.20±62.7415.03±10.87知柏地黄丸组ZBDHW12.99±3.130.65±0.297.44±2.843.49±0.59110.97±42.6115.66±12.81
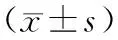
表2 各组小鼠第66天血清激素水平Tab.2 Serum hormone levels in the mice at the 66th day of experiment
注:与对照组比较,**P<0.01。
Note. Compared with the control group,**P<0.01.
2.4 各组小鼠脂肪、肌肉重量指数
与对照组比较,模型组、金匮肾气丸组、知柏地黄丸组肾周脂肪重量指数、附睾脂肪重量指数均显著升高;知柏地黄丸组与模型组比较,脂肪重量指数进一步升高(P<0.05或P<0.01图3A、B);模型组股四头肌重量指数也显著降低(P<0.01图3C),胫骨前肌重量指数有明显下降趋势;金匮肾气丸显著提高胫骨前肌重量指数(P<0.01图3D)。

注:* P< 0.05,** P< 0.01, 与对照组比较;#P< 0.05,## P< 0.01, 与模型组比较。图3 各组小鼠体成分、MDA、呼吸链酶活性及ATP水平(n=8,模型组Note. JKSQ:Jinkuishenqi pill; ZBDH: Zhibaidihuang pill.* P< 0.05,** P< 0.01, compared with the control group; # P< 0.05,## P< 0.01, compared with the model group.Fig.3 Body composition, MDA, respiratory chain enzyme activities and ATP levels in each group of mice
2.5 各组小鼠MDA、呼吸链酶活性、ATP水平
能量代谢率改变和线粒体功能也可能有关系。实验发现模型组MDA水平较对照组显著升高,两种补肾药物均能使之降低(P<0.01图3E)。模型组SDH和COX活性、ATP水平,与对照组比较均显著降低,仅金匮肾气丸对该降低具显著提高作用(P<0.01图3 F G H)。
2.6 各组小鼠肝、肾HE染色观察
对照组小鼠肝组织HE染色示形态正常,模型组肝细胞内出现大量脂肪空泡;金匮肾气丸组脂肪空泡略有减少,知柏地黄丸组则与模型组相近(图4)。各组小鼠肾组织HE染色比较,均大致正常,未见显著差别。
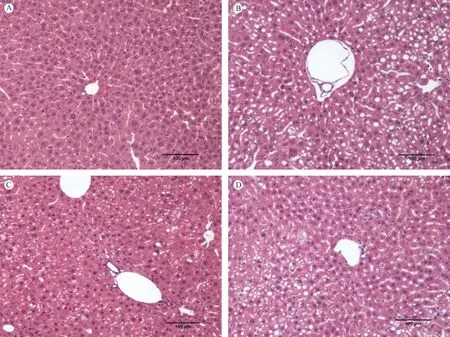
注:A:对照组;B:模型组;C:金匮肾气丸组;D:知柏地黄丸组。图4 各组小鼠肝组织HE染色Note. A: Control group; B: Model group; C: Jinkuishenqi pill group; D: Zhibaidihuang pill group.Fig.4 Histological images of liver tissue in the mice(HE staining)

注:* P< 0.05,** P< 0.01, 与对照组比较。图5 长期应用皮质酮小鼠出现肾阳虚证“表型组合”Note.*P< 0.05,**P< 0.01, compared with the control group.Fig.5 Phenotype combination for Kidney Yang deficiency syndrome induced by long-term use of corticosterone in the mice
2.7 长期使用激素小鼠肾小管细胞形态、冷应激、性行为、ABR结果
中医学认为肾阳虚时常会出现一个“表型”组合:小便多、怕冷、性行为障碍、听力减退等。实验发现,激素作用66 d的小鼠24 h尿量增多(n=6),肾小管上皮细胞内线粒体肿胀(图5 A B)。小鼠在冷环境中能量代谢上升速率降低(图5 C,n=6)。对雌鼠的捕捉潜伏期显著升高(P<0.05 图5 D,n=6),而15 min内骑跨次数显著降低(P<0.01 图5 E,n=6)。模型组小鼠ABR反应阈值显著升高(P<0.01 图5 E,n=6),提示听力敏感度下降。
3 讨论
能量代谢在中医证候鉴别及研究中的作用一直未得到充分重视,但很多证候显然和能量代谢相关。我们曾提出,“凡涉及或意指阴或阳两个词的证候,都涉及局部和全身的热量代谢或为患者主观感觉的热量代谢障碍”[8]。热量代谢则是能量代谢的一部分。本研究结果显示,静息能量代谢率在整个糖皮质激素处理过程中,先升高,再逐渐下降,最后显著降低,这种变化趋势与应用激素后,从“阴虚火旺”转变为“阳虚”的描述吻合。我们检测的其他各项指标均没有出现先升高后下降的特殊形态,提示能量代谢率可能是糖皮质激素应用后中医证候鉴别及相关证候研究的关键指征。
进而我们对糖皮质激素引起能量代谢变化的机制进行了研究。糖皮质激素短期应用引起能量代谢升高,研究较多。本研究发现糖皮质激素长期应用能引起总T4水平显著降低;能改变体成分,使脂肪含量升高,而肌肉含量下降;同时使组织的线粒体功能下降,氧化水平升高。线粒体损伤及功能下降可能在糖皮质激素长期应用致能量低下中扮演核心作用,研究发现糖皮质激素能能直接调控线粒体基因组基因表达[9]。另外糖皮质激素也可能通过产生自由基而损伤线粒体[10]。最近有学者提出“线粒体负荷”的概念,即营养底物过多,能调节线粒体动力学或损伤线粒体,造成线粒体处理不了底物,形成超负荷,认为是多种代谢性疾病的中心环节[11],而研究已经表明,糖皮质激素能使动物血糖、血脂升高[12],进而导致“线粒体负荷”也可能是机制之一。
在临床上,中医证候根据患者的症状表现来判断,主观性较强,因此如何制备中医证候动物模型就存在困难,但“主观感觉也有客观基础”,也因此,快乐、意识的研究成为了神经科学的前沿。我们曾提出,若能应用一种内源性物质同时制备出证候的“表型组合”,可以有根据地认为制备了某个证候动物模型[13],如应用一种内源性激素能同时制备出动物怕冷、性行为障碍、小便增多、听力异常等,说这是一个肾阳虚模型就有相当的合理性。本文的确观察到长期应用糖皮质激素,动物同时出现了小便增多、怕冷、性功能下降、听力异常等中医肾阳虚的表型组合。
本中医证候动物模型还有几点值得提及。首先,中医的证型多相互重叠,并相互转化,如有研究通过随机抽样方法调研住院患者的病案资料,结果发现单一中医证型比例很少,绝大部分为复合证型[14,15]。本研究也观察到长期应用糖皮质激素小鼠肥胖、体脂含量增高、肌肉含量减少。研究报道糖皮质激素应用使动物血糖、血脂、血压升高[12],因此本模型必夹杂其他证型,如痰湿证、脾虚证,甚至瘀血证等,只能认为它包含了典型的肾阴/肾阳虚证。承认这一点,并不会削弱证候模型的合理性,因为这就是中医证候本身的特点:可能并没有“标准”或单纯的某个证的模型,只有典型地包含了某个证的动物模型。
其次,很多人将糖皮质激素长期效应解释为“耗竭”,或者为“毒性”效应[16],糖皮质激素虽然使蛋白质、糖原分解,但其它方面的作用,如促进脂肪生成,促进骨髓干细胞向脂肪方向分化、抑制免疫反应等并非“耗竭”一词所能解释;并没有引起组织细胞的坏死,解释为“毒性”反应也不合适,实际上,糖皮质激素处理鼠常用作抑郁症、代谢综合症模型[17,18],研究糖皮质激素的效应可能具有重要的病理生理意义。
[1] 沈自尹, 陈泽霖, 查良伦, 等. 祖国医学“肾”的研究中有关滋阴泻火药作用的探讨1.生地、知母、甘草对地塞米松反馈抑制作用的影响(临床观察) [J]. 上海第一医学院学报, 1979, 6(5): 313-318.
[2] 叶任高, 张素梅, 张琳, 等. 中药与激素在治疗肾病中的相互关系探讨 [J]. 广东医学, 1991, 12(2): 34-36.
[3] 王萍,王喜军. 肾阴虚证动物模型研究概况 [J]. 中医药信息,2013, 30(4): 123-125.
[4] 邝安堃. 某些助阳药对于大剂量皮质激素所致耗竭现象的影响 [J]. 中华内科杂志, 1963, 2(2): 113.
[5] 卢文丽,方肇勤.阳虚证动物模型的造模方法与评析 [J]. 上海中医药大学学报. 2004, 18(4): 44-48.
[6] Lee RS, Tamashiro KL, Yang X, et al. Chronic corticosterone exposure increases expression and decreases deoxyribonucleic acid methylation of Fkbp5 in mice [J]. Endocrinology, 2010,151(9): 4332-4343.
[7] 刘金保, 饶敏. 一种简便测定小鼠耗氧量的实验方法 [J]. 中国病理生理杂志,1996, 12(1): 105-107.
[8] 黄建华. 论中医阴阳五行理论中诸命题的性质 [J]. 南京中医药大学学报(社会科学版), 2015, 16(1): 5-10.
[9] Psarra AM1, Sekeris CE.Glucocorticoids induce mitochondrial gene transcription in HepG2 cells: role of the mitochondrial glucocorticoid receptor[J].Biochim Biophys Acta, 2011 1813(10):1814-1821.
[10] Sato H, Takahashi T, Sumitani K, et al. Glucocorticoid generates ROS to induce oxidative injury in the hippocampus, leading to impairment of cognitive function of rats[J]. J Clin Biochem Nutr, 2010, 47(3):224-232.
[11] Picard M, Turnbull DM. Linking the metabolic state and mitochondrial DNA in chronic disease, health, and aging[J]. Diabetes, 2013, 62(3):672-678.
[12] Morgan SA, McCabe EL, GathercoleLL,et al. 11β-HSD1 is the major regulator of the tissue-specific effects of circulating glucocorticoid excess[J]. Proc Natl Acad Sci USA, 2014, 111(24):E2482-2491.
[13] 黄建华,蔡外娇,沈自尹. 论利用动物模型研究中医证候的可能性及限度 [J]. 中医学,2013,2(3): 26-29.
[14] 刘小斌, 刘友章, 王清海, 等. 五脏相关理论学说临床基础调研—附1200 例病案资料分析 [J]. 中医药学刊, 2004, 22(2): 211-213.
[15] 刘小斌, 邱仕君, 郑洪, 等. 邓铁涛五脏相关理论研究 [J]. 中国中医基础医学杂志, 2008, 14(1): 20-22.
[16] 王君,仝小林,王道坤. 中药防治肾上腺皮质激素副作用的实验研究概况 [J]. 甘肃中医学院学报,1999,16(3): 36-39.
[17] Wong SK, Chin KY, Suhaimi FH, et al. Animal models of metabolic syndrome: a review[J]. Nutr Metab (Lond), 2016, 13:65.
[18] Skupio U, Tertil M, Sikora M, et al. Behavioral and molecular alterations in mice resulting from chronic treatment with dexamethasone: relevance to depression[J].Neuroscience, 2015, 286:141-150.
The role of resting metabolic rate in evaluation of Kidney Yin or Kidney Yang deficiency animal model induced by glucocorticoids
TAO Lin-lin1, SUN Xian-jun2,3, DUAN Xiao-hong2,3, ZHOU Wen-jiang1*, HUANG Jian-hua2,3*
(1. School of Pharmacy, Fudan University,Shanghai 201203,China; 2. Huashan Hospital, Fudan University,Shanghai 200040; 3. Basic Theory and Application Research Institute, Academy of Integrative Medicine, Fudan University,Shanghai 200040)
Objective To observe the role of resting metabolic rate (RMR) in evaluation of animal model of glucocorticoid-induced Kidney Yin deficiency and Kidney Yang deficiency syndrome. Methods Male BALB/c mice were divided into control group, model group, Jinkuishenqi pill group, and Zhibaidihuang pill group. The later 3 groups were given drinking water containing corticosterone (first dissolved in 1% ethanol, with a final concentration of corticosterone 100 μg/mL). The control group was given drinking water containing 1% ethanol. RMR was measured by closed fluid pressure respirometer. At the end of the experiment, the mice were sacrificed to detect the weight index of perirenal fat, epididymal fat, quadriceps, and tibialis anterior muscle. ELISA assay was used to detect the level of serum hormones. Histological changes of the liver and kidney were examined by HE staining. Malondialdehyde (MDA) content, succinate dehydrogenase (SDH) activity, cytochrome c oxidase (COX) activity and ATP level were measured. Results Compared with the control group, the RMR of model group was significantly increased at the 2nd day of beginning of the experiment, reached the highest on the 4th day (P<0.01), then decreased gradually, and to the 66th day, the RMR was significantly reduced (P<0.05). Use of corticosterone resulted in decrease of the serum levels of thyroxine (T4), muscle mass index, SDH activity, COX activity and ATP level, while increase of fat mass index and MDA level. The two Kidney nourishing prescriptions reduced animal mortality, and reduced the content of MDA in liver tissue. But only Jinkuishenqi pill increased the RMR at the 4th and 66th days (P<0.05), and significantly improved the liver SDH activity, COX activity and ATP level (P<0.01). The Zhibaidihuang pill showed no such effects. Conclusions RMR can be used for evaluation of animal model of Kidney Yin or Kidney Yang deficiency induced by glucocorticoids.
Glucocorticoid; Kidney Yin deficiency; Kidney Yang deficiency; Animal model; Resting metabolic rate
HUANG Jian-hua. E-mail: hjhzyj@aliyun.com. ZHOU Wen-jiang. E-mail: wjzhou@shmu.edu.cn
国家自然科学基金项目(编号:81373791)。
陶林琳(1986-),女,助理实验师,研究方向:疾病动物模型研究。Email: mailto:taolinlin@fudan.edu.cn
黄建华(1975-),男,副研究员,研究方向:中医证候研究。Email: hjhzyj@aliyun.com。周文江(1963-),男,主任技师。研究方向:疾病动物模型研究。E-mail:wjzhou@shmu.edu.cn。*共同通讯
Q95-33
A
1005-4847(2017)03-0241-09
10.3969/j.issn.1005-4847.2017.03.003
2016-10-27
