慢病毒携带的短发夹RNA对乳腺癌细胞乙酰肝素酶基因表达的沉默作用
2017-07-18陈国利郑志方张学军
陈国利 郑志方 李 巍 张学军
(承德医学院附属医院外一科,河北 承德 067000)
慢病毒携带的短发夹RNA对乳腺癌细胞乙酰肝素酶基因表达的沉默作用
陈国利 郑志方1李 巍 张学军
(承德医学院附属医院外一科,河北 承德 067000)
目的 通过构建短发夹RNA(shRNA)慢病毒载体,转染乳腺癌MDA-MB-231细胞,探讨慢病毒携带的shRNA对乳腺癌细胞乙酰肝素酶(HPA)基因表达的沉默作用。方法 采用RNA干扰(RNAi)序列设计原则,以乳腺癌HPA基因为靶基因,将构建5对shRNA重组慢病毒载体,转染乳腺癌MDA-MB-231细胞,通过Western印迹检测HPA-shRNA对MDA-MB-231细胞HPA蛋白表达水平的影响;用CCK-8的方法检测HPA-shRNA对乳腺癌细胞的生长抑制作用及5-氟尿嘧啶(5-Fu)对乳腺癌细胞的杀伤作用,运用transwell实验检测HPA-shRNA对乳腺癌细胞侵袭能力的影响。进一步,运用流式分析的方法检测HPA-shRNA对乳腺癌细胞周期的影响。建立小鼠转移瘤模型,检测HPA-shRNA在体内对乳腺癌细胞的生长抑制作用。结果 成功构建HPA-shRNA重组慢病毒载体。在体外,实验组HPA-shRNA1组、HPA-shRNA3组、HPA-shRNA4组有效沉默了人乳腺癌MDA-MB-231细胞HPA的表达,HPA蛋白表达明显降低(P<0.05)。HPA-shRNA1对乳腺癌细胞的生长具有良好的抑制作用,HPA-shRNA1能够增加乳腺癌细胞对5-Fu的敏感性。此外,HPA-shRNA1能够诱导乳腺癌细胞在S期发生细胞周期阻滞。在体内,HPA-shRNA1组HPA基因mRNA相对表达量明显低于阴性对照组(P<0.05),HPA-shRNA1能够沉默乳腺癌移植瘤HPA mRNA表达。在体内HPA-shRNA1同样能够抑制乳腺癌细胞生长。结论 HPA-shRNA重组慢病毒载体可有效抑制乳腺癌HPA基因的表达,进而发挥良好的抗肿瘤作用。
乙酰肝素酶;乳腺癌;慢病毒载体;短发夹RNA;MDA-MB-231细胞
新发乳腺癌患者逐年递增〔1〕,其复发和转移一直是肿瘤科的难题,严重影响患者疗效。研究乳腺癌复发转移机制为临床采取有针对性的防治措施,防止乳腺癌复发和转移,减轻患者的痛苦,延长患者的生存期具有重要的意义。乙酰肝素酶(HPA)是一种能够裂解细胞表面和细胞外基质的β-D葡萄糖醛酸酶,HPA的活性与肿瘤的转移和血管生成密切相关〔2〕。HPA的高表达与乳腺癌的复发转移密切相关〔3〕。本研究采用RNA干扰(RNAi)技术,构建HPA-短发夹RNA(shRNA)重组慢病毒表达载体,通过在体内外实验研究靶向沉默乳腺癌HPA基因的表达,为乳腺癌的基因靶向治疗寻找新的靶点。
1 材料和方法
1.1 主要材料和试剂 慢病毒包装293T细胞和乳腺癌MDA-MB-231细胞株购自上海中科院细胞库,L-15培养基和胰酶购自Gibco公司,胎牛血清购自杭州四季青公司,鼠单克隆HPA抗体购自Abcam公司,慢病毒系统(转移载体、pGag/Pol、pRev、pVSV-G四质粒) 由上海吉玛制药技术有限公司提供,Trizol试剂盒购自Invitrogen公司,SYBR Premix Ex Taq荧光实时定量PCR试剂盒购自TaKaRa公司,BCA蛋白质定量试剂盒购自碧云天公司,健康BALB/C雌性裸鼠购自上海斯莱克实验动物有限责任公司。
1.2 体外实验
1.2.1 乳腺癌MDA-MB-231细胞培养 乳腺癌MDA-MB-231细胞株接种L-15培养基中,置于5%CO2,37℃培养箱培养。
1.2.2 靶向HPA-shRNA序列设计 以HPA基因为靶基因,根据shRNA序列计基本原则设计出的shRNA序列分别为:HPA-shRNA1:5′GCTGCCTAGATGTGCGCCTATACA3′;HPA-shRNA2:5′GCATAACTACTATTTATTGAATGG3′;HPA-shRNA3:5′GCACGGGTGCAAGGTATTTCAAAG3′;HPA-shRNA4:5′GCTGCCCAGCTTTCTTGGCATATA3′;HPA-shRNA5:5′GGAGCCACAAGCTCTACCGCATAT3′;阴性对照:5′GTTGCCCGAACGTGTGAACACGT3′。
1.2.3 HPA-shRNA慢病毒表达载体的构建 将合成寡核苷酸片段退火形成双链DNA,PCR扩增、回收、纯化。双链DNA经T4 DNA连接酶与线性化质粒连接,转化DH5α大肠杆菌,挑取重组阳性克隆进行测序鉴定。
1.2.4 HPA-shRNA重组慢病毒的包装和滴度测定 用10%胎牛血清(FBS)+杜尔伯科改良伊格尔培养基(DMEM)对293T细胞进行培养。当细胞密度达到约80%进行细胞传代,把细胞平均分到3个25 cm2培养皿中过夜。细胞密度达到70%~90%开始转染,病毒包装质粒和HPA基因RNAi序列重组质粒转染293T细胞,转染72 h后收集上清液,离心过滤并浓缩得到慢病毒液,分装保存在-80℃。病毒原液10 μl用10倍有限稀释法稀释后依次浸染293T细胞,72 h后观察绿色荧光蛋白表达情况,可测出慢病毒原液滴度。
1.2.5 MDA-MB-231细胞转染HPA-shRNA重组慢病毒效果检测 细胞分为6组:①HPA-shRNA1组;②HPA-shRNA2组;③HPA-shRNA3组;④HPA-shRNA4组;⑤HPA-shRNA5组;⑥阴性对照组。①~⑥MDA-MB-231细胞组分别转染HPA shRNA1、2、3、4、5、阴性对照组慢病毒。将转染后的细胞培养72 h后在荧光显微镜下观察转染效率。
1.2.6 Western印迹检测HPA的表达 转染72 h,PBS洗涤细胞,通过RIPA裂解液裂解细胞,提取各组细胞总蛋白,考马斯亮蓝法蛋白定量,电泳分离,转到PVDF膜封闭,2 h后加入HPA单克隆抗体,4℃温育过夜,洗涤后加入稀释的二抗,室温温育2 h后显色,以GAPDH作为内参照,凝胶成像系统分析。
1.2.7 CCK-8试剂盒检测细胞活性 取适当浓度的细胞悬液在96孔板中接种细胞(100 μl/孔)。将培养板放在细胞培养箱中培养(37℃,5%CO2)。分别于1,2,3,4 d,向每孔加入10 μl CCK-8溶液。③将培养板在培养箱内孵育1~4 h。用酶标仪测定每个孔在450 nm处的吸光度。
1.3 体内实验
1.3.1 实验动物分组 采用健康BALB/C雌性裸鼠,将裸鼠随机分2组(实验HPA-shRNA1组、阴性对照组),每组4只,构建乳腺癌皮下移植瘤模型。
1.3.2 构建肿瘤模型 MDA-MB-231细胞配成1×109细胞/ml悬液,取0.2 ml注射裸鼠右侧腋窝,裸鼠右侧腋窝出现一个球形凸起。观察肿瘤的生长情况。
1.3.3 HPA-shRNA重组慢病毒注射 将体外实验筛选的沉默MDA-MB-231细胞HPA表达的HPA-shRNA1序列包装成重组慢病毒。当肿瘤直径约10 mm,携带HPA-shRNA1、HPA-阴性对照的重组慢病毒分别注射各组裸鼠移植瘤,隔日1次,分4次,每只裸鼠总量400 μl,观察MDA-MB-231细胞生长情况、5-氟尿嘧啶(5-FU)对细胞生长的影响及细胞周期情况。
1.3.4 实时定量PCR检测裸鼠乳腺癌移植瘤HPA mRNA的表达 HPA-shRNA重组慢病毒注射裸鼠移植瘤1个月,将每组裸鼠分别逐一编号,共2组,每组4只。手术剥离出移植瘤,实时定量PCR检测HPA mRNA表达。提取总RNA,用紫外分光光度仪测定RNA含量,琼脂糖凝胶电泳得到5.8 S、18 S、28 S三条带,提取的RNA纯度良好。按照实时定量PCR试剂盒进行检测。
1.4 统计学方法 采用SPSS19.0软件进行t检验及方差分析。
2 结 果
2.1 HPA-shRNA表达载体构建和测序 构建的特异性靶向抑制人HPA基因的5个重组慢病毒表达载体HPA-shRNA1、2、3、4、5,经测序鉴定证实插入的碱基序列与设计的5个HPA-shRNA序列完全一致,表明成功构建了HPA-shRNA重组慢病毒表达载体。
2.2 乳腺癌MDA-MB-231细胞转染HPA-shRNA重组慢病毒效果检测 用人乳腺癌MDA-MB-231细胞转染HPA-shRNA重组慢病毒,转染72 h后可见大多数MDA-MB-231细胞表达荧光蛋白(图1),证明转染效率较高。
2.3 Western印迹检测HPA蛋白表达 HPA-shRNA1组、HPA-shRNA2组、HPA-shRNA3组、HPA-shRNA4组、HPA-shRNA5组、阴性对照组HPA蛋白相对表达水平分别为0.023±0.015、0.447±0.140、0.083±0.035、0.033±0.015、0.917±0.075、0.947±0.051。HPA-shRNA1组、HPA-shRNA3组、HPA-shRNA4组HPA蛋白的表达明显低于阴性对照组(P<0.05),表明HPA-shRNA1、HPA-shRNA3、HPA-shRNA4能够下调HPA基因蛋白表达,见图2。
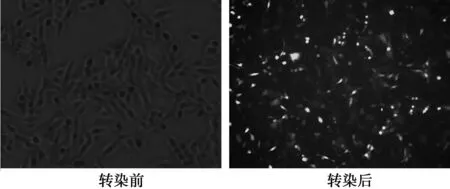
图1 转染72 h前后MDA-MB-231细胞荧光图片(×200)

1、HPA-shRNA1组;2、HPA-shRNA2组;3、HPA-shRNA3组;4、HPA-shRNA4组;5、HPA-shRNA5组;6、阴性对照组图2 Western印迹检测HPA蛋白的表达
2.4 HPA-shRNA1抑制乳腺癌细胞MDA-MB-231细胞的生长 与阴性对照组相比,MDA-MB-231转染HPA-shRNA1组的细胞生长缓慢,增殖率显著低于阴性对照组,HPA-ShRNA1组第2,3,4天OD值分别为0.741±0.059,0.833±0.063,0.926±0.069,阴性对照组第2,3,4天OD值分别为1.173±0.045,1.341±0.061,1.512±0.091,自第2天起两组OD值有显著差异(P<0.05),说明随着培养时间的延长,转染HPA-shRNA1的MDA-MB-231细胞增殖能力被显著抑制。
2.5 HPA-shRNA1增强5-Fu对乳腺癌细胞MDA-MB-231细胞的杀伤作用 与阴性对照组相比,5-Fu能够显著抑制转染HPA-shRNA1 的MDA-MB-231细胞的增殖能力,并且随着5-Fu浓度的增加,对MDA-MB-231细胞增殖能力的抑制率增强。0.400、2.000、10.000、50.000、250.000 μg/ml时,HPA阴性对照组OD值分别为1.539±0.077、1.337±0.049、0.949±0.055、0.631±0.032、0.315±0.021,而且HPA-shRNA1组OD值分别为0.956±0.055、0.598±0.023、0.551±0.042、0.332±0.054、0.100±0.013,均显著低于对照组(P<0.05)。
2.6 HPA-shRNA1抑制乳腺癌细胞MDA-MB-231细胞的侵袭能力 两组细胞中,均有部分细胞能穿过transwell小室底部的8 μm小孔,转染空载病毒的阴性对照组细胞穿过小孔的细胞数量明显高于转染HPA-shRNA1组。因此,HPA-shRNA1能够显著抑制MDA-MB-231细胞的侵袭能力。见图3。

图3 HPA-shRNA1抑制乳腺癌MDA-MB-231细胞的侵袭能力

图4 两组裸鼠移植瘤生长情况
2.7 HPA-shRNA1诱导乳腺癌MDA-MB-231细胞周期阻滞 乳腺癌细胞转染HPA-shRNA1病毒孵育72 h后,用流式分析的方法检测乳腺癌细胞的周期,阴性对照组细胞G1、G2、S期比例分级为:70.57%、2.2%、27.23%;HPA-shRNA1组细胞G1、G2、S期比例分别为59.31%、1.41%、39.82%。与阴性对照组细胞相比,HPA-shRNA1组细胞发生显著的S期细胞阻滞。
2.8 HPA-shRNA1在体内抑制乳腺癌MDA-MB-231细胞的增殖及移植病内HPA mRNA表达水平 如图4。观察两组小鼠肿瘤的生长情况,30 d后,将转染HPA-shRNA1和空载的病毒的小鼠肿瘤取出,HPA-shRNA1能够显著抑制乳腺癌细胞在小鼠体内生长见图4。HPA-shRNA1组HPA mRNA相对表达量(0.183±0.075)明显低于阴性对照组(0.933±0.206,P<0.05);表明在体内实验,HPA-shRNA1能够下调乳腺癌移植瘤HPA mRNA表达。
3 讨 论
肿瘤的转移仍然是癌症患者的主要死亡原因。研究表明〔4〕,肿瘤的转移与多种蛋白酶有关,如金属蛋白酶、HPA等。HPA作为葡萄糖醛酸酶,是一种哺乳动物糖类内切酶,能够降解细胞表面和细胞外基质的硫酸类肝素蛋白多糖促进肿瘤转移,在大多数人类肿瘤细胞中高表达〔5~8〕。而在人类正常组织,HPA含量低表达,主要分布肝细胞、血小板、巨噬细胞、淋巴细胞等〔9〕。HPA有两种形式,即HPA和HPA2,其中HPA和肿瘤侵袭有关,而HPA2调节其活性,其活性在恶性肿瘤高于良性肿瘤〔10〕。人类HPA的前体是一种由543个氨基酸组成的蛋白质,这种蛋白质的活化与切除一个内部连接片段有关,切除后产生具有活性的异质二聚体,切除位于两个功能组织蛋白酶连接片段的C端的10个氨基酸是激活HPA前体的关键〔11〕。
HPA和血管内皮生长因子(VEGF)-C是重要的细胞因子,促进许多恶性肿瘤的转移和血管生成,肿瘤通过释放降解基底膜(BM)和细胞外基质(ECM)的酶促进肿瘤转移〔12〕。HPA的活性和肿瘤细胞的转移潜能密切相关,其能够裂解和破坏上皮细胞和内皮细胞的ECM和BM的HS侧链,提高肿瘤细胞的播散能力。研究表明,HPA的表达可以减少细胞核syndecan-1的含量,增加组蛋白乙酰转移酶(HAT)的活性,从而上调侵袭性肿瘤相关基因的转录水平〔13〕。HPA作为侵袭性肿瘤相关蛋白的激活蛋白,在一定程度上提高了肿瘤相关蛋白的表达,如血管内皮生长因子和基质金属蛋白酶-9等。HPA的β-D葡萄糖醛酸酶活性和血管内皮细胞的迁移、黏附和免疫细胞的激活密切相关,从而参与新血管形成、炎症反应和自身免疫反应〔5〕。
HPA与多种肿瘤的转移密切相关,如淋巴瘤、胆囊癌、肾癌、骨肉瘤、肝癌、黑色素瘤等〔14~19〕。另外,HPA在乳腺癌中高表达,而在癌旁正常组织低表达〔20〕。因此,以HPA为抗原,研究以HPA为靶点的肿瘤疫苗是治疗肿瘤转移的有效方法,然而,单一肿瘤疫苗的免疫激发功能较低,需要佐剂提高其免疫激发功能,甲壳低聚糖已被证明是一种有效的以HPA为靶点的肿瘤疫苗佐剂〔21〕。
慢病毒载体是能传递遗传物质进入细胞的重要的工具〔22〕。为了将目的基因导入靶细胞,采用合适的载体是肿瘤基因靶向治疗的关键之一,慢病毒是基因转移成熟载体,慢病毒载体广泛应用于基因转移和基因治疗〔23〕。与其他载体相比具有独特优势:①转染效率高〔24〕;②对分裂细胞和非分裂细胞均具有转染作用,并能够使目的基因在靶细胞稳定表达,且具有安全、低毒、高稳定性。本研究表明慢病毒作为shRNA转移载体是可行的。
RNAi参与天然免疫反应,可以保护细胞免受病原体(如病毒和细菌)的入侵,沉默同源目标靶基因的转录后表达〔25〕。RNAi通过不同的信使RNA降解途径沉默目标基因的表达,RNAi主要通过三种方式进行基因调控:微小RNA(microRNA)、shRNA和小干扰RNA(siRNA)〔26〕。
有研究表明,抑制HPA的表达能够抑制结直肠癌肿瘤细胞的生长〔27〕,本研究证实了在乳腺癌中,应用HPA-shRNA降低HPA在乳腺癌MDA-MB-231细胞的表达,能够抑制其增殖和侵袭能力。目前5-Fu广泛应用于乳腺癌的治疗,但是,耐药不仅降低乳腺癌患者的生存期,同时降低患者的生活质量〔28〕,本研究证实,HPA-shRNA1能够增强5-Fu对MDA-MB-231细胞的杀伤能力,增强化疗药物的敏感性,为乳腺癌耐药患者提供了新的治疗途径,可能是由于HPA与细胞周期相关〔29〕。
1 郑 莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征〔J〕.中国癌症杂志,2013;23(8):561-9.
2 王晓露, 解方为,欧阳学农.黄酮类化合物葡萄糖醛酸化和硫酸化代谢机理及其对P糖蛋白的作用研究〔J〕.中药药理与临床,2010;26(3):26-8.
3 Breidenbach M,Rein DT,Schondorf T,etal.A new targeting approach for breast cancer gene therapy using the Heparanase promoter〔J〕.Cancer Lett,2006;240 (1):114-22.
4 Arvatz G,Shafat I,Levy-Adam F,etal.The heparanase system and tumor metastasis:is heparanase the seed and soil〔J〕?Cancer Metastasis Rev,2011;30(2):253-68.
5 Barash U,Cohen-Kaplan V,Dowek I,etal.Proteoglycans in health and disease:new concepts for heparanase function in tumor progression and metastasis〔J〕.FEBS J,2010;277(19):3890-903.
6 Levy-Adam F,Ilan N,Vlodavsky I,etal.Tumorigenic and adhesive properties of heparanase〔J〕.Semin Cancer Biol,2010;20(3):153-60.
7 Ilan N,Elkin M,Vlodavsky I.Regulation,function,and clinical significance of heparanase in cancer metastasis and angiogenesis〔J〕.Int J Biochem Cell Biol,2006;38(12):2018-39.
8 Sanderson RD,Yang Y,Suva LJ,etal.Heparan sulfate proteoglycans and heparanase-partners in osteolytic tumor growth and metastasis〔J〕.Matrix Biol,2004;23(J):341-52.
9 Vlodavsky I,Elkin M,Pappo O,etal.Mammalian heparanase as mediator of tumor metastasis and angiogenesis〔J〕.Isr Med Assoc J,2000;2(Suppl):37-45.
10 蔡小玲,佘志刚,林永成.具抗肿瘤活性的乙酰肝素酶抑制剂的研究与开发〔J〕.生命的科学,2008;28(5):617-21.
11 Abboud-Jarrous G,Atzmon R,Peretz T,etal.Cathepsin L is responsible for processing and activation of proheparanase through multiple cleavages of a linker segment〔J〕.J Biol Chem,2008;283(26):18167-76.
12 王顺祥, 田志宏, 吴晓慧, 等.乙酰肝素酶和血管内皮生长因子在肝癌中的表达及其与血管生成的关系〔J〕.中华实验外科杂志,2006;23(1):107.
13 Purushothaman A,Douglas R,Pisano C,etal.Heparanase-mediated loss of nuclear syndecan-1 enhances histone acetyltransferase (HAT) activity to promote expression of genes that drive an aggressive tumor phenotype〔J〕.J Biol Chem,2011;286(35):30377-83.
14 周怀龙,黎才海,李其云.乙酰肝素酶和血管内皮生长因子在肝癌中的表达及其与血管生成的关系〔J〕.实用癌症杂志,2010;25(1):104-7.
15 任小龙,朱任之.乙酰肝素酶与肿瘤血管生成及肿瘤转移〔J〕.国外医学:生理,病理学与临床医学分册,2002;22(5):462-4.
16 Mikami S,Oya M,Mizuno R,etal.Invasion and metastasis of renal cell carcinoma〔J〕.Med Mol Morphol,2014;47(2):63-7.
17 Fan L,Wu Q,Xing X,etal.Targeted silencing of heparanase gene by small interfering RNA inhibits invasiveness and metastasis of osteosarcoma cells〔J〕.J Huazhong Univ Sci Technolog Med Sci,2011;31(3):348-52.
18 Dong S,Wu XZ.Heparanase and hepatocellular carcinoma:promoter or inhibitor〔J〕?World J Gastroenterol,2010;16(3):306-11.
19 Liu XY,Tang QS,Chen HC,etal.Lentiviral miR30-based RNA interference against heparanase suppresses melanoma metastasis with lower liver and lung toxicity〔J〕.Int J Biol Sci,2013;9(6):564-77.
20 Theoeoro TR,Dematos LL,Santanna AV,etal.Heparanase expression in circulating lymphocytes of breast cancer patients depends on the presence of the primary tumor and/or systemic metastasis〔J〕.Neoplasia,2007;9(6):504-10.
21 Quan HQ,Xu Z.Hypotheses:a new way against cancer metastasis,chitooligosaccharides as mucosal adjuvant for therapeutic vaccination targeting heparanase〔J〕.Anim Vet Adv,2012;11(15):2788-91.
22 Nasri M,Karimi A,Allahbakhshian FM.Production,purification and titration of a lentivirus-based vector for gene delivery purposes〔J〕.Cytotechnology,2014;66(6):1031-8.
23 李跃萍,宋丽萍,邱曙东.慢病毒载体在肿瘤基因治疗中的应用〔J〕.现代肿瘤医学,2006;14(12):1614-7.
24 Vannucci L,Lai M,Chiuppesi F,etal.Viral vectors:a look back and ahead on gene transfer technology〔J〕.New Microbiol,2013;36(1):1-22.
25 康 洁,刘福林.RNAi抗病毒作用及其机制〔J〕.现代免疫学,2004;24(5):439-51.
26 Khatri N,Rathi M,Baradia D,etal.In vivo delivery aspects of miRNA,shRNA and shRNA〔J〕.Crit Rev Ther Drug Carrier Syst,2012;29(6):487-527.
27 肖 毅,冯云路,钱家鸣,等.乙酰肝素酶在结直肠癌中的表达及意义〔J〕.中国普外基础与临床杂志,2007;14(4):442-7.
28 李 燕,邢克飞,李福洋,等.白藜芦醇联合5-FU对人乳腺癌细胞系MCF-7的促凋亡作用〔J〕.2006;27(7):658-61.
29 Xiong Z,Lu MH,Fan YH,etal.Downregulation of heparanase by RNA interference inhibits invasion and tumorigenesis of hepatocellular cancer cells in vitro and in vivo〔J〕.Int J Oncol,2012;40(5):1601-9.
〔2015-09-17修回〕
(编辑 苑云杰/曹梦园)
承德市科学技术研究与发展计划项目(No.20151029)
陈国利(1980-),男,硕士,主治医师,主要从事乳腺肿瘤治疗的研究。
R655.8
A
1005-9202(2017)13-3169-04;
10.3969/j.issn.1005-9202.2017.13.021
1 承德医学院附属医院小儿内科
